Журнал аналитической химии, 2021, T. 76, № 2, стр. 183-192
Дифференциальная сканирующая калориметрия как метод контроля подлинности растительных масел
О. Б. Рудаков a, *, И. А. Саранов b, **, Нгуен Ван Ань c, Л. В. Рудакова d, К. К. Полянский e
a Воронежский государственный технический университет
394006 Воронеж, ул. 20-летия Октября, 84, Россия
b Воронежский государственный университет инженерных технологий
394036 Воронеж, просп. Революции, 19, Россия
c Белгородский государственный национальный исследовательский университет
308015 Белгород, ул. Победы, 85, Россия
d Воронежский государственный медицинский университет им. Н.Н. Бурденко
394000 Воронеж, ул. Студенческая, 10, Россия
e Воронежский филиал Российского экономического университета им. Г.В. Плеханова
394030 Воронеж, ул. Карла Маркса, 67А, Россия
* E-mail: robi57@mail.ru
** E-mail: mr.saranov@mail.ru
Поступила в редакцию 09.07.2020
После доработки 20.08.2020
Принята к публикации 29.08.2020
Аннотация
Методом дифференциальной сканирующей калориметрии (ДСК) изучены теплофизические свойства жидких при комнатной температуре растительных масел амаранта, кукурузы, льна, подсолнечника, рапса, расторопши, рыжика и тыквы. Установлены характеристические тепловые эффекты этих масел – температуры максимумов эндотермических пиков и их площади на термограммах ДСК. В качестве идентификационных показателей обсуждены эндотермические пики разной интенсивности на кривых плавления жидких растительных масел в диапазонах от –40 до –15°С, от –25 до –8°С, от –19 до +6°С и от –10 до +4°С. Координаты максимумов этих пиков по оси абсцисс (Ti) и их площади (Si) значимо коррелируют с содержанием основных жирных кислот и триацилглицеринов (Wi, %), определенных методом обращенно-фазовой ВЭЖХ. Показана возможность эффективно контролировать методом ДСК подлинность растительных масел.
Теплофизические свойства твердых жиров, таких как молочный жир, масло какао, пальмовое и кокосовое масло, а также целого спектра заменителей молочного жира и масла какао изучены методом дифференциальной сканирующей калориметрии (ДСК) достаточно подробно [1–4], поскольку для пищевой технологии и потребления сведения о температурах плавления и кристаллизации жиров имеют важное значение. Кроме того, молочный жир и масло какао относятся к категории дорогостоящих продуктов. Для снижения стоимости масложировой и кондитерской продукции и оптимизации технологии молочный жир и масло какао частично или полностью заменяют искусственными комбинированными жирами. Термический анализ применяют и для жидких растительных масел [5–7]. В работе [1], пожалуй, наиболее детально изучены методом ДСК теплофизические свойства 17 пищевых жиров, в том числе типичных растительных масел (РМ). Для интерпретации кривых кристаллизации и плавления в качестве подтверждающих методов использованы газожидкостная хроматография (ГЖХ) и ВЭЖХ (данные о жирнокислотном и триглицеридном составе жиров), а также химическое определение иодного числа, учтено распределение фракций триацилглицеринов (ТАГ): триненасыщенных, диненасыщенных, мононасыщенных и тринасыщенных ТАГ. В работе [1] сопоставлены данные ДСК разных РМ, однако не выполнен корреляционный анализ изменения температур максимумов и их площадей на термограммах в зависимости от химического состава РМ. Обычно для исследования РМ методом ДСК используют кривые кристаллизации, однако они хуже воспроизводятся, чем кривые плавления [2, 4]. В работах [3, 5] применяют так называемую “быструю” ДСК с градиентом температур 10–20 град/мин. При быстром нагреве пики, характеризующие тепловые эффекты, сливаются, снижается информативность термограмм, поэтому стандартная скорость нагрева или охлаждения составляет 5 град/мин. Часто в исследованиях РМ методом ДСК не приводятся хроматографические данные для подкрепления сделанных выводов, делается акцент на том, что ДСК – самодостаточный метод идентификации жиров, который не требует больших затрат времени, реактивов и растворителей, сложного оборудования, высокой квалификации персонала. Демонстрируя высокую чувствительность термограмм к изменениям жирнокислотного и триглицеридного состава, авторы цитируемых работ не обсуждают вариативность химического состава РМ, обусловленную генотипическими и фенотипическими факторами. Наконец, в работах [1–7] не предложен понятный и простой алгоритм идентификации, например, с использованием контрольных карт, визуализирующих цифровую информацию, содержащую несколько параметров термограмм [8].
Цель настоящей работы – изучение теплофизических свойств некоторых жидких растительных масел, полученных из выращенного в России сырья, с использованием кривых плавления ДСК и контрольных карт, учитывающих вариативность химического состава, для проверки подлинности этих масел.
В качестве объектов изучения выбрали подсолнечное, кукурузное, рапсовое и рыжиковое масла как недорогие сорта, и амарантовое, льняное, тыквенное и масло расторопши как масла, используемые преимущественно в качестве биологически активных добавок (БАД). БАДы на основе дорогих натуральных РМ могут фальсифицироваться или разбавляться недорогими РМ, которые в 10–20 раз дешевле.
Приоритетными методами контроля качества и подлинности жиров и масел являются капиллярная ГЖХ жирных кислот (ЖК) и обращенно-фазовая ВЭЖХ триацилглицеринов, входящих в состав жировой фазы [8–18]. Триацилглицерины рассматриваемых жидких РМ содержат в сумме от 75 до 90% ненасыщенных ЖК (олеиновой, линолевой и линоленовой), 5–20% насыщенных ЖК (пальмитиновой и стеариновой) и различное количество минорных насыщенных и/или ненасыщенных ЖК [8, 9]. Покомпонентная идентификация ТАГ в различном растительном сырье методом ВЭЖХ позволила получить большую базу хроматографических данных [8–18], которую использовали в настоящей работе при интерпретации хроматограмм. В первую очередь использовали инкрементный подход, разработанный Дейнекой с соавт. [10–15] и основанный на идее аддитивности вкладов (инкрементов) функциональных групп в удерживание сорбата [15]. Этот подход не позволяет различить изомеры положения и отдельные аналогичные по хроматографическим свойствам ТАГ, но в целом он зарекомендовал себя продуктивным и хорошо согласующимся с данными других работ.
В отличие от покомпонентного анализа методами ГЖХ и ВЭЖХ, в методе ДСК в качестве идентификационных параметров и аналитических сигналов служат геометрические параметры кривых ДСК – экстремумы температур плавления или кристаллизации, площади эндо- и экзотермических пиков и их соотношения [1–4]. Преимуществом метода ДСК является простота пробоподготовки и высокая чувствительность теплофизических характеристик к составу жировой фазы. Например, ДСК смесей молочного жира и пальмового масла позволяет обнаружить 2–10% добавки последнего в молочный жир [2–4]. Аналогичные результаты получены при анализе методом ДСК смесей оливкового масла с другими более дешевыми РМ [5, 6]. По характерному профилю термограмм ДСК можно проверить не только аутентичность образца масла, но также географическое происхождение и сорт масличного растения, из которого оно выделено [6].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы масел (образцы сравнения) произведены в лабораторных условиях в ФГБОУ ВО “ВГУИТ” и в ООО “Русская Олива” методом холодного отжима с применением шнекового пресса. Для проведения термического анализа использовали прибор синхронного термического анализа STA 449 F3 Jupiter® фирмы “NETZSCH” (Германия). Для анализа отбирали навески образцов РМ массой 15–22 мг. Теплофизические свойства измеряли в диапазоне температур от –150 до +20°С, скорость нагрева 5 град/мин. Систему охлаждали жидким азотом. Измерения выполняли в атмосфере гелия (расход продувочного газа 10 мл/мин, расход защитного газа 10 мл/мин). Точность измерения температуры составляла ±0.3°С.
Состав РМ анализировали методом ВЭЖХ на хроматографе Shimadzu L20 с рефрактометрическим детектором Shimadzu RID-10A (Япония). Колонка: 250 × 4.6 мм, Kromasil 100-5C18, 35°С. Элюент – смесь ацетонитрил–ацетон (15 : 85, по объему), расход 0.8 мл/мин. Идентификацию ТАГ и ЖК проводили с применением инкрементного расчета [15].
Для повышения информативности термограмм, полученных методом ДСК, использовали программное разделение суперпозиции пиков тепловых эффектов, накладывающихся друг на друга, в программе NETZSCH Peak Separation по алгоритму General.
Триацилглицерины обозначали по общепринятой схеме – буквами указывали тип ЖК с указанием их числа в ТАГ с помощью подстрочного индекса без дифференциации положения радикалов в молекуле. Буквенные обозначения кислот, входящих в состав изучаемых РМ: А – арахиновая, B – бегеновая, E – эйкозеновая, E'' – эруковая, L – линолевая, L'' – линоленовая, О – олеиновая, P – пальмитиновая, S – стеариновая кислота. Например, L2О обозначает ТАГ, образованный двумя радикалами линолевой и одним радикалом олеиновой кислоты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 и 2 приведены кривые плавления ДСК образцов РМ и хроматограммы ТАГ. На термограммах плавления ДСК масел можно выделить от 2 до 4 характеристичных эндотермических максимумов, которые имеют различную амплитуду и геометрию, расположены на различных расстояниях по оси температур; пики имеют отличающиеся по величине площади (Si), которые также несут в себе идентификационные признаки.
Рис. 1.
Термограммы ДСК плавления и хроматограммы ВЭЖХ растительных масел из рыжика (а), расторопши (б), рапса (в), подсолнечника (г).
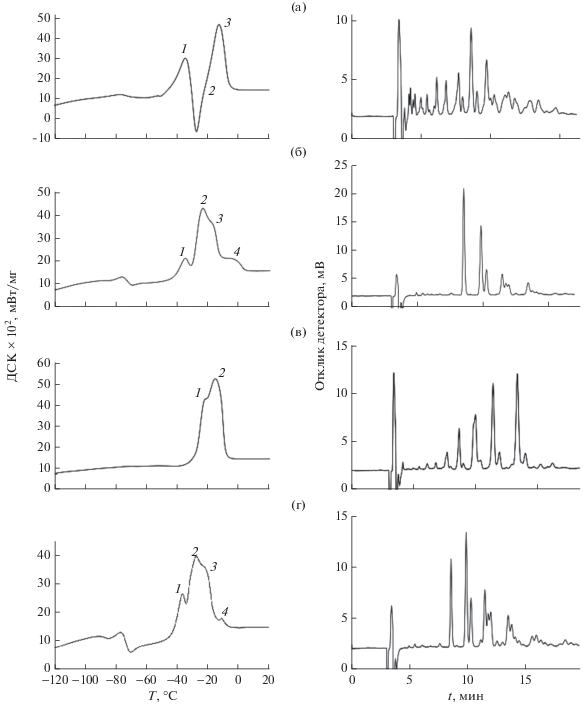
Рис. 2.
Термограммы ДСК плавления и хроматограммы ВЭЖХ растительных масел из льна (а), амаранта (б), тыквы (в), кукурузы (г); вторая производная кривой ДСК плавления кукурузного масла (д).

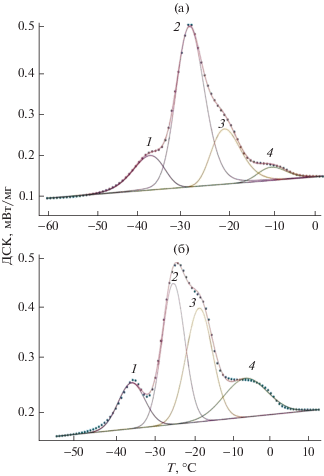
Для более точного определения Ti слабо выраженных термических эффектов, так называемых “плеч” на основных пиках, применяли вторые производные от ДСК по времени (см. пример на рис. 2д). Наиболее интенсивный пик, а точнее суперпозиция неразделенных пиков, на термограммах ДСК, имеющий ассиметричную форму, расположен в диапазоне примерно от –30 до –20°С, окончание плавления происходит в диапазоне от –10 до +5°С. В связи с плохим разделением суперпозиции пиков эндотермических эффектов РМ их программно разделяли на 2–4 пика и рассчитывали относительные площади Si (%). На рис. 3 приведены примеры программного разделения пиков на термограммах ДСК плавления.
Рис. 3.
Термограммы ДСК плавления с компьютерным разделением пиков: (а) – льняное масло; (б) – масло расторопши.
В табл. 1 приведены установленные величины теплофизических характеристик исследуемых образцов РМ – Ti и Si. В табл. 2 представлены результаты идентификации ТАГ, а в табл. 3 – обнаруженные ЖК. Отметим, что в табл. 2 и 3 приведены наши данные, полученные для конкретных образцов РМ, теплофизические свойства которых определяли в данной работе. Это важно, так как теплофизические свойства масел чутко реагируют на химический состав жиров, который может заметно варьировать даже для РМ одного и того же вида растений в зависимости от генотипа и фенотипа [8, 9]. Хроматографические данные находятся в типичных диапазонах содержания ЖК, нормируемых или установленных ранее для рассматриваемых видов РМ [8, 9], отсутствуют данные о ЖК, содержание которых <1%. Детальную интерпретацию кривых ДСК осложняет наличие полиморфизма, взаимной растворимости различных фракций ТАГ, образующиеся эвтектики. Однако как показал корреляционный анализ для взятой выборки РМ, между химическим составом РМ и эндотермическими эффектами прослеживаются значимые корреляции. В работе [1] показано, что жидкие пищевые РМ, содержащие в своем составе 61–81% триненасыщенных ТАГ (UUU) и 35–17% диненасыщенных, мононасыщенных ТАГ (UUS), такие как оливковое, каноловое масло и др., имеют на кривых плавления ДСК ярко выраженный эндотермический пик в области от –42 до +6°С, на плечах которого слева и справа можно выделить как минимум еще два пика. В указанном диапазоне температур наблюдаются основные тепловые эффекты и в исследуемых нами РМ, у которых сумма ТАГ (UUU) составляет от 84 до 44%, а ТАГ (UUS) – 16–40%. Кроме этих ТАГ, в РМ присутствует несколько процентов мононенасыщенных, динасыщенных ТАГ (USS) и незначительное или следовое количество тринасыщенных ТАГ (SSS), которые имеют более высокие температуры плавления, чем ТАГ (UUU) и ТАГ (UUS) (табл. 2).
Таблица 1.
Температуры максимумов (Тi, °C) и площади (Si, %) характеристичных пиков кривых плавления ДСК растительных масел
| Растительное масло | Т1 | Т2 | Т3 | Т4 | S1 | S2 | S3 | S4 |
|---|---|---|---|---|---|---|---|---|
| Амарант | –39.3* | –22.6 | –6.3* | 4.2* | 12.1 | 55.0 | 29.4 | 3.5 |
| Лён | –38.2* | –28.5 | –19.1* | –7.4 | 14.1 | 60.2 | 21.0 | 4.8 |
| Подсолнечник | –36.4 | –27.4 | –18.8* | –10.7 | 15.3 | 71.8 | 8.4 | 4.5 |
| Рапс | – | –23.0* | –15.4 | – | – | 22.5 | 77.5 | – |
| Рыжик | –34.6 | –23.8* | –12.8 | – | 14.1 | 21.3 | 64.6 | – |
| Тыква | –36.6 | –23.1 | –16.3* | 3.8* | 16.1 | 50.4 | 5.8 | 16.1 |
| Кукуруза | –33.2 | –21.5 | –7.0* | – | 12.9 | 32.1 | 55.0 | – |
| Расторопша (ВГУИТ), образец 1 | –35.7 | –24.9 | –18.2* | –6.2* | 13.5 | 35.2 | 33 | 18.4 |
| Расторопша (ООО “Русская олива”, образец 2 | –34.8 | –21.7 | –15.1* | –5.8* | 11.9 | 40.5 | 28.5 | 21.0 |
| Расторопша (торговая сеть), образец 3 | –38.3 | –26.6 | –20* | –3.7* | 14.3 | 12.1 | 49.6 | 23.9 |
| Расторопша, образец 3 + подсолнечник (9 : 1) | –40.3 | –21.4 | –10.5* | 0.4* | 19.3 | 28.5 | 7.8 | 14.3 |
| Расторопша, образец 3 + кукуруза (9 : 1) | –35.5 | –28.1 | –22.5* | –13.3* | 7.8 | 3.6 | 64.4 | 24.2 |
Таблица 2.
Триглицеридный состав образцов растительных масел
| Триглицерид | NEC* | Рыжик | Лён | Рапс | Подсолнечник | Амарант | Тыква | Расторопша | Кукуруза |
|---|---|---|---|---|---|---|---|---|---|
| ${\text{L}}_{3}^{{''}}$ | 35.4 | 4.6 | 22.6 | 1.2 | 0 | 0 | 0 | 0 | 0 |
| ${\text{L}}_{2}^{{''}}$L | 37.4 | 4.5 | 11.4 | 1 | 0 | 0 | 0 | 0 | 0 |
| L"L2 | 39.4 | 3.1 | 3.7 | 3.8 | 0 | 0 | 0 | 0 | 3.7 |
| ${\text{L}}_{2}^{{''}}$O | 39.4 | 4.9 | 13.9 | 7.7 | 0 | 0 | 0 | 0 | 1.9 |
| ${\text{L}}_{2}^{{''}}$P | 39.6 | 3.0 | 7.0 | 0.6 | 0 | 0 | 0 | 0 | 0 |
| L3 | 41.4 | 3.3 | 1.5 | 1.4 | 33.0 | 12.0 | 14.2 | 15.6 | 30.7 |
| L"LO | 41.4 | 12.7 | 5.4 | 6.5 | 0 | 0 | 0 | 0 | 5.7 |
| ${\text{L}}_{2}^{{''}}$E | 41.4 | 9.8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| L"LP+${\text{L}}_{2}^{{''}}$S | 41.6 | 4.1 | 8.5 | 1.2 | 0 | 0 | 0 | 0 | 0 |
| L2O | 43.4 | 2.5 | 2 | 9.1 | 26 | 16.4 | 19.6 | 20.5 | 15 |
| L"O2 | 43.4 | 3.2 | 6.9 | 8.9 | 0 | 0 | 0 | 0 | 0 |
| L"LE | 43.4 | 4.9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| L'LS + L2P | 43.6 | 4.2 | 0 | 1.2 | 0 | 0 | 0 | 0 | 0 |
| L"OP | 43.6 | 1.8 | 3.6 | 2 | 0 | 0 | 0 | 0 | 0 |
| L"P2 | 43.8 | 2.7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| L2P | 43.6 | 0 | 0 | 0 | 9.8 | 15.8 | 14.3 | 8.4 | 0 |
| LO2 | 45.4 | 6.2 | 2.5 | 18.7 | 9.3 | 10.2 | 10.7 | 11.6 | 12 |
| L2E | 45.4 | 3.9 | 0 | 0 | 0 | 0 | 0 | 1.6 | 0 |
| L2S | 45.6 | 3.9 | 2.7 | 0 | 4.8 | 3.7 | 5.2 | 7.1 | 5.7 |
| LОP | 45.6 | 2.3 | 0 | 3.7 | 4.3 | 11.4 | 10.3 | 6.7 | 5.9 |
| LOP + L"OS | 45.6 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 0 |
| LP2 | 45.8 | 2.3 | 0.9 | 0 | 0.8 | 6.4 | 3.8 | 1.8 | 2 |
| L"ОE | 45.4 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| L"OA | 47.6 | 0 | 0 | 1.6 | 0 | 0 | 0 | 0 | 0 |
| LPS | 45.8 | 0 | 0 | 0 | 0 | 3.2 | 4.0 | 0 | 0 |
| O3 | 47.4 | 5.2 | 2.4 | 24.2 | 6.5 | 5 | 3.9 | 8.1 | 7.8 |
| LOS | 47.4 | 0 | 0 | 0 | 1.9 | 3.1 | 5.3 | 5.8 | 2.5 |
| O2P | 47.6 | 1.5 | 1 | 3.9 | 2.0 | 4.0 | 2.6 | 1.7 | 2.6 |
| P3 | 48.0 | 0 | 0 | 0 | 0.9 | 1.3 | 1.3 | 1.6 | 0.3 |
| OP2 | 48.8 | 0 | 0 | 0 | 0 | 2.1 | 1.2 | 0 | 2.8 |
| LS2 | 49.8 | 0 | 0 | 0 | 0 | 2.0 | 0 | 0 | 0 |
| OPS | 49.8 | 0 | 0 | 0 | 0 | 2.3 | 1.2 | 0.9 | 0.5 |
| O2E | 49.4 | 0 | 0 | 1.5 | 0 | 0 | 0 | 1.7 | 0 |
| O2S | 50.4 | 0 | 0 | 1.8 | 0.7 | 1.1 | 2.4 | 2.0 | 0.9 |
| О2E" | 51.4 | 3.4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| LOB | 51.6 | 0 | 0 | 0 | 0 | 0 | 0 | 2.2 | 0 |
| S2O | 51.8 | 0 | 0 | 0 | 0 | 0 | 0 | 0.9 | 0 |
| LPB | 51.8 | 0 | 0 | 0 | 0 | 0 | 0 | 0.6 | 0 |
| PS2 | 52.0 | 0 | 0 | 0 | 0 | 0 | 0 | 1.2 | 0 |
| ΣТАГ (UUU) | 72.2 | 72.3 | 84.0 | 74.8 | 43.6 | 48.4 | 59.1 | 76.8 | |
| ΣТАГ (UUS) | 20.8 | 26.8 | 16 | 23.5 | 39.1 | 40.1 | 33.9 | 17.6 | |
| ΣТАГ (USS) | 7 | 0.9 | 0 | 0.8 | 16 | 10.2 | 4.1 | 5.3 | |
| ΣТАГ (SSS) | 0 | 0 | 0 | 0.9 | 1.3 | 1.3 | 2.9 | 0.3 | |
* NEC = NC – 2.0ND – 0.2NAl, где NC – общее количество атомов углерода в остатках ЖК, ND – общее количество двойных связей входящих в структуру ТАГ, а NAl – количество ненасыщенных ЖК в молекуле [18].
Таблица 3.
Состав жирных кислот исследуемых образцов растительных масел (W, %)
| ЖК | Амарант | Лён | Подсолнечник | Кукуруза | Рапс | Расторопша | Рыжик | Тыква |
|---|---|---|---|---|---|---|---|---|
| Пальмитиновая (С16:0) | 17.9 | 8.3 | 6.5 | 12.3 | 4.4 | 9.7 | 9.0 | 13.3 |
| Стеариновая (С18:0) | 5.3 | 1.4 | 2.8 | 2.0 | 1.4 | 6.1 | 2.8 | 6.4 |
| Олеиновая (С18:1) | 25.2 | 18.7 | 23.3 | 27.8 | 58.6 | 28.3 | 20 | 27.7 |
| Линолевая (С18:2) | 49.1 | 16.9 | 66.4 | 54.1 | 20.1 | 50.4 | 21.6 | 52.6 |
| α-Линоленовая (С18:3) | 1.3 | 54.6 | – | 1.9 | 11.6 | – | 32.3 | – |
| Арахиновая (С20:0) | – | – | – | – | – | 1.7 | 1.3 | – |
| Эйказеновая (С20:1) | – | – | – | – | – | 1.0 | 11.1 | – |
| Бегеновая (С22:0) | – | – | – | – | – | 1.6 | – | – |
Следует отметить индивидуальный характер сочетания температур максимумов (Тi) и площадей (Si) на кривых РМ, что позволяет использовать эти теплофизические параметры для качественной идентификации.
Триглицеридный состав РМ в табл. 2 ранжирован по величине эквивалентного углеродного числа NEC, который в первом приближении прогнозирует диапазон плавления и хроматографического поведения ТАГ [18]. Чем ниже величина NEC, тем ниже температура плавления ТАГ, тем меньше его время удерживания при обращенно-фазовой ВЭЖХ. В табл. 4 приведены обнаруженные значимые линейные корреляции (1)–(32) между теплофизическими свойствами РМ и химическим составом (коэффициенты парной корреляции R > 0.50). Конечно, наблюдаемые частные тренды (1)–(32) нельзя считать репрезентативными для больших баз данных по свойствам РМ, вместе с тем установленные тенденции позволяют интерпретировать теплофизические свойства РМ и помогают проверить их подлинность.
Таблица 4.
Значимые корреляции между теплофизическими свойствами растительных масел и содержанием фракций триацилглицеринов и отдельных жирных кислот: Тi= aх + b и Si= aх + b (n = 8, P = 0.95)
| х/у | Тренд | R | х/у | Тренд | R |
|---|---|---|---|---|---|
| ΣТАГ (UUU)/ΣТАГ (UUS) | y = –0.6x + 69.2 (1) | –0.96 | O3/S3 | y = 2.6x + 13.6 (17) | 0.71 |
| ΣТАГ (UUU)/ΣТАГ (USS) | y = –0.3x + 27.0 (2) | –0.85 | L3 + L2O/S2 | y = 0.6x + 31.2 (18) | 0.60 |
| ΣТАГ (UUS)/ΣТАГ (USS) | y = 0.4x – 5.3 (3) | 0.69 | L3 + L2O/S3 | y = –0.9x + 56.1 (19) | –0.64 |
| ΣТАГ (UUS)/S1 | y = –0.4x + 29.3 (4) | –0.57 | LP2 + O3/S3 | y = 2.8x + 5.4 (20) | 0.69 |
| ΣТАГ (UUS)/S2 | y = –2.0x + 89.9 (5) | –0.66 | P/T3 | y = 0.9x – 26.6 (21) | 0.92 |
| ΣТАГ (UUU)/S3 | y = 1.0x – 27.9 (6) | 0.53 | P/T4 | y = 1.0x – 18.4 (22) | 0.77 |
| ΣТАГ (USS)/T3 | y = 0.7x – 17.4 (7) | 0.73 | S/T3 | y = 1.5x – 22.7 (23) | 0.69 |
| ΣТАГ (USS)/T4 | y = 0.8x – 6.8 (8) | 0.76 | S/T4 | y = 1.7x – 14.6 (24) | 0.67 |
| ΣТАГ (USS,SSS)/T3 | y = 0.5x – 17.1 (9) | 0.64 | S/S4 | y = 1.6x + 3.7 (25) | 0.53 |
| ΣТАГ (USS,SSS)/T4 | y = 0.8x – 8.1 (10) | 0.83 | O/T3 | y = 0.7x – 32.9 (26) | 0.57 |
| ΣТАГ (SSS)/T4 | y = 4.5x – 7.5 (11) | 0.69 | O/S3 | y = 1.2x – 0.7 (27) | 0.60 |
| ΣТАГ (SSS)/S4 | y = 3.8x + 5.8 (12) | 0.58 | O/S4 | y = 1.4x – 24.2 (28) | 0.77 |
| L3/S1 | y = 0.3x + 11.6 (13) | 0.58 | L/S2 | y = 0.6x + 22.9 (29) | 0.59 |
| L3/S2 | y = 0.9x + 33.6 (14) | 0.63 | L/S3 | y = –1.0x + 72.1 (30) | –0.59 |
| L3/S3 | y = –1.6x + 52.5 (15) | –0.65 | L''/T2 | y = –0.2x – 22.8 (31) | –0.73 |
| *LOP/T2 | y = 0.5x – 26.6 (16) | 0.69 | L''/T3 | y = –0.2x – 8.2 (32) | –0.90 |
Максимум при Т1. Как видно из табл. 1, максимум пика при Т1 слабо варьирует от –39 до –33°С, его относительная площадь S1 также изменяется в зависимости от вида РМ незначительно в области 12–16%, асимбатно уменьшаясь при увеличении суммы ТАГ (UUS) и симбатно возрастая с увеличением в РМ доли L3 (табл. 4). Таким образом, этот пик можно отнести прежде всего к фракции ТАГ (UUU) с наименьшими температурами плавления и NEC ≤ 41.4.
Максимум при Т2. Второй пик c максимумом при T2 от –28.5 до –21.5°С имеет наибольшую площадь S2, которая варьирует от 32 до 72%. Его формирует смесь фракций ТАГ (UUU) и ТАГ (UUS). Площадь S2 растет при увеличении в РМ доли линолевой кислоты и ТАГ, в которых присутствует остаток этой кислоты – L3, L2O, LOP, при этом возрастание доли LOP приводит к смещению максимума пика в область более высоких температур. Увеличение всей суммы ТАГ (UUS) в целом снижает площадь S2 за счет включения в состав ТАГ остатков стеариновой и других насыщенных ЖК. NEC этих ТАГ находится, как правило, в области от 41.6 до 45.6.
Максимум при Т3 смещается от –19 до –6°С. Его площадь (S3) для жидких РМ может изменяться в зависимости от вида РМ в самом широком диапазоне – от 6 до 77.5%. Он формируется смесью, содержащей преимущественно ТАГ (UUS), но с примесью ТАГ (UUU) и ТАГ (USS). Увеличение доли олеиновой, пальмитиновой и стеариновой кислот и суммы ТАГ (USS) смещает максимум пика в область более высоких температур. Площадь S3 симбатно растет при увеличении в ТАГ доли олеиновой и пальмитиновой кислот (O3, LP2) и асимбатно уменьшается при увеличении доли линолевой и линоленовой кислот в составе ТАГ. Эту область плавления можно отнести к фракции ТАГ, для которых характерны значения NEC от 45.8 до 48.8.
Максимум при Т4. Этот пик образуют прежде всего фракции ТАГ (USS) и ТАГ (SSS). Если этот пик находится в области положительных температур, то в нем преобладают ТАГ (SSS), содержащие пальмитиновую и стеариновую кислоты. Площадь S4 растет симбатно сумме ТАГ (USS) и ТАГ (SSS). Для ТАГ, формирующих этот пик, характерны значения NEC от 48 до 52.
Анализ реальных проб рассматривали на примере масла расторопши. В качестве образца сравнения использовали полученный нами образец масла (ВГУИТ). Один образец, полученный под контролем авторов, предоставлен ООО “Русская олива”. Третий образец приобрели в торговой сети. Кроме этого, из третьего образца приготовили две смеси с 10% подсолнечного и кукурузного масел. Результаты определения теплофизических характеристик приведены в табл. 1. Для визуализации и анализа данных построили контрольные карты (КК) с нормализованными параметрами Ti и Si в виде диаграмм, на оси ординат которых отложены нормализованные значения Ti и Si (рис. 4):
Рис. 4.
Контрольные карты для масла расторопши: 1 – нормализованные значения Ti (а) и Si (б), образец сравнения; 2 – образец OOO “Олива”; 3 – образец из торговой сети; 4 – образец 3 с подсолнечным маслом (9 : 1); 5 – образец 3 с кукурузным маслом (9 : 1).
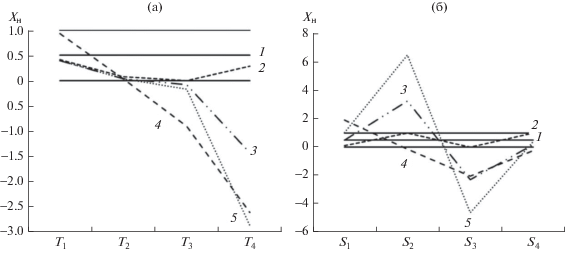
Хн = (Х – Хмин)/(Хмакс – Хмин),
а ось абсцисс является осью категорий, на которой обозначены контролируемые параметры. Известно, что натуральный состав РМ варьирует в достаточно широких пределах в зависимости от генотипических и фенотипических факторов [8, 9], что несколько усложняет контроль подлинности продукции. В связи с этим, учитывая типичный разброс в химическом составе РМ, который будет влиять на вид кривых ДСК, в КК выделили коридор допустимых значений, составляющий ±15% от значений Ti и Si, характерных для образца сравнения. В нормализованном виде минимально допустимое значение равно 0, максимальное – 1, идеальное совпадение соответствует 0.5. Как видно из рис. 4, в коридор допустимых значений от 0 до 1 попадает только образец 2. В образце 3 заметно ниже коридора находятся значения Т4 и S3, и завышено значение S2. Добавка к этому образцу подсолнечного масла приводит к занижению значения Т3, выравниванию до нормы S2 и резкому снижению Т4 при завышенном значении S1 и заниженном значении S3. Внесение кукурузного масла приводит к дополнительному падению нормализованных значений Т4 и S3 и завышению величины S2 относительно допустимого уровня. В самом общем виде такие изменения кривых ДСК для образца 3 и его смесей с подсолнечным и кукурузным маслами можно интерпретировать завышенной по сравнению с натуральным маслом расторопши долей в них ТАГ (UUU), в частности L3, и заниженной долей ТАГ (SSS). Сопоставление полученных данных позволяет предположить, что образец масла расторопши, приобретенный в розничной сети, содержал добавку около 5% кукурузного масла.
* * *
Таким образом, современные разработки в области термического анализа растительных масел методом ДСК демонстрируют его широкие возможности в идентификации и контроле качества растительных масел. Метод ДСК позволяет характеризовать теплофизические свойства образцов масла, важные в технологии их получения и применения в фармацевтической, пищевой и технической отраслях. Выполненные исследования подтверждают тот факт, что жировая фаза каждого растительного масла имеет свое неповторимое соотношение теплофизических характеристик, которое взаимосвязано с определенным фракционным составом триацилглицеринов. Метод идентификации растительных масел по термограммам плавления ДСК отличается простотой пробоподготовки и хорошей воспроизводимостью, предоставляет дополнительную информацию о происхождении сырья к полученной с помощью хроматографических методов, и может быть самостоятельным методом идентификации и контроля качества жировой фазы.
Авторы выражают благодарность канд. биол. наук Мирошниченко Л.А. (ООО “Русская Олива”) за предоставленные образцы растительных масел.
Работа выполнена при финансовой поддержке гранта № МК-590.2020.8.
Список литературы
Tan C.P., Cheman Y.B. Differential scanning calorimetric analysis of edible oils: comparison of thermal properties and chemical composition // J. Am. Oil Chem. Soc. 2000. V. 77. № 2. P. 143.
Tomaszewska-Gras J. Rapid quantitative determination of butter adulteration with palm oil using the DSC technique // Food Control. 2016. V. 60. № 2. P. 629.
Верещагин А.Л., Резниченко И.Ю., Бычин Н.В. Термический анализ в исследовании качества шоколада и кондитерских изделий // Техника и технология пищевых производств. 2019. Т. 49. № 2. С. 289.
Рудаков О.Б., Саранов И.А., Полянский К.К. Контроль содержания пальмового масла в смесях с молочным жиром методом ДСК // Аналитика и контроль. 2019. Т. 23. № 1. С. 127.
Van Wetten I.A., Van Herwaarden A.W., Splinter R., Boerrigter-Eenling R., Van Ruth S.M. Detection of sunflower oil in extra virgin olive oil by fast differential scanning calorimetry // Thermochim. Acta. 2015. V. 603. № SI. P. 237.
Chatziantoniou S.E., Triantafillou D.J., Karayannakidis P.D., Diamantopoulos E. Traceability monitoring of Greek extra virgin olive oil by Differential Scanning Calorimetry // Thermochim. Acta. 2014. V. 576. P. 9.
Zhang Zhen-Shan, Li Dong, Zhang Li-Xia, Liu Yu-Lan, Wang Xue-De. Heating effect on the DSC melting curve of flaxseed oil // J. Therm. Anal. Calorim. 2014. V. 117. № 3. P. 2129.
Рудаков О.Б., Пономарев А.Н., Полянский К.К., Любарь А.В. Жиры. Химический состав и экспертиза качества. М.: ДеЛи Принт, 2005. 312 с.
О’Брайен Р. Жиры и масла. Производство, состав и свойство, применение. СПб: Профессия, 2007. 752 с.
Дейнека В.И., Туртыгин А.В., Дейнека Л.А. Сопоставление эффективности методов ГЖХ и ВЭЖХ при дифференциации растительных масел, содержащих изомеры октадекатриеновых кислот // Аналитика и контроль. 2016. Т. 20. № 4. С. 314.
Ань В.Н., Дейнека В.И., Хиен Ч.Т.Н., Дейнека Л.А., Рудаков О.Б. Установление подлинности сыров методом обращенно-фазовой ВЭЖХ // Сорбционные и хроматографические процессы. 2018. Т. 18. № 6. С. 816.
Ань Ван Нгуен, Дейнека В.И., Лонг Куок Фам, Фыонг Лан Доан, Дейнека Л.А., Ань Тхи Нгок Ву, Тхуи Тхи Тху Динь. Определение триацилглицеринов и жирнокислотного состава масла семян Momordica cochinchinensis и некоторых других растений данного рода // Химия растительного сырья. 2019. № 3. С. 53.
Нгуен А.В., Попова А.А., Дейнека В.И., Дейнека Л.А. Определение триацилглицеринов масла манкетти методом обращенно-фазовой ВЭЖХ // Журн. аналит. химии. 2017. Т. 72. № 9. С. 854. (An Nguen Van, Popova A.A., Deineka V.I., Deineka L.A. Determination of triacylglycerols of manketti oil by reversed-phase HPLC // J. Analyt. Chem. 2017. V. 72. № 9. P. 1007.)
Дейнека В.И., Дейнека Л.А., Анисимович И.П., Перистый В.А., Туртыгин А.В. Использование обращенно-фазовой ВЭЖХ в установлении подлинности жиров и масел // Заводск. лаборатория. 2008. Т. 74. № 3. С. 15.
Дейнека В.И., Староверов В.М., Фофанов Г.М., Балятинская Л.Н. Инкрементный подход при определении состава триглицеридов // Химико-фармацевтический журнал. 2002. Т. 36. № 7. С. 50. (Deineka V.I., Staroverov V.M., Fofanov G.M., Balyatinskaya L.N. An increment approach to the HPLC analysis of triglycerides // Pharm. Chem. J. 2002. V. 36. № 7. С. 392.)
Andrikopoulos N.K. Chromatographic and spectroscopic methods in the analysis of triacylglycerol species and regiospecific isomers of oils and fats // Crit. Rev. Food Sci. Nutr. 2002. V. 42. № 5. P. 473.
Jabeur H., Zribi A., Makni J., Rebai A., Abdelhedi R., Bouaziz M. Detection of chemlali extra-virgin olive oil adulteration mixed with soybean oil, corn oil, and sunflower oil by using GC and HPLC // J. Agric. Food Chem. 2014. V. 62. № 21. P. 4893.
Podlaha O., Toregerd B. System for identification of triglycerides in reversed phase HPLC chromatograms based on equivalent carbon numbers // J. High Resolut. Chromatogr. Chromatogr. Commun. 1982. V. 5. P. 553.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


