Журнал аналитической химии, 2021, T. 76, № 3, стр. 227-233
Определение меламина методом спектроскопии диффузного отражения по его влиянию на формирование нанокомпозита золота и пенополиуретана
А. И. Исаченко a, А. О. Мелехин a, В. В. Апяри a, *, П. А. Волков b, С. Г. Дмитриенко a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1/3, Россия
b Институт химических реактивов и особо чистых химических веществ Национального исследовательского центра “Курчатовский институт”
107076 Москва, ул. Богородский вал, 3, Россия
* E-mail: apyari@mail.ru
Поступила в редакцию 25.12.2019
После доработки 14.09.2020
Принята к публикации 21.09.2020
Аннотация
Предложен химический способ получения нанокомпозита на основе наночастиц золота (AuНЧ) и пенополиуретана (ППУ). Он включает сорбцию восстановителя – борогидрида натрия на ППУ из раствора, содержащего гидроксид натрия в качестве стабилизатора и бромид цетилтриметиламмония в роли ион-парного реагента, и последующее взаимодействие модифицированного полимера с золотохлористоводородной кислотой, приводящее к образованию окрашенного нанокомпозита. Оценена возможность использования процесса формирования нанокомпозита на основе AuНЧ и ППУ для определения меламина в сухом молоке и заменителе сухого молока методом спектроскопии диффузного отражения. Установлено, что меламин оказывает влияние на образование данного нанокомпозита, вызывая уменьшение интенсивности полосы поверхностного плазмонного резонанса наночастиц золота в составе материала. Этот эффект предложено использовать для определения меламина методом спектроскопии диффузного отражения. Исследовано влияние времени взаимодействия, pH раствора и концентрации золотохлористоводородной кислоты на аналитический сигнал, а также мешающее влияние аминокислот при определении меламина. В выбранных условиях предел обнаружения меламина составил 0.2 мг/л.
Меламин (2,4,6-триамино-1,3,5-триазин) используют в промышленном органическом синтезе для производства смол, дубителей, красителей и гербицидов. В последние годы меламин привлек к себе внимание благодаря серии широко освещаемых инцидентов, связанных с безопасностью пищевых продуктов [1, 2]. Обнаружено, что недобросовестные производители добавляли меламин, содержащий 66% азота, в продукты питания и корма для животных, чтобы имитировать высокое содержание белка – одного из важнейших показателей качества продукции, определяющих ее пищевую ценность.
Меламин не метаболизируется в организме человека и образует нерастворимые комплексы с циануровой кислотой, что приводит к образованию нерастворимых кристаллов цианурата меламина в почках [3]. Загрязнение меламином молока, молочных смесей для детского питания, яиц и других продуктов привело к появлению камней в почках у тысяч новорожденных в 2008 г. в Китае, было зарегистрировано шесть летальных случаев [4]. Выявление этой проблемы вызвало необходимость строгого контроля содержания меламина в продуктах питания. В большинстве стран, включая Россию, утверждены предельно допустимые концентрации меламина в продуктах питания, которые составляют менее 1 мг/кг [5].
Проблеме определения меламина в продуктах питания посвящен ряд обзоров [6–10 ] и оригинальных публикаций [11–15]. Основными методами определения меламина в продуктах питания являются газовая хроматография [11], высокоэффективная жидкостная хроматография [12, 13], в том числе c масс-спектрометрическим детектированием [6, 14 ] , спектроскопия гигантского комбинационного рассеяния [15]. Несмотря на очевидные достоинства перечисленных методов, они в большинстве случаев требуют дорогостоящего оборудования, высококвалифицированного персонала, а зачастую и сложной предварительной подготовки образца. Разработка простых, экспрессных и чувствительных методов определения меламина, не требующих применения дорогих и сложных приборов, остается актуальной задачей.
В последние годы наночастицы золота (AuНЧ) находят применение в качестве колориметрических зондов для обнаружения и определения различных веществ. Их применение в спектрофотометрии обусловлено наблюдаемым для них эффектом поверхностного плазмонного резонанса, вызывающим возникновение интенсивной полосы поглощения около 520 нм [16, 17]. С использованием AuНЧ разработано множество простых и чувствительных методик определения неорганических ионов и органических соединений [18, 19], включая меламин [20–30].
Для стабилизации и улучшения эксплуатационных характеристик наночастиц золота их можно иммобилизовать на различных твердых матрицах. Полученные данным способом нанокомпозиты могут выгодно отличаться по своим химико-аналитическим характеристикам от классических твердофазных хромогенных реагентов и других оптических сенсорных систем. Среди всего многообразия матриц стоит выделить пенополиуретаны (ППУ), обладающие рядом достоинств: хорошая сорбционная способность, малая плотность (0.015–0.045 г/см3), монолитность, устойчивость к термоокислительной деструкции, химическая инертность по отношению ко многим соединениям [31]. Описано использование таких нанокомпозитов для определения цистеина и других тиосоединений [32, 33]. При использовании этих твердофазных реагентов регистрация аналитического сигнала, в частности, может быть легко осуществлена с помощью таких компактных и дешевых устройств, как мини-спектрофотометры – калибраторы мониторов, сканеры, цифровые фотокамеры и т.д. [34, 35].
Цель данной работы − изучение возможности определения меламина методом спектроскопии диффузного отражения по его влиянию на формирование нанокомпозитов AuНЧ и ППУ, проявляющемуся в изменении интенсивности полосы поверхностного плазмонного резонанса AuНЧ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты, материалы и оборудование. Использовали меламин (99%, Acros Organics, Бельгия), борогидрид натрия (99%, Acros Organics, Бельгия), золотохлористоводородную кислоту х. ч., цетилтриметиламмония бромид (ЦТМА) х. ч., NaOH ч. д. а, HCl х. ч., трихлоруксусную кислоту ч. д. а., этанол ч. д. а., цистеин ч. д. а., тирозин ч. д. а., аланин ч. д. а., серин ч. д. а., фенилаланин ч. д. а., изолейцин ч. д. а., метионин ч. д. а., фосфорную кислоту ч. д. а., дигидрофосфат калия ч. д. а. Растворы реагентов готовили в деионизованной воде. Таблетки ППУ диаметром 16 мм, толщиной 4 мм и массой 20 ± 2 мг выбивали металлическим пробойником из промышленного листа полимера. Для очистки от примесей таблетки ППУ помещали в ацетон и встряхивали в течение 10 мин, процедуру повторяли дважды, после чего их высушивали под струей воздуха. Таблетки хранили в защищенном от света месте.
Спектры диффузного отражения в видимой области регистрировали на мини-спектрофотометре – калибраторе мониторов Eye-OnePro 2 (X-Rite, США). Значения pH контролировали на иономере Эксперт 001 (ЭкониксЭксперт, Россия). Электронно-микроскопические исследования проводили с использованием сканирующего электронного микроскопа JSM 7100 F (Jeol, Япония). Деионизованную воду получали с использованием системы очистки Simplicity (Millipore, США). Использовали механический шейкер.
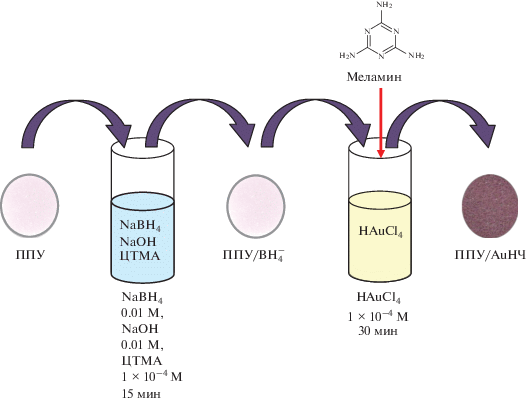
Техника эксперимента. Для изучения влияния меламина на образование AuНЧ на поверхности ППУ эксперимент проводили в 2 этапа (рис. 1). На первом этапе сорбционным способом получали ППУ, модифицированный борогидридом натрия. Сорбцию осуществляли в статическом режиме. Таблетки ППУ помещали в 5 мл водного раствора, содержащего 0.01 М борогидрид натрия, 0.01 М гидроксид натрия и 0.0001 М ЦТМА, прожимали их стеклянной палочкой для удаления воздуха из пор и встряхивали на шейкере 15 мин. После этого таблетки извлекали и высушивали фильтровальной бумагой. На втором этапе свежеприготовленные таблетки ППУ, модифицированного борогидридом, помещали в 5 мл раствора золотохлористоводородной кислоты с концентрацией 20 мкг/мл по золоту, содержащего меламин. Затем таблетки тщательно прожимали стеклянной палочкой и перемешивали с раствором путем встряхивания на шейкере в течение получаса. Таблетки извлекали и высушивали фильтрoвальной бумагой. После этого снимали их спектры диффузного отражения и строили зависимость в координатах функция Кубелки−Мунка (F)–длина волны (нм):
где R – диффузное отражение при данной длине волны; ε – молярный коэффициент поглощения сорбата, М–1 см–1; c – его концентрация, М; S – коэффициент рассеивания, см–1. О содержании AuНЧ в фазе ППУ судили по значению F при длине волны, соответствующей максимуму поглощения AuНЧ (λmax 530–540 нм).Электронная микрофотография (сканирующая электронная микроскопия) нанокомпозитов, полученных в отсутствие меламина, их спектр диффузного отражения и гистограмма распределения по размерам AuНЧ на поверхности ППУ приведены на рис. 2.
Рис. 2.
СЭМ-изображение (а), спектр диффузного отражения нанокомпозита наночастиц золота с пенополиуретаном (б) и гистограмма распределения по размерам наночастиц золота на поверхности пенополиуретана (в). Стадия 1: 0.01 М NaBH4, 0.01 М NaOH, 100 мкМ ЦТМА, t = 15 мин; стадия 2: 100 мкM HAuCl4, t = 30 мин.

РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние меламина на образование нанокомпозитов наночастиц золота и пенополиуретана. В предварительных экспериментах установлено, что присутствие меламина в растворе для синтеза нанокомпозитов (на второй стадии эксперимента) приводит к уменьшению полосы поверхностного плазмонного резонанса AuНЧ (рис. 3). Меламин, вероятно, стабилизирует AuНЧ за счет координации поверхностных атомов золота наночастиц и аминогрупп меламина, что влечет за собой уменьшение степени их сорбции на поверхности ППУ. Появление стабилизированных НЧ в растворе проявляется в возникновении слабой розовой окраски и появлении характерной полосы поглощения в спектре поглощения раствора. При увеличении концентрации меламина их доля в растворе увеличивается и одновременно уменьшается интенсивность окрашивания таблетки нанокомпозита.
Рис. 3
. Спектры диффузного отражения и фотографии нанокомпозита, полученного при концентрации меламина 0 (1), 3 (2), 10 (3) и 20 мкМ (4). Стадия 1: 0.01 М NaBH4, 0.01 М NaOH, 100 мкМ ЦТМА, t = 15 мин; стадия 2: 50 мкM HAuCl4, t = 30 мин, рН 3.7.

Уменьшение функции Кубелки−Мунка при 540 нм (∆F) связано с концентрацией меламина и может быть рассмотрено в роли аналитического сигнала при его определении методом спектроскопии диффузного отражения.
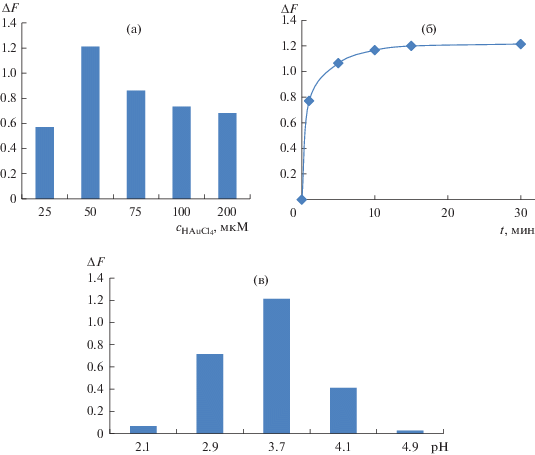
Выбор условий определения меламина. Исследовали влияние рН, времени контакта фаз и концентрации золотохлористоводородной кислоты при определении меламина по его влиянию на формирование нанокомпозитов AuНЧ и ППУ (рис. 4). Максимальный аналитический сигнал наблюдается при рН 3.5–3.7. Для поддержания заданного значения рН использован фосфатный буферный раствор на основе фосфорной кислоты и дигидрофосфата калия. Максимальный аналитический сигнал наблюдается при концентрации золотохлористоводородной кислоты 10 мкг/мл по золоту (50 мкМ) и времени контакта фаз 5–10 мин.
Рис. 4.
Зависимость аналитического сигнала от концентрации HAuCl4 (а), времени контакта фаз (б) и рН (в). Стадия 1: 0.01 М NaBH4, 0.01 М NaOH, 100 мкМ ЦТМА. Стадия 2: 15 мкМ меламин; 540 нм; 50 мкM HAuCl4 (б), (в); t = 30 мин (а), (в); рН 3.7 (а), (б).
Оценка аналитических характеристик способа. Оценены аналитические характеристики определения меламина методом спектроскопии диффузного отражения с использованием мини-спектрофотометра – калибратора мониторов. Градуировочный график в координатах ΔF = = f(смеламина, мкM) описывается уравнением ΔF = = 0.072c (r = 0.98, $S_{{{\text{ад}}}}^{2}$ = 0.015) и линеен в диапазоне 3–20 мкМ. Предел обнаружения составил 1.5 мкМ (0.2 мг/л).
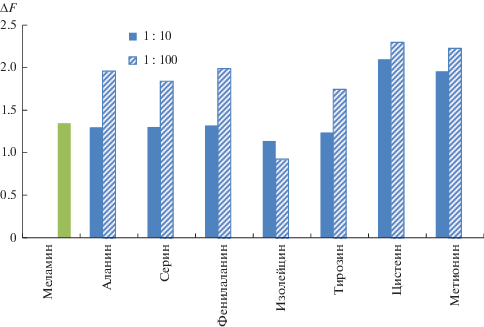
Изучено влияние аминокислот на определение меламина предложенным способом (рис. 5). Как известно, меламин определяют в молоке и молочных продуктах, поэтому важна селективность его определения относительно соединений этого класса. Установлено, что при мольном соотношении 1 : 10 аланин, изолейцин, фенилаланин, серин и тирозин не мешают определению 15 мкМ меламина; при соотношении 1 : 100 влияние этих аминокислот существенное. Серосодержащие аминокислоты метионин и цистеин оказывают мешающее влияние уже при соотношении 1 : 10, что связано с возможностью образования прочной связи серы с золотом.
Рис. 5.
Влияние аминокислот на определение 15 мкМ меламина. Стадия 1: 0.01 М NaBH4, 0.01 М NaOH, 100 мкМ ЦТМА, t = 15 мин; стадия 2: 15 мкМ меламин, 540 нм, 50 мкM HAuCl4, t = 30 мин, рН 3.7.
Разработанный способ апробирован при анализе сухого молока и заменителя сухого молока (табл. 1). Правильность оценивали методом введено–найдено. Сухое молоко и заменитель сухого молока растворяли в деонизованной воде, затем удаляли матричные компоненты добавлением 2.6%-ного раствора трихлоруксусной кислоты и центрифугированием. В полученный декантат добавляли фосфатный буферный раствор и использовали смесь для определения по предлагаемой схеме. Полученные результаты указывают на то, что разработанная методика характеризуется хорошей правильностью. Относительное стандартное отклонение не превышает 0.12.
Список литературы
Wei Y., Liu.D. Review of melamine scandal: still a long way ahead // Toxicol. Ind. Health. 2012. V. 28. № 7. P. 579.
Золотов. Ю.А. Детективная история о меламине // Журн. аналит. химии. 2010. Т. 65. С. 1125.
Puschner B., Poppenga R.H., Lowenstine L.J., Filigenzi M.S., Pesavento P.A. Assessment of melamine and cyanuric acid toxicity in cats // J. Vet. Diagn. Invest. 2007. V. 19. № 6. P. 616.
Zhang L., Wu L.L., Wang, Y.P., Liu A.M., Zou C.C., Zhao Z.Y. Melamine contaminated milk products induced urinary tract calculi in children // World J. Pediatr. 2009. V. 5. № 1. P. 31.
Определение меламина в молоке и молочных продуктах: Методические указания. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2008. 16 с.
Lin M. A review of traditional and novel detection techniques for melamine and its analogues in foods and animal feed // Front. Chem. Eng. China. 2009. V. 3. № 4. P. 427.
Chu P.W.S., Chan K.M., Cheung S.T.C., Wong Y.-C. Review of analytical techniques used in proficiency-testing programs for melamine in animal feed and milk // Trends Anal. Chem. 2010. V. 29. № 9. P. 1014.
Rovina K., Siddiquee S. A review of recent advances in melamine detection techniques // J. Food Compos. Anal. 2015. V. 43. P. 25.
Wu Y., Zhang Y. Analytical chemistry, toxicology, epidemiology and health impact assessment of melamine in infant formula: Recent progress and developments // Food Chem. Toxicol. 2013. V. 56. P. 325.
Tittlemier S.A. Methods for the analysis of melamine and related compounds in foods: A review // Food Addit. Contam. 2010. V. 27. № 2. P. 129.
Lim J., Kim G., Mo C., Kim M.S., Chao K., Qin J., Fu X., Baek I., Cho B.-K. Detection of melamine in milk powders using near-infrared hyperspectral imaging combined with regression coefficient of partial least square regression model // Talanta. 2016. V. 151. P. 183.
Faraji M., Adeli M. Sensitive determination of melamine in milk and powdered infant formula samples by high-performance liquid chromatography using dabsyl chloride derivatization followed by dispersive liquid–liquid microextraction // Food Chem. 2017. V. 221. P. 139.
Chutrtong J., Chutrtong W. Simple method for monitoring melamine in food by ion pair chromatography // Procedia Manufacturing. 2019. V. 32. P. 1000.
Zhao Z., Chen L., Bai B., Zhao X., Zhou C. Liquid chromatography-mass spectrometry method for evaluating the dissipation dynamics of cyromazine and its metabolite in Agaricus bisporus and dietary risk assessment // Environ. Sci. Pollut. R. 2018. V. 25. № 3. P. 2285.
Lin M., He L., Awika J., Yang L., Ledoux D.R., Li H. Detection of melamine in gluten, chicken feed, and processed foods using surface enhanced Raman spectroscopy and HPLC // J. Food Sci. 2008. V. 73. № 8. P. 129.
Amendola V., Pilot R., Frasconi M., Maragò O.M., Iatì M.A. Surface plasmon resonance in gold nanoparticles: A review // J. Phys.: Condens. Matter. 2017. V. 29. № 20. Article 203002. https://doi.org/10.1088/1361-648X/aa60f3
Ghosh S.K. Pal T. Interparticle coupling effect on the surface plasmon resonance of gold nanoparticles: from theory to applications // Chem. Rev. 2007. V. 107. № 11. P. 4797.
Апяри В.В., Архипова В.В., Дмитриенко С.Г., Золотов Ю.А. Применение наночастиц золота в спектрофотометрии // Журн. аналит. химии. 2014. Т. 69. № 1. С. 4. (Apyari V.V., Arkhipova V.V., Dmitrienko S.G., Zolotov Yu.A. Using gold nanoparticles in spectrophotometry // J. Anal. Chem. 2014. V. 69. № 1. P. 1.)
Апяри В.В., Дмитриенко С.Г., Горбунова М.В., Фурлетов А.А., Золотов Ю.А. Наночастицы золота и серебра в методах оптической молекулярной абсорбционной спектроскопии // Журн. аналит. химии. 2019. Т. 74. № 1. С. 26. (Apyari V.V., Dmitrienko S.G., Gorbunova M.V., Furletov A.A., Zolotov Y.A. Gold and silver nanoparticles in optical molecular absorption spectroscopy // J. Anal. Chem. 2019. V. 74. № 1. P. 21.)
Ai K.L., Liu Y.L., Lu L.H. Hydrogen-bonding recognition-induced color change of gold nanoparticles for visual detection of melamine in raw milk and infant formula // J. Am. Chem. Soc. 2009. V. 131. № 27. P. 9496.
Kuang H., Chen W., Yan W.J., Xu L.G., Zhu Y.Y., Liu L.Q. Crown ether assembly of gold nanoparticles: Melamine sensor // Biosens. Bioelectron. 2011. V. 26. № 5. P. 2032.
Ping H., Zhang M., Li H., Li S., Chen Q., Sun C., Zhang T. Visual detection of melamine in raw milk by label-free silver nanoparticles // Food Control. 2012. V. 23. № 1. P. 191.
Cao Q.A., Zhao H., He Y. J., Li X.J., Zeng L.X., Ding N. Hydrogen-bonding-induced colorimetric detection of melamine by nonaggregation-based Au-NPs as a probe // Biosens. Bioelectron. 2010. V. 25. № 12. P. 2680.
Wu Z., Zhao H., Xue Y., Cao Q., Yang J., He Y., Li X., Yuan Z. Colorimetric detection of melamine during the formation of gold nanoparticles // Biosens. Bioelectron. 2011. V. 26. № 5. P. 2574.
Chi H., Liu B.H., Guan G.J., Zhang Z.P., Han M.Y. A simple, reliable and sensitive colorimetric visualization of melamine in milk by unmodified gold nanoparticles // Analyst. 2010. V. 135. № 5. P. 1070.
Kumar N., Seth R., Kumar H. Colorimetric detection of melamine in milk by citrate-stabilized gold nanoparticles // Anal. Biochem. 2014. V.45. № 1. P. 643.
Qi W.J., Wu D., Ling J., Huang C.Z. Visual and light scattering spectrometric detections of melamine with polythymine-stabilized gold nanoparticles through specific triple hydrogen-bonding recognition // Chem. Commun. 2010. V. 46. № 27. P. 4893.
Roy B., Saha A., Nandi A.K. Melamine sensing through riboflavin stabilized gold nanoparticles // Analyst. 2011. V. 136. № 1. P. 67.
Nie B., Luo Y., Shi J., Gao L., Duan G. Bowl-like pore array made of hollow Au/Ag alloy nanoparticles for SERS detection of melamine in solid milk powder // Sens. Actuators B. 2019. V. 301. Article 127087.https://doi.org/10.1016/j.snb.2019.127087
Chen X.-Y., Ha W., Shi Y.-P. Sensitive colorimetric detection of melamine in processed raw milk using asymmetrically PEGylated gold nanoparticles // Talanta. 2019. V. 194. P. 475.
Дмитриенко С.Г., Апяри В.В. Пенополиуретаны. Сорбционные свойства и применение в химическом анализе. М.: Красанд, 2010. 264 с.
Apyari V.V., Arkhipova V.V., Isachenko A.I., Volkov P.A., Dmitrienko S.G., Torocheshnikova I.I. Label-free gold nanoparticle-based sensing of cysteine: new peculiarities and prospects // Sens. Actuators B. 2018. V. 260. P. 953.
Apyari V.V., Arkhipova V.V., Gorbunova M.V., Volkov P.A., Isachenko A.I., Dmitrienko S.G., Zolotov Yu.A. Towards the development of solid-state platform optical sensors: Aggregation of gold nanoparticles on polyurethane foam // Talanta. 2016. V. 161. P. 780.
Апяри В.В., Горбунова М.В., Исаченко А.И., Дмитриенко С.Г., Золотов Ю.А. Использование бытовых цветорегистрирующих устройств в количественном химическом анализе // Журн. аналит. химии. 2017. Т. 72. № 11. С. 963. (Apyari V.V., Gorbunova M.V., Isachenko A.I., Dmitrienko S.G., Zolotov Y.A. Use of household color-recording devices in quantitative chemical analysis // J. Anal. Chem.. 2017. V. 72. № 11. P. 1127.)
Моногарова О.В., Осколок К.В., Апяри В.В. Цветометрия в химическом анализе // Журн. аналит. химии. 2018. Т. 73. № 11. С. 857. (Monogarova O.V., Oskolok K.V., Apyari V.V. Colorimetry in chemical analysis // J. Anal. Chem. 2018. V. 73. № 11. P. 1076.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии