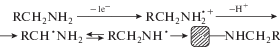Журнал аналитической химии, 2021, T. 76, № 4, стр. 342-349
Влияние взаимного расположения заместителей в молекуле аминобензойной кислоты на аналитические характеристики безметочного электрохимического иммуносенсора с ковалентно-иммобилизованным рецепторным слоем
Т. С. Свалова a, *, Р. А. Зайдуллина a, Н. Н. Малышева a, С. Ю. Сараева a, А. И. Матерн a, А. Н. Козицина a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина,
Химико-технологический институт
620002 Екатеринбург, ул. Мира, 28, Россия
* E-mail: t.s.svalova@urfu.ru
Поступила в редакцию 10.06.2020
После доработки 22.07.2020
Принята к публикации 17.08.2020
Аннотация
Исследовано влияние взаимного расположения заместителей в молекуле аминобензойной кислоты на аналитические характеристики определения бактерий Staphylococcus aureus с использованием безметочного электрохимического иммуносенсора. Наилучшие аналитические характеристики продемонстрировал безметочный электрохимический иммуносенор на основе мета-аминобензойной кислоты. По-видимому, это обусловлено наилучшим сочетанием плотности формируемого в результате электрохимического осаждения покрытия и доступности функциональных карбоксильных групп для карбодиимидной сшивки с иммунорецептором.
Экспрессное, чувствительное и надежное определение инфекционных агентов является одной из наиболее актуальных задач современной диагностики. Staphylococcus aureus (золотистый стафилококк) – одна из самых распространенных бактерий-комменсалов: колонизирует кожу и поверхности слизистых оболочек организма, может вызывать различные кожные заболевания, а также при наступлении благоприятных условий возбуждать хронические заболевания. В то же время S. aureus является частой причиной внутрибольничных инфекций (пневмонии, сепсиса и других послеоперационных осложнений) вследствие своей способности поражать практически любой орган и систему организма. Многие штаммы проявляют резистентность к традиционно используемым антибиотикам пенициллинового ряда [1, 2].
Традиционно используемым методом обнаружения бактериальных патогенов является бактериальный посев, главные недостатки которого – длительность процедуры, а также невысокая чувствительность. Метод позволяет достоверно обнаруживать лишь более чем 1000 КОЕ/мл, тогда как в ряде случае для заражения достаточно нескольких десятков [3]. Другие распространенные способы диагностики – иммуноферментный анализ и ДНК-тесты, однако они дороги в обслуживании и могут быть реализованы только в хорошо оснащенных лабораториях высококвалифицированными специалистами [4]. В связи с этим актуальной задачей является разработка портативных тест-систем и (био)сенсоров [5–7]. Безметочные электрохимические иммуносенсоры, благодаря уникальному сочетанию ультраспецифичности иммунореакции, высокой надежности, чувствительности электрохимических методов, а также экспрессности и экономичности безметочных процедур анализа, по праву занимают лидирующие позиции среди современных разработок в области создания тест-систем [8].
Ключевую роль в обеспечении требуемых аналитических характеристик определения с помощью электрохимических иммуносенсоров играет способ иммобилизации рецепторного слоя [9, 10]. Ковалентные методы иммобилизации с использованием кросс-линкеров позволяют прочно закрепить один из компонентов иммунореакции на поверхности рабочего электрода [11]. На сегодня наиболее широко распространен метод карбодиимидной сшивки. Взаимодействие карбоксильных и аминогрупп молекул кросс-линкера, предварительно иммобилизованных на поверхности рабочего электрода, с иммунорецептором происходит в “мягких”, близких к физиологическим условиях, а потому не приводит к денатурации последнего. Эффективность реакции увеличивается при добавлении в реакционную смесь катализатора – пары 1-этил-3-(3-диметиламинопропил)карбодиимид/н-гидроксисукцинимид (EDC/NHS) [12].
Предложен [13] электрохимический иммуносенсор для определения бактерий Legionella pneumophila. Монослой 16-амино-1-гексаканетиола, ковалентно иммобилизованного на поверхности золотого электрода, использован в качестве кросс-линкера для карбодиимидной сшивки с антителами. Безметочный электрохимический иммуносенсор для экспресс-определения вируса Citrus tristeza представлен в работе [14]. Моноклональные антитела иммобилизованы методом карбодиимидной сшивки на поверхности золотого электрода, модифицированного 11-меркаптоундекановой и 3-меркаптопропионовой кислотами. Аналитический сигнал регистрировали вольтамперометрически с использованием K3[Fe(CN)6]/K4[Fe(CN)6].
В качестве кросс-линкеров для карбодиимидной сшивки нередко применяют карбоновые кислоты, амины и аминокислоты, иммобилизованные на поверхности электрода, в частности, посредством электрохимического осаждения [15]. Предложенный Пинсоном метод электрографтинга [16] сегодня приобретает все большую популярность при разработке биосенсоров и тест-систем, поскольку позволяет создавать на поверхности электрода функциональные слои различной толщины и емкости, пригодные для биоконъюгации. Выделяют восстановительный и окислительный электрографтинг.
Среди множества публикаций по электрографтингу более половины посвящено электрохимическому восстановлению солей арилдиазония [17–20]. Авторами работы [21] предложен способ ковалентной иммобилизации рецептора для определения простатспецифического антигена на основе электрографтинга 4-азидофенилдиазония. Оригинальный подход позволяет контролировать плотность иммобилизации рецепторного слоя и реализовать безреагентное и ультрачувствительное (до 10–12 М) определение онкомаркера. Ранее нами показано [22], что структурирование рецепторного слоя безметочного электрохимического иммуносенсора посредством электрографтинга хлорида п-нитрофенилдиазония и последующей карбодиимидной иммобилизацией антител позволяет улучшить чувствительность определения антител к вирусу кори по отношению к аналогичному иммуносенсору, но с капельно-иммобилизованным рецепторным слоем. К ограничениям метода большинство авторов относят крайне низкую стабильность солей диазония. Поверхностные характеристики модифицированных электродов в значительной степени определяются условиями электровосстановления, природой радикала и фонового электролита [23]. Так, например, электрографтинг солей диазония с отличным от бензольного радикалом позволил сформировать на поверхности электрода тонкий функциональный слой и улучшить аналитические характеристики иммуносенсора для определения карциноэмбрионального антигена [24].
В настоящее время все большее внимание исследователей привлекают методы окислительного электрографтинга. Известны реакции электрохимического окисления органических аминов [25, 26], спиртов, карбоновых кислот [27], сопровождающиеся образованием ковалентной связи органической молекулы с поверхностью рабочего электрода. Окислительный электрографтинг аминов представляет особый интерес. Установлено, что ароматические амины легче алифатических подвергаются электрохимическому окислению. Изучены процессы электрографтинга п-аминосульфоновой, п-аминобензилфосфоной и других ароматических аминокислот на поверхности металлических и углеродсодержащих электродов в водной среде [28–31]. Толщина, сплошность, проводимость покрытий, а также карбодиимидная емкость (количество функциональных амино-/карбоксильных групп) модифицированных электродов определенно зависит от взаимного расположения заместителей в органической молекуле и во многом определяет аналитические характеристики биосенсоров.
Цель настоящего исследования – оценка влияния взаимного расположения заместителей в молекуле аминобензойной кислоты, электрохимически осажденной на поверхности платинового электрода, на аналитические характеристики безметочного электрохимического иммуносенсора для определения бактерий S. aureus в водной среде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и рабочие растворы. Все реактивы были предоставлены фирмой “Sigma-Aldrich” (США): 2-аминобензойная кислота (о-АБК), 3-аминобензойная кислота (м-АБК), 4-аминобензойная кислота (п-АБК), хлорид калия, калия гексацианоферрат(II/III), аминоферроцен, N-гидроксисукцинимид (NHS), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), антитела против Staphylococcus aureus (1 мг/мл), бактерии Staphylococcus aureus, фосфатные буферные растворы с pH 5.0–7.0 (K2HPO4/KH2PO4, 0.067 М, приготовлены по стандартной методике).
Методики эксперимента. Электрографтинг аминобензойных кислот. Рабочую поверхность планарного платинового электрода тщательно полировали оксидом алюминия и промывали водой. Полировку проводили до тех пор, пока не получали типичные циклические вольтамперограммы K3[Fe(CN)6]/K4[Fe(CN)6] (5 мМ), характерные для “чистого электрода”. Аминобензойную кислоту (5 мМ) растворяли в 0.1 М растворе KCl при активном перемешивании. Электрод выдерживали в растворе аминобензойной кислоты при линейно изменяющемся потенциале. Регистрировали 1 цикл с разверткой потенциала от 0.5 до 1.2 В, со скоростью сканирования 10 мВ/с.
Карбодиимидная иммобилизация антител и формирование иммунокомплекса. Карбоксильные группы электроосажденного слоя активировали с использованием системы EDC/NHS. Инкубацию модифицированного платинового электрода проводили в растворе 100 мМ NHS и 400 мМ EDC в фосфатном буферном растворе с pH 5.0 (с 0.067 М) в течение 30 мин. Далее отмывали непрореагировавшие компоненты буферным раствором с рабочей поверхности электрода. После активации модифицированный электрод инкубировали в 50 мкл суспензии, содержащей антитела к S. aureus, при комнатной температуре в течение 30 мин. Непрореагировавшие карбоксильные группы блокировали путем инкубации электрода в 0.25%-ном растворе бычьего сывороточного альбумина. Далее электрод снова промывали буферным раствором и инкубировали в модельной суспензии бактерий при 37°С.
Приготовление стандартных суспензий бактерий S. aureus. Ночную культуру Staphylococcus aureus штамм B-1266 разводили с использованием стерильного физиологического раствора (рН 7.0–7.2) до 105–106 КОЕ/мл. Затем из полученной суспензии получали еще пять последовательных десятикратных разведений, аликвоты (10 мкл) каждой из которых высеивали на агаризованную среду для определения титра клеток в полученных разведениях.
Электрохимические измерения проводили с использованием потенциостата/гальваностата μAutolab type III (Metrohm, Швейцария) со встроенным программным обеспечением Nova 1.11 в комплекте с трехэлектродной ячейкой. Рабочим электродом служил планарный платиновый электрод (геометрическая площадь поверхности 1 см2) на керамической подложке, изготовленный методом ступенчатого отжига (ООО НПП “Эльсенс”, Екатеринбург), в качестве вспомогательного и электрода сравнения использовали стеклоуглеродный стержень и хлоридсеребряный электрод соответственно. Измерения методом электрохимической импедансной спектроскопии проводили при потенциале равновесия (0.35 В), изменяющемся с амплитудой 0.02 В в интервале частот 100 кГц–1 Гц.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Рабочую поверхность планарных платиновых электродов модифицировали путем электрохимического осаждения о-АБК, м-АБК и п-АБК (рис. 1). Известно [25, 26, 31], что электрохимическое окисление ароматических аминов протекает при потенциале около +1 В в водной или водно-органической среде и сопровождается формированием на поверхности рабочего электрода органического слоя. Как видно из рис. 1, при первичном циклировании потенциала на циклической вольтамперограмме (ЦВА) наблюдается выраженный анодный пик в области потенциалов 0.8–1 В (рис. 1а). На втором и последующих циклах ток окисления снижается, выраженного анодного пика не наблюдается (рис. 1б). При этом происходит закономерное снижение токов пиков K3[Fe(CN)6]/K4[Fe(CN)6] (рис. 1в) и увеличение сопротивления переноса заряда в эквивалентной ячейке Рэндлса R[R(CW)] (рис. 1г). Электрохимически осаждаемые органические слои блокируют рабочую поверхность электрода, затрудняя процессы переноса заряда. По данным [25] электрохимическое окисление аминов представляет собой процесс, включающий перенос электрона с образованием катион-радикала, который затем депротонирует α-аминогруппу, обеспечивая ковалентное связывание с поверхностью электрода (схема 1). Толщина и сплошность осаждаемого покрытия зависит от параметров электролиза, состава фонового электролита и структуры линкера.
Схема 1. Механизм окислительного электрографтинга аминобензойной кислоты [25].
Рис. 1.
Анодные вольтамперограммы в растворах п- (1), м- (2), о-аминобензойной кислот (3) и в фоновом электролите (4) (а); циклические вольтамперограммы в растворе м-аминобензойной кислоты (3 цикла) (б); циклические вольтамперограммы K3[Fe(CN)6]/K4[Fe(CN)6] на немодифицированном (1) и модифицированном м-аминобензойной кис-лотой электродах (2) (в); диаграммы Найквиста на немодифицированном электроде (1), модифицированном п‑ (2), м- (3), о-аминобензойной кислотами (4) электродах. Рабочий электрод – планарный платиновый, концентрация аминобензойной кислоты 5 мМ, медиаторная система – 5 мМ раствор K3[Fe(CN)6]/K4[Fe(CN)6], фоновый электролит 0.1 М раствор KCl.
В настоящей работе в качестве аналитического сигнала использовали степень блокирования рабочей поверхности электрода (I*), определяемую по снижению тока пика окисления K3[Fe(CN)6]/K4[Fe(CN)6] согласно уравнению (1):
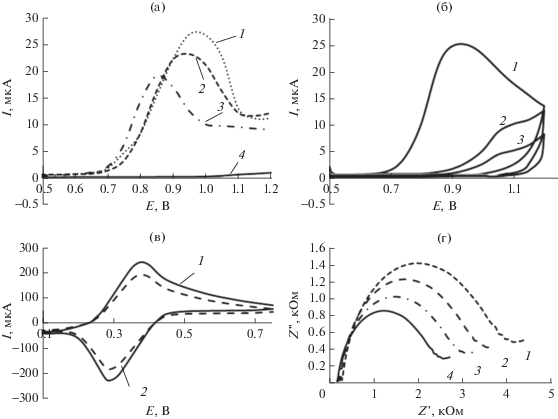
где I0 – ток пика, зарегистрированный на немодифицированном электроде; I – ток пика, зарегистрированный на модифицированном электроде.На рис. 2 приведены зависимости величины аналитического сигнала от потенциала, продолжительности электролиза и концентрации АБК. Как видно, оптимальными условиями электрографтинга АБК является электролиз в течение 3 с при потенциале, соответствующем пику на ЦВА, при концентрации не более 5 × 10–3 М. Установлено, что в выбранных условиях степень блокирования поверхности платинового электрода возрастает в ряду о-АБК < м-АБК < п-АБК (табл. 1).
Рис. 2.
Зависимости степени блокирования поверхности платинового электрода п- (1), м- (2), о-аминобензойной кислотами (3) от потенциала электролиза (а), времени электролиза (б), концентрации аминобензойной кислоты (в) (n = 3, P = 0.95).
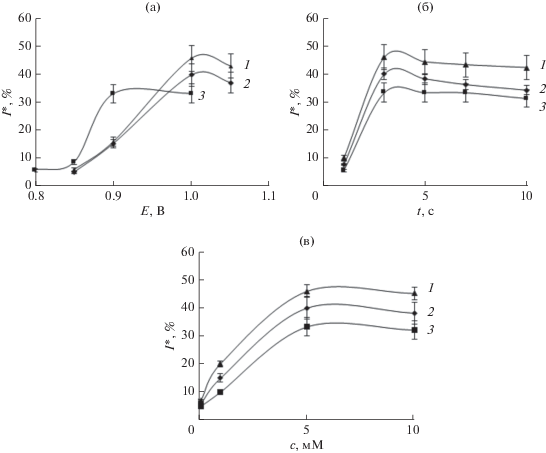
Таблица 1.
Изменение степени блокирования и импедиметрических характеристик планарного платинового электрода, модифицированного аминобензойной кислотой (n = 3, P = 0.95)
| Вещество | I*, % | R, кОм |
|---|---|---|
| о-АБК | 33 ± 3 | 3.1 ± 0.6 |
| м-АБК | 40 ± 4 | 3.8 ± 0.7 |
| п-АБК | 46 ± 5 | 4.3 ± 0.9 |
Модифицированные таким образом электроды показали стабильность аналитических характеристик при хранении как в фосфатном буферном растворе с рН 6.5 (0.067 М), так и на воздухе в течение 30 дней.
Для определения плотности карбоксильных групп на рабочей поверхности электрода, доступных для конъюгации с антителами, электроды с осажденным слоем АБК инкубировали в растворе аминоферроцена. После этого регистрировали ЦВА в 0.1 М растворе KCl и оценивали эффективность протекания реакции по величине тока пика окисления ферроцена (рис. 3). Как видно, после успешного взаимодействия карбоксильной и аминогрупп наблюдается выраженный пик при потенциале –0.2 В, соответствующий электрохимическому окислению ферроцена. Величина пика зависит от структуры поверхностного слоя модифицированных электродов и продолжительности инкубации электрода в растворе аминоферроцена (рис. 3б). Наиболее быстро (в течение 5 мин) реакция протекает на электродах, модифицированных о-АБК; максимальная величина тока пика ферроцена зарегистрирована на электродах с электроосажденной м-АБК. Поверхностную концентрацию доступных для коньюгации функциональных карбоксильных групп рассчитывали по уравнению (2) (результаты приведены в табл. 2):
где Γ – поверхностная концентрация иммобилизованной АБК на поверхности платинового электрода, моль/см2; Q – количество электричества; Кл, n – число электронов, участвующих в реакции; F – постоянная Фарадея, равная 96 485.3 Кл/моль; A – геометрическая площадь поверхности планарного платинового электрода (1 см2). Полученные средние расчетные значения приведены ниже (n = 3, P = 0.95):Рис. 3.
Дифференциально-импульсные вольтамперограммы, зарегистрированные в 0.1 М растворе KCl после инкубации модифицированных электродов в растворе аминоферроцена (а); зависимости тока пика аминоферроцена от времени инкубации (б): 1 – м-аминобензойная кислота, 2 – п-аминобензойная кислота, 3 – о-аминобензойная кислота (n = 3, P = 0.95).
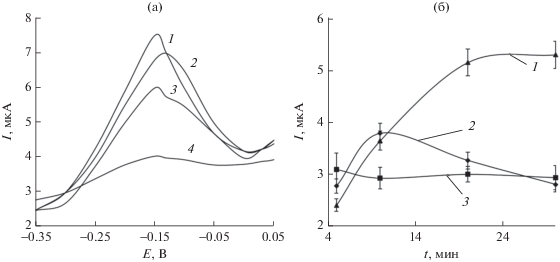
Таблица 2.
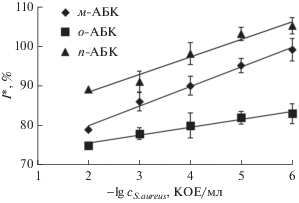
Аналитические характеристики безметочных электрохимических иммуносенсоров для определения S. aureus1 (n = 5, P = 0.95)
| Вещество | Уравнение градуировочной зависимости | Предел обнаружения, КОЕ/мл |
|---|---|---|
| о-АБК | I* = (2.5 ± 0.3)lg c + (69 ± 5) | 16.4 |
| м-АБК | I* = (4.8 ± 0.5)lg c + (71 ± 6) | 8.2 |
| п-АБК | I* = (3.9 ± 0.4)lg c + (82 ± 7) | 12.6 |
Планарные платиновые электроды с электроосажденным слоем м-АБК характеризуются максимальным значением расчетной величины поверхностной концентрации карбоксильных групп, доступных для биоконъюгации.
На рис. 4 приведены зависимости аналитического сигнала от условий иммобилизации антител и формирования иммунокомплекса на поверхности планарного платинового электрода, модифицированного АБК. Принимая во внимание характер полученных зависимостей, в дальнейшей работе рецепторный слой формировали в течение 30 мин в суспензии антител с концентрацией 0.1 г/л, формирование иммунокомплекса осуществляли в течение 25 мин в фосфатном буферном растворе с рН 6.5 (0.067 М).
Рис. 4.
Зависимости величины I* от рН буферного раствора (а), концентрации антител к S. aureus (б), времени иммобилизации антител (1) и формирования иммунокомплекса (2) (в) (n = 3, P = 0.95).

В выбранных условиях получены градуировочные зависимости величины аналитического сигнала безметочного электрохимического иммуносенсора от концентрации бактерий S. aureus в модельных суспензиях (рис. 5) и определены аналитические характеристики детектирования бактерий (табл. 2). Полученные результаты указывают на высокую чувствительность и точность определения бактерий S. aureus в модельных суспензиях. Наилучшие аналитические характеристики продемонстрировал безметочный электрохимический иммуносенор на основе м-АБК. По-видимому, это обусловлено наилучшим сочетанием плотности формируемого в результате электрохимического осаждения покрытия и доступности функциональных карбоксильных групп для карбодиимидной сшивки с иммунорецептором.
Рис. 5.
Градуировочные зависимости величины I* от концентрации бактерий S. aureus в модельных суспензиях (n = 5, P = 0.95).
Работа выполнена при поддержке Совета по грантам Президента Российской Федерации (грант № МК-567.2020.3).
Список литературы
Bush L.M., Schmidt C.E., Perez M.T. Staphylococcus infections. https://www.merckmanuals.com/professional/infectious-diseases/gram-positive-cocci/staphylococcal-infections (26.05.2020).
Moreillon P., Que Y.-A., Glauser M.P. Staphylococcus aureus (Including Staphylococcal Toxic Shock) / Principles and practice of infectious disease. 6th Ed. / Eds. Mandell G.L., Bennett J.E., Dolin R. Philadelphia: Churchill Livingstone, 2005. P. 2701.
Vandepitte J., Engbaek K., Piot P. Heuck C.C. Основные методы лабораторных исследований в клинической бактериологии. М: Медицина, 1994. 132 с.
Struelens M.J., Hawkey P.M., French G.L., Witte W., Tacconelli E. Laboratory tools and strategies for methicillin-resistant Staphylococcus aureus screening, surveillance and typing: state of the art and unmet needs // Clin. Microbiol. Inf. 2009. V. 15. № 2. P. 112.
Li L., Wang C., Nie Y., Yao B., Hu H. Nanofabrication enabled lab-on-a-chip technology for the manipulation and detection of bacteria // Trends Anal. Chem. 2020. V. 127. Article 115905.
Rubab M., Shahbaz H. M., Olaimat A.N., Oh D.-H. Biosensors for rapid and sensitive detection of Staphylococcus aureus in food // Biosens. Bioelectron. 2018. V. 105. P. 49.
Козицина А.Н. Электрохимические сенсорные системы на основе органических и неорганических наноразмерных модификаторов для бесферментного определения клинически значимых соединений. Дис. … док. хим. наук. Екатеринбург: Уральский Федеральный университет, 2018. 343 с.
Riu J., Giussani B. Electrochemical biosensors for the detection of pathogenic bacteria in food // Trends Anal. Chem. 2020. V. 126. Article 115863.
Kokkinos C., Economou A., Prodromidis M.I. Electrochemical immunosensors: Critical survey of different architectures and transduction strategies // Trends Anal. Chem. 2016. T. 79. C. 88.
Евтюгин Г.А., Будников Г.К., Стойкова Е.Е. Основы биосенсорики. Казань: Казанский гос. ун-т, 2007. 80 с.
Kozitsina A., Svalova T., Malysheva N., Glazyrina Y., Matern A., Rusinov V. Determination of Staphylococcus aureus B-1266 by an enzyme-free electrochemical immunosensor incorporating magnetite nanoparticles // Anal. Lett. 2017. V. 50. № 6. P. 924.
Hermanson G.T. Bioconjugate Technique. Rockford, IL, USA: Pierce Biotechnology, 2013. C. 259.
Laribi A., Allegra S., Souiri M., Mzoughi R., Othmane A., Girardot F. Legionella pneumophila sg1-sensing signal enhancement using a novel electrochemical immunosensor in dynamic detection mode // Talanta. 2020. V. 215. Article 120904.
Haji-Hashemi H., Norouzi P., Safarnejad M.R., Ganjali M.R. Label-free electrochemical immunosensor for direct detection of Citrus tristeza virus using modified gold electrode // Sens. Actuators B. 2017. V. 244. P. 211.
Mattson G., Conklin E., Desai S., Nielander G., Savage M.D., Morgensen S. A practical approach to crosslinking // Mol. Biol. Rep. 1993. V. 17. № 3. P. 167.
Bélanger D., Pinson J. Electrografting: a powerful method for surface modification. // Chem. Soc. Rev. 2011. V. 40. № 7. P. 3995.
Cao C., Zhang Y., Jiang C., Qi M., Liu G. Advances on aryldiazonium salt chemistry based interfacial fabrication for sensing applications // ACS Appl. Mater. Interfaces. 2017. T. 9. № 6. C. 5031.
Shul G., Parent R., Mosqueda H.A., Bélanger D. Localized in situ generation of diazonium cations by electrocatalytic formation of a diazotization reagent // ACS Appl. Mater. Interfaces. 2013. V. 5. № 4. P. 1468.
Yáñez-Sedeño P., González-Cortés A., Campuzano S., Pingarrón J.M. Copper(I)-catalyzed click chemistry as a tool for the functionalization of nanomaterials and the preparation of electrochemical (bio)sensors // Sensors. 2019. V. 19. № 10. C. 2379.
Menanteau T., Levillain E., Downard A.J., Breton T. Evidence of monolayer formation via diazonium grafting with a radical scavenger: Electrochemical, AFM and XPS monitoring // Phys. Chem. Chem. Phys. 2015. V. 17. № 19. P. 13137.
Nowicka A.M., Fau M., Rapecki T., Donten M. Polypyrrole-Au nanoparticles composite as suitable platform for DNA biosensor with electrochemical impedance spectroscopy detection // Electrochim. Acta. 2014. V. 140. P. 65.
Свалова Т.С., Малышева Н.Н., Бубекова А.К., Сайгушкина А.А., Медведева М.В., Козицина А.Н. Влияние способа иммобилизации рецепторного слоя на аналитические характеристики безметочного электрохимического иммуносенсора для определения антител к вирусу кори // Журн. аналит. химии. 2020. Т. 75. № 2. С. 162. (Svalova T.S., Malysheva N.N., Bubekova A.K., Saigushkina A.A., Medvedeva M.V., Kozitsina A.N. Effect of the method for immobilizing receptor layer on the analytical characteristics of a label-free electrochemical immunosensor for the determination of measles antibodies // J. Analyt. Chem. 2020. V. 75. № 2. P. 254.)
Карякин А., Уласова E., Вагин M., Карякина E. Биосенсоры: устройство, классификация и функциональные характеристики // Сенсор. 2002. Т. 24. С. 1.
Svalova T.S., Saigushkina A.A., Medvedeva M.V., Malysheva N.N., Zhdanovskikh V.O., Kozitsin I.V., Kozitsina A.N. Modification of gold electrode via electrografting of the in situ generated 3-carboxy-1,2,4-triazoldiazonium salt for label-free determination of carcinoembryonic antigen // Electroanalysis. 2020. V. 32. № 4. P. 698.
Adenier A., Chehimi M. M., Gallardo I., Pinson J., Vilà N. Electrochemical oxidation of aliphatic amines and their attachment to carbon and metal surfaces // Langmuir. 2004. V. 20. № 19. P. 8243.
Yang G., Liu B., Dong S. Covalent modification of glassy carbon electrode during electrochemical oxidation process of 4-aminobenzylphosphonic acid in aqueous solution // J. Electroanal. Chem. 2005. V. 585. № 2. P. 301.
Randriamahazaka H., Ghilane J. Electrografting and controlled surface functionalization of carbon based surfaces for electroanalysis // Electroanalysis. 2016. V. 28. № 1. P. 13.
Vanossi D., Benassi R., Parenti F., Tassinari F., Giovanardi R., Florini N., De Renzi V., Arnaud G., Fontanesi C. Functionalization of glassy carbon surface by means of aliphatic and aromatic amino acids. An experimental and theoretical integrated approach // Electrochim. Acta. 2012. V. 75. P. 49.
Yang G., Shen Y., Wang M., Chen H., Liu B., Dong S. Copper hexacyanoferrate multilayer films on glassy carbon electrode modified with 4-aminobenzoic acid in aqueous solution // Talanta. 2006. V. 68. № 3. C. 741.
Guerrero S., Agüí L., Yáñez-Sedeño P., Pingarrón J.M. Screen-printed gold electrodes functionalized with grafted p-aminobenzoic acid for the construction of electrochemical immunosensors. determination of TGF-β1 cytokine in human plasma // Electroanalysis. 2018. V. 30. № 7. P. 1327.
Liu J., Cheng L., Liu B., Dong S. Covalent modification of a glassy carbon surface by 4-aminobenzoic acid and its application in fabrication of a polyoxometalates-consisting monolayer and multilayer films // Langmuir. 2000. V. 16. № 19. P. 7471.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии