Журнал аналитической химии, 2021, T. 76, № 4, стр. 331-341
Особенности образования и хроматографического детектирования гидратов органических соединений
И. Г. Зенкевич a, *, Д. А. Никитина a, А. Деруиш a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 17.10.2020
После доработки 15.11.2020
Принята к публикации 15.11.2020
Аннотация
Образование гидратов неорганических соединений хорошо известно и широко обсуждается в современной литературе. Проанализированы причины недостаточно подробной характеристики не менее многочисленных известных гидратов органических соединений, главная из которых заключается в их нестабильности. Подтверждением интереса к таким гидратам можно считать присвоенные многим из них номера CAS. Показано, что обратимое образование гидратов органических соединений различной химической природы может быть одной из причин аномалий зависимостей их параметров удерживания (tR) от содержания органического модификатора элюента (c) в обращенно-фазовой высокоэффективной жидкостной хроматографии. Наиболее эффективным способом выявления подобных аномалий является рекуррентная аппроксимация параметров удерживания, tR(c + Δc) = atR(c) + b (*), где Δc = const – постоянный шаг изменения c. Для соединений, у которых вариации c и, следовательно, содержания воды в элюенте (1 – c) влияют на положение равновесия Х + nH2O $ \rightleftarrows $ X ∙ nH2O, наблюдаются отклонения зависимостей вида (*) от линейности.
Образование гидратов (в общем случае – сольватов) неорганическими соединениями (прежде всего, солями) в кристаллическом состоянии и в водных растворах хорошо известно [1]. Многие неорганические гидраты могут быть выделены в индивидуальном состоянии и охарактеризованы различными методами. Что же касается ковалентно не связанных гидратов различных органических соединений (X ∙ nH2O), то они не менее многочисленны, но характеристика таких соединений чаще всего осложнена их относительно низкой стабильностью:
(1)
${\text{Х}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O }} \rightleftarrows {\text{X}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В сочетании с малой растворимостью гидрофобных органических соединений в водных средах подтверждение образования подобных гидратов может стать сложной задачей.
В справочной литературе (см., например, издания [2–5] и др.) возможность образования гидратов обычно не упоминают в ряду других свойств органических соединений. Более того, их образование относительно редко принимают во внимание даже в тех случаях, когда это представляется безусловно необходимым, в том числе в обращенно-фазовой ВЭЖХ. Обычно (по умолчанию) в этом аналитическом методе аналитам приписывают структуры безводных форм, несмотря на то, что на выходе хроматографической колонки они являются компонентами водно-органических растворов и могут существовать в форме гидратов. Поскольку свойства полярных гидратов существенно отличаются от свойств менее полярных негидратированных аналогов, их обратимое образование может быть одной из главных причин аномалий хроматографического удерживания аналитов в обращенно-фазовой ВЭЖХ. Этим же объясняется относительно невысокая эффективность предсказания параметров удерживания в этом методе по расчетным значениям факторов гидрофобности негидратированных форм (lg P) [6]. Кроме того, вариации содержания гидратной воды в составе веществ приводят к закономерному межлабораторному разбросу значений их растворимости в воде, что необходимо учитывать при обработке данных [7]. Небезынтересным примером несколько “пренебрежительного” отношения к гидратам органических соединений является отсутствие соответствующей им рубрикации в Универсальной десятичной классификации (УДК).
Несмотря на относительно редкое упоминание гидратов органических соединений, в настоящее время их образование известно или предполагается для большого числа соединений различной химической природы. Их наиболее объективной характеристикой являются константы гидратации, Kравн, но из-за экспериментальных сложностей они определены лишь для небольшого числа соединений [8]:
(2)
${{K}_{{{\text{равн}}}}} = {{\left[ {{\text{X}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{X}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]} {\left\{ {\left[ {\text{X}} \right] \cdot {{{\left[ {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]}}^{n}}} \right\}}}} \right. \kern-0em} {\left\{ {\left[ {\text{X}} \right] \cdot {{{\left[ {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right]}}^{n}}} \right\}}}.$Образование гидратных форм аналитов в обращенно-фазовой ВЭЖХ может приводить к аномалиям зависимостей их параметров удерживания (tR) от содержания органического компонента (c) в элюенте, tR = f(c). Недавно показано, что выявление подобных аномалий возможно в результате рекуррентной аппроксимации указанных зависимостей [9, 10]. Однако для лучшего понимания возможностей такого способа обработки данных необходимо более детальное рассмотрение общих вопросов образования гидратов органических соединений, что и является одной из задач настоящей работы. Особенности рекуррентной аппроксимации параметров удерживания в ВЭЖХ подробно рассмотрены на примере двух лекарственных препаратов противоопухолевого действия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выбор модельных аналитов. Для характеристики зависимостей параметров удерживания от содержания органического компонента элюента (ацетонитрил) выбраны два препарата противоопухолевого действия с тривиальными названиями гефитиниб (I) и пазопаниб (II) (табл. 1), выпускаемые ЗАО “Биокад” (Санкт-Петербург).
Таблица 1.
Модельные аналиты для характеристики зависимостей параметров удерживания от содержания органического компонента элюента
| Тривиальное название, CAS № | Молекулярная формула | Структурная формула |
|---|---|---|
| Гефитиниб (I) (Gefitinib) CAS № 184475-35-2 |
C22H24ClFN4O3 | 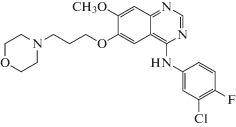 |
| Пазопаниб (II) (Pazopanib) CAS № 444731-52-6 |
C21H23N7O2S | 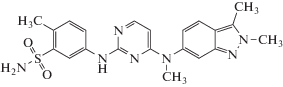 |
Хроматографическое определение соединений (I) и (II) выполняли на жидкостном хроматографе Agilent 1260 Infinity с диодно-матричным детектором с использованием колонок InfinityLabPoroshell 120 EC-C18, 50 × 3.0 мм, размер частиц сорбента 2.7 мкм (для соединения I) и XBridge, WatersPhenyl, 50 × 4.6 мм (3.5 мкм) (для соединения II) в водно-ацетонитрильных подвижных фазах с добавками ацетата аммония или муравьиной и трифторуксусной кислот в нескольких изократических режимах с интервалами концентраций органического компонента 5% при расходе элюента 0.4 мл/мин и температуре колонки 40°C. Объем проб составлял 5 мкл. Число параллельных измерений времен удерживания – три. Более обширный набор соединений охарактеризован в работе [10].
Обработка результатов. Для рекуррентной аппроксимации данных и построения графиков регрессионных уравнений использовали программное обеспечение ORIGIN (версии 4.1 и 8.1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Общие особенности образования гидратов органических соединений. Реальные структуры многих природных и синтетических органических соединений в водных растворах не всегда соответствуют их номинальным структурным формулам, что обусловлено несколькими причинами, в том числе образованием гидратов аналитов и изменением положения таутомерных равновесий. Для характеристики проблемы целесообразно начать ее обсуждение с многообразия органических соединений, для которых существование гидратов предполагается или доказано.
Обсуждаемая информация систематизирована в табл. 2 и 3. В табл. 2 перечислены 52 соединения (без учета дополнительных сведений в примечании), гидраты которых в водных растворах нестабильны. Для каждого из соединений указаны молекулярная масса безводной формы, номер CAS и некоторые наиболее характеристические свойства (прежде всего, температуры плавления, Тпл, и кипения, Ткип), а для гидратов – номер CAS (при наличии), стехиометрический состав (количество связанных молекул воды) и (редко) некоторые дополнительные данные. В последней графе “Источники информации” приведены доступные ссылки на оригинальные публикации, однако из-за их ограниченного количества в большинстве случаев указаны лишь названия сайтов, где упомянуты те или иные гидраты. Расположение соединений соответствует различным классам органических соединений, а именно ароматическим углеводородам, карбонильным соединениям, фенолам, карбоновым кислотам, амидам кислот и далее (без специальной систематизации) соединениям различной химической природы. Кроме того, в табл. 2 для сравнения упомянуты несколько соединений близкой химической природы (3,4-дихлорфенол, салициловая кислота, теобромин и диметилсульфон), для которых сведений об образовании гидратов найти не удалось.
Таблица 2.
Характеристика нестабильных гидратов некоторых органических соединений
| Соединение | Мол. масса | Безводная форма | Гидрат | Источники информации | ||
|---|---|---|---|---|---|---|
| CAS № | некоторые свойства | CAS № | состав | |||
| Антрацен | 178 | 120-12-7 | Ткип 340°С | 188974-01-8 | 1 : 1 | PubChem |
| Фенантрен | 178 | 85-01-8 | Ткип 340°С | 919080-09-4 | 1 : 1 | PubChem, ChemSpider |
| Формальдегид* | 30 | 50-00-0 | Ткип –20 ± 1°С | 463-57-0; 53280-35-6; 53280-36-7 | 1 : 1; гидраты олигомеров (n : 1); Кравн ∼ 103 | [11–13]; PubChem, ChemSpider |
| Ацетальдегид | 44 | 75-07-0 | Ткип 22°С | – | 1 : 1 | [14, 15]; ChemSpider |
| Глиоксаль | 58 | 107-22-2 | Тпл 15°С; Ткип 51°С | 4405-13-4 (дигидрат тримера) |
Гидраты олигомеров (n : x, x ≥ 1) | PubChem. ChemBook |
| Бензальдегид** | 106 | 100-52-7 | Ткип 179°С | 4403-72-9 | 2 : 1; рКа 14.9; Кравн ∼ 1 × 10–2 | [8], ChemSpider, PubChem, MolBase и др. |
| Дифторхлорацетальдегид | 114 | 811-96-1 | Ткип 17.8°С | 63034-47-9 | - | PubChem, ChemSpider, MolBase и др. |
| Ацетон | 58 | 67-64-1 | Ткип 56.1°С | 18879-06-6 (гидрат-клатрат) | 1 : 1; 1 : n
(гидрат-клатрат); Кравн ∼ 1.4 × 10–3 |
[8, 16–19]; Chemical Encyclopedia |
| 2-Бутанон | 72 | 78-93-3 | Ткип 79.6°С | – | 1 : 1 | PubChem |
| 1,1,1-Трифторацетон | 112 | 421-50-1 | Ткип 22°С | – | 1 : 1 | Spectra Base |
| Циклогексанон | 98 | 108-94-1 | Ткип 155.6°С | 28553-75-5 | 1 : 1 | ChemSpider |
| Ацетофенон | 120 | 98-86-2 | Ткип 202°С | – | Кравн ∼ 6.6×10–6 | [8], PubChem, Sigma-Aldrich |
| 2-Гидроксиацетофенон | 136 | 118-93-4; 582-24-1 |
Тпл 4.5°С; Ткип 213–218°С | – | 1 : 1 | PubChem, ChemSpider, Sigma-Aldrich |
| Ванилин | 152 | 121-33-5 | Тпл 81–83°С | – | – | HydrateWeb |
| Бензофенон | 182 | 119-61-9 | Тпл 48.5°С; Ткип 305°С | – | Кравн ∼ 1.7 × 10–7 | [8], Sigma-Aldrich, ChemSpider |
| Фенол | 94 | 108-95-2 | Тпл 40.5°С; Ткип 181.7°С | 217182-78-0; 144796-97-4 | 1 : 1 | PubChem, ChemSpider, Sigma-Aldrich |
| 2,3-Дихлорфенол | 162 | 576-24-9 | Тпл 56°С | 848169-92-6 | 1 : 1 | ChemSpider |
| 2,4-Дихлорфенол | 162 | 120-83-2 | Тпл 41–45°С | – | 1 : 1 | PubChem |
| 3,4-Дихлорфенол | 162 | 95-77-2 | Тпл 65–68°С | Нет данных | ||
| Уксусная кислота | 60 | 64-19-7 | Ткип 118–119°С; Тпл 16–17°С | 19215-29-3; 99294-94-7 |
1 : 1; 1 : 2 |
ChemSpider, PubChem |
| Пропионовая кислота | 74 | 79-09-4 | Ткип 141.1°С | – | 1 : 1 | PubChem, Sigma-Aldrich |
| Бензойная кислота | 122 | 65-85-0 | Тпл 122°С; Ткип 250°С | – | 1 : 1 | PubChem, Sigma-Aldrich, SynQuest |
| 2-Гидроксибензойная (салициловая) кислота | 138 | 69-72-7 | Тпл 158.6°С; Ткип разл. | Нет данных | ||
| 3-Гидроксибензойная кислота | 138 | 99-96-7 | Тпл 200–203°С | – | 1 : 1 | PubChem |
| 4-Гидроксибензойная кислота | 138 | 99-06-9 | Тпл 214.5°С | 26158-92-9 | 1 : 1 | ChemSpider, PubChem |
| Формамид | 45 | 75-12-7 | Ткип 288°С | 56827-75-9 | 1 : 1 | PubChem, ChemSpider |
| Ацетамид | 59 | 60-35-5 | Тпл 79-81°С; Ткип 221.2°С | 137547-89-3 | 1 : 1 | PubChem |
| Пропионамид | 73 | 79-05-0 | Тпл 80°С; Ткип 213°С | – | 1 : 1 | PubChem |
| Бензамид | 121 | 55-21-0 | Тпл 127–130°С; Ткип 288°С | – | 1 : 1 | PubChem |
| Мочевина | 60 | 57-13-6 | Тпл 133°С (разл) | 163931-63-3 (1 : 1) | 1 : 1; 2 : 1 | PubChem, ChemSpider |
| Этаноламин | 61 | 141-43-5 | Ткип 171°С | 922193-26-8 | 1 : 1 | PubChem |
| Метилгидразин | 46 | – | Ткип 87–88°С | – | 1 : 1 | PubChem |
| Триэтилфосфат | 182 | 78-40-0 | Ткип 215°С | 114019-85-1 | 2 : 1 | ChemSpider, ChemSrc |
| Трибутилфосфат | 266 | 126-73-8 | Ткип 289°С | 19517-53-4 | 1 : 1 | ChemSpider, ChemSrc |
| Кофеин*** | 194 | 58-08-2 | Тпл 234°С; RI(ГЖХ) 1793 ± 19; lg P –0.07, 0.54, 1.10; pKa 0.60 | 5743-12-4 | 1 : 1; RI(ВЭЖХ) 633 ± 27 |
[20, 21]; PubChem, ChemSpider, Kegg Drugs, Fisher Scientific, MolBase |
| Теобромин | 180 | 83-67-0 | Тпл 345–350°С; RI(ВЭЖХ) 586 | Нет данных | ||
| Теофиллин | 180 | 58-55-9 | Тпл 272°С; 271–273°С | 5967-84-0 | 1 : 1; RI(ВЭЖХ) 580 ± 24 |
[22–27]; PubChem |
| Сульфамид*** | 172 | 63-74-1 | Тпл 165°С | – | 1 : 1; RI(ВЭЖХ) 481 ± 22 |
PubChem, HydrateWeb |
| Пирацетам*** | 142 | 74791-74-9 | RI(ГЖХ) 1649 [ref – NIST] | 68497-62-1 | 2 : 1; 1 : 1; RI(ВЭЖХ) 474 | [28]; ChemSpider, HydrateWeb |
| Диметилсульфоксид | 78 | 67-68-5 | Ткип 189°С | 1 : 1; 1 : n | [18, 29]; PubChem, HydrateWeb | |
| Диметилсульфон | 94 | 67-71-0 | Ткип 236 ± 2°С | Нет данных | ||
| Нитрометан | 61 | 75-52-5 | Ткип 101.2°С | – | 1 : 1 | PubChem |
| Трихлорнитрометан | 163 | 76-06-2 | Ткип 112°С | – | 1 : 1 | PubChem |
| Хлороформ | 118 | 67-66-3 | Ткип 61.2°С | – | 1 : 1 | [30]; PubChem |
| Ацетонитрил | 41 | 75-05-8 | Ткип 82°С | 128870-13-3 | 1 : 1 | PubChem, ChemSpider |
| 1,3-Диоксолан | 74 | 646-06-0 | Ткип 75.1°С | 34776-95-9 | 1 : 1 | PubChem |
| 1,4-Диоксан | 88 | 123-91-1 | Ткип 101.3°С | 16468-05-6 | 1 : 1 | [31–34]; ChemSpider |
| Бензол-1,2-дикарбоновая (фталевая) кислота | 166 | 88-99-3 | Тпл 191°С | – | 1 : 1 | ChemSpider |
| 4-Нитроаналин | 138 | 100-01-6 | Тпл 48°С | – | 1 : 1 | PubChem |
| 4-Нитрофенол | 139 | 100-02-7 | Тпл 113–114°С | – | 1 : 1 | PubChem |
| 3-Фенил-3-этил-2,6-пиперидиндион (Глутетимид)*** | 217 | 18389-24-7; 77-21-4 |
– | 60490-74-6 | 1 : 1 | PubChem |
| Флороглюцин | 126 | 108-73-6 | Тпл 215–220°С | 6099-90-7 (1 : 2) |
1 : 1; 1 : 2 | [35]; PubChem |
* Для формальдегида кроме Kравн определена константа скорости гидратации K = exp(3769/T-5.494) [13], где Т – абсолютная температура (К). ** Помимо бензальдегида образование моногидратов подтверждено для многочисленных замещенных бензальдегидов RC6H4CHO, где R = 4-CH3 (CAS № 45792-02-7), 2-Cl (CAS № 80950-29-4), 3-Cl (CAS № 85152-57-4), 4-CF3 (CAS № 85152-58-5), а также для арилглиоксалей общей формулы RC6H4COCHO, где R = 4-CH3 (CAS № 7466-72-0), 4-ОН (CAS № 197447-05-5 и 24645-80-5), 4-NO2 (CAS № 4974-57-6), 4-C3H7O (CAS № 99433-68-8), 3,4-(CH3О)2 (CAS № 163428-90-8), 3,4-(C2H5O)2 (CAS № 952-17-0), 2-CF3 (CAS № 745783-91-9), 3-CF3 (CAS № 38923-38-5), 4-CF3 (CAS № 1736-56-7) и других. Образование гидратов различных карбонильных соединений обсуждается в работе [36] и на сайте [37]. *** Образование гидратов лекарственных препаратов рассмотрено в специальном обзоре [38].
Таблица 3.
Характеристика стабильных гидратов некоторых органических соединений
| Соединение | Мол. масса | Безводная форма | Гидрат | Источники информации | ||
|---|---|---|---|---|---|---|
| CAS № | некоторые свойства | CAS № | состав и некоторые свойства | |||
| Пирен | 202 | 129-00-0 | Тпл 145–148°С; Ткип 404°С; | 64201-64-5; 1613-37-2 | 1 : 1; Тпл 50–55°С | ChemBook, ACROS Organics, ChemSpider, Sigma-Aldrich |
| 1,2,3-Индантрион (Нингидрин) | 160 | 938-24-9 | Тпл 250°С; RI 1574 | 485-47-2; 2462-59-1 | 1 : 1; pKa 8.47; RI(ВЭЖХ) 574 ± 17 | Sigma-Aldrich, PubChem, Merck и др. |
| 1,2,3,4-Тетраоксотетралин (Оксолин) | 188 | 30266-58-1 | –* | 34333-95-4 | 1 : 2; lg P = –0.55 | PubChem, ChemBook и др. |
| Трифторацетальдегид | 98 | 75-90-1 | Ткип – 19.4 ± 1.4°С | 421-53-4; 33953-86-5 | 1 : 1; Ткип 105 ± 1°С | [39]; PubChem, ChemSpider, MolBase и др. |
| Пентафторпропаналь | 148 | 422-06-0 | Ткип +2°С | 422-63-9 | 1 : 1; Ткип 92°С | Alfa Aesar и др. |
| Гептафторбутаналь | 198 | 375-02-0 | Ткип 28.2–29.0°С | 375-02-0 | 1 : 1; Ткип 95 ± 1°С | Alfa Aesar и др. |
| Трихлорацетальдегид | 146 | 75-87-6 | Ткип 97.8°С; Тплав –57.5°С | 302-17-0 | 1 : 1; Ткип 96.3°С; Тпл 57°С; рКа 9.66; 10.0–11.3 | PubChem, Sigma-Aldrich и др. |
| Гексафторацетон | 166 | 684-16-2 | Ткип –27.6 ± 0.3°С | 677-71-4; 10543-95-0; тригидрат 34202-69-2; сесквигидрат 13098-39-0 |
1 : 1; Ткип 100 ± 7°С; Кравн ∼ 106; тригидрат Тпл 18–21°С; сесквигидрат Тплавл 11–20°С |
PubChem, DrugBank, Cameo Chemicals, ChemSpider и др. |
| 1,1,1-Трифтор-3,3-дихлорацетон | 180 | – | –* | 126266-75-9; 1049731-87-4 |
1 : 1; Ткип 103°С | PubChem, Sigma-Aldrich, ChemSpider, ChemBook, SynQuest и др. |
| Глюкоза | 180 | 50-99-7 | Тпл 150°С | 77938-63-7; 14431-43-7 | 1 : 1; Тпл 83–92°С | ChemSpider, DrugBank, SigmaAldrich, BioChemica |
| Этилендиамин | 60 | 107-15-3 | Ткип 116°С | 6780-13-8 | 1 : 1; Ткип 118°С; $n_{{\text{D}}}^{{20}}$ 1.448–1.451; $d_{{\text{4}}}^{{20}}$ 0.96 | ChemBook, PubChem, ChemSpider и др. |
| Пиперазин | 86 | 110-85-0 | Ткип 145–146°С; Тпл 42–44°С | 16832-43-2 (1 : 1); 142-63-2 (1 : 6) | 1 : 1; 1 : 6; Ткип 125–130°С; Тпл 42–46°С | PubChem, Sigma-Aldrich, DrugBank, ChemSpider и др. |
| Гидразин** | 32 | 302-01-2 | Ткип 113.5–114°С | 7803-57-8 | 1 : 1; Ткип 120–121°С | [2–5] |
| Бензолсульфокислота | 158 | 98-11-3 | Тпл 51°С | 26158-00-9 | Тпл 42–49°С | PubChem. Sigma-Aldrich |
Представленные в табл. 2 нестабильные гидраты по объективным причинам не могут быть охарактеризованы значениями каких-либо физико-химических свойств. По этой причине в графе “Состав” указаны только стехиометрические соотношения компонентов гидрата и, в отдельных случаях, особенности их состава (например, факт образования гидратов олигомеров) и (для пяти их приведенных примеров) константы равновесия [уравнение (2)]. Напротив, в табл. 3 приведены примеры стабильных гидратов органических соединений, что позволяет определять их физико-химические характеристики, прежде всего, Тплавл и Ткип. Во многих случаях (8 из 14) они образуются в результате нуклеофильного присоединения воды к карбонильным группам.
Сравнительная характеристика данных табл. 2 позволяет заключить, что наиболее информативным критерием подтверждения предположений о существовании гидратов органических соединений представляется наличие соответствующих им номеров CAS (иногда таких номеров несколько). Для 21 из 52 соединений существование гидратов предполагается, но номера CAS им не присвоены. Необходимо заметить, что наличие таких номеров не является критерием выделения гидратов в виде индивидуальных веществ; они могут существовать как нестабильные компоненты растворов в состоянии динамического равновесия (1) со своими безводными формами и растворителем (вода). Для сравнения можно привести еще несколько примеров нестабильных органических соединений, которым присвоены номера CAS (табл. 4).
Таблица 4.
Примеры некоторых нестабильных соединений, имеющих номера CAS
| Соединение | Структура | Причина нестабильности | CAS № |
|---|---|---|---|
| Виниловый спирт | CH2=CH–OH | Изомеризуется в ацетальдегид | 557-75-5; 9002-89-5 |
| 1,2-Этилендиол | HO–CH=CH–OH | Изомеризуется в глиоксаль | 1571-60-4 |
| Нитрозометан | CH3–NO | Изомеризуется в оксим формальдегида или образует димер | 865-40-7 |
| Фторметанол | FCH2–OH | Отщепляет HF с образованием формальдегида | 420-03-1 |
| Хлорметанол | ClCH2–OH | Отщепляет HCl с образованием формальдегида | 15454-33-8 |
| Бромметанол | BrCH2–OH | Отщепляет HBr с образованием формальдегида | 50398-29-3 |
Количественной характеристикой стабильности гидратов являются значения Kравн (уравнение (2)) при комнатной температуре. Из перечисленных в табл. 2 примеров они известны всего для пяти веществ, однако на основании даже столь ограниченной информации можно заключить, что признак нестабильности гидратов – условие Kравн ≤ 10–2. Для формальдегида Kравн ∼ 103, но препаративное выделение его гидрата(ов) из водных растворов невозможно из-за смещения равновесия (1) влево.
В отличие от нестабильных гидратов, номера CAS закономерно приписаны всем реально существующим гидратным формам, перечисленным в табл. 3. Восемь из них – ковалентные соединения (продукты нуклеофильного присоединения воды), а шесть других – молекулярные гидраты с неопределенным характером ее связывания. Для 12 из 14 гидратов в табл. 3 определены значения физико-химические свойств (прежде всего, Ткип и Тпл), существенно отличающиеся от соответствующих характеристик безводных аналогов. Для двух соединений (1,2,3,4-тетраоксотетралин и 1,1,1-трифтор-2,2-дихлорацетон) гидратные формы настолько устойчивы, что сложности представляет характеристика уже не гидратов, а их безводных аналогов. Еще одним любопытным подтверждением образования гидратов является наличие констант кислотности (значений рKа) у соединений, безводные формы которых не имеют активных атомов водорода. Примерами являются значения рKа = 8.47 1,2,3-индантриона (нингидрин), который в водных средах существует исключительно в форме 2,2-дигидрокси-1,3-индандиона, и трихлорацетальдегида (рKа = 9.7–11.3). Во втором случае обращает на себя внимание значительный диапазон вариаций значений рKа, обусловленный, скорее всего, вариациями соотношения альдегида и его гидратной формы в зависимости от концентрации вещества в растворе.
Значение Kравн ∼ 106 для одного из фторпроизводных карбонильных соединений – гексафторацетона, образующего стабильный гидрат (перегоняется без разложения при атмосферном давлении), существенно превышает значения Kравн нестабильных гидратов. Следовательно, границу устойчивости гидратов можно приблизительно оценить диапазоном Kравн: ∼103 (формальдегид) – ≥106.
Проявление гидратации аналитов в обращенно-фазовой ВЭЖХ. Во всех методах хроматографического разделения уравнения, связывающие параметры удерживания аналитов с характеристиками процесса разделения, относятся к важнейшим соотношениям. В газовой хроматографии влияние температуры (Т) на параметры удерживания (времена удерживания, tR) описывают соотношениями вида уравнения Антуана (3). В обращенно-фазовой ВЭЖХ зависимости времен удерживания от содержания органического компонента элюента (с) аппроксимируют логарифмическими (Снайдера и Снайдера–Сочевинского) (4) или гиперболическими уравнениями (Скотта–Кучеры) (5) соотношениями:
(3)
${\text{lg}}t_{{\text{R}}}^{'} = {a \mathord{\left/ {\vphantom {a {T + b}}} \right. \kern-0em} {T + b}},$(5)
${{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {t_{{\text{R}}}^{'}}}} \right. \kern-0em} {t_{{\text{R}}}^{'}}} = a + bc.$Все перечисленные зависимости нелинейны, что затрудняет выявление каких-либо аномалий хроматографического удерживания. Однако использование такой формы представления данных, как рекуррентная аппроксимация параметров удерживания позволяет привести не только зависимости tR(T) в газовой, но и зависимости tR(c) в обращено-фазовой (ОФ) ВЭЖХ к линейному виду [40–42]:
где Y = T или с (в рассматриваемом нами случае Y = c), ΔY = const – постоянный “шаг” изменения концентрации органического компонента элюента (Δс = 5%), a и b – коэффициенты, вычисляемые методом наименьших квадратов.Рекуррентные соотношения объединяют свойства арифметических и геометрических прогрессий [40–42], что объясняет их уникальные аппроксимирующие свойства. Важная особенность графиков рекуррентных зависимостей состоит в том, что число точек на них на единицу меньше числа используемых для их построения значений функции, причем каждая точка одновременно соответствует двум значениям функции, тогда как значения аргумента на графиках вовсе не представлены.
Аппроксимирующие возможности рекуррентных соотношений велики, но не безграничны. Если на “нормальные” зависимости параметров удерживания в ОФ ВЭЖХ, аппроксимируемые уравнениями (4) или (5), накладывается влияние равновесия (1), то эффективность этих уравнений снижается:
(6)
${{t}_{{\text{R}}}}\left( {{\text{Х}} \rightleftarrows {\text{X}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right) \ne {{t}_{{\text{R}}}}\left( {\text{Х}} \right) \ne {{t}_{{\text{R}}}}\left( {{\text{X}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right).$Параметры удерживания безводной и гидратной форм аналитов в общем случае неодинаковы, но зависимости их значений от концентрации органического растворителя в элюенте (и, следовательно, от содержания в нем воды) для каждой из них могут быть приведены к линейному виду с использованием рекуррентной аппроксимации [40–42]. Если же эти формы в растворе существуют в состоянии динамического равновесия (1), то это приводит к искажениям не только зависимостей (4) или (5), но и рекуррентной аппроксимации (6). Таким образом, можно полагать, что выявление отклонений рекуррентных зависимостей (6) от линейности представляет собой эффективный способ выявления аномалий хроматографического удерживания в ОФ ВЭЖХ, в том числе за счет образования гидратных форм аналитов. Для иллюстрации возможностей этого способа рассмотрим обработку данных по параметрам удерживания двух лекарственных препаратов с тривиальными названиями гефитиниб (I) и пазопаниб (II) (табл. 1). Более обширный набор соединений охарактеризован в работе [10].
Графики зависимостей абсолютных времен удерживания (I) и (II) от содержания ацетонитрила в элюенте (с, об. %) имеют ожидаемый логарифмический или гиперболический вид, соответствующий уравнениям (4) или (5) (рис. 1а, 1б), что не позволяет предполагать какие-либо особенности их хроматографического удерживания. Однако представление этих же данных в виде рекуррентных зависимостей вида (6) (рис. 2а, 2б) позволяет выявить их принципиальные отличия. В случае гефитиниба (рис. 2а) все шесть точек соответствуют уравнению линейной регрессии с параметрами: a = 0.555 ± 0.007, b = 0.372 ± 0.016, R = = 0.9996, s0 = 0.017. Это означает, что в интервале концентраций CH3CN в элюенте от 35 до 65% соединение существует в одной и той же форме, соответствующей структуре, приведенной в табл. 1. В случае, представленном на рис. 2б, только четыре точки, отвечающие минимальным временам удерживания (наибольшей концентрации CH3CN в элюенте), лучше всего соответствуют уравнению линейной регрессии с параметрами a = 0.687 ± 0.008, b = 0.277 ± 0.009, R = 0.9998, s0 = = 0.002. Две другие точки (в области содержаний CH3CN менее 30%) заметно отклоняются от линии регрессии, причем степень отклонений возрастает при увеличении содержания воды в элюенте.
Рис. 1.
Графики зависимостей времен удерживания (tR, мин) гефитиниба (I) (а) и пазопаниба (II) (б) от содержания ацетонитрила в элюенте (с, об. %), tR = f(c).
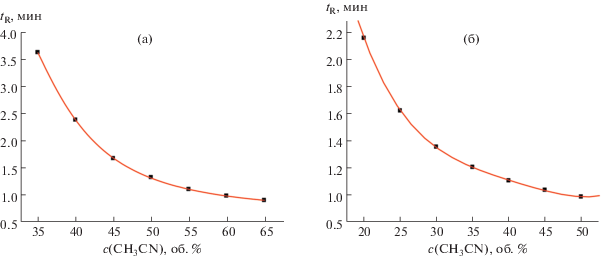
Рис. 2.
Графики рекуррентных зависимостей tR(c + 5%) = atR(c) + b гефитиниба (I) (а) и пазопаниба (II) (б).
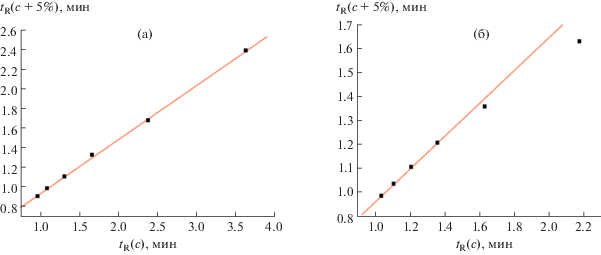
Объяснение наблюдаемых аномалий даже для достаточно сложных полифункциональных органических соединений связано с образованием их гидратов. Молекула пазопаниба (II) содержит сульфонамидный фрагмент структуры –SO2–NH– (табл. 1). Известно, что полярные амиды карбоновых кислот и тем более еще более полярные сульфонамиды как в кристаллическом состоянии, так и в водных растворах могут образовывать достаточно устойчивые гидраты [43]. В ОФ ВЭЖХ при уменьшении содержания CH3CN в элюенте равновесие (1) сдвигается в сторону образования гидрата. Это означает, что формы пазопаниба (II) в элюентах разного состава могут быть не идентичны друг другу; содержание его гидрата увеличивается в элюентах с бóльшим содержанием воды. Гефитиниб (I) не содержит столь полярных фрагментов структуры, в результате чего рекуррентная зависимость (6) для него не имеет искажений (практически линейна).
Подобный способ выявления обратимого образования гидратов аналитов в элюенте может быть распространен и на другие соединения. В работе [10] эта проблема рассмотрена на примере бóльшего числа лекарственных препаратов. Следовательно, рекуррентная аппроксимация параметров удерживания в ОФ ВЭЖХ может быть рекомендована как способ выявления обратимого образования гидратов органических соединений в водных растворах.
* * *
Таким образом, можно отметить, что в настоящее время образование гидратных форм известно или предполагается для многочисленных органических соединений, но на практике эти эффекты чаще всего не принимают во внимание из-за малой стабильности многих таких гидратов. Константы гидратации определены только для небольшого числа соединений. Однако для представителей некоторых классов веществ именно образование гидратов в водных средах позволяет объяснить аномалии зависимостей параметров их удерживания в ОФ ВЭЖХ от содержания органического модификатора элюента. Наиболее эффективным способом выявления подобных аномалий представляется рекуррентная аппроксимация зависимостей хроматографических параметров удерживания от содержания органического компонента элюента.
Список литературы
Griesser U.J. The importance of solvates. Ch. 8. / Polymorphism in the Pharmaceutical Industry / Ed. Hilfiket R. N.Y.: Wiley-VCH Verlag GmbH, 2006. 414 p. https://doi.org/10.1002/3527607889.ch8
Справочник химика. Т. 2. Основные свойства неорганических и органических соединений. Л.: Химия, 1971. 1168 с.
The Merck Index. An Encyclopedia of chemicals and drugs. 9th Edn. Merck & Co., Inc. 1976. 1313 p.
Свойства органических соединений. Справочник / Под ред. Потехина А.А. Л.: Химия, 1984. 519 с.
Handbook of Chemistry and Physics / Ed. Lide D.R. Boca Raton: Taylor & Francis, Version 2006. (CD-ROM).
Sangster J. Octanol-water partition coefficients: fundamentals and physical chemistry. N.Y.: J. Wiley & Sons, 1997. 178 p.
Зенкевич И.Г., Олисов Д.А., Шафигуллин Р.В., Буланова А.В. Новый подход к хроматографическому определению растворимости кверцетина в воде // Аналитика и контроль. 2019. Т. 23. № 3. С. 386. https://doi.org/10.15826/analitika.2019.23.3.013
Rawn J.D., Quellette R. Organic Chemistry. 2nd Ed. N.Y.: Acad. Press, 2019. 1056 p.
Зенкевич И.Г., Никитина Д.А. Выявление обратимого образования гидратов лекарственных препаратов рекуррентной аппроксимацией их параметров удерживания в обращенно-фазовой ВЭЖХ / Тез. докл. IV Всерос. конф. молодых ученых “Медико-биологические аспекты химической безопасности”. СПб: 18–20 сент. 2020 г. MEDLINE.RU. t11. 5 с.
Зенкевич И.Г., Никитина Д.А. Особенности рекуррентной аппроксимации параметров удерживания полифункциональных соединений в обращенно-фазовой высокоэффективной жидкостной хроматографии // Журн. физ. химии. 2021. Т. 95. № 2. С. 285. (Zenkevich I.G., Nikitina D.A. Features of recurrent approximation of retention parameters of polyfunctional compounds in reversed phase HPLC // J. Phys. Chem. A. 2021. V. 95. № 2. P. 395.) https://doi.org/10.31857/S004445372102028X
Martin R. The dissociation constant of methylene glycol (formaldehyde hydrate) // Austr. J. Chem. 1954. V. 7. № 4. P. 400. https://doi.org/10.1071/CH9540400
Zavitas A.A., Coffiner M., Wiseman T., Zavitas L.R. Reversible hydration of formaldehyde. Thermodynamic parameters // J. Phys. Chem. 1970. V. 74. № 14. P. 2746. https://doi.org/10.1021/j100708a003
Winkelman L.G.M., Voorwinde O.K., Ottens M., Beenackers A.A.C.M., Janssen L.P.B.M. Kinetics and chemical equilibrium of the hydration of formaldehyde // Chem. Eng. Sci. 2002. V. 57. P. 4067.
Bell R.P., Higginsen W.C.E. The catalytic dehydration of acetaldehyde hydrate, and the effect of structure on the velocity of photolytic reactions // Proc. Royal Soc. London. Ser. A. Methods Phys. Sci. 1949. V. 197. № 1047. P. 141.
Scheithauer A., Grutzner T., Rijksen C., Zollinger D., Thiel W.R. 1H and 13C-NMR spectroscopic study of chemical equilibria in the system acetaldehyde + water // AIChE J. 2015. V. 61. № 1. P. 177. https://doi.org/10.1002/aic.14623
Wilson G.J., Davidson D.W. Dielectric evidence for acetone hydrate // Can. J. Chem. 1963. V. 41. № 2. P. 264. doi 19.1138/v63-041
Yamamuro O., Kuratomi N., Matsuo T., Suga H. Heat capacity and phase transition of acetone clatrate hydrate // Solid State Commun. 1990. V. 73. № 4. P. 317.
McLain S.E., Soper A.K., Luzar A. Investigations on the structure of dimethyl sulfoxide and acetone in aqueous solutions // J. Chem. Phys. 2007. V. 127. Paper № 174 515. https://doi.org/10.1063/1.2784555
Du J., Kiang D.-O., Li D.-L., Li X.-J. Phase equilibrium data of binary hydrate in the system hydrogen plus acetone plus water // J. Chem. Eng. Data. 2010. V. 55. № 10. P. 4532.
Edwards H.G., Lawson E., Matas M., Shields L., York P. Metamorphosis of caffeine hydrate and anhydrous caffeine // J. Chem. Soc. Perkin Trans. 2. 1997. № 10. P. 1985. https://doi.org/10.1039//A702041D
Hedoux A., Paccou L., Derollez P., Guinet Y. Dehydration mechanism of caffeine hydrate and structural description of driven metastable anhydrates analyzed by micro Raman spectroscopy // Int. J. Pharm. 2015. № 1–2. P. 331. https://doi.org/10.1016/ijpharm.2015.04.001
Suzuki E., Shimomura K., Sekiguchi K. Thermochemical study of theopjylline and its hydrate // Chem. Pharm. Bull. 1989. V. 37. № 1. P. 493. https://doi.org/10.1248/cpb37.493
Gould P.L., Howard J.R., Oldenshaw G.A. The effect of hydrate formation on the solubility of theophylline in binary aqueous cosolvent systems // Int. J. Pharm. 1989. V. 51. № 3. P. 195. https://doi.org/10.1016/0378-5173(89)90192-0
Agbada C.O., York P. Theophylline hydrate/anhydrous system: effect of water of hydration on mechanical properties of compacted beams // J. Pharm. Pharmacol. 1990. V. 42. № S1. P. 76P. https://doi.org/10.1111/j.2042-7158.1990.tb14449.x
Rodriguez-Hornedo N., Wu H.-J. Crystal growth kinetics of theophylline monohydrate // Pharm. Res. 1991. V. 8. P. 643.
Sun C.C., Zhou D., Grant D.J.W., Young V.G. Theophylline monohydrate // Acta Crystallogr. 2002. V. 58. № 4. P. o368. https://doi.org/10.1107/S1600536802002921
Gonzalez-Gonzalez J.S., Zuniga-Lemus O., Hernandez-Galindo M. del C. Hydrated solid forms of theophylline and caffeine obtained by mechanochemistry // IOSR J. Pharm. 2017. V. 7. № 5. P. 28.
Shcherbakov A.A., Danilov I.P., Sazhin V.A., Petrov V.I. Investigation of the effect of hydration and amphyphilic properties of nootropic drugs of piracetam and pramiracetam // Theor. Exp. Chem. 1993. V. 28. № 4. P. 277. https://doi.org/10.1007/BF00530289
Scott H. Extent of hydration of dimethyl sulfoxide in aqueous solution // J. Pharm. Sci. 1969. V. 58. № 8. P. 946. https://doi.org/10.1002/jps.2600580807
Tester J.W., Wiegandt H.F. The fluid hydrates of methylene chloride and chloroform: Their phase equilibria and behavior as influences by hexane // AIChE J. 1969. V. 15. № 2. P. 239. https://doi.org/10.1002/aic.690150221
Nakayama H., Tahara M. Hydrates of organic compounds. I. Solid-liquid phase equilibria in the water + 1,4-dioxane system and some properties of 1,4-dioxane hydrate // Bull. Chem. Soc. Japan. 1973. V. 46. P. 2965. doi 19.1246/bcsj. 46.2965
Gough S.R., Ripmeester J.A., Davidson D.W. 1,4-Dioxane hydrate: dielectric absorption by a nondipolar enclathrated molecule // Can. J. Chem. 1075. V. 53. № 15. P. 2216.
Kamran-Pirzaman A., Pahlavanzadeh H., Mohammadi A.H. Hydrate phase equilibria of furan, acetone, 1,4-dioxane, TBAC and TBAF // J. Chem. Thermodyn. 2013. V. 45. № 21. P. 151. https://doi.org/10.1016/j.jct.2013.04.012
Пчелкин В.Н., Торяник А.И. Исследование методом Монте-Карло гидратации 1,4-диоксана в конформациях “кресло” и “ванна” // Журн. структ. химии. 1991. Т. 32. № 2. С. 88.
Braun D., Tocher D.A., Price S.L., Griesser U.J. The complexity of hydration of phloroglucinol; a comprehensive structural and thermodynamic characterization // J. Phys. Chem. 2012. V. 116. № 3. P. 3361. https://doi.org/10.1021/jp211948q
Buschmann H.-J., Fuldner H.-H., Knocke W. The reversible hydration of carbonyl compounds in aqueous solutions. Part I. The keto-gem-diol equilibrium // Berichte. 1980. V. 84. № 1. P. 41. https://doi.org/10.1002/bbpc.19800840109
Web-page: ebi.ac.uk/chebi/searched.do?chebiId=63733 (дата обращения: октябрь 2020 г.).
Heady A.M., Worku Z.A., Kumar D., Madi A.M. Pharmaceutical solvents, hydrates and amorphous forms: A special emphasis on cocrystals // Adv. Drug. Deliv. Rev. 2017. V. 117. P. 25. doi . 2017. 03.002https://doi.org/10.1016/j.addr
Funabiki K., Matsunaga K., Nojiri M., Hashimoto W. The use of trifluoroacetaldehyde ethyl hemiacetal or hydrate in a simple and practical regioselective synthesis of β-hydroxy-β-trifluoromethyl ketones from enamines and imines // J. Org. Chem. 2003. V. 68. № 7. P. 2853. https://doi.org/10.1021/jo026697
Зенкевич И.Г. Применение рекуррентных соотношений в хроматографии // Журн. физ. химии. 2008. Т. 82. № 6. С. 1012. (Zenkevich I.G. Application of recurrent relations in chromatography // J. Phys. Chem. A. 2008. V. 82. № 6. P. 886). https://doi.org/10.1134/S0036024408060022
Zenkevich I.G. Application of recurrent relationships in chromatography // J. Chemom. 2009. V. 23. P. 179. https://doi.org/10.1002/cem.1214
Zenkevich I.G. Recurrent relationships in separation science. Ch. 24 / Chemometrics in Chromatography / Eds. Komsta L., Heyden Y.V., Sherma J. London: CRC Press, 2018. P. 449.
Kobayashi M., Nishioka K. Hydration of N-monosubstituted amides in the binary solvents dioxane-water-d2 and dioxane-water // J. Phys. Chem. 1987. V. 91. № 5. P. 1247. https://doi.org/10.1021/j100289a041
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


