Журнал аналитической химии, 2021, T. 76, № 9, стр. 804-811
Микроэмульсионное концентрирование стероидных гормонов из водных растворов и образцов мочи
Л. А. Карцова a, *, С. А. Соловьева a, Е. А. Бессонова a
a Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Университетский просп., 26, Петродворец, Россия
* E-mail: kartsova@gmail.com
Поступила в редакцию 07.04.2021
После доработки 10.04.2021
Принята к публикации 12.04.2021
Аннотация
Показана возможность использования микроэмульсии типа “масло-в-воде” состава 3% додецилсульфата натрия, 8% н-бутанола, 1% этилацетата, 88% воды (по массе) в качестве экстрагента для извлечения и концентрирования стероидных гормонов кортизола, кортизона, кортикостерона, 11-дезоксикортизола, 11-дезоксикортикостерона из водных растворов и образцов мочи с последующим анализом методом обращенно-фазовой ВЭЖХ со спектрофотометрическим детектированием. При оптимизации условий экстракции варьировали природу масла, время и температуру экстракции, а также время расслоения микроэмульсии. Для разрушения микроэмульсии использовали хлорид магния. Установлено, что коэффициенты концентрирования стероидных гормонов возрастают с увеличением гидрофобности аналитов. Пределы обнаружения стероидов составили 0.5–3 нг/мл, коэффициенты концентрирования – 8–20.
Микроэмульсии (МЭ) представляют собой гомогенные, термодинамически стабильные и оптически прозрачные системы с размером капель (10–200) нм. Для микроэмульсий, в отличие от их макроаналогов, характерна бóльшая площадь поверхности. Выделяют микроэмульсии типа “масло-в-воде” (М/В) и “вода-в-масле”, где под маслом понимают любую малорастворимую в воде органическую жидкость. В составе микроэмульсии обязательно содержится поверхностно-активное вещество (ПАВ) в концентрации, превышающей критическую концентрацию мицеллообразования. Для формирования МЭ часто требуется введение второго немицеллобразующего ПАВ (со-ПАВ) – спирта с небольшим гидрофобным радикалом (от н-бутанола до н-октанола). Роль со-ПАВ заключается в стабилизации МЭ и снижении поверхностного натяжения на границе раздела двух фаз [1, 2]. Микроэмульсии обладают повышенной солюбилизирующей емкостью, т.е. способностью растворять полярные и неполярные аналиты. Это свойство МЭ оказалось востребованным при определении стероидных гормонов [3–8], полифенолов и катехоламинов [9, 10], витаминов [11–13] и др. в условиях микроэмульсионной электрокинетической хроматографии, а также в процессах пробоподготовки объектов со сложной матрицей для извлечения и концентрирования соединений различной природы и получило название метода микроэмульсионной экстракции [14, 15]. Принцип такой экстракции заключается в концентрировании аналитов в капли масла или воды, после чего микроэмульсии разрушают. При этом образуются несмешивающиеся слои органической и водной фаз. Целевые компоненты концентрируются в фазе меньшего объема. При оптимизации условий микроэмульсионной экстракции варьируют природу масла, со-ПАВ, время экстракции и расслоения МЭ.
Способы разрушения микроэмульсии зависят от типа используемого детергента (ионогенного, цвиттер-ионного, неионогенного). Среди анионных ПАВ наибольшее распространение получили додецилсульфат (ДДСН) и октилсульфонат натрия; катионных – цетилтриметиламмония бромид; неионогенных – гидроксиэтилированные первичные и вторичные жирные спирты, полиэтиленгликолевые эфиры жирных кислот и др. Растворы анионных ПАВ подвергают фазовому разделению путем добавления кислот [16]. Данный способ применен для экстракции в мицеллы ДДСН различных полициклических ароматических углеводородов (ПАУ) из водных образцов. Растворы неионогенных ПАВ разделяют на две фазы при повышении температуры (так называемая “экстракция в точке помутнения”). Подобный подход применен для разрушения МЭ на основе Тритона Х-100 с целью извлечения ионов кальция, магния и кобальта из образцов дизельного топлива [17]. Показана [15] возможность расслоения МЭ на основе ДДСН путем добавления избытка ионов кальция за счет образования осадка с ДДСН. Способ апробирован при определении ПАУ и диалкилфталатов в образцах почв. В некоторых работах стабильные МЭ разрушают при длительном (15 мин) и интенсивном центрифугировании. Такой способ применили в работе [18] для извлечения антиоксиданта ликопина из томатов с помощью МЭ с сапонином в качестве ПАВ.
Цель данной работы – выявление возможности использования микроэмульсий типа масло в воде в качестве экстрагента для извлечения и концентрирования стероидных гормонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Способ приготовления микроэмульсии типа “масло в воде”. Общий алгоритм приготовления микроэмульсии следующий. К точной навеске ПАВ (додецилсульфата натрия) добавляют необходимое количество дистиллированной воды и помещают в ультразвуковую баню до полного растворения ДДСН. Затем к полученному раствору прибавляют определенное количество масла и тщательно перемешивают; далее добавляют со-ПАВ (н-бутанол), перемешивают и помещают в ультразвуковую баню на 15 мин для образования микроэмульсии.
После серии предварительных экспериментов выбрали состав микроэмульсии. Для приготовления 10 мл МЭ состава 3% ДДСН, 8% н-бутанола, 1% этилацетата, 88% воды (по массе), используемой для извлечения стероидных гомонов из образцов мочи, в пробирке емк. 25 мл взвешивали 0.3 г ДДСН, добавляли 8.9 мл дистиллированной воды и помещали в ультразвуковую баню до полного растворения ДДСН. Затем к раствору ДДСН добавляли 111 мкл этилацетата, перемешивали, добавляли 990 мкл н-бутанола, снова перемешивали и помещали в ультразвуковую баню на 15 мин для образования микроэмульсии.
Приготовление растворов стандартов. Тестовые растворы аналитов с концентрацией 1 мг/мл получали растворением точной навески каждого из стероидов (0.001 г в 1 мл ацетонитрила) и хранили при –16°С в морозильной камере. Разбавлением тестовых растворов дистиллированной водой получали требуемые рабочие растворы.
Схема пробоподготовки образцов мочи для извлечения кортикостероидов с использованием микроэмульсии типа “масло в воде”. В пробирке типа Эппендорф емк. 2 мл смешивали 1000 мкл образца мочи и 500 мкл микроэмульсии типа масло в воде (3% ДДСН, 8% н-бутанола, 1% этилацетата, 88% (по массе)). Полученный раствор помещали в ультразвуковую баню на 5 мин для экстракции стероидных гормонов в каплю микроэмульсии. Затем к раствору добавляли 0.3 г сухого MgCl2 и помещали в ультразвуковую баню на 10 мин для разрушения микроэмульсии. Отбирали 40 мкл образовавшегося органического слоя, добавляли 20 мкл 1 М раствора NaOH, центрифугировали в течение 1 мин со скоростью 10 000 об/мин и отбирали надосадочную жидкость для хроматографического анализа.
Условия хроматографического разделения кортикостероидов со спектрофотометрическим детектированием. Хроматографический анализ сконцентрированных стероидных гормонов методом микроэмульсионной экстракции из водных образцов и проб мочи выполняли на жидкостном хроматографе “Shumadzu” LC-20 (Япония) c мультиволновым детектором (SPD-20A); на колонке Luna C18 (2) (150 × 3 мм, 3 мкм). Условия обращенно-фазовой (ОФ) ВЭЖХ: подвижная фаза: вода (раствор А)–СH3CN (раствор Б). Программа градиентного элюирования: 0 мин – 26% Б; 3 мин – 26% Б; 10 мин – 40% Б; 13 мин – 60% Б; 15 мин – 80% Б; 17 мин – 80% Б. Скорость подвижной фазы (п.ф.) – 0.3 мл/мин; объем вводимой пробы – 20 мкл; спектрофотометрическое детектирование при 254 и 242 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
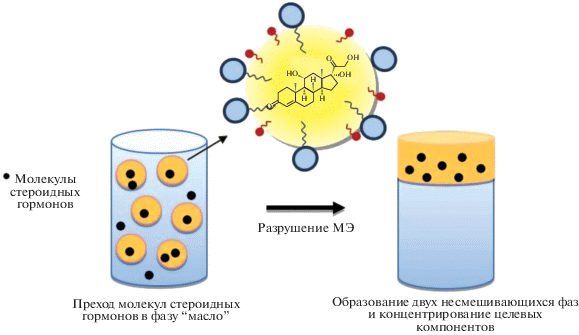
Для хроматографического определения стероидных гормонов, содержание которых в биологических жидкостях (сыворотка крови, моча) составляет всего несколько нг/мл, требуются предварительные стадии концентрирования и освобождения от большинства сопутствующих компонентов матрицы пробы. Мы предположили, что гидрофобные по природе стероидные гормоны могут проникать из водного раствора в каплю масла микроэмульсии М/В, а после разрушения МЭ концентрироваться в органической фазе, объем которой существенно меньше по сравнению с водной (рис. 1).
Рис. 1.
Схема извлечения и концентрирования стероидных гормонов из водных растворов с помощью микроэмульсии типа “масло-в-воде”.
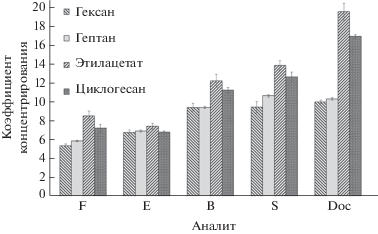
При оптимизации условий экстракции стероидных гормонов с помощью микроэмульсии масло-в-воде на модельных системах варьировали природу масла, время и температуру экстракции, а также время расслоения МЭ. Установили, что аналитическими возможностями обладает экстрагирующая система – микроэмульсия состава 3% ПАВ, 8% со-ПАВ (н-бутанол), 1% масла, 88% воды (по массе). В качестве масла исследовали различные органические растворители (гексан, гептан, циклогексан, этилацетат), плотность которых меньше 1 г/мл. Необходимо, чтобы органическая фаза находилась над водной, и после разрушения МЭ в объеме органической фазы оставались масло и со-ПАВ (н-бутанол, ρ = 0.81 г/мл). Максимальные значения коэффициентов концентрирования достигнуты в случае этилацетата (рис. 2). Другие параметры микроэмульсионной экстракции стероидов выбирали далее с составом микроэмульсии 3% ДДСН, 1% этилацетата, 8% н-бутанола, 88% воды (по массе).
Рис. 2.
Зависимости коэффициентов концентрирования F, E, B, S, Doc от природы масла (n = 3, P = 0.95). Концентрация стероидных гормонов 100 нг/мл. F – кортизол, E – кортизон, B – кортикостерон, S – 11-дезоксикортизол, Doc – 11-дезоксикортикостерон.
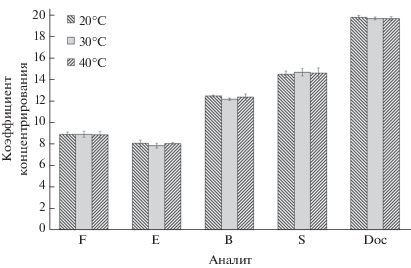
Максимальные значения коэффициентов концентрирования стероидов достигаются при времени и температуре экстракции в ультразвуковой бане 5 мин и 30°С соответственно. Увеличение значений этих параметров не приводит к росту коэффициентов концентрирования (рис. 3, 4).
Рис. 3.
Зависимости коэффициентов концентрирования F, E, B, S, Doc от времени экстракции (n = 3, P = 0.95). Концентрация стероидных гормонов 100 нг/мл. F – кортизол, E – кортизон, B – кортикостерон, S – 11-дезоксикортизол, Doc – 11-дезоксикортикостерон.
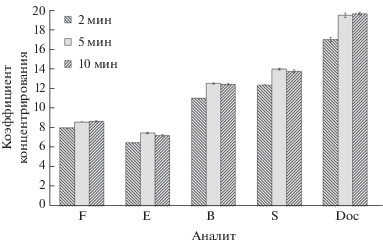
Рис. 4.
Зависимости коэффициентов концентрирования стероидных гормонов (F, E, B, S, Doc) от температуры экстракции (n = 3, P = 0.95). Концентрация стероидных гормонов 100 нг/мл. F – кортизол, E – кортизон, B – кортикостерон, S – 11-дезоксикортизол, Doc – 11-дезоксикортикостерон.
Для разрушения МЭ необходимо выделить ПАВ в осадок, что может привести к нестабильности капли масла и расслоению гомогенной системы. С этой целью провели предварительную серию экспериментов по разрушению микроэмульсии с применением водного раствора стандартов стероидных гормонов кортизола (F), кортизона (Е), кортикостерона (B), 11-дезоксикортизола (S), 11-дезоксикортикостерона (Doc). Использование микроэмульсии М/В с цетилтриметиламмоний бромидом в качестве ПАВ с добавлением перхлората лития привело к образованию рыхлого осадка перхлората цетилтриметиламмония, который не отделялся при центрифугировании и мешал отбору органической фазы.
Для разрушения микроэмульсии М/В на основе ДДСН применили способ, ранее предложенный в работе [15] и основанный на осаждении ДДСН солями двухвалентных металлов:
В настоящей работе с этой целью использовали сухой хлорид магния. В предварительных экспериментах обнаружили, что расслоение микроэмульсии начинается при концентрации ионов магния 1 М, что соответствует его 20-кратному избытку по отношению к ДДСН. Рассчитали коэффициенты концентрирования (КК) стероидных гормонов как отношение площадей пиков аналита до и после экстракции с помощью микроэмульсии масло-в-воде при различных концентрациях хлорида магния (табл. 1). К водному раствору стандартов стероидных гормонов добавляли МЭ в соотношении 2 : 1 (по объему), помещали в ультразвуковую баню на 15 мин для экстракции аналитов в каплю масла, затем вводили необходимое количество сухого MgCl2 и вновь помещали в ультразвуковую баню на 10 мин для разрушения микроэмульсии. Далее отбирали органический слой и проводили ОФ ВЭЖХ-УФ-анализ.
Таблица 1.
Коэффициенты концентрирования кортизола (F), кортизона (Е), кортикостерона (B), 11-дезоксикортизола (S), 11-дезоксикортикостерона (Doc) при использовании микроэмульсии масло в воде* (n = 3, P = 0.95)
| Концентрация ионов Mg2+, М | F | E | B | S | Doc |
|---|---|---|---|---|---|
| 1 | 5.5 ± 0.3 | 4.6 ± 0.1 | 10.9 ± 0.5 | 11.2 ± 0.9 | 16.0 ± 0.4 |
| 1.5 | 8.4 ± 0.4 | 7.2 ± 0.2 | 12.3 ± 0.8 | 13.9 ± 0.7 | 18.9 ± 0.7 |
| 2 | 8.0 ± 0.8 | 6.9 ± 0.4 | 12.0 ± 0.3 | 13.5 ± 0.4 | 19.3 ± 0.5 |
Обнаружено, что коэффициенты концентрирования стероидных гормонов возрастают с увеличением гидрофобности аналитов. При концентрации ионов Mg2+ выше 1.5 М значения КК практически не изменяются. Таким образом, для разрушения системы водный раствор аналитов–микроэмульсия (2 : 1) (по объему) в исследуемую пробу добавляли твердый MgCl2 в таком количестве, чтобы его концентрация составила 1.5 М.
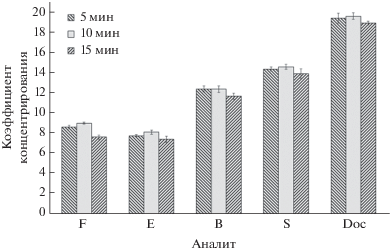
Максимальные значения КК стероидных гормонов получили при времени расслаивания системы в ультразвуковой бане 10 мин. Дальнейшее увеличение времени расслаивания приводит к снижению коэффициентов концентрирования (рис. 5), что возможно, связано с миграцией молекул стероидных гормонов к границе раздела органической и водной фаз.
Рис. 5.
Зависимости коэффициентов концентрирования F, E, B, S, Doc от времени расслаивания системы (n = 3, P = 0.95). Концентрация стероидных гормонов 100 нг/мл. F – кортизол, E – кортизон, B – кортикостерон, S – 11-дезоксикортизол, Doc – 11-дезоксикортикостерон.
Таким образом, извлечение и концентрирование кортикостероидов из водного раствора с помощью микроэмульсии М/В в выбранных оптимальных условиях включает следующие этапы:
• Добавление к водному раствору МЭ состава 3% ДДСН, 8% н-бутанола, 1% этилацетата, 88% воды в соотношении 2 : 1 (по объему).
• Выдерживание раствора в ультразвуковой бане при 30°С в течение 5 мин для экстракции стероидных гормонов в каплю масла.
• Добавление MgCl2 в концентрации 1.5 М и выдерживание раствора в ультразвуковой бане в течение 10 мин для разрушения МЭ.
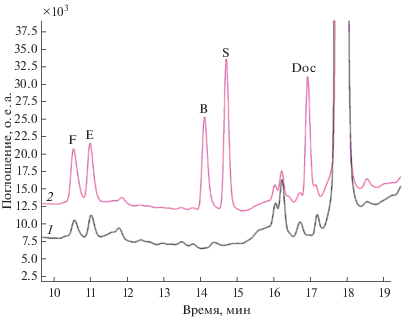
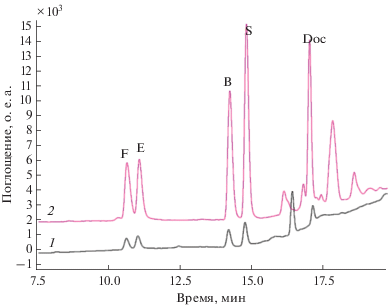
• Отделение органического слоя и его хроматографический анализ (рис. 6).
Рис. 6.
Хроматограммы водного раствора стандартов F, E, B, S, Doc (100 нг/мл) до (1) и после экстракции (2) с помощью микроэмульсии масло-в-воде (3% ДДСН, 8% н-бутанола, 1% этилацетата, 88% воды, по массе). F – кортизол, E – кортизон, B – кортикостерон, S – 11-дезоксикортизол, Doc – 11-дезоксикортикостерон. Условия: жидкостный хроматограф Shumadzu LC-20 с мультиволновым детектором (SPD-20A); колонка Luna C18 (2) (150 × 3 мм, 3 мкм); подвижная фаза: 1 – H2O, 2 – СH3CN; градиентный режим элюирования; скорость подвижной фазы – 0.3 мл/мин; объем вводимой пробы – 20 мкл.
Как видно из табл. 2, коэффициенты концентрирования для F, E, B, S, Doc коррелируют с гидрофобностью аналитов. Хроматограммы водных растворов стандартов стероидных гормонов до и после экстракции с помощью МЭ М/В в выбранных условиях представлены на рис. 6. Пределы обнаружения стероидных гормонов F, E, B, S, Doc, рассчитанные по утроенному уровню шума, составили 0.5–3 нг/мл.
Таблица 2.
Значения коэффициентов концентрирования и критерия гидрофобности (Н) стероидных гормонов
| Параметр | F | E | B | S | Doc |
|---|---|---|---|---|---|
| Коэффициент гидрофобности (Н) | 12.06 | 12.06 | 13 | 13 | 14.07 |
| Коэффициенты концентрирования | 9.1 ± 0.4 | 8.2 ± 0.2 | 12.5 ± 0.7 | 14.7 ± 0.5 | 19.8 ± 0.9 |
Условия пробоподготовки с использованием микроэмульсии типа “масло в воде”, выбранные на модельных растворах, апробировали на образцах мочи с целью извлечения кортизола и кортизона. Обнаружена необходимость промывки анализируемого органического слоя после разрушения МЭ щелочью (1 М раствор NaOH) для удаления мешающих компонентов реального образца (пигментов и т.д.) и снижения уровня шума от матрицы пробы. Степени извлечения (RE) добавленных до и после процедуры пробоподготовки в образец биологической матрицы кортизола и кортизона, рассчитывали как отношение площадей их пиков:
Они составили 83 и 74% соответственно.
Хроматограммы образцов мочи без и с добавкой стандартов стероидных гормонов представлены на рис. 7.
* * *
Предложен экспрессный способ пробоподготовки образцов мочи для определения кортизона, кортизола с помощью микроэмульсии М/В состава 3% ДДСН, 8% н-бутанола, 1% этилацетата, 88% воды (по массе): соотношение образец–МЭ (2 : 1, по объему); экстракция в течение 5 мин, добавление сухого MgCl2 в таком количестве, чтобы его концентрация составила 1.5 М; разрушение МЭ в течение 10 мин; промывка органического слоя 1 М раствором NaOH. Степени извлечения кортизола, кортизона составили 83 и 74% соответственно.
Выражаем благодарность Ресурсному центру СПбГУ “Методы анализа состава вещества” за предоставленное оборудование.
Работа выполнена при финансовой поддержке проекта РНФ № 19-13-00370.
Список литературы
Puell U. Micellar and Microemulsion Electrokinetic Chromatography. Capill. Electromigr. Sep. Methods. Elsevier, 2018. P. 113.
Пирогов А.В., Шпигун О.А. Применение микроэмульсий в жидкостной хроматографии и электрокинетических методах анализа. Достоинства и недостатки подхода // Журн. аналит. химии. 2020. Т. 75. № 2. С. 99. (Pirogov A.V., Shpigun O.A. Application of microemulsions in liquid chromatography and electrokinetic methods of analysis: Advantages and disadvantages of the approach // J. Anal. Chem. 2020. V. 75. № 2. P. 139.)
Noe S., Bohler J., Keller E., Frahm A.W. Evaluation and optimisation of separation buffers for the determination of corticosteroids with micellar electrokinetic capillary chromatography (MECC) // J. Pharm. Biomed. Anal. 1998. V. 18. P. 911.
Vomastová L., Mikšík I., Deyl Z. Microemulsion and micellar electrokinetic chromatography of steroids // J. Chromatogr. B. Biomed. Sci. Appl. 1996. V. 681. P. 107.
Pomponio R., Gotti R., Fiori J., Cavrini V. Microemulsion electrokinetic chromatography of corticosteroids: Effect of surfactants and cyclodextrins on the separation selectivity // J. Chromatogr. A. 2005. V. 1081. P. 24.
Silva C.A., Aurora-Prado M.S., Altria K.D., Tavares M.F.M. Separation of steroids and the determination of estradiol content in transdermic patches by microemulsion electrokinetic chromatography // Chromatographia. 2011. V. 73. P. 373.
Карцова Л.А., Бессонова Е.А., Москвичев Д.О. Разделение стероидных гормонов методом микроэмульсионной электрокинетической хроматографии с участием ионных жидкостей // Аналитика и контроль. 2019. Т. 23. № 2. С. 193. (Kartsova L.A., Bessonova E.A., Moskvichev D.O. Separation of steroid hormones by microemulsion electrokinetic chromatography involving ionic liquids // Analytics and Control. 2019. V. 23. P. 193.)
Pomponio R., Gotti R., Fiori J., Cavrini V. Microemulsion electrokinetic chromatography of corticosteroids: Effect of surfactants and cyclodextrins on the separation selectivity // J. Chromatogr. A. 2005. V. 1081. P. 24.
Карцова Л.А., Ганжа О.В. Новые возможности мицеллярной и микроэмульсионной электрокинетической хроматографии при определении катехинов и катехоламинов в природных объектах // Журн. аналит. химии. 2010. Т. 65. № 3. С. 285.
Kartsova L., Moskvichev D., Bessonova E., Peshkova M. Imidazolium ionic liquids in microemulsion electrokinetic chromatography for separation of polyphenol antioxidants // Chromatographia. 2020. V. 83. № 8. P. 1001.
Yin C.N., Cao Y.H., Ding S.D., Wang Y. Rapid determination of water- and fat-soluble vitamins with microemulsion electrokinetic chromatography // J. Chromatogr. A. 2008. V. 1193. P. 172.
Карцова Л.А., Ганжа О.В., Хмельницкий И.К. Факторы, влияющие на разделение полифенолов, стероидных гормонов и витаминов в режиме микроэмульсионной электрокинетической хроматографии // Сорбционные и хроматографические процессы. 2009. Т. 9. № 1. С. 33.
Свидрицкий Е.П., Пашкова Е.Б., Пирогов А.В., Шпигун О.А. Одновременное определение жиро- и водорастворимых витаминов методом микроэмульсионной электрокинетической хроматографии // Журн. аналит. химии. 2010. Т. 65. № 3. С. 292.
Дербина А.А., Пирогов А.В., Каргин И.Д., Шпигун О.А. Применение микроэмульсий типа “вода в масле” в микроэмульсионной электрокинетической хроматографии и в качестве экстрагентов для извлечения полярных веществ // Журн. аналит. химии. 2015. Т. 70. № 10. С. 1102.
Толмачева Н.Г., Чжан М., Пирогов А.В., Шпигун О.А. Использование микроэмульсий для извлечения и одновременного концентрирования бенз(а)пирена из почвы // Сорбционные и хроматографические процессы. 2017. Т. 17. № 3. С. 358.
Casero I., Sicilia D., Rubio S., Pérez-Bendito D. An acid-induced phase cloud point separation approach using anionic surfactants for the extraction and preconcentration of organic compounds // Anal. Chem. 1999. V. 71. № 20. P. 4519.
Pereira F.M., Fábio B., Lepri Ricardo D.M.G., Cassella J. Extraction induced by emulsion breaking as a tool for Ca and Mg determination in biodiesel by fast sequential flame atomic absorption spectrometry (FS-FAAS) using Co as internal standard // Microchem. J. 2014. V. 117. P. 172.
Amiri-Rigi A., Abbasi S. Microemulsion-based lycopene extraction: Effect of surfactants, co-surfactants and pretreatments // Food Chem. 2016. V. 197. P. 1002.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии