Журнал аналитической химии, 2021, T. 76, № 9, стр. 812-818
Мицеллярная экстракция активных компонентов из специй и оценка Сe(IV)-восстанавливающей способности извлечений
Г. К. Зиятдинова a, *, Г. К. Будников a
a Химический институт им. А.М. Бутлерова, Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 11.04.2021
После доработки 19.04.2021
Принята к публикации 19.04.2021
Аннотация
Найдены условия мицеллярной экстракции активных компонентов из специй с помощью 0.1 М Brij® 35 в качестве экстрагента. Для интенсификации извлечения использована ультразвуковая обработка. Показано, что однократная экстракция в течение 10 мин обеспечивает максимальное извлечение активных компонентов. Соотношение сырье/экстрагент варьируется в широких пределах в зависимости от типа специй. Для характеристики полученных извлечений использован показатель Ce(IV)-восстанавливающая способность, основанный на взаимодействии компонентов экстрактов с электрогенерированным Сe(IV). На примере аскорбиновой кислоты показано, что мицеллярная среда Brij® 35 не оказывает влияния на выход по току кулонометрического титранта. Установлены стехиометрические коэффициенты ряда биологически активных соединений с электрогенерированным Сe(IV). Оценена Ce(IV)-восстанавливающая способность 20 специй. Полученные результаты сопоставлены с обобщенными антиоксидантными показателями.
Одним из основных источников биологически активных веществ для человека являются пищевые продукты, среди которых следует отметить специи, проявляющие широкий спектр биологической активности, в том числе антиоксидантные свойства [1, 2]. Эти полезные свойства специй предопределили их применение в качестве консервантов продуктов питания, а также вкусоароматических добавок к ним. Кроме того, многие биологически активные вещества, применяемые в производстве биологически активных добавок или лекарственных средств, получают путем выделения из растительного сырья, в том числе и специй. Экстракты специй активно используют в пищевой промышленности. В связи с этим поиск и разработка способов извлечения активных компонентов из специй представляет теоретический и практический интерес. Для решения этой задачи обычно используют жидкостную, твердофазную и сверхкритическую флюидную экстракцию [3, 4]. Для интенсификации процесса извлечения часто применяют ультразвуковую обработку. Это позволяет значительно сократить продолжительность процедуры экстракции и расход экстрагента, число стадий извлечения, а также использовать достаточно мягкие условия для извлечения аналитов [3–5], что соответствует концепции “зеленой химии”. Другой способ реализации этой концепции – переход от экстракции органическими растворителями к нетоксичным водным средам, в качестве которых применяют мицеллярные среды на основе поверхностно-активных веществ (ПАВ). Их главным преимуществом по сравнению с другими экстрагентами является способность солюбилизировать как полярные, так и неполярные соединения, что имеет значение для обобщенной характеристики свойств полученных извлечений [3]. В литературе описаны лишь единичные примеры мицеллярной экстракции активных компонентов из специй. Так, для извлечения эвгенола и полифенолов из гвоздики предложен метод динамической мацерации при 50°С в течение 40 мин с помощью 5%-ного Tween 80 при рН 12, обеспечивающий более высокий выход аналитов по сравнению с традиционной экстракцией этанолом и водно-этанольными смесями [6].
Представляет практический интерес сочетание экстракции ПАВ-содержащими средами с ультразвуковой обработкой. Для извлечения таншинонов (биоактивных компонентов сальвии) из Salvia miltiorrhiza bunge успешно использованы мицеллярные среды на основе ионных жидкостей с ультразвуковой обработкой [7]. Показана возможность ультразвуковой экстракции фенольных антиоксидантов из специй с помощью 0.25 мM Triton X-100 [8], однако подход неприменим для извлечения куркуминоидов. Это ограничение успешно преодолевается при ультразвуковой экстракции антиоксидантов из специй мицеллярной средой Brij® 35 [9, 10]. Установлено, что такой подход обеспечивает более высокий выход фенольных антиоксидантов по сравнению с экстракцией органическими растворителями [9].
В настоящей работе для экстракции активных компонентов из специй применили мицеллярную экстракцию 0.1 М Brij® 35, эффективность которой оценивали методом кулонометрического титрования электрогенерированным Се(IV). Применение Сe(IV) в качестве кулонометрического титранта позволяет охватить широкий круг биологически активных веществ, способных к окислению, в том числе антиоксидантов различной природы, поскольку Сe(IV) проявляет сильные окислительные свойства. Кроме того, Сe(IV) является одноэлектронным окислителем, что позволяет в какой-то степени приблизиться к условиям протекания реакций в живых системах с участием активных форм кислорода и азота. Рассмотрена электрогенерация Се(IV) в присутствии Brij® 35 и его влияние на реакции титранта с биологически активными соединениями. Определена Ce(IV)-восстанавливающая способность полученных мицеллярных экстрактов специй и сопоставлена с другими антиоксидантными показателями.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. Использовали 97%-ный рутин тригидрат (Alfa Aesar, Великобритания), 98%-ный кверцетин дигидрат, 98%-ный катехин гидрат (Sigma, Германия), танин фармакопейной чистоты (Fluka, Германия), 99%-ную галловую, 98%-ную кофейную, 98%-ную розмариновую и 98%-ную п-кумаровую кислоты (Sigma, Германия), 70%-ный куркумин из Curcuma longa, 96%-ный α-токоферол и 95%-ный ретинол (Sigma, Германия), 50%-ный капсаицин (Sigma, Индия), 95%-ную хлорогеновую и 99%-ную феруловую кислоты, 99%-ный эвгенол и 98%-ный сиреневый альдегид (Aldrich, Германия), 99.5%-ный тимол (Sigma, Германия). Их стандартные 0.40–10 мМ растворы готовили растворением точной навески в 0.1 М Brij® 35 (Sigma, Германия) с ультразвуковой обработкой (WiseClean WUC-A03H (DAIHAN Scientific Co., Ltd., Корея)) в течение 10 мин. Остальные реактивы были марки х. ч.
Кулонометрические определения проводили на анализаторе Эксперт-006 (ООО “Эконикс-Эксперт”, Россия). Электрогенерацию Ce(IV) осуществляли из 0.1 М раствора нитрата церия(III) в 3 М H2SO4 на Pt-электроде при постоянной силе тока 5.0 мА, обеспечивающей 100%-ный выход по току титранта. В качестве катода использовали свернутую спиралью платиновую проволоку. Катодная камера со вспомогательным электродом была отделена от анодной камеры пористой стеклянной перегородкой. Конечную точку титрования определяли биамперометрически с платиновыми электродами (ΔЕ = 200 мВ). Поверхность платиновых электродов очищали азотной кислотой с последующим промыванием дистиллированной водой.
В электрохимическую ячейку емк. 50 мл вносили 20.0 мл фонового электролита, помещали в ячейку электроды и включали генераторную цепь. По достижении индикаторным током определенного значения генераторная цепь автоматически отключалась и снова включалась одновременно с таймером после внесения аликвоты исследуемого соединения или экстракта специй. Для титрования брали аликвоты с таким расчетом, чтобы время титрования не превышало 2 мин. Конечную точку титрования устанавливали по достижении индикаторным током первоначального значения. По времени титрования рассчитывали количество электричества, затраченного на титрование экстракта, или число электронов по закону Фарадея для индивидуальных соединений.
Интегральную антиоксидантную емкость и железовосстанавливающую способность определяли кулонометрическим титрованием экстрактов с помощью электрогенерированных брома и гексацианоферрат(III)-ионов соответственно [8, 10].
Экстракция мицеллярной средой Brij® 35. Точную навеску (0.1000 ± 0.0005 г) коммерческих образцов специй помещали в пробирки емк. 15.0 мл, добавляли от 2.0 до 9.0 мл 0.1 М раствора Brij® 35 и помещали в ультразвуковую ванну на 10 мин [9]. Экстракт отфильтровывали и использовали для оценки полноты экстракции и церий-восстанавливающей способности.
Статистическую обработку результатов проводили для пяти измерений (три измерения для оценки эффективности электрогенерации титранта) при доверительной вероятности 0.95. Результаты представляли как X ± ΔX, где X – среднее значение и ΔX – доверительный интервал. Случайную погрешность определения оценивали по величине относительного стандартного отклонения (sr). Корреляционный анализ проводили в программе OriginPro 8.0 (OriginLab, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для извлечения активных компонентов из специй предложена мицеллярная экстракция 0.1 М Brij® 35, так как неоиногенное ПАВ обеспечивает максимальное извлечение по сравнению с катионными и анионными ПАВ [9].
Электрогенерация Се(IV) в присутствии Brij® 35. Обязательным условием реализации метода кулонометрического титрования является количественный выход по току титранта. При переходе к ПАВ-содержащим средам происходит изменение вязкости растворов, что приводит к уменьшению скорости диффузии ионов, из которых генерируется титрант в ходе электрохимической реакции, а следовательно, и скорости переноса электрона [11, 12]. Поэтому концентрация ПАВ в среде генерирования титранта имеет значение.
Рассмотрена электрогенерация Ce(IV) в присутствии Brij® 35. Сопоставление времени генерации титранта показало, что одноэлектронное окисление Се(III) до Се(IV) не осложняется в присутствии Brij® 35 в диапазоне его концентраций от 0.050 до 4 мМ. Эффективность электрогенерации Ce(IV) оценена по титрованию аскорбиновой кислоты в качестве стандарта. Для этого генерировали титрант в течение времени, составляющего 90–95% от теоретически необходимого в отсутствие титруемого вещества, затем в ячейку вводили определенное количество аскорбиновой кислоты и дотитровывали до точки эквивалентности.
Аскорбиновая кислота окисляется электрогенерированным Ce(IV) до дегидроаскорбиновой кислоты с участием двух электронов. Эффективность генерации титранта для различных количеств аскорбиновой кислоты рассчитывали как отношение теоретического и практического значений количества электричества, выраженное в процентах (табл. 1). Установлено, что электрогенерация титранта в присутствии Brij® 35 протекает со 100%-ным выходом по току, что позволяет использовать Ce(IV) как титрант для решения аналитических задач.
Таблица 1.
Эффективность тока генерации Ce(IV) в присутствии Brij® 35 по данным кулонометрического титрования аскорбиновой кислоты (n = 3, Р = 0.95)
| сBrij® 35, мМ | Qтеор, Кл | Qпракт, Кл | sr | Выход титранта по току, % |
|---|---|---|---|---|
| 0.25 | 0.102 | 0.102 ± 0.004 | 0.015 | 100 ± |
| 0.50 | 0.205 | 0.205 ± 0.001 | 0.0028 | 99.8 ± 0.3 |
| 0.75 | 0.307 | 0.306 ± 0.005 | 0.0068 | 99.6 ± 0.7 |
| 1.0 | 0.409 | 0.408 ± 0.002 | 0.0025 | 99.9 ± 0.3 |
Реакции электрогенерированного Се(IV) с компонентами специй. Кулонометрическое титрование стандартных растворов индивидуальных биологически активных компонентов специй показало, что все рассматриваемые соединения окисляются Се(IV). Число электронов, участвующих в реакции, варьируется, что обусловлено природой рассматриваемых соединений и силой титранта-окислителя (в кислой среде Ce(IV) проявляет сильные окислительные свойства). Так, аскорбиновая, кофейная, хлорогеновая, феруловая и п-кумаровая кислоты и α-токоферол окисляются по двухэлектронному механизму. Для галловой кислоты и рутина реакция протекает с участием трех электронов, а в случае кверцетина, эвгенола, розмариновой кислоты и ретинола – четырех электронов. Окисление катехина и тимола включает перенос пяти электронов, а куркумина и капсаицина – шести электронов. Танин окисляется с участием 150 электронов, что свидетельствует о глубоком окислении молекулы и согласуется с большим числом фенольных гидроксильных групп в его структуре. Следует отметить, что Се(IV) является одноэлектронным окислителем, что сводит к минимуму вероятность протекания конкурирующих реакций. Таким образом, электрогенерированный Се(IV) обладает высокой реакционной способностью и может быть использован для оценки содержания активных компонентов специй.
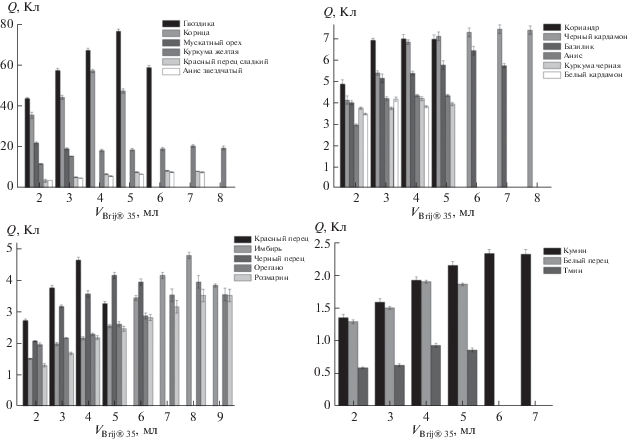
Мицеллярная экстракция активных компонентов из специй и Ce(IV)-восстанавливающая способность полученных извлечений. Оценена эффективность мицеллярной экстракции с ультразвуковой обработкой активных компонентов специй с использованием в качестве экстрагента 0.1 М Brij® 35. Для этого проводили кулонометрическое титрование экстрактов электрогенерированным Се(IV). В качестве параметра для оценки эффективности извлечения использовали количество электричества, затраченное на титрование экстракта. Варьирование времени экстракции в диапазоне 5–15 мин на примере гвоздики показало, что 10 мин достаточно для извлечения активных компонентов. Соотношение сырье/экстрагент, обеспечивающее максимальное извлечение, устанавливали для каждой специи индивидуально (рис. 1). Показано, что этот параметр варьируется в широких пределах (от 1 : 20 до 1 : 90) в зависимости от природы специи, что согласуется с литературными данными [8–10].
Определили Ce(IV)-восстанавливающую способность экстрактов 20 специй (табл. 2), которую выражали как количество электричества, затраченное на титрование экстракта в пересчете на 1 г сухой специи. Основные компоненты, вносящие вклад в Ce(IV)-восстанавливающую способность, представлены главным образом терпеноидами и различными классами фенольных антиоксидантов (табл. 3). Максимальные значения Ce(IV)-восстанавливающей способности получены для гвоздики и корицы, что хорошо согласуется с антиоксидантными параметрами их спиртовых экстрактов [10, 13–15] и мицеллярных извлечений средой Triton X-100 [8].
Таблица 2.
Ce(IV)-восстанавливающая способность мицеллярных экстрактов специй (экстрагент – 0.1 М Brij® 35, n = 5, P = 0.95)
| Специя | VBrij® 35 на 1 г специи, мл | Ce(IV)-восстанавливающая способность, Кл/1 г | sr |
|---|---|---|---|
| Гвоздика | 50 | 768 ± 8 | 0.010 |
| Корица | 40 | 569 ± 7 | 0.011 |
| Мускатный орех | 20 | 219 ± 4 | 0.014 |
| Куркума желтая | 70 | 205 ± 7 | 0.020 |
| Красный перец сладкий | 60 | 87 ± 3 | 0.012 |
| Анис звездчатый | 60 | 79 ± 1 | 0.011 |
| Черный кардамон | 70 | 74 ± 2 | 0.012 |
| Белый кардамон | 80 | 69 ± 4 | 0.025 |
| Кориандр | 30 | 69 ± 1 | 0.0083 |
| Базилик | 60 | 64 ± 1 | 0.016 |
| Имбирь | 90 | 47.6 ± 0.7 | 0.0092 |
| Красный перец | 40 | 46.5 ± 0.5 | 0.009 |
| Анис | 40 | 43.0 ± 0.4 | 0.0038 |
| Куркума черная | 40 | 42.0 ± 0.7 | 0.010 |
| Черный перец | 60 | 41 ± 3 | 0.029 |
| Орегано | 80 | 40 ± 1 | 0.012 |
| Розмарин | 80 | 35.2 ± 0.9 | 0.018 |
| Кумин | 60 | 23.3 ± 0.5 | 0.017 |
| Белый перец | 40 | 18.8 ± 0.30 | 0.0062 |
| Тмин | 40 | 9.3 ± 0.6 | 0.025 |
Таблица 3.
| Специя | Биологически активные компоненты специй |
|---|---|
| Гвоздика | Эвгенол и его производные, галлаты, флавоноиды, ванилин, сесквитерпеноиды |
| Корица | Эвгенол и его производные, коричный альдегид, монотерпены, линалоол, β-кариофиллен, флавоноиды (катехины, процианидины, кверцетин, кемпферол), танины |
| Мускатный орех | Эвгенол и его производные, флавоноиды (катехины, мирицетин, оргентин), γ-терпены, олеиновая, кофейная, пальмитиновая и миристиновая кислоты, терпеновые спирты, камфен, мирцен |
| Куркума желтая | Куркуминоиды (куркумин, деметоксикуркумин, бисдеметоксикуркумин и тетрагидрокуркумин), аскорбиновая, сиреневая, ванилиновая и гидроксикоричные кислоты, эвгенол, β-каротин |
| Куркума черная | Эстрагол, производные эвгенола, терпеноиды (камфора, 1,8-цинеол, турмерон, оцимен, борнеол), флавоноиды |
| Красный перец сладкий | Аскорбиновая, пальмитиновая, миристиновая и гидроксикоричные кислоты, γ-терпены, терпеновые спирты, эвгенол, флавоноиды, α-токоферол, β-каротин, β-ситостерол, камфен |
| Красный перец | Капсаициноиды, терпеновые спирты, аскорбиновая, пальмитиновая, миристиновая и гидроксикоричные кислоты, флавоноиды, β-каротин |
| Черный перец | Пиперин и его производные, фенольные амиды, терпеновые спирты, аскорбиновая, лауриловая, пальмитиновая и миристиновая кислоты, флавоноиды, β-каротин, камфен |
| Кардамон | Терпеноиды (лимонен, 1,8-цинеол, мирцен, терпинолен), кофейная кислота, флавоноиды (кверцетин, кемпферол, лютеолин), антоцианы (пеларгонин) |
| Кориандр | Аскорбиновая, ванилиновая, миристиновая, протокатехиновая и гидроксикоричные кислоты, флавоноиды, терпеновые спирты, γ-терпены, пальмитиновая кислота, β-каротин, β-ситостерол, камфен, мирцен |
| Базилик | Флавоноиды (апигенин, катехины, кверцетин, рутин, кемпферол), антоцианы, эвгенол, терпеноиды (линалоол, пинен, оцимен), танины, фенольные кислоты (кофейная, ванилиновая, п-кумаровая, розмариновая), урсоловая кислота, метилхавикол |
| Имбирь | Зингерон, шогаолы, парадолы, диарилгептаноиды, γ-терпены, терпеновые спирты, флавоноиды, миристиновая и гидроксикоричные кислоты, β-каротин, β-ситостерол, камфен, капсаицин, куркумин, мирцен |
| Анис | Хлорогеновые кислоты, транс-анетол, анисовый альдегид, флавоноиды, эстрагол, терпеноиды |
| Анис звездчатый | цис- и транс-Анетол, шикимовая и гидроксибензойные кислоты, флавоноиды, лигнаны, сесквитерпеноиды, фенилпропаноиды |
| Орегано | Фенольные кислоты (розмариновая, протокатеховая, п-кумаровая, кофейная) и их производные, флавоноиды (апигенин, кверцетин, лютеолин, мирицетин, диосметин и эриодиктиол), изопропилметилфенолы (тимоли карвакрол), токоферолы, γ-терпены, терпеновые спирты, камфен |
| Розмарин | Карнозиновая, розмариновая, урсоловая, аскорбиновая и гидроксикоричные кислоты, карнозол, розманол, γ-терпены, терпеновые спирты, флавоноиды (апигенин, диосмин, лютеолин), танины, эвгенолы, олеиновая кислота, β-каротин, β-ситостерол, камфен, пинен, 1,8-цинеол |
| Кумин | Фенольные монотерпеноиды (тимол, α-терпинеол, куминовый спирт), терпеноиды (лимонен, 1,8-цинеол, мирцен, терпинолен) |
| Тмин | β-Каротин, камфен, мирцен, γ-терпены, миристиновая, пальмитиновая и лауриновая кислоты, кверцетин, танин |
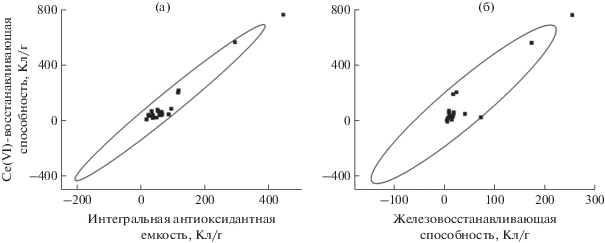
Результаты определения Ce(IV)-восстанавливающей способности мицеллярных экстрактов специй сопоставили с их интегральной антиоксидантной емкостью по реакции с электрогенерированным бромом и железовосстанавливающей способностью по реакции с электрогенерированными гексацианоферрат(III)-ионами. Установлены положительные корреляции (рис. 2) c коэффициентами 0.9826 и 0.9382 для интегральной антиоксидантной емкости и железовосстанавливающей способности соответственно, что подтверждает правильность полученных результатов. Предложенный подход можно успешно использовать для скрининга специй и других растительных материалов.
Список литературы
Rubió L., Motilva M.-J., Romero M.-P. Recent advances in biologically active compounds in herbs and spices: A review of the most effective antioxidant and anti-inflammatory active principles // Crit. Rev. Food Sci. Nutr. 2013. V. 53. № 9. P. 943. https://doi.org/10.1080/10408398.2011.574802
Yashin A., Yashin Y., Xia X., Nemzer B. Antioxidant activity of spices and their impact on human health: a review // Antioxidants 2017. V. 6. № 3. Article 70. https://doi.org/10.3390/antiox6030070
Зиятдинова Г.К., Будников Г.К. Антиоксиданты специй как объекты аналитической химии // Журн. аналит. химии. 2018. Т. 73. № 10. С. 739. (Ziyatdinova G.K., Budnikov H.C. Spice antioxidants as objects of analytical chemistry // J. Anal. Chem. 2018. V. 73. № 10. P. 946. )https://doi.org/10.1134/S106193481810012X
Ajila C.M., Brar S.K., Verma M., Tyagi R.D., Godbout S., Valero J.R. Extraction and analysis of polyphenols: recent trends // Crit. Rev. Biotechnol. 2011. V. 31. № 3. P. 227. https://doi.org/10.3109/07388551.2010.513677
Chemat F., Rombaut N., Sicaire A.-G., Meullemiestre A., Fabiano-Tixier A.-S., Abert-Vian M. Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications. A review // Ultrasonics Sonochemistry. 2017. V. 34. P. 540. https://doi.org/10.1016/j.ultsonch.2016.06.035
Cortés-Rojas D.F., Souza C.R.F., Oliveira W.P. Surfactant mediated extraction of antioxidants from Syzygium aromaticum // Sep. Sci. Technol. 2015. V. 50. № 2. P. 207. https://doi.org/10.1080/01496395.2014.952305
Wu K., Zhang Q., Liu Q., Tang F., Long Y., Shouzhuo Y. Ionic liquid surfactant-mediated ultrasonic-assisted extraction coupled to HPLC: Application to analysis of tanshinones in Salvia miltiorrhiza bunge // J. Sep. Sci. 2009. V. 32. № 23–24. P. 4220. https://doi.org/10.1002/jssc.200900398
Зиятдинова Г.К., Нгуен Конг Ф., Будников Г.К. Оценка антиоксидантных свойств мицеллярных экстрактов специй методом гальваностатической кулонометрии с электрогенерированными гексацианоферрат(III)-ионами // Журн. аналит. химии. 2015. Т. 70. № 8. С. 854. (Ziyatdinova G.K., Nguen Cong F., Budnikov H.C. Assessment of the antioxidant properties of micellar spice extracts by galvanostatic coulometry with electrogenerated hexacyanoferrate(III) ions // J. Anal. Chem. 2015. V.70. № 8. P. 974. )https://doi.org/10.1134/S1061934815080195
Ziyatdinova G., Ziganshina E., Nguyen Cong Ph., Budnikov H. Ultrasound-assisted micellar extraction of phenolic antioxidants from spices and antioxidant properties of the extracts based on coulometric titration data // Anal. Methods. 2016. V. 8. № 39. P. 7150. https://doi.org/10.1039/c6ay02112c
Зиганшина Э.Р., Зиятдинова Г.К., Нгуен Конг Ф., Будников Г.К. Интегральная антиоксидантная емкость мицеллярных экстрактов специй по данным гальваностатической кулонометрии // Бутлеровские сообщения. 2015. Т. 42. № 5. С. 56.
Rosen M.J., Kunjappu J.T. Surfactants and Interfacial Phenomena. 4th Ed. Hoboken: John Wiley & Sons, Inc, 2012. 616 p. https://doi.org/10.1002/9781118228920
Ziyatdinova G., Ziganshina E., Budnikov H. Surfactant media for constant-current coulometry. Application for the determination of antioxidants in pharmaceuticals // Anal. Chim. Acta. 2012. V. 744. P. 23. https://doi.org/10.1016/j.aca.2012.07.023
Зиятдинова Г.К., Будников Г.К. Оценка антиоксидантных свойств специй по данным циклической вольтамперометрии // Журн. аналит. химии. 2014. Т. 69. № 10. С. 1086. (Ziyatdinova G.K., Budnikov H.C. Evaluation of the antioxidant properties of spices by cyclic voltammetry // J. Anal. Chem. 2014. V. 69. № 10. P. 990. )https://doi.org/10.1134/S1061934814100189
Chemistry of Spices / Eds. Parthasarathy V.A., Chempakam B., Zachariah T.J. CABI, 2008. 445 p.
Mansour A.F., Ramadan M.M., Fekry R.M., Salem M.T., Mohammad A.A., Ali M.M., Mohammed N.S. Evaluation of synergistic interactions on antioxidant and anticancer efficacy of methanol extracts of some egyptian spices in combination // Int. J. Biol. Chem. 2017. V. 11. № 1. P. 9. https://doi.org/10.3923/ijbc.2017.9.16
Embuscado M.E. Bioactives from culinary spices and herbs: a review // J. Food Bioact. 2019. V. 6. P. 68. https://doi.org/10.31665/JFB.2019.6186
Shan B., Cai Y.Z., Sun M., Corke H. Antioxidant capacity of 26 spice extract and characterization of their phenolic constituents // J. Agric. Food Chem. 2005. V. 53. № 20. P. 7749. https://doi.org/10.1021/jf051513y
Embuscado M.E. Spices and herbs: natural sources of antioxidants – A mini review // J. Funct. Foods. 2015. V. 18. Part B. P. 811. https://doi.org/10.1016/j.jff.2015.03.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии