Журнал аналитической химии, 2021, T. 76, № 9, стр. 788-796
Влияние модификаторов на электрофоретическое разделение и внутрикапиллярное концентрирование биологически активных соединений
А. В. Кравченко a, *, Л. А. Карцова a
a Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Университетский просп., 26, Петродворец, Россия
* E-mail: kravchenko161216@gmail.com
Поступила в редакцию 07.04.2021
После доработки 19.04.2021
Принята к публикации 19.04.2021
Аннотация
Применение модификаторов при электрофоретическом разделении многокомпонентных смесей позволяет существенно расширить аналитические возможности метода капиллярного электрофореза. Различные по природе и свойствам, модификаторы электрофоретических систем могут выполнять различные функции: формировать стационарные и псевдостационарные фазы, предотвращать сорбцию определяемых соединений на стенках кварцевого капилляра, способствовать снижению пределов обнаружения аналитов в процессе концентрирования и т.д. В представленном обзоре рассмотрены различные варианты применения модификаторов для электрофоретического разделения и концентрирования аналитов различной природы на примере имидазолиевых ионных жидкостей, которые могут выступать в качестве стационарной и псевдостационарной фаз, а также принимать непосредственное участие в онлайн-концентрировании аналитов гидрофильной и гидрофобной природы.
Метод капиллярного электрофореза (КЭ) позволяет оценивать аналитические возможности различных модификаторов при их применении в качестве стационарных и псевдостационарных фаз, способных регулировать эффективность и селективность разделения аналитов, а также предлагать новые пути внутрикапиллярного концентрирования с их участием. Достижения органического синтеза, существенно расширили спектр соединений, способных выполнять роль таких модификаторов. Для этой цели востребованы поверхностно-активные вещества (ПАВ) [1, 2], гидрофильные и гидрофобные полимеры [3–6], дендритные [7] и молекулярно-импринтированные полимерные материалы, связанные с наночастицами [8, 9], наночастицы [10], ионные жидкости [11–14] и др. Выбор того или иного модификатора в существенной степени обусловлен природой определяемых аналитов [15]. При введении в состав фонового электролита (ФЭ) модификаторы могут выполнять различные функции: предотвращать сорбцию определяемых соединений, изменять скорость и направление электроосмотического потока (ЭОП), регулировать селективность разделения за счет дополнительных взаимодействий с аналитами, способствовать реализации различных режимов капиллярного электрофореза (мицеллярная электрокинетическая хроматография, капиллярная электрохроматография, микроэмульсинная электрокинетическая хроматография, лигандообменный капиллярный электрофорез), участвовать в процессах внутрикапиллярного концентрирования. Наиболее часто для этих целей используют анионные и катионные ПАВ (додецилсульфат натрия, ДДСН; цетилтриметиламмоний бромид, ЦТАБ) в концентрации выше критической концентрации мицеллообразования (ККМ), а также циклодекстрины (ЦД) и их производные. Проникновение аналитов в гидрофобную полость мицелл или макроциклов обеспечивает дополнительный вклад в селективность разделения и лежит в основе некоторых широко применяемых методов концентрирования.
Одним из наиболее универсальных и эффективных вариантов электрофоретического онлайн-концентрирования заряженных и нейтральных соединений является свипинг (sweeping), в основе которого лежит концентрирование аналитов псевдостационарной фазой (мицеллами), проникающей в зону образца, не содержащую мицелл. Факторы концентрирования достигают значений 1000–5000. В клинической медицине именно свипинг предпочтителен при определении следовых количеств биологически активных веществ в моче, сыворотке и плазме крови. Наряду с ДДСН [2] и ЦТАБ [1], в формировании псевдостационарных фаз и процессах внутрикапиллярного концентрирования успешно применяют и более сложные ПАВ, такие как “гемини” [16] и диалкилзамещенные ПАВ [17], для которых характерна более высокая стабильность и меньшее значение ККМ. Производные ЦД в условиях мицеллярной электрокинетической хроматографии могут одновременно выполнять роль концентрирующих агентов и хиральных селекторов [18, 19]. В работе [18] применение сульфо-β-ЦД в качестве хиральной псевдостационарной фазы обеспечило разделение энантиомеров хлорфенамина с одновременным его концентрированием в 190 раз.
В последние годы успешно зарекомендовали себя методы онлайн-концентрирования нейтральных соединений, основанные на разрушении мицелл (analyte focusing by micelle collapse, AFMC) [13, 20, 21]. В отличие от процедуры классического свипинга, мицеллы при таком подходе добавляют в раствор пробы с высокой проводимостью. В качестве фонового электролита используют разбавленный буферный раствор с низкой проводимостью, не содержащий мицелл. Мицеллы переносят нейтральные аналиты в кварцевый капилляр. На границе с ФЭ концентрация ПАВ становится ниже их ККМ. В результате мицеллы разрушаются и аналиты высвобождаются. Повторный перенос и разрушение мицелл приводит к концентрированию аналитов. Аналогичный подход к внутримолекулярному концентрированию разработан и для заряженных аналитов (micelle to solvent stacking, MSS) [14]. В этом случае мицеллы в растворе анализируемой пробы должны иметь заряд, противоположный заряду определяемых аналитов. В фоновый электролит добавляют органический растворитель, либо его вводят в капилляр перед дозированием пробы. Как и в предыдущем случае, ионогенные аналиты переносятся мицеллами в кварцевый капилляр под действием приложенного напряжения. Внутри капилляра они встречаются с зоной органического растворителя, что приводит к изменению ККМ и разрушению или уменьшению концентрации мицелл в растворе. Свободные аналиты электрофоретически мигрируют обратно в зону мицелл, вновь взаимодействуя с ними. Процесс повторяется до тех пор, пока все мицеллы в пробе не разрушатся. Это, в свою очередь, приводит к эффективному концентрированию ионов пробы.
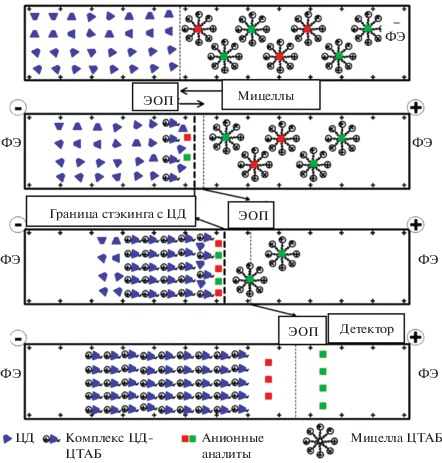
Причиной разрушения мицелл может стать и взаимодействие с ЦД (micelle to cyclodextrin stacking, MCDS) [22, 23], что реализовано при концентрировании катионных (с использованием мицелл ДДСН), анионных (с использованием мицелл ЦТАБ) [22] и нейтральных аналитов [23] (рис. 1). Последовательно в капилляр вводят образец с мицеллами ДДСН и аналитами, а затем пробку из нейтрального ЦД в растворе фонового электролита. Под действием напряжения аналиты, связанные с отрицательно заряженными мицеллами, мигрируют к границе с ЦД, где формируются комплексы включения макроцикла с ДДСН. Количество свободного ДДСН становится недостаточным для образования мицелл, что приводит к высвобождению аналитов на границе раздела. Далее сконцентрированные аналиты мигрируют по направлению к аноду за счет собственных электрофоретических подвижностей.
Рис. 1.
Схема концентрирования анионных аналитов при разрушении мицелл с участием циклодекстрина [22].
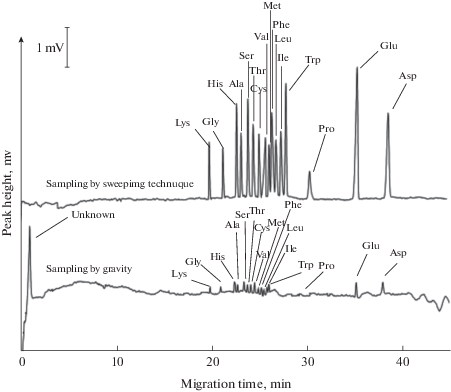
Интересный вариант свипинга, обеспечивший увеличения чувствительности в 25–30 раз при электрофоретическом определении 16 аминокислот, предложен в работе [24] (рис. 2). Введенные в фоновый электролит ионы меди(II), обладающие большей по сравнению с аминокислотами электрофоретической подвижностью, “догоняют” аналиты, и за счет процессов комплексообразования ([Cu(AК)n]+2) способствуют их эффективному концентрированию [24, 25].
Подобный подход применен и при электрофоретическом определении ионов тяжелых металлов (Pb, Cd, Cu) с участием ЭДТА в качестве комплексообразователя (динамическое хелатирование) с достигнутыми факторами концентрирования 33–100 [26].
Модификатор может не только вводиться в ФЭ и выполнять роль псевдостационарной фазы и концентрирующего агента, но и быть ковалентно связанным или адсорбированным на поверхности кварцевого капилляра [27], что влияет на скорость и направление электроосмотического потока и обеспечивает дополнительный резерв селективности разделения аналитов с реализацией режима капиллярной электрохроматографии. Различные типы модификаторов, используемых для формирования покрытий и предотвращающих сорбцию аналитов на стенках капилляра, подробно описаны в работе [15].
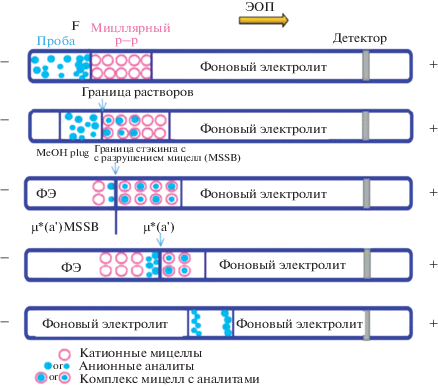
В последние годы отмечается рост интереса к применению новых модификаторов и мицеллообразующих агентов при электрофоретическом разделении и внутрикапиллярном концентрирования гидрофильных и гидрофобных аналитов. Это в существенной степени относится к имидазолиевым ионным жидкостям (ИЖ), применение которых оказалось весьма перспективным в процессах формирования динамических и ковалентных покрытий [28–32], псевдостационарных фаз для реализации режима свипинга [33] и техники концентрирования с разрушением мицелл [13, 14, 33]. Так, в работе [33] описан пример трехэтапного концентрирования анионных аналитов с использованием имидазолиевой ионной жидкости в качестве катионного ПАВ для формирования мицелл и положительно заряженного динамического покрытия: ионселективный стэкинг, свипинг и разрушение мицелл (MSS) (рис. 3). Капилляр заполняют положительно заряженной мицеллярной фазой, далее осуществляют электрокинетический ввод анализируемого образца и затем вводят метанольную пробку. При наложении напряжения мицеллы проникают в матрицу пробы и взаимодействуют с аналитами. Образующиеся ассоциаты типа мицелла–аналит мигрируют к границе матрицы пробы с метанолом. Изменение гидрофобно-гидрофильного баланса на границе приводит к разрушению мицелл и высвобождению отрицательно заряженных аналитов. Наличие положительно заряженного покрытия кварцевого капилляра и его тип влияют на факторы концентрирования. Среди исследуемых катионных модификаторов (поли(диаллилдиметиламмоний) хлорид, гексадиметрин бромид, 1-додецил-3-метилимидазолия гидросульфат и др.) именно применение имидазолиевых ИЖ позволило достичь максимальных факторов концентрирования (1167–2424) при разделении методом КЭ и онлайн-концентрировании органических кислот [33].
Рис. 3.
Схема процесса трехэтапного концентрирования с использованием положительно заряженных динамических покрытий [33].
Введение в фоновый электролит ИЖ с небольшим алкильным радикалом и объемным каркасным заместителем не приводит к заметной модификации стенок кварцевого капилляра: скорость ЭОП снижается лишь на 20–25%. Напротив, в случае длинноцепочечных имидазолиевых ИЖ генерируется сильный анодный ЭОП, что свидетельствует о формировании динамического покрытия. Максимальное значение скорости ЭОП (–62.7 × 10–9 м2/(В с)) наблюдается при концентрации ионной жидкости C12MImCl в ФЭ, близкой к критической концентрации мицеллообразования ИЖ (12–15 мМ) [28]. Тем не менее наличие в фоновом электролите ИЖ C4MImCl (10 мМ) обеспечило повышение эффективности и селективности разделения биогенных аминов.
Несмотря на простоту формирования динамических покрытий, растет число работ, в которых для разделения и концентрирования биологически активных аналитов используют ковалентно связанные стационарные фазы. Это обеспечивает стабильный ЭОП и высокую воспроизводимость результатов анализа. Дизайн на основе имидазолиевого катиона прекрасно зарекомендовал себя и в этой роли.
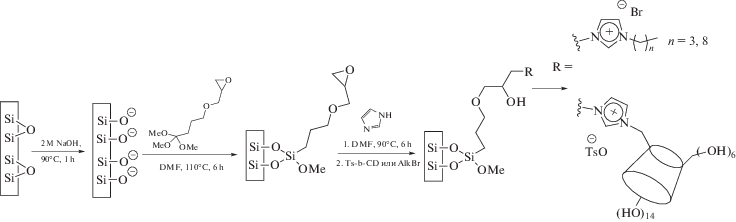
Нами предложен вариант синтеза ковалентных покрытий на основе имидазолиевого катиона, который включает в себя предварительную подготовку капилляра, формирование слоя-линкера и функционализацию [28, 30] (рис. 4). Подготовка капилляра заключалась в активации его стенок путем травления щелочью и десорбции координированной воды. Слой-линкер был син-тезирован в форме олигомера 3-глицидилпропилтриметоксисилана в результате четырех последовательных реакций силилирования. Первый этап фунционализации – реакция нуклеофильного замещения имидазолом с раскрытием оксиранового кольца. Наличие нуклеофила в полученной на этом этапе структуре покрытия обеспечило возможность последующей функционализации посредством реакции нуклеофильного замещения (в нашем случае использованы 1-бромбутан, 1-бромоктан, а также предварительно синтезированный для этой цели моно-п-толуолсульфонил-β-циклодекстрин).
Аналитические характеристики бутил- и октилимидазолиевых покрытий изучены на примере электрофоретического разделения основных аналитов – биогенных аминов. Ковалентная модификация внутренней стенки кварцевого капилляра предотвратила сорбцию аналитов, а дополнительные π–π-взаимодействия с имидазолиевым кольцом проявились в улучшении эффективности и селективности разделения. Применение различных вариантов онлайн-концентрирования на таком покрытии позволило существенно снизить пределы обнаружения (ПО) биогенных аминов (при сочетании свипинга с электростэкингом для бутилового покрытия – 1–2 нг/мл; для октилового – 0.3–1.1 нг/мл). Это, в свою очередь, обеспечило определение этих нейромедиаторов в образцах мочи [28].
В серии электрофоретических экспериментов используемый дизайн синтезированного ковалентного покрытия (рис. 4) позволил обнаружить весьма интересное явление. Наличие в структуре покрытия β-ЦД обеспечило, помимо электрофоретического определения гидрофильных аналитов, разделение гидрофобных стероидных гормонов (гидроксикортизон, кортикостерон, 11-дезоксикортизол) в режиме капиллярной электрохроматографии за счет их взаимодействия с гидрофобной полостью макроцикла на поверхности капилляра. При этом циклодекстрин выполнил роль и хирального селектора, обеспечив разделение энантиомеров нестероидного противовоспалительного препарата (рис. 5) [30]. Однако в ходе реализации различных подходов к онлайн-концентрированию (стэкинг с большим объемом вводимой пробы, свипинг) с целью увеличения селективности разделения выявились некоторые ограничения. Для реализации свипинга в качестве мицеллярного агента мы использовали β-ЦД, гидроксипропил-β-ЦД, β-ЦД-MImOTs, а также ионные жидкости С16MImCl и С12MImCl в концентрациях, превышающих значение ККМ. Вместо ожидаемого эффекта роста селективности разделения наблюдалось ее снижение. Причиной этого могла стать блокировка полостей β-ЦД в составе стационарной фазы введенными в фоновый электролит добавками. Для нивелирования нежелательного эффекта испытали вариант с вводом мицеллярной пробки. Предположили, что введение псевдостационарной фазы в виде пробки обеспечит дополнительный резерв селективности разделения за счет взаимодействия с аналитами, не блокируя полость макроцикла в составе стационарной фазы. Несмотря на то, что ожидаемого улучшения селективности не произошло, введение мицеллярной пробки с ИЖ в качестве мицеллобразующего агента (С16MImCl, С12MImCl в концентрации выше ККМ и 3-метил-1-β-циклодекстринимидазолтозилат) позволило реализовать режим стэкинга с большим объемом вводимой пробы (факторы конентрирования 3–10) с сохранением селективности разделения [35].
Рис. 5.
Аналитические возможности ковалентного покрытия на основе β-циклодекстрина и имидазола [34].
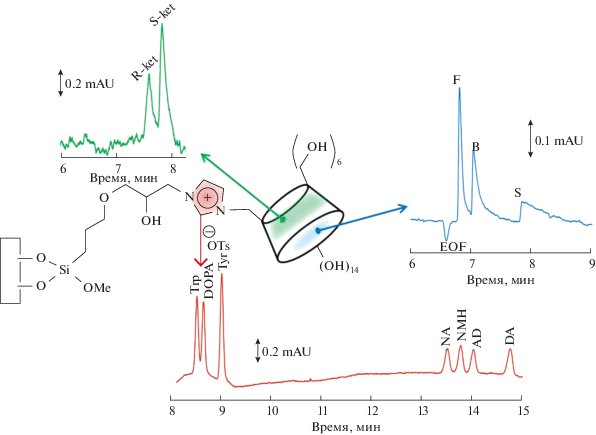
Таким образом, применение имидазолиевых ионных жидкостей в качестве многофункциональных катионных модификаторов позволяет контролировать скорость и направление ЭОП за счет формирования стабильных ковалентных и динамических покрытий и способствовать снижению пределов обнаружения за счет реализации онлайн-концентрирования. Некоторые результаты, полученные при работе с имидазолиевыми ионными жидкостями, суммированы в табл. 1.
Таблица 1.
Имидазолиевые ионные жидкости в качестве динамических и ковалентных покрытий при разделении и концентрировании биогенных аминов и стероидных гормонов
| Тип покрытия | Модифика-ция ЭОП, µЭОП × 109, м2/|(В с) |
Вариант концентрирования | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| биогенные амины | стероидные гормоны | ||||||||||
| наличие разделения | FASS | свипинг + FASI | наличие разделения | FASS | свипинг + FASI | ||||||
| SEFh | ПО | SEFh | ПО | SEFh | ПО | SEFh | ПО | ||||
| Динамическое покрытие на основе С12MImCl [36] | –62.7a | + tанализа > > 18 мин |
10–13 | Не подходящие условия для реализации | – (требуется введение псевдостационарной фазы) |
– | – | ||||
| Динамическое покрытие на основе С4MImCl | –18.5б | + | Не подходящие условия для реализации | – (требуется введение псевдостационарной фазы) |
– | – | |||||
| N-бутилимидазолиевое ковалентное покрытие [28] | –40.3в | + | 105–125 | 11–17 нг/мл | 930–1500 | 1.4–2.3 нг/мл |
– | – | – | – | – |
| N-β-циклодекстринимидазолиевое ковалентное покрытие [30] | –37.7в | + | 3–6 | 150–240 нг/мл | Мицеллы блокируют полость ЦД | ± (разделение трех стероидных гормонов) | 2–3 | 120–160 нг/мл |
Не подходящие условия для реализации | ||
Обозначения: FASS – стэкинг с усилением поля (field-amplified sample stacking), FASI – электростэкинг (field-amplified sample injection), SEFh – фактор концентрирования (staking efficiency factor). a10 мМ NaH2PO4 (pH 2.0, доводили 0.1 M HCl), 9 мМ С12MImCl, –20 кВ, 220 нм, маркер ЭОП – 3%-ный (по объему) раствор диметилформамида (ДМФА) в воде. б10 мМ NaH2PO4 (pH 2.0, доводили 0.1 M HCl), 20 мМ ИЖ, –20 кВ, 220 нм, маркер ЭОП – 3%-ный (по объему) раствор ДМФА в воде. в10 мМ NaH2PO4 (pH 2.0, доводили 0.1 M HCl), –20 кВ, 220 нм, маркер ЭОП – 3%-ный (по объему) раствор ДМФА в воде.
* * *
Применение различных модификаторов для электрофоретического определения и внутрикапиллярного концентрирования гидрофобных и гидрофильных аналитов – одна из активно развивающихся областей капиллярного электрофореза, существенно расширяющая аналитические возможности этого метода. Сюда можно отнести увеличение селективности разделения, предотвращение сорбции аналитов, снижение пределов обнаружения и увеличениe чувствительности анализа, формирование ковалентных и динамических покрытий, обеспечивающих различные режимы электрофоретического метода. Особый интерес представляют полифункциональные модификаторы, среди которых успешно зарекомендовали себя имидазолиевые ионные жидкости.
Работа выполнена при финансовой поддержке Российского научного фонда (номер гранта 19-13-00370).
Список литературы
Brugnerotto P., Betta F.D., Gonzaga L.V., Fett R., Costa A.C.O. A capillary electrophoresis method to determine aliphatic organic acids in bracatinga honeydew honey and floral honey // J. Food Compost. Anal. 2019. V. 82. 103243. https://doi.org/10.1016/j.jfca.2019.103243
Li W., Qian Z., Li C., Guo D., Wei J., Liu X. On-line electrokinetic supercharging and sweeping for the preconcentration and determination of nucleosides and related compounds by capillary electrophoresis // Anal. Lett. 2020. V. 53. №. 12. P. 1919. https://doi.org/10.1080/00032719.2020.1725033
Righetti P.G., Gelfi C., Verzola B., Castelletti L. The state of the art of dynamic coatings // Electrophoresis. 2001. V. 22. P. 603. https://doi.org/10.1002/1522-2683(200102)22:4<603::AID-ELPS603>3.0.CO;2-N
Znaleziona J., Petr J., Knob R., Maier V., Sevcik J. Dynamic coating agents in CE // Chromatographia. 2008. V. 67. P. 5. .https://doi.org/10.1365/s10337-007-0509-y
Lucy C.A., MacDonald A.M., Gulcev M.D. Non-covalent capillary coatings for protein separations in capillary electrophoresis // J. Chromatogr. A. 2008. V. 1184. P. 81. https://doi.org/10.1016/j.chroma.2007.10.114
Liua X., Suna S, Niea R., Maa J., Qub Q., Yanga L. Highly uniform porous silica layer open-tubular capillary columns produced via in-situ biphasic sol–gel processing for open-tubular capillary electrochromatography // J. Chromatogr. A. 2018. V. 1538. P. 86. https://doi.org/10.1016/j.chroma.2018.01.024
Polikarpov N., Potolytsyna V., Bessonova E., Tripp S., Appelhans D., Voit B., Kartsova L. Dendritic glycopolymers as dynamic and covalent coating in capillary electrophoresis: View on protein separation processes and detection of nanogram-scaled albumin in biological samples // J. Chromatogr. A. 2015. V. 1378. P. 65. https://doi.org/10.1016/j.chroma.2014.11.051
Wang X.-N., Liang R.-P., Meng X.-Y., Qiu J.-D. One-step synthesis of mussel-inspired molecularly imprinted magnetic polymer as stationary phase for chip-based open tubular capillary electrochromatography enantioseparation // J. Chromatogr. A. 2014. V. 1362. https://doi.org/10.1016/j.chroma.2014.08.044
Ramezani Z., Safdarian M., Ghadiri A.A. Metal-coded hydrogel magnetic molecularly imprinted polymer for preconcentration and cleanup of sarcosine: Determination in urine; coupled to on-column capillary electrophoresis // Talanta. 2021. V. 230. https://doi.org/10.1016/j.talanta.2021.122309
Kartsova L.A., Makeeva D.V., Davankov V.A. Nano-sized polymer and polymer-coated particles in electrokinetic separations // Trends Anal. Chem. 2019. V. 120. https://doi.org/10.1016/j.trac.2019.115656
Бессонова Е.А., Карцова Л.А., Галлямова В.Ф. Влияние ионной жидкости хлорид 3-метил-1-цетилимидазолия на процессы электрофоретического концентрирования стероидных гормонов // Журн. аналит. химии. 2016. Т. 71. № 7. С. 724. https://doi.org/10.7868/S0044450216070045 (Bessonova E.A., Kartsova L.A. Gallyamova V.F. Effect of 3-methyl-1-cetylimidazolium chloride ionic liquid on the electrophoretic preconcentration of steroid hormones // J. Anal. Chem. 2016. V. 71. № 7. P. 696. )10.7868/S0044450216070045
Su H.L., Lan M.T., Hsieh Y.Z. Using the cationic surfactants N-cetyl-N-methylpyrrolidinium bromide and 1-cetyl-3-methylimidazolium bromide for sweeping-micellar electrokinetic chromatography // J. Chromatogr. A. 2009. V. 1216. P. 5313. https://doi.org/10.1016/j.chroma.2009.05.001
El-Hady D.A., Albishri H.M. Simultaneous determination of acrylamide, asparagine and glucose in food using short chain methyl imidazolium ionic liquid based ultrasonic assisted extraction coupled with analyte focusing by ionic liquid micelle collapse capillary electrophoresis // Food Chem. 2015. V. 188. P. 551. https://doi.org/10.1016/j.foodchem.2015.05.047
Quirino J.P., Anres P., Sirieix-Plénet J., Delaunay N., Garei P. Potential of long chain ionic liquids for on-line sample concentration techniques: Application to micelle to solvent stacking // J. Chromatogr. A. 2011. V. 1218. P. 5718. https://doi.org/10.1016/j.chroma.2011.06.071
Карцова Л.А., Кравченко А.В., Колобова Е.А. Ковалентные покрытия кварцевых капилляров для электрофоретического определения биологически активных аналитов // Журн. аналит. химии. 2019. Т. 74. № 8. С. 563. (Kartsova L.A., Kravchenko A.V., Kolobova E.A. Covalent coatings of quartz capillaries for the electrophoretic determination of biologically active analytes // J. Anal. Chem. 2019. V. 74. № 8. P. 729). https://doi.org/10.1134/S0044450219080103
Yang X., Hao L., Zhang S., Wang C., Wang Z. Sweeping-micelle to solvent stacking for the online preconcentration and determination of organic acids in Angelica sinensis by capillary electrophoresis // RSC Adv. 2018. V. 8. P. 7949. https://doi.org/10.1039/C7RA11553A
Hsieh S.Y., Wang C.C., Kou H.S., Wu S.M. Dialkyl anionic surfactant in field-amplified sample injection and sweeping-micellar electrokinetic chromatography for determination of eight leanness-promoting β-agonists in animal feeds // J. Pharm. Biomed. Anal. 2017. V. 141. P. 222. https://doi.org/10.1016/j.jpba.2017.04.013
Yao Y., Zhou L., Li M., Guo X. The cation-selective exhaustive injection and sweeping capillary electrophoresis method for the analysis of chlorpheniramine enantiomers in rat plasma // J. Pharm. Biomed. Anal. 2018. V. 148. P. 142. https://doi.org/10.1016/j.jpba.2017.09.021
Rabanes H.R., Quirino, J.P. Sweeping of alprenolol enantiomers with an organic solvent and sulfated β-cyclodextrin in capillary electrophoresis // Electrophoresis. 2013. V. 34. P. 1319. https://doi.org/10.1002/elps.201200595
Chao H.C., Liao H.W., Kuo C.H. Using water plug-assisted analyte focusing by micelle collapse in combination with microemulsion electrokinetic chromatography for analyzing phthalate esters // J. Chromatogr. A. 2016. V. 1445. P. 149. https://doi.org/10.1016/j.chroma.2016.03.086
Chang C.W., Chen Y.C. Liu C.Y. Separation and on-line preconcentration of nonsteroidal anti-inflammatory drugs by microemulsion electrokinetic chromatography // Electrophoresis. 2015. V. 36. P. 2745. https://doi.org/10.1002/elps.201500160
Quirino J.P., Grochocki W., Markuszewski M.J. Sample concentration of charged small molecules and peptides in capillary electrophoresis by micelle to cyclodextrin stacking // Anal. Chem. 2017. V. 89. № 24. P. 13422. https://doi.org/10.1021/acs.analchem.7b03700
Chu C., Liu C., Yang F., Lian L., Li J., Mao H., Yan J. A dual preconcentration method by combining micro matrix solid-phase dispersion extraction with field-enhanced sample injection and micelle to cyclodextrin stacking for sensitive analysis of neutral coumarins // Electrophoresis. 2021. https://doi.org/10.1002/elps.202000273
Luo T., Ke J., Xie Y., Dong Y. Determination of underivatized amino acids to evaluate quality of beer by capillary electrophoresis with online sweeping technique // J. Food Drug Anal. 2017. V. 25. № 4. P. 789. https://doi.org/10.1016/j.jfda.2017.03.003
Zhou X.J., Chen J., Shi Y.P. Determination of amino acids in plasma and nutritional supplements by capillary electrophoresis with copper(II) coordination // Anal. Lett. 2015. V. 48. P. 25. https://doi.org/10.1080/00032719.2014.936019
Chen K.L., Jiang S.J., Chen Y.L. Determining lead, cadmium and mercury in cosmetics using sweeping via dynamic chelation by capillary electrophoresis // Anal. Bioanal. Chem. 2017. V. 409. P. 2461. https://doi.org/10.1007/s00216-017-0193-1
Hou M., Zhang M., Chen L., Gong K., Pan C., Wang Y. Amplification of lysozyme signal detected in capillary electrophoresis using mixed polymer brushes coating with switchable properties // Talanta. 2019. V. 202. P. 426. https://doi.org/10.1016/j.talanta.2019.05.014
Kolobova E., Kartsova L., Kravchenko A., Bessonova E. Imidazolium ionic liquids as dynamic and covalent modifiers of electrophoretic systems for determination of catecholamines // Talanta. 2018. V. 188. P. 183. https://doi.org/10.1016/j.talanta.2018.05.057
Колобова Е.А., Карцова Л.А., Бессонова Е.А., Кравченко А.В. On-line концентрирование биогенных аминов методом капиллярного электрофореза с использованием синтезированных ковалентных покрытий на основе ионных жидкостей // Аналитика и контроль. 2017. Т. 21. № 1. С. 57. https://doi.org/10.15826/analitika.2017.21.1.006 (Kolobova E.A., Kartsova L.A., Bessonova E.A., Kravchenko A.V. On-line concentration of biogenic amines by capillary electrophoresis method using the synthesized covalent coating based on the imidazolium ionic liquids // Analytics and Control. 2017. V. 21. № 1. P. 57. )10.15826/analitika.2017.21.1.006
Kravchenko A., Kolobova E., Kartsova L. Multifunction covalent coatings for separation of amino acids, biogenic amines, steroid hormones, and ketoprofen enantiomers by capillary electrophoresis and capillary electrochromatography // Sep. Sci. Plus. 2020. V. 3. P. 102. https://doi.org/10.1002/sscp.201900098
Li L., Du H., Yu H., Xu L., You T. Application of ionic liquid as additive in determination of three β-agonists by capillary electrophoresis with amperometric detection // Electrophoresis. 2013. V. 34. P. 277. https://doi.org/10.1002/elps.201200385
Xiao W., Wang F.Q., Li C.H., Zhang Q., Xia Z.N., Yang F.Q. Determination of eight isoflavones in Radix Puerariae by capillary zone electrophoresis with an ionic liquid as an additive // Anal. Methods. 2015. V. 7. P. 1098. https://doi.org/10.1039/C4AY02374A
Chu C., Wei M., Liu C., Li H., Cao J., Yan J. Over 1000-fold improvement in an online preconcentration of trace anionic compounds by capillary electrophoresis with ionic liquid micelle-based three-step stacking // Anal. Chim. Acta. 2018. V. 1044. P. 191. https://doi.org/10.1016/j.aca.2018.08.027
Kravchenko A.V., Kolobova E.A., Kartsova L.A. Application of covalent coatings based on imidazolium cations for separation and online preconcentration of basic and neutral analytes in capillary electrophoresis / Proc. 16th Int. Students Conf. “Modern Analytical Chemistry” / Edited Nesměrák Karel. Prague: Faculty of Science, Charles University, 2020. P. 35
Кравченко А.В. Синтез полифункциональных модификаторов на основе имидазолиевых ионных жидкостей для селективного электрофоретического определения стероидов и бета-блокаторов … Магистерская диссертация. Санкт-Петербург: Санкт-Петербургский государственный университет, 2019. 109 с.
Колобова Е.А., Карцова Л.А., Бессонова Е.А. Ионные жидкости на основе имидазола в качестве модификаторов электрофоретических систем при определении биогенных аминов и стероидных гормонов // Вестник СПбГУ. 2015. Сер. 4. Т. 2. № 2. С. 185. (Kolobova E.A., Kartsova L.A., Bessonova E.A. Ionic liquids based on imidazole as a modifier of electrophoretic systems for determination of biogenic amines and steroid hormones // Vestn. SPbSU (Russ.). 2015. V. 2. P. 185.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии