Журнал аналитической химии, 2021, T. 76, № 9, стр. 819-831
ОЦЕНКА СОДЕРЖАНИЙ ИЗОФЛАВОНОИДОВ В КЛЕВЕРЕ ЛУГОВОМ (TRIFOLIUM PRATENSE L.) ИЗ СЕМЕЙСТВА БОБОВЫЕ (FABACEAE) В УСЛОВИЯХ ЭКСТРАКЦИИ РАЗЛИЧНЫМИ СПОСОБАМИ
З. А. Темердашев a, *, Т. К. Чубукина a, Е. А. Виницкая a, М. В. Нагалевский a, Н. В. Киселева a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: temza@kubsu.ru
Поступила в редакцию 29.03.2021
После доработки 07.04.2021
Принята к публикации 15.04.2021
Аннотация
Проведена хроматографическая оценка извлечения нативных форм основных изофлавоноидов в водно-спиртовые экстракты в условиях экстракции различными способами из разных морфологических частей клевера лугового (Trifolium pratense L.). Проанализированы водно-спиртовые экстракты клевера лугового, полученные мацерацией, микроволновым, ультразвуковым, субкритическим и фармакопейными способами. Из соцветий клевера лугового максимально извлекаются формононетин (0.260 мг/г) и генистеин (0.051 мг/г) мацерацией, биоканин А – субкритической экстракцией (0.340 мг/г), а дайдзеин – ультразвуковым способом (0.034 мг/г). Оптимизированы условия ВЭЖХ-определения дайдзеина, генистеина, формононетина и биоканина А в водно-спиртовых экстрактах клевера лугового. Определены концентрации изофлавоноидов в различных морфологических частях клевера лугового. Максимальное суммарное содержание изофлавоноидов (0.190 мг/г) наблюдается в водно-этанольном экстракте соцветий.
Изофлавоноиды и их производные иногда называют фитоэстрогенами – природными гормоноподобными веществами растительного происхождения, принадлежащими к классу флавоноидов, многие из которых являются биологически активными веществами [1]. По строению фитоэстрогены сходны с эстрадиолом и могут проявлять себя как эстрогены, связываясь с эстрогеновыми рецепторами [1, 2].
Распространенными источниками природных аналогов эстрогенов являются растения из семейства Бобовые (Fabaceae) – клевер (Trifolium), люцерна (Medicágo), донник (Melilótus) [3, 4]. Род Trifolium насчитывает порядка 300 видов, произрастающих в Европе, Азии, Северной Америке, Австралии и некоторых районах Африки [5]. В настоящее время содержание изофлавоноидов исследовано в 37 природных и гибридных видах клевера (Trifolium), наиболее полно изученным и распространенным из которых является клевер луговой (Trifolium pratense L.) [6–10]. При изучении 23 видов клевера Висневски-Некрасова с соавт. [10] обнаружили, что наибольшее количество изофлавоноидов содержится в клевере подземном (Trifolium subterraneum L.), клевере александрийском (Trifolium alexandrinum L.), клевере луговом (Trifolium pratense L.), клевере репейниковом (Trifolium lappaceum L.), подвиде клевера подземного (Trifolium subterr. subsp. brachycalycinum L.). Ренда с соавт. [9] считают, что самыми богатыми по содержанию изофлавоноидов среди 11 изученных ими видов являются клевер седоватый (Trifolium canescens L.) и одна из разновидностей клевера лугового (Trifolium pratense var. pratense L.).
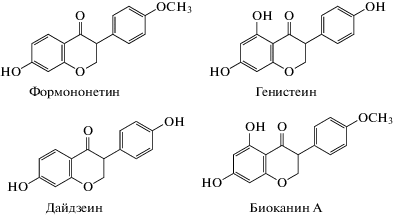
На содержание изофлавоноидов в клевере влияет не только вид, но и условия произрастания: влажность климата, характер почв, район произрастания, температура, режим полива и др. [6, 10]. Накоплению изофлавоноидов способствует более мягкий климат и влажность. Кроме того, их содержание зависит от времени сбора, а также от частей растения [11–14]. В период роста растения изофлавоноиды в большей степени накапливаются в листьях и стеблях, в период цветения их концентрация повышается и часть из них накапливается в цветах [11, 15, 16]. Так как при использовании клевера в фитотерапии наиболее важной является фаза максимального содержания изофлавоноидов, наибольший интерес для исследования представляют растения, собранные на стадии цветения. Основными изофлавоноидами, определяющими биологическую активность клевера лугового (Trifolium pratense L.), считаются дайдзеин (ДЗ), генистеин (ГН), формононетин (ФН) и биоканин А (БКА) [17] – соединения с фенильным радикалом в положении С3 (схема 1 ). Формононетин может метаболизироваться до дайдзеина, а биоканин А до генистеина в процессе роста растения, что повышает его эстрогенную активность [2].
Схема 1 . Основные изофлавоноиды, определяющие биологическую активность клевера лугового (Trifolium pratense L.).
Чаще всего извлечение изофлавоноидов из клевера лугового проводят жидкостной экстракцией (ЖЭ) с различными видами физического воздействия (табл. 1), в качестве растворителей обычно используют водно-спиртовые смеси различного состава [15, 16, 18]. При необходимости перевода гликозидных форм в агликоны проводят кислотный гидролиз добавлением трифторуксусной [11, 19, 20] или соляной кислоты [8, 9, 12, 14]. Некоторые примеры способов извлечения, а также содержания основных изофлавоноидов в различных частях Trifolium pratense L. приведены в табл. 1.
Таблица 1.
Некоторые приемы извлечения и данные по месту, времени сбора образцов и содержанию изофлавоноидов из различных морфологических частей клевера лугового (мг/г)*
| Объект | Условия извлечения | Метод анализа | Место и время сбора | ДЗ | ГН | ФН | БКА | Литера-тура |
|---|---|---|---|---|---|---|---|---|
| Листья | УЗЭ, МеОН−вода−ацетон (40 : 32 : 28) + 0.05% ТФУ | УВЭЖХ-МС | Декабрь 2015 (лето в Южном полушарии); Порту-Алегри, Бразилия | н.о. | н.о. | 12.689 | 1.832 | [11] |
| Май 2015 (осень в Южном полушарии); Порту-Алегри, Бразилия | 0.368 | 0.198 | 15.407 | 0.763 | ||||
| ЖЭ, 50% ЕtОН + 2 М HCl, 40°С | ВЭЖХ-УФ | Стадия цветения; опытное поле Института сельского хозяйства, Кедайняйский район, Литва | 0.786 | 0.452 | 1.51 | – | [14] | |
| ЖЭ, 80% МеОН, встряхивание, 180 об/мин | ВЭЖХ-УФ-Vis-МС | Стадия роста растения; сад факультета биологии Университета Анкары | 0.490 | 0.276 | 2.930 | 6.958 | [15] | |
| Стадия цветения; сад факультета биологии Университета Анкары | 0.639 | 0.110 | 1.934 | 1.372 | ||||
| ЖЭ, 80% МеОН + + ТФУ, перерастворение в ДМСО, 80°С, рефлюксная система | ВЭЖХ-ДМД | Образцы от компании Мелброзин, Вена, Австрия | 0.11 | 0.10 | 2.04 | 2.89 | [19] | |
| ЖЭ, 70% МеОН | ВЭЖХ-ДМД-МС | Ранняя стадия бутонизации; Исследовательский центр (Шарлоттаун, ПЕЙ, Канада) | 0.42 | 0.54 | 10.58 | 6.81 | [16] | |
| Поздняя стадия цветения; Исследовательский центр (Шарлоттаун, ПЕЙ, Канада) | 0.08 | 0.07 | 12.72 | 11.63 | ||||
| УЗ + ЖЭ, 80% МеОН + 2 М HCl, на бане 80–85°С |
УВЭЖХ-ДМД | Стадия цветения; Институт сельского хозяйства Литовского исследовательского центра сельского и лесного хозяйства, Центральная низменность Литвы | 0.11 | 0.64 | 5.77 | 5.76 | [12] | |
| MSPD, С18, дихлорметан−метанол (25 : 75) | ВЭЖХ-ДМД | Февраль−июнь; опытный участок аграрной станции Вайрао в Университете Порту, Португалия | 0.0017 | 0.0095 | 0.2912 | 0.3248 | [10] | |
| Стебли | УЗ + ЖЭ, 80% МеОН + 2 М HCl, на бане 80–85°С | УВЭЖХ-ДМД | Стадия цветения; Институт сельского хозяйства Литовского исследовательского центра сельского и лесного хозяйства, Центральная низменность Литвы | 0.13 | 0.48 | 1.76 | 0.56 | [12] |
| ЖЭ, 70% МеОН | ВЭЖХ-ДМД-МС | Ранняя стадия бутонизации; Исследовательский центр (Шарлоттаун, ПЕЙ, Канада) | 0.29 | 0.36 | 15.49 | 3.79 | [16] | |
| Поздняя стадия цветения; Исследовательский центр (Шарлоттаун, ПЕЙ, Канада) | 0.62 | 0.24 | 8.64 | 1.81 | ||||
| ЖЭ, 80% МеОН, встряхивание, 180 об/мин | ВЭЖХ-УФ-Vis-МС | Стадия цветения; сад факультета биологии Университета Анкары | 1.291 | 0.104 | н.о. | н.о. | [15] | |
| Стадия роста растения; сад факультета биологии Университета Анкары |
2.630 | 0.199 | 0.319 | 0.158 | ||||
| ЖЭ, выдерживание последовательно в деион. воде, 100%-ном и 70%-ном ЕtОН | ВЭЖХ-ДМД | Июнь-октябрь; полевая станция Фармакогнозии Университета Иллинойса, Даунерс-Гроув, Иллинойс, США | 0.13–0.33 | 0.14–0.68 | 2.1–5.9 | 0.7–3.3 | [18] | |
| ЖЭ, 50% ЕtОН + + 2 М HCl, 40°С | ВЭЖХ-УФ | Стадия цветения; опытное поле Института сельского хозяйства, Кедайняйский район, Литва | 0.947 | 0.181 | 2.19 | – | [14] | |
| Цветы | УЗ + ЖЭ, 80% МеОН + 2 М HCl, на бане 80−85°С |
УВЭЖХ-ДМД | Стадия цветения; Институт сельского хозяйства Литовского исследовательского центра сельского и лесного хозяйства, Центральная низменность Литвы | 0.001 | 0.11 | 0.52 | 0.78 | [12] |
| ЖЭ, 80% МеОН, встряхивание, 180 об/мин | ВЭЖХ-УФ-Vis-МС | Стадия цветения; сад факультета биологии Университета Анкары | н.о. | 0.025 | 0.893 | 0.192 | [15] | |
| ЖЭ, 70% МеОН | ВЭЖХ-ДМД-МС | Поздняя стадия цветения; Исследовательский центр (Шарлоттаун, ПЕЙ, Канада) | н.о. | 0.11 | 0.88 | 0.98 | [16] | |
| ЖЭ, выдерживание последовательно в деион. воде, 100%-ном и 70%-ном ЕtОН | ВЭЖХ-ДМД | Июнь−октябрь; полевая станция фармакогнозии Университета Иллинойса, Даунерс-Гроув, Иллинойс, США | 0.025–0.079 | 0.18–0.19 | 0.47–1.2 | 0.70–1.4 | [18] | |
| ЖЭ, 50% ЕtОН + + 2 М HCl, 40°С | ВЭЖХ-УФ | Стадия цветения; опытное поле Института сельского хозяйства, Кедайняйский район, Литва | 0.324 | 0.231 | 1.66 | – | [14] | |
| ЖЭ + УЗ, 80% МеОН + 2М HCl, 80°С | ВЭЖХ-ДМД | Стадия цветения; экспериментальные сады Университета Анкары, биологического факультета и факультета естественных наук |
н.о. | 0.020 | 0.249 | 0.072 | [9] | |
| Корни | ЖЭ, 80% МеОН, встряхивание, 180 об/мин | ВЭЖХ-УФ-Vis-МС | Стадия цветения; сад факультета биологии Университета Анкары | 2.681 | 0.116 | 0.054 | н.о. | [15] |
| Стадия роста растения; сад факультета биологии Университета Анкары |
1.656 | 0.040 | 0.075 | 0.011 | ||||
| Наземные части | УЗЭ, 75% МеОН, 35–38% HCl, 75°С, ТФЭ на C6H11 | ВЭЖХ-ДМД-ФЛД | Стадия цветения; различные регионы Польши | 0.113 | 0.239 | 0.877 | 1.060 | [8] |
| 80% МеОН + ТФУ, 75°С, перерастворение в ДМСО | ВЭЖХ-УФ | Лето; Анатолия, Турция | 0.0147 | 0.3742 | 0.1125 | 0.0711 | [9] |
* ДЗ – дайдзеин, ГН – генистеин, ФН – формононетин, БКА – биоканин А, н.о. – не обнаружено, “–” – не исследовано, УЗЭ – ультразвуковая экстракция, МеОН – метанол, ТФУ – трифторуксусная кислота, ЖЭ – жидкостная экстракция, ЕtОН – этанол, МС – масс-спектрометрический детектор, УФ – спектрофотометрическое детектирование в ультрафиолетовой области, Vis – спектрофотометрическое детектирование в видимой области, ДМСО – диметилсульфоксид, ДМД – диодно-матричный детектор, MSPD – матричная твердофазная дисперсия, С18 – сорбент для твердофазной экстракции с привитыми октадецильными группами, деион. вода – деионизованная вода, ТФЭ – твердофазная экстракция, C6H11 – сорбент для твердофазной экстракции с привитыми циклогексильными группами, ФЛД – флуориметрический детектор, наземные части – листья, стебли, цветы.
Для определения изофлавоноидов в экстрактах клевера лугового наибольшее распространение получили хроматографические методы [21]. Для разделения и идентификации изофлавоноидов можно использовать планарную хроматографию (бумажную и тонкослойную). Несмотря на ряд преимуществ данного метода (простота, возможность сравнения со стандартными образцами, экспрессность и низкая стоимость), его применяют нечасто из-за ограниченного круга выделяемых компонентов [22]. Применение метода газовой хроматографии при определении изофлавоноидов ограничено из-за трудностей, связанных с работой при высоких температурах, что может привести к разложению аналитов, а также с необходимостью их дериватизации, усложняющей анализ [23, 24].
Наиболее эффективным методом разделения и определения изофлавоноидов в экстрактах клевера лугового является ВЭЖХ с различными вариантами детектирования [25]. Метод ВЭЖХ с диодно-матричным и масс-спектрометрическим детектированием позволяет получить наиболее полную информацию о качественном составе и количественном содержании изофлавоноидов в исследуемых экстрактах и позволяет определять как агликоны, так и гликозиды без применения дополнительных операций пробоподготовки (табл. 1). Для получения правильных результатов важно подобрать оптимальные условия хроматографирования: режим элюирования, состав подвижной фазы, температуру колонки, длину колонки, состав и размер частиц сорбента. ВЭЖХ-определение изофлавоноидов, как правило, проводят в обращенно-фазовом режиме [26, 27] с использованием хроматографических колонок, заполненных химически модифицированным силикагелем с привитыми октадецильными группами [7, 9, 22], в качестве подвижной фазы применяют смесь воды с метанолом или ацетонитрилом [28, 29].
Целью данной работы является хроматографическая оценка извлечения нативных форм основных изофлавоноидов в водно-спиртовые экстракты в условиях экстракции различными способами из разных морфологических частей клевера лугового (Trifolium pratense L.).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал. Объект исследования – образцы клевера лугового (Trifolium pratense L.), собранные на территории ботанического сада Кубанского госуниверситета (Краснодар, средняя высота над уровнем моря 36 м). Исходное сырье предварительно сушили путем его раскладки в затемненном помещении на ровной поверхности тонким слоем при 30°С до воздушно-сухого состояния. Затем сырье измельчали и просеивали, выделяя фракции 0.5−1.0 мм [30], после чего усредняли путем перемешивания.
Реактивы и стандартные образцы. Из растворителей использовали ацетонитрил (HPLC-S, Biosolve BV, Нидерланды), муравьиную кислоту (85%, ЛенРеактив, Россия), этанол (ректифицированный, высшей очистки), метанол х. ч. (Вектон, Россия) и изопропанол х. ч. (Экос 1, Россия). Деионизованную воду с удельным сопротивлением 18.2 МОм · см (25°С) получали на установке Milli-Q-UV (Millipore, Франция).
Для идентификации аналитов использовали стандартные образцы дайдзеина, генистеина и формононетина (Sigma-Aldrich, Германия).
Сорбционные материалы. В качестве сорбентов использовали картриджи для твердофазной экстракции с массой сорбента 100 мг: Strata X (размер частиц 33 мкм, диаметр пор 85 нм) и Strata C18-E (размер частиц 55 мкм, диаметр пор 7 нм) (Phenomenex, США), Oasis HLB (размер частиц 30 мкм, диаметр пор 82 нм) (Waters, США) и Isolute ENV+ (размер частиц 90 мкм, диаметр пор 80 нм) (Biotage, Швеция).
Экстракция изофлавоноидов из клевера лугового. Извлечение изофлавоноидов из клевера лугового проводили регламентированными фармакопейной статьей способами [30], а также с интенсификацией процесса ультразвуком [31, 32], микроволновым излучением [33–35] и при повышенном давлении [23, 36, 37]. Данные по извлечению изофлавоноидов различными способами представляли в пересчете на единицу массы воздушно-сухого сырья, мг/г.
Изофлавоноиды экстрагировали по методике согласно Государственной Фармакопее РФ (ГФ). Навеску сырья (1.0000 г) помещали в круглодонную колбу, растворяли в 96%-ном этаноле (30 мл) с добавлением 10%-ной соляной кислоты (2 мл), подключали к обратному холодильнику и проводили экстракцию на кипящей водяной бане в течение 30 мин. Далее экстракт фильтровали через вату в мерную колбу емк. 100 мл и доводили объем до метки 96%-ным этанолом. Перед хроматографическим анализом экстракт пропускали через фильтр с диаметром пор 45 мкм.
Микроволновую экстракцию (МВЭ) изофлавоноидов из клевера лугового проводили с использованием микроволновой системы ETHOS EX (Milestone, Италия). Навеску сухой измельченной пробы (0.5000 г) помещали в ячейку-экстрактор, куда добавляли 70%-ный этиловый спирт (25 мл). Продолжительность экстракции составляла 30 мин при мощности микроволнового излучения 300 Вт и температуре 75°С [38]. Далее экстракт фильтровали через вату в мерную колбу емк. 25 мл и доводили до метки 70%-ным этанолом. Перед хроматографическим анализом экстракт пропускали через фильтр с диаметром пор 45 мкм.
Для ультразвуковой экстракции (УЗЭ) изофлавоноидов из клевера лугового навеску сухой измельченной пробы (0.5000 г) помещали в коническую колбу со шлифом емк. 100 мл. В качестве растворителя использовали 70%-ный этиловый спирт (25 мл). Экстракцию проводили в ультразвуковой ванне УЗВ–4.0/1 ТТЦ (Сапфир, Россия) с частотой ультразвукового излучения 35 кГц в течение 30 мин. Затем экстракт фильтровали через вату в мерную колбу емк. 25 мл, доводили до метки 70%-ным этанол, пропускали через фильтр с диаметром пор 45 мкм и анализировали.
Для экстракции изофлавоноидов из клевера лугового мацерацией навеску пробы (1.2500 г) помещали в коническую колбу со шлифом емк. 100 мл, добавляли 70%-ный этанол (25 мл) и оставляли на 24 ч отстаиваться. Затем экстракт фильтровали через вату в мерную колбу емк. 25 мл и при необходимости доводили до метки 70%-ным этанолом. Перед хроматографическим анализом полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Субкритическую экстракцию (СЭ) фитоэстрогенов из клевера лугового в динамических условиях при повышенных температуре и давлении проводили на экспериментальной установке, включающей термостат с регулируемым электронным электронагревателем. Экстрагент подавали насосом от жидкостного хроматографа LC20AD (Shimadzu, Япония), в качестве ячейки-экстрактора использовали стальной корпус хроматографической колонки размером 150 × 4.6 мм, которую подключали к установке двумя стальными капиллярами. Для предотвращения закипания экстрагента и поддержания требуемого давления в системе использовали ограничитель противодавления. Высушенную и измельченную навеску пробы (0.2000 г) помещали в ячейку-экстрактор в печи термостата. Экстрагент – 70%-ный этанол − предварительно продували азотом для удаления растворенного кислорода и с помощью насоса заполняли им систему. Затем останавливали поток экстрагента и включали нагрев термостата. По достижении термостатом заданной температуры (120°С) выдерживали систему в течение 10 мин при постоянной температуре и остановленном потоке экстрагента, после чего его подавали в систему со скоростью 1 мл/мин. Давление в системе по показаниям манометра насоса составляло 80–150 атм. На выходе собирали 5 мл экстракта в стеклянные емкости. Перед ВЭЖХ с диодно-матричным (ДМД) и масс-спектрометрическим (МС) детектированием полученный экстракт фильтровали через фильтр с диаметром пор 45 мкм.
Твердофазную экстракцию (ТФЭ) изофлавоноидов проводили из экстракта клевера лугового, предварительно полученного с использованием метода УЗЭ. Для концентрирования изофлавоноидов и очистки экстрактов использовали сорбенты Strata X, Oasis HLB, Isolute ENV+ и Strata C18-E. Для этого пропускали 1 мл экстракта через кондиционированный сорбент, который затем сушили в токе азота, и далее элюировали аналиты с картриджа метанолом.
Хроматографическое определение изофлавоноидов в экстрактах клевера лугового. ВЭЖХ-определение изофлавоноидов в полученных экстрактах проводили на хроматографе LC-20 Prominence (Shimadzu, Япония), состоящем из дегазатора DGU-20A5, насоса LC20AD, автоматического дозатора SIL-20A, термостата колонок CTO-20AC, спектрофотометрического детектора на основе диодной матрицы SPD-M20A, масс-спектрометрического детектора LCMS2010EV. Изофлавоноиды разделяли на хроматографической колонке Luna C18 100А, 250 × 2.0 мм, 5 мкм (Phenomenex, США) с предколонкой C18 4 × 2.0 мм, 5 мкм (Phenomenex, США) в режиме градиентного элюирования. Подвижной фазой являлась смесь ацетонитрил (А)–0.1%-ная муравьиная кислота (В): 0.01–7 мин от 70 до 65% В, 7–15 мин от 65 до 50% В, 15–20 мин от 50 до 40% В, 20–22 мин от 40 до 5% В, 22–23 мин 5% В, 23–28 мин от 5 до 70% В. Скорость потока подвижной фазы составляла 0.35 мл/мин при температуре термостата колонки 30°С и объеме вводимой пробы 5 мкл. Сбор данных на диодно-матричном детекторе проводили в диапазоне длин волн 190–800 нм. При МС-детектировании веществ применили ионизацию электрораспылением: напряжение на детекторе 2 кВ, температура ионного источника 250°C, скорость потока азота 0.18 л/мин, скорость сканирования масс-спектра 2000 а. е. м./с, диапазон сканируемых масс 120–700 m/z. Анализ проводили в режиме отрицательной ионизации. Сбор и последующую обработку данных осуществляли с помощью программного обеспечения LCMS Solution (Shimadzu, Япония).
Изофлавоноиды идентифицировали сопоставлением времен удерживания, спектров поглощения и масс-спектров с аналогичными характеристиками стандартов индивидуальных соединений (табл. 2).
Таблица 2.
Параметры ВЭЖХ-ДМД-МС-определения* изофлавоноидов в водно-этанольных экстрактах соцветий клевера лугового
| Соединение | tR, мин | m/z | λmах, нм | cмин, мкг/мл | cн, мкг/мл |
|---|---|---|---|---|---|
| Дайдзеин | 6.1 | 253 | 249; 301 | 0.03 | 0.10 |
| Генистеин | 11.0 | 269 | 260; 328 | 0.02 | 0.07 |
| Формононетин | 14.0 | 267 | 249 | 0.03 | 0.10 |
| Биоканин А | 18.6 | 283 | 261; 326 | 0.02 | 0.07 |
* tR – время удерживания; λmах – длина волны поглощения; cмин – предел обнаружения; cн – предел определения; cмин и cн рассчитаны согласно рекомендациям [39].
Градуировочные зависимости для дайдзеина, генистеина и формононетина в методе ВЭЖХ-ДМД-МС получали с использованием соответствующих стандартных образцов. Линейность отклика сигнала определяли для 10 уровней концентраций всех соединений в 70%-ном этаноле; в каждом случае проводили не менее трех параллельных определений одной концентрации раствора. Все градуировочные кривые строили по данным шести параллельных измерений. Для всех соединений градуировочный график линеен в диапазоне концентраций аналитов 0.1–10 мкг/мл с коэффициентами корреляции ≥0.999. Параметры ВЭЖХ-ДМД-МС-определения изофлавоноидов в водно-этанольных экстрактах соцветиях клевера лугового приведены в табл. 2. Концентрацию биоканина А определяли методом одного эталона, в качестве последнего использовали генистеин с учетом схожести спектральных характеристик этих соединений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор условий хроматографирования экстрактов клевера лугового. Высокая гидрофобность изофлавоноидов требует использования при хроматографических исследованиях подвижной фазы (ПФ) с большей долей неполярного элюента. В настоящей работе использовали хроматографическую колонку Luna C18 100А (250 × 2.0 мм, 5 мкм), которая обеспечивала разделение изофлавоноидов за 28 мин в градиентном режиме элюирования. В качестве подвижных фаз опробовали смеси ацетонитрил–0.1%-ная муравьиная кислота и метанол–0.1%-ная муравьиная кислота. Некоторые хроматографические характеристики стандартных образцов ДЗ, ГН, ФН и компонентов экстракта соцветий клевера лугового, полученные с применением подвижных фаз различного состава, представлены в табл. 3.
Таблица 3.
Некоторые хроматографические характеристики компонентов водно-этанольного экстракта соцветий клевера лугового, полученные для подвижных фаз различного состава и стандартных образцов дайдзеина, генистеина, формононетина
| Хроматографический параметр | Ацетонитрил–0.1%-ная муравьиная кислота | Метанол–0.1%-ная муравьиная кислота | ||||
|---|---|---|---|---|---|---|
| ДЗ | ГН | ФН | ДЗ | ГН | ФН | |
| Стандартные образцы | ||||||
| Разрешение (аналит/предшествующий пик) | 9.7 | 11.5 | 8.5 | 12.1 | 5.2 | 7.0 |
| Нагрузочный коэффициент | 2.9 | 5.9 | 7.7 | 2.8 | 25.7 | 5.3 |
| Экстракт соцветий клевера | ||||||
| Разрешение (аналит/предшествующий пик) | 1.3 | 2.2 | 21.2 | 0.27 | 2.0 | 0.9 |
| Нагрузочный коэффициент | 3.7 | 7.1 | 9.4 | 50.1 | 62.5 | 86.3 |
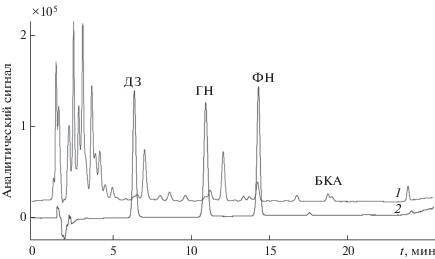
Помимо целевых аналитов в экстрактах соцветий клевера присутствует большое количество компонентов матрицы, поэтому особого внимания требует разрешающая способность ПФ, учитывающая влияние ширины пика и размывания зоны на селективность разделения соседних веществ. Если величина разрешающей способности ПФ <1, то разделение веществ считается неполным, и наоборот. Альтернативным параметром, позволяющим оценить степень удерживания растворенного вещества по степени его взаимодействия с неподвижной фазой (НФ), является нагрузочный коэффициент, определяемый по отношению числа молекул вещества в НФ к числу молекул, находящихся в ПФ. Оптимальные значения данного параметра лежат в диапазоне от 2 до 10 [40]. Совокупность полученных данных по разрешающей способности ПФ и нагрузочному коэффициенту позволила выбрать в качестве оптимальной ПФ смесь состава ацетонитрил–0.1%-ная муравьиная кислота. Полученные в оптимальных условиях разделения хроматограммы водно-этанольного экстракта клевера лугового и смеси стандартных веществ приведены на рис. 1.
Рис. 1.
Хроматограмма водно-этанольного экстракта клевера лугового (1) и стандартных образцов изофлавоноидов (2) в условиях ВЭЖХ-ДМД-МС-анализа.
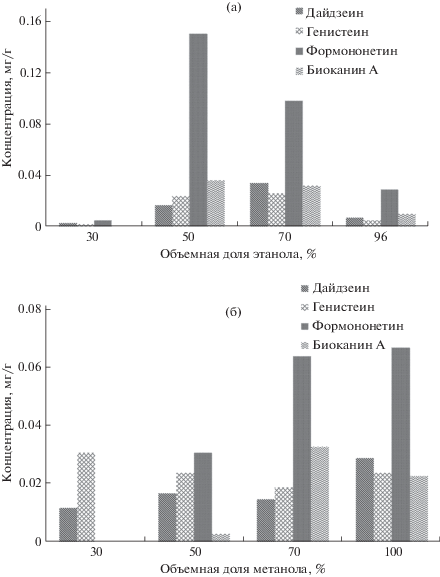
Подбор оптимального состава растворителя для экстракции изофлавоноидов. Эффективность извлечения изофлавоноидов оценивали по концентрациям дайдзеина, генистеина, формононетина и биоканина А в водно-спиртовых системах при УЗЭ из соцветий клевера лугового с различным содержанием этанола и метанола (30, 50, 70 и 100%, по объему). Из полученных диаграмм (рис. 2) видно, что качественный и количественный выход изофлавоноидов при использовании водно-спиртовых смесей различного состава в качестве экстрагента разный. Максимальное суммарное извлечение изофлавоноидов метанолом достигается при его 100%-ном содержании и составляет 0.143 мг/г, включая 0.029 мг/г дайдзеина, 0.024 мг/г генистеина, 0.067 мг/г формононетина и 0.023 мг/г биоканина А. При использовании в качестве экстрагента этанола характер выхода изофлавоноидов иной. Максимальное суммарное извлечение изофлавоноидов (0.227 мг/г) наблюдается при использовании водно-этанольной системы с 50% этанола, причем 66% составляет формононетин – 0.150 мг/г. Выход изофлавоноидов более сбалансированный при экстракции 70%-ной водно-этанольной системой, которая суммарно извлекает 0.190 мг/г, включая 0.034 мг/г ДЗ, 0.026 мг/г ГН, 0.098 мг/г ФН и 0.032 мг/г БКА. Видно, что извлечение дайдзеина максимально при использовании 70%-ного этанола (0.034 мг/г), а генистеина – 30%-ного метанола (0.031 мг/г). С учетом полученных результатов 70%-ную водно-этанольную систему выбрали в качестве оптимального растворителя.
Рис. 2.
Концентрации дайдзеина, генистеина, формононетина и биоканина А в этанольных (а) и метанольных (б) экстрактах соцветий клевера лугового, полученных с помощью ультразвуковой экстракции.
Эффективность экстракции изофлавоноидов из соцветий клевера лугового различными способами. Изучали и сравнивали различные способы экстракции – мацерацию, субкритическую, ультразвуковую, микроволновую и твердофазную экстракцию, а также экстракцию по Государственной фармакопее РФ. Полученные результаты приведены в табл. 4.
Таблица 4.
Концентрации (мг/г) изофлавоноидов в водно-этанольных экстрактах клевера лугового, полученных различными способами (n = 6, P = 0.95)
| Соединение | Ультразвуковая экстракция | Микроволновая экстракция | Субкритическая экстракция | Мацерация | Экстракция по ГФ* |
|---|---|---|---|---|---|
| Дайдзеин | 0.034 ± 0.005 | 0.014 ± 0.003 | 0.015 ± 0.002 | 0.029 ± 0.003 | 0.007 ± 0.001 |
| Генистеин | 0.026 ± 0.003 | 0.031 ± 0.003 | 0.033 ± 0.003 | 0.051 ± 0.004 | 0.009 ± 0.002 |
| Формононетин | 0.098 ± 0.007 | 0.129 ± 0.003 | 0.210 ± 0.020 | 0.260 ± 0.020 | 0.043 ± 0.009 |
| Биоканин А | 0.032 ± 0.006 | 0.051 ± 0.005 | 0.340 ± 0.050 | 0.032 ± 0.009 | 0.041 ± 0.008 |
| Суммарное содержание изофлавоноидов |
0.190 ± 0.010 | 0.225 ± 0.009 | 0.598 ± 0.030 | 0.372 ± 0.010 | 0.100 ± 0.009 |
В Государственной фармакопее РФ отсутствует способ экстракции фенольных соединений флавоноидного ряда из клевера лугового, но описан способ экстракции 96%-ным этанолом кипячением с обратным холодильником фенольных соединений флавоноидного ряда из высушенной и измельченной травы Донника (Melilotus), относящейся к семейству бобовые. Исходя из их принадлежности к одному семейству, этот способ экстракции применили по отношению к клеверу луговому. Согласно ГФ РФ, в экстракционную систему добавляют соляную кислоту, разрушающую гликозидные связи, что затрудняет определение нативных форм изофлавоноидов. В данных условиях из клевера лугового извлекли 0.007 мг/г ДЗ, 0.009 мг/г ГН, 0.043 мг/г ФН и 0.041 мг/г БКА (табл. 4). Сравнивая результаты, приведенные в табл. 1 и в табл. 4, можно отметить, что суммарное содержание изофлавоноидов в водно-этанольном экстракте ниже, что связано, по-видимому, с большим сродством ГН, ФН и БКА к метанолу. Степень экстракции ДЗ водно-этанольной смесью оказалась выше, чем 80%-ным метанолом. Недостатком данного способа являются длительность и трудоемкость, а также извлечение в экстракт большого количества посторонних компонентов.
Традиционно применяемым способом экстракции является мацерация. Основным недостатком данного способа извлечения изофлавоноидов является длительность, которая может достигать нескольких часов, а иногда и суток. С другой стороны, суммарное извлечение изофлавоноидов этим способом достаточно высокое и достигает 0.372 мг/г.
Наличие в изофлавоноидах полярных групп позволяет применить микроволновое излучение для их извлечения. Экстракцию целевых соединений проводили при 300–450 Вт; при более высокой мощности возможен разрыв клеточной стенки и извлечение в растворитель матричных компонентов. Выход целевых компонентов повышается с увеличением продолжительности микроволновой экстракции, но при этом возрастает и риск их деструкции. При микроволновом излучении выход дайдзеина, генистеина, формононетина и биоканина А оказался более высоким по сравнению с ГФ. Суммарное содержание изофлавоноидов в полученных при МВЭ и ГФ извлечениях составило 0.225 и 0.100 мг/г соответственно. С другой стороны, МВЭ по эффективности уступает способам субкритической экстракции и мацерации (табл. 4).
Субкритическую экстракцию изофлавоноидов проводили 70%-ным этанолом при повышенных температуре и давлении. Величина суммарного извлечения изофлавоноидов (0.598 мг/г) показала, что такой способ является наиболее эффективным. По количеству извлеченного дайдзеина субкритическая экстракция сопоставима с МВЭ (0.015 и 0.014 мг/г соответственно), но почти в два раза менее эффективна, чем УЗЭ и мацерация (табл. 4). Низкие содержания дайдзеина в экстрактах при использовании МВЭ и СЭ возможны из-за его вероятной деструкции под воздействием микроволнового излучения, нагревания или повышенного давления.
Одним из распространенных способов извлечения изофлавоноидов из растительного сырья считается ультразвуковая экстракция, которая более экспрессна и позволяет использовать широкий набор растворителей. Дайдзеин и биоканин А в условиях УЗЭ извлекаются в количествах, сопоставимых с экстракцией мацерацией. Содержание генистеина в извлечении (0.026 мг/г) сопоставимо с результатами МВЭ (0.031 мг/г) и субкритической экстракции (0.033 мг/г), а также с полученными другими авторами и приведенными в табл. 1 данными по ЖЭ 80%-ным метанолом, но меньше, чем при использовании мацерации (0.051 мг/г).
Анализ полученных результатов позволяет заключить, что наиболее эффективным способом извлечения изофлавоноидов является субкритическая экстракция. Наибольшее количество формононетина извлекается из соцветий клевера лугового способами мацерации (0.260 мг/г) и субкритической экстракции (0.210 мг/г). Наибольшее количество биоканина А содержится в экстрактах, полученных субкритической экстракцией (0.340 мг/г). Полученный нами результат в два раза выше значений, полученных авторами работы [15], но в три раза меньше данных [16], приведенных в табл. 1. Генистеин более эффективно извлекается мацерацией (0.051 мг/г), а экстракция дайдзеина под действием сильного внешнего воздействия падает. Можно заключить, что способ экстракции необходимо выбирать, исходя из поставленных конкретных задач.
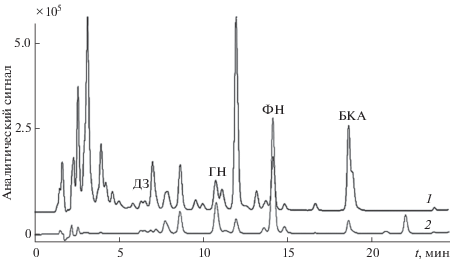
Для концентрирования целевых компонентов и очистки экстрактов можно использовать твердофазную экстракцию изофлавоноидов с сорбентами различных типов. Изучена ТФЭ изофлавоноидов из водно-этанольных экстрактов соцветий клевера с использованием различных сорбентов – Strata C18-Е, Strata X, Oasis HLB и Isolute ENV+. Десорбцию аналитов проводили 100%-ным метанолом, который наиболее часто применяется для этих целей. В выбранных условиях наблюдаются низкие степени реэкстракции целевых соединений (табл. 5), что может быть связано с необратимой сорбцией аналитов на материалах сорбентов. Исключением по отношению к ДЗ является сорбент Strata X, который количественно его извлекает (R = 92%) при незначительном концентрировании и обеспечивает очистку экстракта от мешающих компонентов (рис. 3). Полученные на сегодняшний день данные по ТФЭ не позволяют рекомендовать данный способ для концентрирования всех целевых компонентов, здесь, по-видимому, требуется проведение дальнейших изысканий.
Таблица 5.
Степень извлечения (%) изофлавоноидов из водно-этанольного экстракта соцветий клевера лугового различными сорбентами (n = 3, P = 0.95)
| Соединение | Strata X | Strata C18-Е | Oasis HLB | Isolute ENV+ |
|---|---|---|---|---|
| Дайдзеин | 92 ± 6 | н.о.* | 17.3 ± 0.5 | н.о. |
| Генистеин | 56 ± 4 | н.о. | 1.1 ± 0.3 | 0.7 ± 0.3 |
| Формононетин | 40 ± 6 | 1.7 ± 0.6 | 3.3 ± 0.6 | н.о. |
| Биоканин А | 1.7 ± 0.4 | 1.9 ± 0.5 | н.о. | н.о. |
Рис. 3.
Хроматограмма водно-этанольного экстракта клевера лугового до (1) и после (2) твердофазной экстракции в условиях ВЭЖХ-ДМД-МС-анализа.
Определение содержания изофлавоноидов в различных морфологических частях клевера лугового. В оптимизированных условиях извлечения изофлавоноидов анализировали водно-этанольные экстракты различных частей клевера лугового – листья, стебли и соцветия (табл. 6). Содержание изофлавоноидов (0.190 мг/г) максимально в водно-этанольном экстракте соцветий. Концентрации изофлавоноидов в морфологических частях клевера лугового отличны от данных, приведенных в табл. 1. Объективно прокомментировать данные отличия не представляется возможным, так как полную идентичность условий произрастания, времени сбора, получения экстрактов клевера лугового из публикаций установить не удалось.
Таблица 6.
Концентрации (мг/г) изофлавоноидов в водно-этанольных экстрактах разных морфологических частей клевера лугового (n = 3, P = 0.95)
| Часть растения | ДЗ | ГН | ФН | БКА | Суммарное содержание изофлавоноидов |
|---|---|---|---|---|---|
| Соцветия | 0.034 ± 0.005 | 0.026 ± 0.003 | 0.098 ± 0.007 | 0.032 ± 0.006 | 0.190 ± 0.010 |
| Листья | 0.003 ± 0.002 | 0.013 ± 0.002 | 0.021 ± 0.001 | 0.033 ± 0.001 | 0.070 ± 0.006 |
| Стебли | 0.003 ± 0.001 | 0.003 ± 0.001 | 0.008 ± 0.001 | 0.008 ± 0.001 | 0.022 ± 0.004 |
Для повышения выхода некоторых изофлавоноидов ряд исследователей в состав экстракционных систем добавляли соляную или трифторуксусную кислоту, которые разрушают гликозидные связи. Такой подход искажает данные о количественном содержании нативных форм изофлавоноидов.
* * *
Таким образом, изучено извлечение нативных форм основных изофлавоноидов в водно-спиртовые экстракты разных морфологических частей клевера лугового (Trifolium pratense L.), полученные мацерацией, микроволновым, ультразвуковым, субкритическим и фармакопейными способами. Наибольшую эффективность по извлечению изофлавоноидов показали ультразвуковая и субкритическая экстракция. Максимально формононетин (0.260 мг/г) и генистеин (0.051 мг/г) извлекаются мацерацией, биоканин А – субкритической экстракцией (0.340 мг/г), а дайдзеин – ультразвуковым способом (0.034 мг/г) из соцветий клевера лугового. Установлены содержания изофлавоноидов в различных морфологических частях клевера лугового – максимальное суммарное содержание которых (0.190 мг/г) наблюдается в водно-этанольном экстракте соцветий.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования (проект № FZEN-2020-0022) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Meghwal M., Sahu C.K. Soy isoflavonoids as nutraceutical for human health: An update // J. Cell Sci. Ther. 2015. V. 6. № 1. P. 1.
Беркегейм М.Л. Фитоэстрогены // Проблемы репродукции. 2000. № 3. С. 12.
Карпук В.В. Фармакогнозия. Минск: БГУ, 2011. 334 с.
Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия. М.: Медицина, 2007. 656 с.
Дренин А.А., Ботиров Э.Х. Флавоноиды и изофлавоноиды растений рода Trifolium L. Структурное разнообразие и биологическая активность // Химия растительного сырья. 2017. № 3. С. 39.
Krenn L., Unterrieder I., Ruprechter R. Quantification of isoflavones in red clover by high-performance liquid chromatography // J. Chromatogr. B. 2002. № 777. P. 123.
Tsao R., Papadopoulos Y., Yang R., Young J.C., McRae K. Isoflavone profiles of red clovers and their distribution in different parts harvested at different growing stages // J. Agric. Food Chem. 2006. № 54. P. 5797.
Lemeziene N., Padarauskas A., Butkute B., Ceseviciene J. The concentration of isoflavones in red clover (Trifolium pratense L.) at flowering stage // Zemdirbyste. 2015. V. 4. № 102. P. 443.
Ercetin T., Toker G., Kartal M., Colgecen H. In vitro isoflavonoid production and analysis in natural tetraploid Trifolium pratense (red clover) calluses // Rev. Bras. Farmacogn. 2012. V. 5. № 22. P. 964.
Visnevschi-Necrasov T., Faria M., Cunha S., Harris J., Meimberg H., Curto M., Pereira M., Oliveira M., Nunes E. Isoflavone synthase (IFS) gene phylogeny in Trifolium species associated with plant isoflavone contents // Plant Syst. Evol. 2013. № 299. P. 299.
Reis A., Scopel M., Zuanazzi J. Trifolium pratense: Friable calli, cell culture protocol and isoflavones content in wild plants, in vitro and cell cultures analyzed by UPLC // Rev. Bras. Farmacogn. 2018. № 28. P. 542.
Lemeziene N., Padarauskas A., Butkute B., Ceseviciene J., Taujenis L., Norkeviciene E., Mikaliuniene J. The concentration of isoflavones in red clover (Trifolium pratense L.) at flowering stage // Zemdirbyste-Agriculture. 2015. V. 102. № 4. P. 443.
Carlsen S., Pedersen H., Spliid N., Fomsgaard I. Fate in soil of flavonoids released from white clover (Trifolium repens L.) // Appl. Environ. Soil Sci. 2011. V. 2012. P. 1.
Dabkeviciene G., Butkute B., Lemeziene N., Jakstas V., Vilcinskas E., Janulis V. Distribution of formononetin, daidzein and genistein in Trifolium species and their aerial plant parts // Chemija. 2012. V. 23. № 4. P. 306.
Colgecen H., Koca Caliskan U., Kartal M., Buyukkartal H. Comprehensive evaluation of phytoestrogen accumulation in plants and in vitro cultures of Medicago sativa L. ‘Elçi’ and natural tetraploid Trifolium pratense L. // Turk. J. Biol. 2014. № 38. P. 619.
Tsao R., Papadopoulos Y., Yang R., Young J.C., McRae K. Isoflavone profiles of red clovers and their distribution in different parts harvested at different growing stages // J. Agric. Food Chem. 2006. № 54. P. 5797.
Zgorka G. Ultrasound-assisted solid-phase extraction coupled with photodiode-array and fluorescence detection for chemotaxonomy of isoflavone phytoestrogens in Trifolium L. (Clover) species // J. Sep. Sci. 2009. № 32. P. 965.
Booth N., Overk C., Yao P., Totura S., Deng Y., Hedayat A., Bolton J., Pauli G., Farnsworth N. Seasonal variation of red clover (Trifolium pratense L., Fabaceae) Isoflavones and estrogenic activity // J. Agric. Food Chem. 2006. № 54. P. 1277.
Krenn L., Unterrieder I., Ruprechter R. Quantification of isoflavones in red clover by high-performance liquid chromatography // J. Chromatogr. B. 2002. № 777. P. 123.
Renda G., Yalcın F., Nemutlu E., Akkol E., Suntar I., Keles H., Ina H., Calıs I., Ersoz T. Comparative assessment of dermal wound healing potentials of various Trifolium L. extracts and determination of their isoflavone contents as potential active ingredients // J. Ethnopharmacol. 2013. № 148. P. 423.
Wu Q., Wang M., Simon J.E. Analytical methods to determine phytoestrogenic compounds // J. Chromatogr. B. 2004. № 812. P. 325.
Kowalska I., Jedrejek D., Ciesla L., Pecio L., Masullo M., Piacente S., Oleszek W., Stochmal A. Isolation, chemical and free radical scavenging characterization of phenolics from Trifolium scabrum L. aerial parts // J. Agric. Food Chem. 2013. № 61. P. 4417.
Huie C.W. A review of modern sample-preparation techniques for the extraction and analysis of medicinal plants // Anal. Bioanal. Chem. 2002. № 373. P. 23.
Benedetti B., Carro M. Di, Mirasole C., Magi E. Fast derivatization procedure for the analysis of phytoestrogens in soy milk by gas chromatography tandem mass spectrometry // Microchem. J. 2018. V. 137. P. 62–70.
Khoddami A., Wilkes M.A., Roberts T.H. Techniques for analysis of plant phenolic compounds // Molecules. 2013. № 18. P. 2328.
Jeong S., Chang M., Choi S., Oh S., Wu H., Zhu Y., Gao X., Wang X., Zhang B., Lim D., Lee J., Kim S., Song Y. Estrogenic effects of phytoestrogens derived from Flemingia strobilifera in MCF-7 cells and immature rats // Arch. Pharm. Res. 2018. V. 41. № 5. P. 57.
Spagnuolo P., Rasini E., Luini E., Legnaro M., Luzzani M., Casareto E., Carreri M., Paracchini S., Marino F., Cosentino M. Isoflavone content and estrogenic activity of different batches of red clover (Trifolium pratense L.) extracts: An in vitro study in MCF-7 cells // Fitoterapia. 2014. № 94. P. 62.
Zarena A.S., Sankar K.U. Phenolic acids, flavonoid profile and antioxidant activity in mangosteen (Garcinia Mangostana L.) pericarp // J. Food Biochem. 2012. № 36. P. 627.
Yingngam B., Brantner A., Jinarat D., Kaewamatawong R., Rungseevijitprapa W., Suksamrarn A., Piyachaturawat P., Chokchaisiri R. Determination of the marker diarylheptanoid phytoestrogens in Curcuma comosa Rhizomes and selected herbal medicinal products by HPLC-DAD // Chem. Pharm. Bull. 2018. № 66. P. 65.
Государственная Фармакопея Российской Федерации. Изд. 14. Москва, 2018. Т. 4. С. 6020.
Vinatoru M. An overview of the ultrasonically assisted extraction of bioactive principles from herbs // Ultrason. Sonochem. 2001. № 8. P. 303.
Biesaga M. Influence of extraction methods on stability of flavonoids // J. Chromatogr. A. 2011. № 1218. P. 2505.
Michel T., Halabalaki M., Skaltsounis A. New concepts, experimental approaches, and dereplication strategies for the discovery of novel phytoestrogens from natural sources // Planta Med. 2013. № 79. P. 514.
Ekezie F., Sun D., Cheng J. Acceleration of microwave-assisted extraction processes of food components by integrating technologies and applying emerging solvents: A review of latest developments // Trends Food Sci. Technol. 2017. № 67. P. 160.
Lauberts M., Lauberte L., Arshanitsa A., Dizhbite T. Structural transformations of wood and cereal biomass components induced by microwave assisted torrefaction with emphasis on extractable value chemicals obtaining // J. Anal. Appl. Pyrolysis. 2018. № 134. P. 1.
Kronholm J., Hartonen K., Riekkola M. Analytical extractions with water at elevated temperatures and pressures // Trends Anal. Chem. 2007. V. 26. № 5. P. 396.
Asbahani A., Miladi K., Badri W., Sala M., Addi A., Casabianca H. Essential oils: From extraction to encapsulation // Int. J. Pharm. 2015. № 483. P. 220.
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Бутыльская Т.С., Шилько Е.А. Экстракция и определение биологически активных компонентов зверобоя и препаратов на его основе // Журн. аналит. химии. 2016. Т. 71. № 7. С. 768. (Milevskaya V.V., Temerdashev Z.A., Kiseleva N.V., Butyl’skaya T.S., Shil’ko E.A., Statkus M.A. Extraction and determination of biologically active components of St. John’s wort and its pharmaceutical preparations // J. Anal. Chem. 2016. V. 71. № 7. P. 741.)
Представление результатов химического анализа (рекомендации IUPAC 1994 г.) // Журн. аналит. химии. 1998. Т. 53. № 9. С. 999.
Рили С.М. Высокоэффективная жидкостная хроматография. Теоретические основы и решение прикладных задач. Пер. с англ. Лапина Б.П. / Под ред. Лоу У.Дж., Уайнер И.У. М.: Мир, 1982, 271 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии