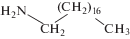Журнал аналитической химии, 2022, T. 77, № 1, стр. 78-86
Кадмийселективный электрод на основе электродноактивных веществ С N-, S- и O-содержащими функциональными группами
С. Д. Татаева a, *, К. Э. Магомедов a
a Дагестанский государственный университет
367000 Махачкала, ул. М. Гаджиева, 43-а, Россия
* E-mail: anchemist@yandex.ru
Поступила в редакцию 13.03.2020
После доработки 28.04.2021
Принята к публикации 28.04.2021
- EDN: PKEEBG
- DOI: 10.31857/S0044450221110165
Аннотация
Показана возможность использования октадециламина (ОДА) в качестве электродноактивного компонента мембраны кадмийселективного электрода (Cd-СЭ). Для выяснения механизма функционирования мембраны изучены равновесия в системе мембрана–раствор в зависимости от кислотности среды и количества ионофора. Октадециламин при pH 1–2 находится в катионной форме, а ионы кадмия в 0.1 М растворе KI – в виде [CdI3]–. Образованный в этих условиях ионный ассоциат [ОДА]+[CdI3]– наиболее стабилен при pH 1 и pI 1, и мембрана откликается только на трииодкадмат-ионы. Оптимизированный состав мембраны, на основе которого создан Cd-СЭ (мас. %): поливинилхлорид – 32.8, октадециламин – 1.7 (концентрация ОДА – 100 мМ), о-нитрофенилоктиловый эфир – 65.5, с внутренним электролитом – CdCl2 (0.01 М) + HCl (0.01 M) + KI (0.1 M). Установлены электрохимические характеристики Cd-СЭ: линейный диапазон 1 × 10–4–1 × 10–2 М, крутизна электродной функции –53 мВ/декада, предел обнаружения кадмия 1 × 10–6 М. Способом биионных потенциалов определены потенциометрические коэффициенты селективности кадмийселективного электрода. Предлагаемый Cd-СЭ использован для определения кадмия в сплаве ПОСК 50-18 и в молоке в стационарном и проточном режимах соответственно. Найдены оптимальные условия работы проточно-инжекционной системы, которые обеспечивают стабильность базовой линии, а также максимальные чувствительность и производительность анализов. Правильность результатов определения кадмия подтверждена методами атомно-абсорбционной спектрометрии и введено–найдено.
Вопросы создания ионселективных электродов (ИСЭ) на основе поливинилхлоридных (ПВХ) мембран с использованием электродноактивных веществ (ЭАВ) и их комплексов с кадмием, а также изучения их электрохимических характеристик остаются актуальными на современном этапе развития ионометрии тяжелых и токсичных металлов [1–3].
Известные к настоящему времени ионселективные электроды позволяют определять индивидуальные элементы или их суммарное содержание, но имеют недостатки, связанные с экспрессностью, чувствительностью и селективностью [4–17]. Объекты, подлежащие контролю на содержание тяжелых элементов, весьма разнообразны: продукты питания, фармацевтические препараты, сточные воды и др. [2, 13–19].
Тенденции развития современной аналитической химии – миниатюризацию, автоматизацию и компьютеризацию анализа – наиболее просто реализовать применительно к электрохимическим методам [1, 5, 6, 20–22]. Изготовление мембран ионселективных электродов из пластифицированного ПВХ с добавками ионофоров и ионообменников является одним из наиболее востребованных направлений в ионометрии. Развитие ионометрии неорганических соединений предполагает использование мембран различных типа (стеклянные, кристаллические, полимерные, комбинированные и др.) и состава. Применение полимерных мембран, в состав которых входят ионофоры органической природы, позволяет существенно повысить чувствительность определения неорганических веществ [1]. С этой точки зрения представляет интерес изучение реагентов, ранее не применявшихся в ионометрии в качестве ЭАВ для определения тяжелых токсичных металлов.
Цель настоящей работы – разработка новых ИСЭ для определения Cd(II) в различных объектах на основе пластифицированных ПВХ-мембран с органическими электродноактивными веществами с N-, S- и O-содержащими функциональными группами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика эксперимента и оборудование. Время отклика (τ, с), линейный диапазон определяемых содержаний (ЛДОС, M), предел обнаружения (ПО, M), крутизну (S, мВ/декада), селективность ИСЭ определяли потенциометрически. Значения ЭДС измеряли при помощи: 1) 8-канальной компьютеризованной системы сбора потенциометрических данных на базе ПК, иономера Экотест-120 и коммутатора КМ-8 (НПП “ЭКОНИКС”, Россия); 2) 6-канальной компьютеризованной высокоскоростной системы сбора потенциометрических данных EMF 6 (LawsonLabs, США).
Методами молекулярной спектроскопии в УФ и видимой областях изучали спектры ЭАВ мембран. Спектры регистрировали с использованием двухлучевого спектрометра с варьируемой шириной щели Specord 210 Plus (Analytik Jena AG, Германия).
Для сорбционного концентрирования использовали хроматографическую установку в проточно-инжекционном варианте. Установка состояла из хроматографических колонок (стеклянные трубки внутренним диаметром 6 мм, длиной 10 см, заполненные катионитом КУ-2 × 8), перистальтичесого насоса Ismatec Ecoline VC-360 (Cole-Parmer Gm-bH, Виртхайм, Германия) и ионометрического детектора.
Для перевода твердых анализируемых образцов в растворы использовали микроволновую систему пробоподготовки TOPwave IV с автоклавами CX100, выдерживающими давление 100 бар и температуру 250°C (Analytik Jena AG, Германия).
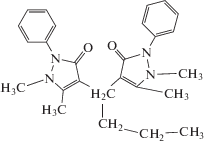
Объекты исследования – органические вещества с N-, S- и O-содержащими функциональными группами, которые использовали в качестве ЭАВ (табл. 1); оловянно-свинцовый припой ПОСК 50-18; молоко сырое (пригородный район Махачкалы).
Таблица 2.
Оптимизированные составы мембран кадмийселективных электродов
| № | Состав мембраны, мас. % | Внутреннее заполнение ИСЭ | Электродная функция |
|---|---|---|---|
| I | ТНЛ 1.4, о-НФОЭ 64.7, ПВХ 33.3, ТХФБК 1.6 | 0.01 М CdCl2 + 0.1 М HCl | Катионная |
| II | ОДА 1.7, о-НФОЭ 65.5, ПВХ 32.8 | 0.01 М CdCl2 + 0.01 М HCl + 0.1 M KI | Анионная |
| III | ОДА 1.7, о-НФОЭ 65.5, ПВХ 32.8 | 0.01 М CdCl2 + 0.01 М HCl + 1 M KBr | Анионная |
Реактивы. В качестве неселективных ионообменников использовали тетрафенилборат натрия (ТФБNa), тетра-п-хлорфенилборат калия (ТХФБК), олеиновую кислоту (ОК); в качестве пластификаторов – диоктилсебацинат (ДОС), дибутилфталат (ДБФ), диоктилфталат (ДОФ), о-нитрофенилоктиловый эфир (о-НФОЭ), трибутилфосфат; в качестве растворителей – циклогексанон, тетрагидрофуран.
Децимолярные растворы кадмия и мешающих ионов готовили из их солей марки х. ч. и ос. ч.
В качестве ЭАВ использовали: октадециламин (ОДА), диантипирилметан (ДАПМ), диантипирилпропилметан (ДАППМ), тионалид (ТНЛ), стуктурные формулы и липофильность которых представлены в табл. 1.
Использовали реактивы производства “Fluka” (Selectophore grade, Швейцария) и “Вектон” (х. ч., С.-Петербург, Россия).
Рутинную работу по расчету соотношения ингредиентов мембранных композиций заменили использованием итеративной формулы предварительного расчета масс и объемов компонентов мембран ИСЭ [23].
Для электрохимических исследований использовали следующую электродную схему:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сравнение ионофоров ИСЭ по липофильности, селективности, линейности рабочего диапазона определяемых концентраций, пределу обнаружения в ПВХ-мембранах позволило расположить их в порядке уменьшения функциональных свойств: ОДА, ДАППМ, ТНЛ, ДАПМ. Дальнейшие исследования проводили с ионофорами ОДА и ТНЛ, имеющими наибольшую липофильность.
Введение в состав мембраны различных пластификаторов (ДОФ, ДОС, ДБФ, о-НФОЭ) в каждом конкретном случае привело к изменению свойств ПВХ-мембраны, снижению предела обнаружения и повышению селективности ИСЭ при потенциометрических определениях. Установлено, что природа пластификатора влияет на распределение компонентов в мембране, наклон электродной функции, линейный диапазон и коэффициент селективности ИСЭ. Для улучшения электродных функций мембран использовали анионные добавки: ОК, ТФБNa и ТХФБК. Наилучшие результаты получили с добавкой ТХФБК, способствующей повышению липофильности и образованию устойчивого ассоциата.
Изучены диаграммы зависимости мольной доли ОДА от кислотности раствора (рис. 1), а также влияние концентрации иодид-ионов на мольную долю иодидных комплексов кадмия (рис. 2) и найдены оптимальные аналитические формы ОДА и иодидных комплексов кадмия.
Рис. 2.
Влияние I–-ионов на состав ионных форм кадмия(II) в водном растворе (а) и крутизну электродной функции (б): 1 – Cd2+, 2 – CdI+, 3 – CdI2, 4 – ${\text{CdI}}_{3}^{ - },$ 5 – ${\text{CdI}}_{4}^{{2 - }}.$
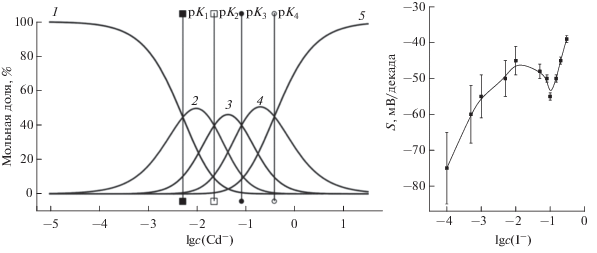
Рабочий диапазон pH составил 0–8, повышение pH приводит к депротонизации ионофора и его переходу в нейтральную форму, не откликающуюся на основной ион. При концентрации фонового электролита 0.08 М наибольшее значение имеет мольная доля [CdI3]– (рис. 2а, кривая 3). Для выбора оптимальной концентрации иодид-ионов изучали зависимость отклика Cd-СЭ электрода от концентрации фонового раствора, поскольку константы устойчивости [CdI3]– и [CdI4]2– близки (рис. 2б). При концентрации фонового электролита 0.1 М крутизна электродной функции близка к теоретическому значению для однозарядного иона (рис. 2б). Дальнейшие измерения проводили при оптимизированной концентрации иодид-ионов.
Механизм взаимодействия мембраноактивного вещества Cd-СЭ с водным раствором иодид-ионов можно описать следующими реакциями:
Подтвержден факт образования ионного ассоциата ионофора ОДА и иодидного комплекса ${\text{CdI}}_{3}^{ - }$ состава [ОДА]+[CdI3]– (рис. 3) для мембраны II (табл. 2). Максимум светопоглощения в спектре ионного ассоциата батохромно сдвинут относительно спектра ОДА и гипсохромно по отношению к спектру трииодкадмат-иона, что свидетельствует об образовании нового соединения – [ОДА]+[CdI3]–.
Галогенидные ацидокомплексы ионов кадмия из-за большего ионного радиуса, низкого заряда характеризуются высокой липофильностью,иCd-СЭ проявляют к ним бóльшую селективность, чем к анионам ${\text{IO}}_{4}^{ - },$ ${\text{ClO}}_{4}^{ - }.$ Электрохимические характеристики мембран I–III (см.табл. 2)представлены в табл. 3. Лучшими электрохимическими характеристиками обладает электрод с мембраной II.
Таблица 3.
Основные электрохимические характеристики кадмийселективных электродов
| № | S, мВ/декада |
ЛДОС, М | τ, c | ПО, М | pHопт | Время жизни, мес | lgP |
|---|---|---|---|---|---|---|---|
| I | 31.6 | 10–5–0.1 | 15–20 | 3.5 × 10–6 | 1–4 | 2.07 | 4 |
| II | –53 | 10–5–0.1 | 10 | 1.0 × 10–6 | 1–2 | 5 | 6.43 |
| III | –14 | 10–5–10–3 | 10 | 1.0 × 10–6 | 1–2 | 5 | 6.43 |
При определенииспособомбиионных потенциаловпотенциометрическихкоэффициентов селективностиCd-CЭприменяли различные составы мембран иэлектролитоввнутренней полости описанных втабл. 2электродов. Электроды состава I обладают катионной функцией, катионы свинцаистронция влияют на отклик Cd-СЭ, остальные ионыпрактически не мешают:
| Катион | Cd2+ | Mg2+ | Sr2+ | Ca2+ | Na+ | Cu2+ | K+ | Pb2+ | Zn2+ |
| $\lg K_{{{\text{сел}}}}^{{{\text{пот}}}}({\text{I}})$ | 0 | –1.7 | 0.8 | –3 | –1.7 | –0.5 | –0.2 | 3 | –1.1 |
Электроды II и III – это анионселективные электроды. Их селективность изучали относительно анионов. Из этих электродов лучшую селективность показал электрод II, который выбрали для дальнейших исследований:
| Анион | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{PO}}_{4}^{{3 - }}$ | ${\text{NO}}_{3}^{ - }$ | Br– | ${\text{IO}}_{4}^{ - }$ | ${\text{CrO}}_{4}^{{2 - }}$ | SCN– | I– |
|---|---|---|---|---|---|---|---|---|
| $\lg K_{{{\text{сел}}}}^{{{\text{пот}}}}({\text{II}})$ | –2.6 | –2.5 | –2.5 | –2.6 | –1.3 | –2.4 | –2 | – |
| $\lg K_{{{\text{сел}}}}^{{{\text{пот}}}}({\text{III}})$ | –2.6 | –2.5 | –2.5 | – | –1.4 | –2.5 | –2.1 | 0.1 |
Иодидные комплексы кадмия более устойчивы, и селективность электродов II относительно бромидных комплексов выше, а также крутизна электродной функции и линейный рабочий диапазон концентраций (см. табл. 3).
Мешающее влияние тяжелых металлов, образующих хлоридные и иодидные комплексы, устраняли введением 0.1 М раствора NaF для Cd-СЭ состава II (табл. 2). Ниже представлены потенциометрические коэффициенты селективности Cd-СЭ состава II до и после маскирования мешающих катионов:
| Катион | Cr3+ | Fe3+ | Pb2+ | Hg2+ | Zn2+ |
|---|---|---|---|---|---|
| Cd-СЭ до маскирования | 0.031 | 0.021 | 0.034 | 0.096 | 0.085 |
| Cd-СЭ после маскирования | 0.003 | 0.002 | 0.003 | 0.008 | 0.006 |
а также потенциометрические коэффициенты селективности Cd-СЭ состава II в присутствии некоторых анионов:
| Анион | F– | Cl– | Br– | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{NO}}_{3}^{ - }$ |
|---|---|---|---|---|---|
| Cd-СЭ II | 0.003 | 0.004 | 0.009 | 0.001 | 0.002 |
Как видно, сопутствующие кадмию в анализируемых объектах ионы мешающего действия не оказывают.
Жидкостной электрод с мембраной на основе ионного ассоциата ОДА и иодидного комплекса кадмия(II), обладающий лучшими аналитическими характеристиками, совместно с электродом сравнения ранее предложен нами в качестве детектора в проточно-инжекционном варианте анализа молока [24]. Для оптимальной работы проточно-инжекционной системы важное значение имеет выбор элюента, который может влиять на стабильность базовой линии, чувствительность и производительность анализа. В качестве элюента использовали 0.1 M раствор KI, скорость потока которого варьировали в пределах от 1.0 до 17 мл/мин, а объем пробы – от 100 мкл до 100 мл. Обнаружено снижение предела обнаружения при увеличении скорости потока носителя за счет вымывания из примембранного слоя ионов кадмия(II), ограничивающих предел обнаружения Сd-СЭ (рис. 4). На основе мембраны, содержащей 100 ммоль/л ОДА, создан Cd-СЭ с крутизной электродной функции –53 мВ/декада, нернстовской областью 1 × 10–4–1 × 10–2 М, пределом обнаружения кадмия в стационарном режиме 1 × 10–6 М (рис. 4).
Рис. 4.
Зависимость потенциала Сd-СЭ от активности [CdI3]– при различной скорости потока 0.1 M раствора KI, мл/мин: 1 – 0, 2 – 1, 3 – 2, 4 – 3.5, 5 – 6, 6 – 8, 7 – 10, 8 – 15, 9 – 17.

Для определения ионов кадмия в сточной воде и в молочных продуктах, где предельно допустимая концентрация (ПДК) ниже предела обнаружения с помощью разработанного Cd-СЭ, использовали сорбционное концентрирование в проточном режиме. При оптимальной скорости потока 3.5 мл/мин и с использованием в качестве элюента 0.1 М раствора KI получили хроматограммы стандартных растворов Cd(NO3)2 с концентрациями 1, 5, 25, 50, 75, 100 мкг/л. Зависимость потенциала Cd-СЭ от концентрации ионов кадмия линейна в диапазоне 1–50 мкг/л. Относительное стандартное отклонение варьируется в пределах 0.01n–0.1n.
Для оценки потенциометрической селективности Cd-СЭ в поток последовательно вводили по 200 мкл 0.001 M растворов солей металлов, сопутствующих кадмию в анализируемых объектах. Отклик Cd-СЭ значительно ослабевает при введении следующих катионов, образующих хлоридные комплексы: Zn(II) > Hg(II) > Fe(III) > Pb(II).
Пики, соответствующие ионам Cu(II), Ag(I), Pb(II), размыты, и время возвращения потенциала Cd-СЭ к уровню базовой линии составило 25–30 мин. Увеличение концентрации ионов Ag(I), Pb(II) в дозируемой пробе до 0.01 М приводит к образованию осадка, загрязняющего коммуникацию мембраны Cd-СЭ.
Увеличение скорости подачи элюента 0.1 M раствора KI до 3.5 мл/мин приводит к снижению чувствительности Cd-СЭ по отношению к Pb(II), Ni(II), Fe(III) и повышению чувствительности и селективности к Cd(II). Предел обнаружения кадмия(II) в стационарном режиме составил 0.8 × × 10–4 М, что не позволило проводить его прямое определение в молочном продукте. Для снижения предела обнаружения применили сорбционное концентрирование Cd(II) на ионообменнике КУ-2 × 8 (размер частиц 0.25–0.50) с элюированием 0.1 М раствором KI, при этом удалось снизить предел обнаружения кадмия на три порядка величины. Предварительное концентрирование и маскирование введением 0.1 М раствора NaF способствовало повышению чувствительности и селективности.
Некоторые электрохимические характеристики предложенного Cd-СЭ сравнили с известными ранее кадмийселективными электродами (табл. 4). Данные табл. 4 иллюстрируют преимущество предложенного электрода по времени жизни и диапазону кислотности функционирования. Способность разработанного Cd-СЭ функционировать в сильнокислой среде обеспечивает повышение селективности определения.
Таблица 4.
Характеристика отклика предложенного и известных ранее кадмийселективных электродов
| ЭАВ | Рабочий диапазон концентраций, М | Предел обнаружения | Рабочий диапазон pH | Крутизна электродной функции | Время отклика, с | Время жизни, дни | Литература |
|---|---|---|---|---|---|---|---|
| Наночастицы CdS | 10–6–10–2 | 8.6 × 10–7 | 2.2–5.8 | 28.56 | – | 70 | [7] |
| 2,3-Дигирохиназолин-4 (1H)-он | 1.8 × 10–8–1.0 × 10–2 | 8.6 × 10–9 | 5.0–6.5 | 28.9 | 45 | 40 | [8] |
| Халькогенидная стеклянная матрица CdS−AgI−Ag2S−As2S3 | 10–7–10–2 | 10–7 | 4–8 | 29 | – | – | [9] |
| Графеновый нанолист | 10–6–10–2.5 | 10–6.5 | 28.57 | 10 | [10] | ||
| Тиазол-4-карбоксамид | 10–7– 10– 4 | – | 5.2–5.7 | 29.4 | – | – | [11] |
| Халькогенидная пленка на основе Сd−Ag−(Ge28Sb12Se60) | – | 3 × 10–7 | – | 27 | 10 | – | [12] |
| Желатино-циркониевый (IV) вольфрамофосфатный нанокомпозитный ионообменник | 10–7–0.1 | 10–7 | 5–7 | 18.55 | 50 | – | [13] |
| Полианилин-циркониевый фосфоборатный нанокомпозит | 10–7–0.1 | 4 × 10–7 | 2.5–8 | 22.9 | 14 | – | [14] |
| (E)-2-бензилиденгидразинкарботиоамид | 10–5–0.1 | 1.8 × 10–6 | 5–10 | 22.5 | 10 | – | [15] |
| ETH 5435 + гальваностатическая поляризация | 10–10–1 | 10–10 | – | 28.5 | 120 | – | [18, 19, 25] |
| ОДА | 10–5–0.1* | 10–6 | 1–2 | –53 | 10 | 150 | Данная работа |
| 10–8–10–5** | 10–9 | 1–2 | 600 |
Изучили возможность определения ионов кадмия в реальных объектах с использованием созданного Cd-СЭ. В качестве объектов анализа выбрали легкоплавкий припой ПОСК 50-18 (ω(Cd) 18%) и молоко (концентрация кадмия ниже ПДК).
Методика потенциометрического определения кадмия в легкоплавком припое ПОСК 50-18 с использованием электрода на основе октадециламина. Оловянно-свинцовый припой ПОСК 50-18 является сплавом с содержанием кадмия 18% и применяется для пайки деталей, чувствительных к перегреву, металлизированной керамики, для ступенчатой пайки конденсаторов.
Навеску сплава ПОСК 50-18 массой 0.2118 г помещают в стакан емк. 100 мл, приливают 45 мл конц. HNO3 и 5 мл конц. HCl. После выпаривания избытка кислот пробу переносят в мерную колбу емк. 50 мл, вводят фоновый электролит 0.1 М раствор KI и доводят объем до метки бидистиллированной водой. Расчет результатов проводят по градуировочному графику (рис. 4).
В припое ПОСК 50-18 найдено кадмия (18 ± 2)% с применением Cd-СЭ и (17.8 ± 0.2)% методом атомно-абсорбционной спектрометрии (n = 3, P = 0.95).
Изучена возможность разработки проточной системы для определения ионов кадмия в различных объектах. Для этих целей созданы проточные ИСЭ на основе мембран, содержащих ОДА (рис. 5). Кадмийселективный электрод с мембраной на основе ионного ассоциата ОДА и иодидного комплекса кадмия совместно с электродом сравнения использовали в качестве детектора в проточно-инжекционном анализе.
Методика потенциометрического определения кадмия в молоке с использованием электрода на основе октадециламина. Пробу молока объемом 500 мл последовательно высушивают, обугливают и озоляют. Полученную золу растворяют в 1 М HCl при нагревании. После растворения золы создают значение рН 5 добавлением 1 М раствора NaOH. Для концентрирования Cd(II) используют ионообменную колонку с катионитом КУ-2 × 8 Н-форме. Пропускают 100 мл исследуемого раствора со скоростью 3.5 мл/мин. Затем элюируют 0.1 М раствором KI. Потенциал измеряют при (23 ± 2)°C. Значения ЭДС регистрируют в течение 600 с. Потенциал регистрируют, когда его дрейф составит не более 1 мВ/мин.
Результаты определения кадмия в молоке представлены в табл. 5.
* * *
Таким образом, показана возможность использования ОДА в качестве ионофора мембраны Cd-СЭ. Изучены равновесия в системе мембрана–раствор: подтверждено образование ионного ассоциата [ОДА]+[CdI3]–, который наиболее стабилен при pH 1–2 и pI 1; в этих условиях электрод откликается только на ионы [CdI3]–. Сконструирован кадмийселективный электрод с оптимизированным составом мембраны (мас. %): ПВХ 32.8, ОДА 1.7, о-НФОЭ 65.5, с внутренним электролитом состава 0.01 М CdCl2 + 0.01 М HCl + + 0.1 М KI. Определены электрохимические характеристики Cd-СЭ: крутизна электродной функции –53 мВ/декада, нернстовская область 1 × 10–4–1 × 10–2 М, предел обнаружения кадмия в стационарном режиме 1 × 10–6 М. Изучена селективность модифицированных мембран к ионам кадмия. Предложенный Cd-СЭ использован для определения кадмия в сплаве в стационарном варианте и в молоке в проточном режиме. Правильность результатов определения кадмия подтверждена методами атомно-абсорбционной спектрометрии и введено–найдено.
Работа выполнена при финансовой поддержке Государственного задания FZNZ-2020-0002.
Список литературы
Mikhelson K.N. Ion-selective Electrodes (Lecture Notes in Chemistry, V. 81). Heidelberg−N.Y.−Dordrecht−London: Springer, 2013. 162 p.
Soloviev V., Varnek A., Babain V., Polukeev V., Ashina J., Legin E., Legin A., Kirsanov D. QSPR modeling of potentiometric sensitivity towards heavy metal ions for polymeric membrane sensors // Sens. Actuators B: Chem. 2019. V. 301. P. 126941.
Bakker E., Bühlmann P., Pretsch E. Carrier-based ion-selective electrodes and bulk optodes. 1. General characteristics // Chem. Rev. 1997. V. 97. № 8. P. 3083.
Bühlmann P., Pretsch E., Bakker E. Carrier-based ion-selective electrodes and bulk optodes. 2. Ionophores for potentiometric and optical sensors // Chem. Rev. 1998. V. 98. № 4. P. 1593.
Золотов Ю.А. Перспективы развития аналитической химии // Журн. аналит. химии. 2019. Т. 74. № 14. С. S3.
Золотов Ю.А. На пути к массовому, в том числе бытовому, использованию аналитических приборов и других средств химического анализа // Журн. аналит. химии. 2021. Т. 76. № 1. С. 3.
Ajadi A.A., Shuaib N.M., Shoukry A.F. Depth profiling X-ray photoelectron spectroscopy and atomic force microscopy of Cd(II)- and Pb(II)-selective electrodes based on nano metal sulfides // RSC Adv. 2018. V. 8. № 7. P. 3574.
Bagheri M. Determination of trace amount of cadmium by modified graphite electrode in aqueous samples // J. Environ. Treat. Tech. 2018. V. 6. № 3. P. 60.
Essi M., Kouame N., Cisse G. Cd-ISe and membrane technique device for in situ monitoring // Chalcogenide Lett. 2018. V. 15. № 7. P. 379.
Jiang C., Li X., Yao Y., Ying Y., Ping J. Fully written flexible potentiometric sensor using two-dimensional nanomaterial-based conductive ink // Anal. Chem. 2018. V. 90. № 21. P. 13088.
Jamil N.W.Z., Yahya M.Z.A., Jumal J., Kasim N.A.M. Liquid polymeric membrane composition of ion selective electrode based on thiazole-4-carboxamide as ionophore // AIP Conf. Proc. 2019. V. 2068. P. 020064. https://aip.scitation.org/doi/abs/10.1063/1.5089363 (31.03.2021).
Essi M., Cisse G., Flaud V. Cadmium chalcogenide thin films for potentiometric applications // Chalcogenide Lett. 2020. V. 17. № 10. P. 495.
Thakur M., Pathania D. Sol–gel synthesis of gelatin–zirconium(IV) tungstophosphate nanocomposite ion exchanger and application for the estimation of Cd(II) ions // J. Sol−Gel Sci. Technol. 2019. V. 89. № 3. P. 700.
Sandeep Kaushal., Badru R., Singh P., Kumar S., Mittal S.K. Estimation of trace level cadmium(ii) by polyaniline−zirconium phosphoborate nanocomposite-based membrane electrode // J. Anal. Chem. 2019. V. 74. № 8. P. 800.
Özbek O., Isildak Ö., Gürdere M.B., Berkel C. Cadmium(II)-selective potentiometric sensor based on synthesised (E)-2-benzylidenehydrazinecarbothioamide for the determination of Cd2+ in different environmental samples // Int. J. Environ. Anal. Chem. 2020. V. 0. P. 1. https://doi.org/ (31.03.2021).https://doi.org/10.1080/03067319.2020.1817427
Baghel A., Bhuvaneswari A., Singh V.V., Boopathi M., Singh B. Synthesis and characterisation of ligand free cadmium imprinted polymer for sensing of Cd(II) from aqueous solution // Def. Life Sci. J. 2019. V. 4. № 3. P. 153.
Ding R., Krikstolaityte V., Lisak G. Inorganic salt modified paper substrates utilized in paper based microfluidic sampling for potentiometric determination of heavy metals // Sens. Actuators B: Chem. 2019. V. 290. P. 347.
Kalinichev A.V., Solovyeva E.V., Ivanova A.R., Khripoun G.A., Mikhelson K.N. Non-constancy of the bulk resistance of ionophore-based Cd2+-selective electrode: A correlation with the water uptake by the electrode membrane // Electrochim. Acta. 2020. V. 334. P. 135541
Peshkova M.A., Koltashova E.S., Khripoun G.A., Mikhelson K.N. Improvement of the upper limit of the ISE Nernstian response by tuned galvanostatic polarization // Electrochim. Acta. 2015. V. 167. P. 187.
Золотов Ю.А. Миниатюризация химического анализа // Журн. аналит. химии. 2014. Т. 69. № 1. С. 3.
Золотов Ю.А. Тенденции в аналитическом приборостроении // Журн. аналит. химии. 2011. Т. 66. № 2. С. 115.
Золотов Ю.А. Растущие возможности химического анализа // Экология и промышленность России. 2016. Т. 20. № 3. С. 42. (Zolotov Yu.A. Growing opportunities of chemical analysis // Ecol. Ind. Russ. 2016. V. 20. P. 42.)
Татаева С.Д., Магомедова В.С., Магомедов К.Э. Определение ионов свинца с помощью электрода на основе диантипирилметана // Журн. аналит. химии. 2016. Т. 71. № 11. С. 1172. (Tataeva S.D., Magomedova V.S., Magomedov K.E. Determination of lead ions using an diantipyrylmethane-based electrode // J. Anal Chem. 2016. V. 71. № 11. P. 1115.)
Татаева С.Д., Магомедов К.Э. Кадмий-селективный электрод. Патент РФ №2712920. Заявка 2019117807 от 07.06.2019, опубл. 03.02.2020.
Пешкова М.А., Сокальски Т., Михельсон К.Н., Левенстам А. Резкое улучшение нижнего предела функционирования ионселективных электродов путем оптимизированной гальваностатической поляризации // Вестник СПбГУ. 2010. Т. 4. № 1. С. 106.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии