Журнал аналитической химии, 2022, T. 77, № 1, стр. 70-77
Вольтамперометрический ДНК-сенсор на основе редокс-активных красителей для определения доксорубицина
Д. Каппо a, *, Ю. И. Кузин a, Д. Н. Шурпик a, И. И. Стойков a, Г. А. Евтюгин a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: almija@mail.ru
Поступила в редакцию 27.04.2021
После доработки 30.06.2021
Принята к публикации 05.07.2021
- EDN: LIYJFR
- DOI: 10.31857/S0044450222010078
Аннотация
Предложен вольтамперометрический ДНК-сенсор на основе стеклоуглерода, модифицированного углеродной чернью, пиллар[5]ареном и электрополимеризованным нейтральным красным. Для повышения чувствительности сигнала в состав поверхностного слоя ДНК-сенсора дополнительно вводили метиленовый синий в мономерной и полимерной формах в качестве специфичного интеркалятора ДНК и медиатора электронного переноса. Охарактеризованы электрохимические характеристики покрытия в зависимости от состава и способа получения и установлено согласованное изменение токов пика красителей при инкубировании ДНК-сенсора в растворе доксорубицина как модельного лекарственного препарата противоракового действия. В оптимальных условиях ДНК-сенсор позволяет определять от 10 нМ до 0.1 мМ доксорубицина. Показана возможность определения доксорубицина в синтетической плазме крови.
Создание чувствительных устройств, способных устанавливать присутствие низкомолекулярных соединений, повреждающих или специфически взаимодействующих с ДНК, является актуальным направлением развития современной аналитической химии. К числу подобных устройств относятся сенсоры для скрининга новых лекарственных препаратов, включая противоопухолевые, и для контроля загрязненности продуктов питания. В настоящее время для этих целей преимущественно используют высокоэффективную жидкостную хроматографию и капиллярный электрофорез [1, 2]. Однако эти методы обладают рядом недостатков, к которым можно отнести требование высокой квалификации оператора, трудоемкую пробоподготовку в условиях стационарной лаборатории и высокую стоимость оборудования. Альтернативой универсальному аналитическому оборудованию выступают миниатюрные аналитические устройства – биосенсоры [3]. Особенно привлекательны биосенсоры, включающие в качестве элемента биораспознавания ДНК, поскольку в них биологический рецептор выступает моделью регистрируемых биохимических взаимодействий в организме человека. ДНК способна с высокой специфичностью взаимодействовать с биологически активными молекулами за счет водородных, электростатических, донорно-акцепторных связей и гидрофобных эффектов [4]. Помимо выявления гибридизации комплементарных последовательностей ДНК в диагностике патогенных микроорганизмов и вирусов, ДНК-сенсоры активно применяют для анализа противораковых препаратов и определения активных форм кислорода [5].
В качестве модельного аналита при разработке подобных ДНК-сенсоров часто используют доксорубицин – антрациклиновый препарат, цитостатический механизм действия которого основан на интеркаляции в двойную спираль ДНК [4]. На данный момент представлено много работ по определению доксорубицина при помощи различных ДНК-сенсоров, прежде всего, электрохимических [6–8]. Однако совершенствование конструкции, упрощение протокола измерения сигнала и улучшение аналитических характеристик ДНК-сенсора остаются важной задачей. Для ее решения необходимо совершенствовать иммобилизацию ДНК в составе биосенсора и оптимизировать условия регистрации сигнала.
Модифицирование поверхности электрода электрохимически активными компонентами позволяет снизить рабочий потенциал биосенсора и улучшить его аналитические характеристики. Одним из перспективных способов такой модификации является нанесение электрохимически активных полимерных пленок, проявляющих медиаторные свойства [9]. Примером является биосенсор с поверхностным слоем полианилина и ДНК [10]. Однако электрополимеризация анилина проводится исключительно в сильных минеральных кислотах, а сам он проявляет электропроводность и электрохимическую активность в кислых средах. Это затрудняет включение ДНК и последующее применение биосенсора в анализе реальных объектов. Альтернативой выступает использование полимерных форм феназиновых и фенотиазиновых красителей. Их полимеризация протекает в диапазоне рН 6–8, а электрополимеризованная форма проявляет обратимость переноса электрона в широком интервале условий измерения сигнала [11]. Взаимодействие феназинов и фенотиазинов с ДНК не полностью блокирует электрохимическую активность этих соединений, что позволяет им сохранять способность к переносу электрона [5].
Ранее нами предложен ДНК-сенсор на основе углеродной черни (УЧ), пиллар[5]арена (П5А) и поли(нейтрального красного) (полиНК) для регистрации окислительного повреждения ДНК и измерения антиоксидантной активности соединений [12]. Нейтральный красный – краситель феназинового ряда, способный полимеризоваться при многократном циклировании потенциала с образованием электроактивного полимера [13]. ПолиНК нашел применение в составе различных сенсоров и биосенсоров как медиатор электронного переноса [14–17]. В то же время реакция полиНК на биохимические реакции с участием ДНК остается недостаточно изученной, кроме того, он демонстрирует низкую селективность и малую чувствительность в отношении низкомолекулярных аналитов. Эти характеристики можно улучшить, оптимизируя условия введения ДНК в состав поверхностного слоя биосенсора, например, путем включения биополимера в раствор мономера красителя на стадии электрополимеризации [6]. Данные сканирующей электронной микроскопии показали, что при этом пленка сополимера получалась более плотной, прочной и шероховатой по сравнению с пленками красителя в отсутствие ДНК. Введение ДНК повышало чувствительность определения доксорубицина с импедиметрической регистрацией сигнала. Вместе с тем чувствительность вольтамперометрической регистрации отклика оставалась недостаточной.
В данной работе нами предложено гибридное покрытие электрохимического ДНК-сенсора, включающее УЧ, П5А и полиНК с введением в состав слоя дополнительного медиатора электронного переноса – метиленового синего (МС). Метиленовый синий обладает высокой электрохимической активностью и активно взаимодействует с ДНК по механизму интеркаляции и электростатической сорбции [18, 19]. Это позволяет использовать конкурентное взаимодействие МС и доксорубицина для высокочувствительного определения последнего. Вызывает интерес как получение сополимера красителей, так и введение мономерной формы МС в буферный раствор для регистрации циклических вольтамперограмм (ЦВА) в качестве дополнительного фактора, повышающего чувствительность регистрации биоспецифических взаимодействий с участием ДНК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Использовали ДНК из молок рыбы, нейтральный красный (n8,n8,3-триметилфеназин-2,8-диамин хлорид), метиленовый синий (3,7-бисдиметиламинофенотиазина хлорид), хитозан (Sigma-Aldrich), углеродную чернь (IMERYS, Бельгия). Пиллар[5]арен был синтезирован на кафедре органической химии Казанского федерального университета по методике [20]. Его структура подтверждена методами ИК-, 1Н ЯМР-спектроскопии и данными элементного анализа.
Все остальные реагенты были категории ч. д. а. и analytical grade и использовались без дополнительной очистки. Растворы для проведения электрохимических измерений готовили на деионизированной воде Millipore®. Для контроля pH рабочих растворов использовали рН-метр-иономер Эксперт-001 (ЗАО НПП “Эконикс-Эксперт”, Москва).
Вольтамперометрические измерения проводили с помощью электрохимического анализатора CHI 660Е (CH Instruments, Inc., США) в трехэлектродной ячейке. Она включала стеклоуглеродный электрод (СУЭ), изготовленный из стержня СУ2000 диаметром 2 мм (НИИГрафит, Москва) в тефлоновом корпусе, снабженном стальным токосъемником. Противоэлектродом служил платиновый проволочный электрод (CHI 129, CH Instruments, Inc., США), электродом сравнения – хлоридсеребряный электрод Ag/AgCl (1 М KCl) (CHI 128, CH Instruments, Inc., США).
Предварительная модификация электрода углеродной чернью и пиллар[5]ареном. Стеклоуглеродный электрод полировали, ополаскивали в этаноле и далее подвергали очистке путем циклирования его потенциала в диапазоне от –1 до 1 В в 0.2 М серной кислоте до стабилизации токов. Далее по методике, описанной ранее [12], на поверхность СУЭ наносили дважды по 1 мкл УЧ (1.3 мг/мл в 0.375%-ном растворе хитозана в 0.05 М HCl) и 0.8 мкл 1 М раствора NaOH с высушиванием каждого слоя при 60°С. Поверх УЧ наносили 2 мкл 1 × 10–4 М раствора П5А в ацетоне и сушили на воздухе. Полученный модифицированный электрод покрывали пленкой полиНК, полиМС/полиНК или сополимера НК и МС. Электрополимеризацию НК проводили путем циклирования потенциала в диапазоне от –0.8 до 0.8 В из фосфатного буферного раствора, содержащего 25 мМ NaH2PO4, 0.1 М NaNO3 (рН 6.0) и 0.4 мМ НК. Электрополимеризацию МС осуществляли путем циклирования потенциала в диапазоне от –0.65 до 1.2 В из фосфатного буферного раствора, содержащего 25 мМ NaH2PO4, 100 мМ Na2SO4 (pH 8.2) и 10 мМ МС. После электрополимеризации электрод переносили в рабочий буферный раствор, не содержащий мономера, и регистрировали 10 циклов сканирования потенциала для удаления из полимерной пленки не связавшихся частиц красителя. ДНК различных концентраций (0.1, 0.2, 0.3, 0.5, 1.0, 2.0 мг/мл) включали в состав растущей пленки полимера на стадии электрополимеризации красителей.
Определение содержания доксорубицина. ДНК-сенсор инкубировали в растворе доксорубицина в воде или искусственной плазме крови. Аналитическим сигналом служило изменение тока пиков окисления–восстановления полимерных форм красителей, регистрированных в 25 мМ фосфатном буферном растворе, содержащем 0.1 М Na2-SO4 (рН 5.0). Искусственная плазма крови содержала 4 × 10–6 М L-метионин, 2 × 10–3 М NaCl, 2 × 10–4 М NaHCO3, 1.3 × 10–6 М L-цистеин, 3.5 × 10–6 М L-глицин, 2.1 × 10–4 М L-триптофан, 2 × 10–4 М L-тирозин, 4 × 10–6 М L-фенилаланин, 5 × 10–6 М DL-лизин, 3.5 × 10–6 М L-гистидин, 2.2 × 10–5 М L-аспарагиновую кислоту, 5 × 10–6 М L-аргинин, 2 × 10–4 М L-аланин [21].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Измерение сигнала поли(нейтрального красного) в присутствии мономерной формы метиленового синего и ДНК. Для установления возможностей совместного использования двух красителей в составе ДНК-сенсора сначала исследовали пленки полиНК, полученные в отсутствие и в присутствии ДНК, с последующим введением в рабочий буферный раствор мономерной формы МС. Соответствующие ЦВА приведены на рис. 1. Измерения проводили при рН 5.0, соответствующем наилучшей воспроизводимости пиков на вольтамперограммах [5, 12].
Рис. 1.
Циклические вольтамперограммы, полученные на стеклоуглеродных электродах с покрытием УЧ/П5А/полиНК (а) и УЧ/П5А/(поли(НК) + ДНК) (б), в 25 мМ фосфатном буферном растворе с рН 5.0, содержащем 0.1 М Na2-SO4 и метиленовый синий в различных концентрациях: 0 – 0, 1 – 1 × 10–6, 2 – 5 × 10–6, 3 – 1 × 10–5, 4 – 5 × 10–5, 5 – 1 × 10–4 М.

В присутствии МС на модифицированном электроде наблюдали две пары пиков. В диапазоне потенциалов от –0.4 до –0.6 В пики отвечают полиНК, в области от –0.2 до –0.1 – мономерному МС. По мере увеличения концентрации МС в растворе анодные пики полиНК уменьшались по величине, оставаясь стабильными при последовательных измерениях на одном и том же электроде. В то же время катодные пики полиНК снижались практически вдвое относительно значений, полученных в отсутствие МС. Это говорит об участии восстановленной формы МС в цепи переноса электрона с участием окисленной формы полиНК. Токи пиков МС демонстрировали небольшое снижение при введении в покрытие ДНК. Вероятно, часть молекул красителя интеркалировала в двойную спираль ДНК, частично теряя способность к окислению/восстановлению на электроде.
Снижение токов пика полиНК после измерения в растворе МС наблюдали и после перемещения модифицированного электрода в буферный раствор, не содержащий МС. Токи полиНК при этом оставались на прежнем уровне, а токи МС, хотя и значительно снижались, оставались достаточно выраженными. Это связано с проникновением МС в состав модифицирующего покрытия и его сохранением в слое при измерениях в растворе, не содержащем МС. Накопление в поверхностном слое МС подтвердили также экспериментом с предварительным 10-минутным выдерживанием модифицированного электрода в растворе МС различных концентраций. Токи пика окисления полиНК продолжали сохранять бóльшую стабильность, нежели токи пика восстановления, а для меньших концентраций МС его токи, особенно токи восстановления, в случае предварительного выдерживания значительно возрастали относительно значений, полученных без такого инкубирования. Это обусловлено электростатическим концентрированием положительно заряженных молекул МС в составе покрытия, содержащего молекулы ДНК с отрицательно заряженными фосфатными группами остова.
Оптимальную концентрацию макроциклического медиатора электронного переноса П5А определяли по результатам экспериментов с варьированием его содержания на стадии нанесения на поверхность СУЭ, модифицированного УЧ. Установлено, что использование растворов медиатора в диапазоне концентраций (1 × 10–7–5 × × 10–5 М) не приводит к каким-либо значимым изменениям электрохимического поведения редокс-активного полимера полиНК. Увеличение концентрации П5А в аликвоте до 0.1 мМ приводит к значительному улучшению условия электронного обмена в рамках модифицирующего покрытия: наблюдали изменение морфологии и величины пиков полиНК, которые становились более выраженными. Использование указанной концентрации П5А также позитивно сказывалось и на пиках диффузионно свободного МС. Однако дальнейшее увеличение концентрации П5А приводило к ухудшению отклика модифицирующего покрытия по причине вероятной агрегации молекул макроцикла и блокировки поверхности, доступной для дальнейшего электроосаждения полиНК. В связи с этим концентрацию П5А 0.1 мМ приняли в качестве оптимальной и использовали в дальнейших экспериментах.
Варьирование концентрации ДНК в пределах 0.1–0.3 мг/мл в растворе для проведения электрополимеризации продемонстрировало отсутствие значимых отличий в сигналах красителей. При использовании концентраций ДНК от 0.5 до 2.0 мг/мл токи красителей уменьшались в силу частичного блокирования поверхности сенсора непроводящими молекулами ДНК. Наибольшую стабильность сигналов красителей в серии последовательных измерений показало покрытие, включающее ДНК с концентрацией 0.2 мг/мл, поэтому в дальнейших экспериментах использовали данное значение концентрации биополимера.
Сополимеризация нейтрального красного и метиленового синего. Несмотря на выявленное благоприятное воздействие мономерной формы МС на окислительно-восстановительные свойства гибридного покрытия УЧ/П5А/полиНК, срок службы и механическая стабильность такого биосенсора ограничены десорбцией мономера МС с поверхности электрода. Электрополимеризация МС могла бы увеличить стабильность покрытия.
Рассмотрели варианты сборки поверхностного слоя биосенсора путем совместной полимеризации красителей из общего раствора мономеров и путем последовательной электрополимеризации НК и далее МС. Соответствующие ЦВА приведены на рис. 2. При электрополимеризации из раствора НК и МС пики окисления–восстановления полиНК слабо выражены, а при последовательной электрополимеризации (электроосаждение полиМС поверх полиНК) на ЦВА наблюдали только пики полиМС, по-видимому, за счет его более высокой эффективности в реакции электронного переноса.
Для покрытий с различимым составом полимерного слоя на основе полиНК исследовали зависимости тока и потенциала пиков электропревращения полимерных форм МС и НК, приведенные в табл. 1. Интересно, что наклон зависимости тока пика от скорости сканирования потенциала в билогарифмических координатах остается на уровне 0.5–0.6, формально отвечая диффузионному контролю переноса электрона при том, что в растворе диффузионно свободных красителей нет. Это связано с лимитированием общей скорости реакции процессами электронного обмена между окисленными и восстановленными формами красителей в поверхностном слое. Единственным исключением можно считать токи пика полиМС, которые существенно выше по сравнению с пиками полиНК независимо от протокола электрополимеризации и приближаются к значению, характерному для лимитирования процесса поверхностными стадиями. Это согласуется с соотношением реакционной способности полимерных форм красителей, установленным, исходя из изменения токов пика смешанных покрытий относительно свойств пленки полиНК. Другим необычным результатом можно считать практически полное отсутствие рН-зависимости потенциалов пика полиНК. Можно предположить, что стадии протонирования/депротонирования указанного красителя не влияют на скорость процесса в силу согласованного переноса ионов водорода и электронов на редокс-центры МС, присутствующего в слое.
Таблица 1.
Параметры зависимости тока и потенциала пиков электропревращения полимерных форм метиленового синего и нейтрального красного от скорости сканирования потенциала и рН
| Состав покрытия | Ток пика окисления | Ток пика восстановления | ||||
|---|---|---|---|---|---|---|
| –a ± Δa | b ± Δb | R2 | –a ± Δa | b ± Δb | R2 | |
| Уравнение регрессии lg(i, мкА) = a + blg(ν, В/с): УЧ/П5А/(сополимер МС и НК) |
||||||
| ПолиНК | 1.08 ± 0.04 | 0.67 ± 0.02 | 0.9922 | 0.03 ± 0.01 | 0.29 ± 0.01 | 0.9962 |
| ПолиМС | 1.11 ± 0.06 | 0.61 ± 0.03 | 0.9768 | 0.46 ± 0.04 | 0.35 ± 0.02 | 0.9660 |
| УЧ/П5А/полиМС/полиНК | ||||||
| ПолиНК | 0.79 ± 0.03 | 0.55 ± 0.01 | 0.9934 | –2.66 ± 0.03 | 0.02 ± 0.00 | 0.9991 |
| ПолиМС | 1.31 ± 0.02 | 0.73 ± 0.01 | 0.9973 | 1.44 ± 0.06 | 0.83 ± 0.03 | 0.9868 |
| Уравнение регрессии lg(E, мВ) = a + bpH: УЧ/П5А/(сополимер МС и НК) |
||||||
| ПолиНК, pH 3–8 | 0.270 ± 0.001 | –0.0050 ± 0.0001 | 0.9997 | 0.49 ± 0.05 | –0.0170 ± 0.0008 | 0.9891 |
| полиМС, pH 3–8 | 0.0079 ± 0.0080 | –0.018 ± 0.014 | 0.9709 | 0.070 ± 0.007 | –0.0260 ± 0.0012 | 0.9898 |
| УЧ/П5А/полиМС/полиНК | ||||||
| ПолиНК, pH 3–8 | 0.180 ± 0.003 | 0.016 ± 0.001 | 0.9955 | 0.380 ± 0.003 | –0.015 ± 0.001 | 0.9952 |
| ПолиМС, pH 3–5 | 0.037 ± 0.004 | –0.0040 ± 0.0003 | 0.9926 | –0.015 ± 0.001 | –0.0280 ± 0.0002 | 0.9999 |
| ПолиМС, pH 6–8 | –0.024 ± 0.006 | –0.016 ± 0.001 | 0.9902 | 0.078 ± 0.001 | –0.0120 ± 0.0003 | 0.9991 |
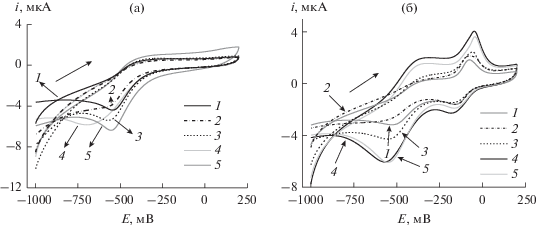
Определение доксорубицина. Для определения доксорубицина с помощью разработанного ДНК-сенсора регистрировали ЦВА до и после инкубирования ДНК-сенсора в растворе аналита (рис. 3). Поскольку предполагаемое повышение чувствительности биосенсора связано с конкурентными взаимодействиями МС и доксорубицина, в данных экспериментах использовали биосенсор с мономерной формой МС в слое.
Рис. 2.
Циклические вольтамперограммы, полученные на стеклоуглеродных электродах в процессе электрополимеризации для покрытий состава: СУЭ/УЧ/П5А/(сополимер МС и НК) (а), СУЭ/УЧ/П5А/полиМС (б), CУЭ/УЧ/П5А/полиМС/полиНК (в).

Рис. 3.
Циклические вольтамперограммы, полученные на стеклоуглеродных электродах, модифицированных УЧ/П5А/(поли(НК) + ДНК) в 25 мМ фосфатном буферном растворе с рН 5.0, содержащем 0.1 М Na2SO4, в отсутствие (а) и в присутствии 1 × 10–4 М метиленового синего (б) после инкубации в водном растворе доксорубицина с концентрацией 1 × 10–8 (1), 1 × 10–7 (2), 1 × 10–6 (3), 1 × 10–5 (4), 1 × 10–4 М (5).
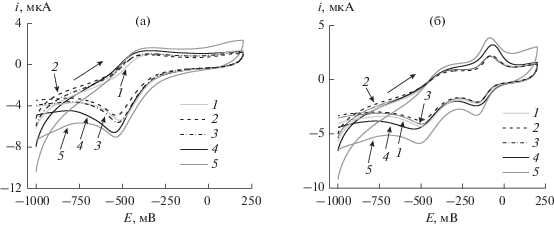
Рис. 4.
Циклические вольтамперограммы, полученные на стеклоуглеродном электроде с покрытием УЧ/П5А/(поли(НК) + ДНК) в 25 мМ фосфатном буферном растворе с рН 5.0, содержащем 0.1 М Na2SO4, в отсутствие (а) и в присутствии 1 × 10–4 М метиленового синего (б) после инкубации в растворе синтетической плазмы крови, содержащем доксорубицин с концентрацией 1 × 10–8 (1), 1 × 10–7 (2), 1 × 10–6 (3), 1 × 10–5 (4), 1 × 10–4 М (5).
При увеличении концентрации доксорубицина токи пика МС возрастали, что связано с конкурентным вытеснением красителя из молекул ДНК и повышением его реакционной способности в окислительно-восстановительной реакции на электроде. Токи пика полиНК проявляли аналогичную тенденцию, что обусловлено повышением эффективности электронного обмена в слое при увеличении доли свободных молекул МС. Все измерения проводили однократно, поскольку удаление доксорубицина из поверхностного слоя биосенсора сопровождалось частичным разрушением покрытия либо нарушением структуры слоя и резким снижением регистрируемых токов на ЦВА. В оптимальных условиях измерения сигнала биосенсор позволяет определять доксорубицин в интервале концентраций от 10 нМ до 0.1 мМ с пределом обнаружения 3 нМ (градуировочное уравнение lg(i, мкА) = (2.85 ± 0.01) + + (0.142 ± 0.002)lg(c, М), n = 5, R2 = 0.9991). Для сравнения, в отсутствие МС чувствительность определения доксорубицина по анодному току пика полиНК составила 0.09 мкА/рс. Установленные характеристики определения доксорубицина сопоставимы или лучше параметров электрохимических сенсоров с вольтамперометрической регистрацией сигнала. Сравнение характеристик сенсоров дано в табл. 2. Биосенсор сохраняет сигнал на доксорубицин при хранении перед измерением в течение не менее чем 30 дней (в отсутствие влаги при 4°С).
Таблица 2.
Аналитические характеристики определения доксорубицина с использованием вольтамперометрических сенсоров
| Состав поверхностного слоя | Линейный диапазон | clim, нМ | Литература |
|---|---|---|---|
| Золотой электрод/квантовые точки графена/поли(таурин)/ β-циклодекстрин | 86 нМ–3.45 мкМ | 12 | [22] |
| СУЭ/наночастицы серебра/поли(хитозан) | 0.103–8.6 мкМ | 103 | [23] |
| СУЭ/квантовые точки графена | 18 нМ–3.6 мкМ | 16 | [24] |
| СУЭ/поли(толуидиновый синий) | 17 нМ–8.6 мкМ | 17 | [25] |
| СУЭ/углеродная чернь/наночастицы меди/NAFION | 0.45–5.1 мкМ | 24 | [26] |
| Угольно-пастовый электрод/додецилсульфат натрия | 10–80 мкМ | 1120 | [27] |
| Угольно-дисковый электрод/многостенные углеродные нанотрубки/мезопористые наночастицы Pd и Pt | 4.4 нМ–8.58 мкМ | 0.86 | [28] |
| Планарный печатный электрод/наночастицы золота/ нанослой 1T-MoS2 | 0.01–9.5 мкМ | 2.5 | [29] |
| СУЭ покрыт УЧ, П5А и полиНК, измерения в присутствии МС | 10 нМ–0.1 мМ | 3 | Данная работа |
Аналогичные измерения выполнили в искусственной плазме крови. В отсутствие МС чувствительность сигнала полиНК к доксорубицину сопоставима с установленной ранее для стандартных растворов аналита при измерении в буферном растворе (0.07 ± 0.01), тогда как в искусственной плазме наклон соответствующей зависимости несколько выше (градуировочное уравнение lg(i, мкА) = (3.76 ± 0.02) + (0.215 ± 0.004)lg(c, М)), n = 5, R2 = 0.9986). Это может быть связано с влиянием компонентов искусственной плазмы на сорбционное удерживание МС и его сигнал. Тем не менее при разбавлении плазмы в 10 раз рабочим буферным раствором указанный эффект исчезает. Правильность определения доксорубицина в разбавленной 1 : 10 плазме охарактеризована в табл. 3.
Таблица 3.
Результаты (мкМ) вольтамперометрического определения доксорубицина в синтетической плазме крови, разбавленной 1 : 10 фосфатным буферным раствором, на СУЭ/УЧ/П5А/полиНК в присутствии метиленового синего методом введено–найдено (n = 5, Р = 0.95)
| Введено | Найдено | sr, % | Степень открытия, % |
|---|---|---|---|
| 0.50 | 0.42 ± 0.03 | 0.03 | 84.0 |
| 5.00 | 5.220 ± 0.235 | 0.03 | 104.4 |
| 50.00 | 48.60 ± 0.82 | 0.01 | 97.2 |
Работа выполнена при поддержке РФФИ (проект 20-33-90132).
Список литературы
Kozlu S., Sahin A., Calis S., Capan Y. Development and validation of a LC-FL method for the simultaneous determination of doxorubicin and celecoxib in nanoparticulate fixed dose combination (NanoFDC) // Pharmazie. 2017. V. 72. № 10. P. 568. https://doi.org/10.1691/ph.2017.7077
Robieux I., Aita P., Sorio R., Toffoli G., Boiocchi M. Determination of unbound etoposide concentration in ultrafiltered plasma by high-performance liquid chromatography with fluorimetric detection // J. Chromatogr. B. 1996. V. 685. P. 383. https://doi.org/10.1016/s0378-4347(96)00300-3
Ribeiro D.B., Silva G.S., Dos Santos D.R., Costa A.R., Ribeiro E.B., Badea M., Nunes G.S. Determination of the antioxidant activity of samples of tea and commercial sources of vitamin C, using an enzymatic biosensor // Antioxidants. 2021. V. 10. № 2. P. 324. https://doi.org/10.3390/antiox10020324
Евтюгин Г.А., Будников Г.К., Порфирьева А.В. Электрохимические ДНК-сенсоры для определения биологически активных низкомолекулярных соединений // Журн. Рос. хим. об-ва им. Д.И. Менделеева. 2008. Т. LII. № 2. С. 66. (Evtyugin G.A., Budnikov G.K., Porfir’eva A.V. Electrochemical DNA-sensors for determining biologically active low-molecular compounds // Russ. J. Gen. Chem. 2008. V. 78. № 12. P. 2489. )https://doi.org/10.1134/S107036320812030X
Kuzin Y., Porfireva A., Stepanova V., Evtugyn V., Stoikov I., Evtugyn G., Hianik T. Impedimetric detection of DNA damage with the sensor based on silver nanoparticles and neutral red // Electroanalysis. 2015. V. 27. № 12. P. 2800. https://doi.org/10.1002/elan.201500312
Porfireva A., Evtugyn G. Electrochemical DNA sensor based on the copolymer of proflavine and Azure B for doxorubicin determination // Nanomaterials. 2020. V. 10. № 5. P. 924. https://doi.org/10.3390/nano10050924
Asai K., Yamamoto T., Nagashima S., Ogata G., Hibino H., Eynaga Y. An electrochemical aptamer-based sensor prepared by utilizing the strong interaction between a DNA aptamer and diamond // Analyst. 2020. V. 145. № 2. P. 544. https://doi.org/10.1039/C9AN01976F
Hajian R., Tayebi Z., Shams N. Fabrication of an electrochemical sensor for determination of doxorubicin in human plasma and its interaction with DNA // J. Pharm. Anal. 2017. V. 7. № 1. P. 27. https://doi.org/10.1016/j.jpha.2016.07.005
Yang R., Ruan C., Deng J. A H2O2 biosensor based on immobilization of horseradish peroxidase in electropolymerized methylene green film on GCE // J. Appl. Electrochem. 1998. V. 28. № 11. P. 1269. https://doi.org/10.1023/A:1003460431109
Kulikova T.N., Porfireva A.V., Shamagsumova R.V., Evtugyn G.A. Voltammetric sensor with replaceable polyaniline-DNA layer for doxorubicin determination // Electroanalysis. 2018. V. 30. P. 1. https://doi.org/10.1002/elan.201800331
Karyakin A.A., Karyakina E.E., Shmidt H.-L. Electropolymerized azines: A new group of electroactive polymers // Electroanalysis. 1999. V. 11. № 3. P. 149. https://doi.org/10.1002/(SICI)1521-4109(199903)11:3<149::AID-ELAN149>3.0.CO;2-G
Kuzin Y., Kappo D., Porfireva A., Shurpik D., Stoikov I., Evtugyn G., Hianik T. Electrochemical DNA sensor based on carbon black-poly(neutral red) composite for detection of oxidative DNA damage // Sensors. 2018. V. 18. № 10. P. 3489. https://doi.org/10.3390/s18103489
Benito D., Gabrielli C., García-Jareño J.J., Keddam M., Perrot H., Vicente F. Study by EQCM on the voltammetric electrogeneration of poly(neutral red). The effect of the pH and the nature of cations and anions on the electrochemistry of the films // Electrochim. Acta. 2003. V. 48. P. 4039. https://doi.org/10.1016/S0013-4686(03)00561-9
Sunil Kumar Naik T.S., Swamy. K. Modification of carbon paste electrode by electrochemical polymerization of neutral red and its catalytic capability towards the simultaneous determination of catechol and hydroquinone: A voltammetric study // Electroanal. Chem. 2017. V. 804. P. 78. https://doi.org/10.1016/j.jelechem.2017.08.047
Romero P.R., González–Rodríguez J., Rodríguez-Amaro R., Rodríguez Mellado J.M. Evolution of Pt and Ag nanoparticles composites with polyphenazines onto ITO electrodes during the oxidation of H2O2 with ascorbic acid // Electrochim. Acta. 2018. V. 48. P. 4039. https://doi.org/10.1016/j.electacta.2018.03.135
Devi C.L., Narayanan S.S. Poly(amido amine) dendrimer and silver nanoparticle–multi-walled carbon nanotubes composite with poly(neutral red)-modified electrode for the determination of ascorbic acid // Bull. Mater. Sci. 2019. V. 42. P. 73. https://doi.org/10.1007/s12034-019-1775-7
Pauliukaite R., Ghica M.E., Barsan M. Characterisation of poly (neutral red) modified carbon film electrodes; application as a redox mediator for biosensors // J. Solid State Electrochem. 2007. V. 11. P. 899. https://doi.org/10.1007/s10008-007-0281-9
Vanickova M., Buckova M., Labuda J. Voltammetric determination of azepine and phenothiazine drugs with DNA biosensors // Chemia Analityczna. 2000. V. 45. P. 125.
Zhong J., Qi Z., Dai H., Fan C., Li G., Matsuda N. Sensing phenothiazine drugs at a gold electrode co-modified with DNA and gold nanoparticles // Anal. Sci. 2003. V. 19. P. 653. https://doi.org/10.2116/analsci.19.653
Ogoshi T., Aoki T., Kitajima K., Fujinami S., Yamagishi T.-A., Nakamoto Y. Facile, rapid, and high-yield synthesis of pillar[5]arene from commercially available reagents and its X-ray crystal structure // J. Org. Chem. 2011. V. 76. P. 328. https://doi.org/10.1021/jo1020823
Parham H., Zargar B. Determination of isosorbide dinitrate in arterial plasma, synthetic serum and pharmaceutical formulations by linear sweep voltammetry on a gold electrode // Talanta. 2001. V. 55. P. 255. https://doi.org/10.1016/S0039-9140(01)00416-7
Alizadeh P.M., Hasanzadeh M., Soleymani J., Gharamaleki J.V., Jouyban A. Application of bioactive cyclic oligosaccharide on the detection of doxorubicin hydrochloride in unprocessed human plasma sample: A new platform towards efficient chemotherapy // Microchem. J. 2019. V. 145. P. 450. https://doi.org/10.1016/j.microc.2018.11.012
Ehsani M., Soleymani J., Mohammadalizadeh P., Hasanzadeh M., Jouyban A., Khoubnasabjafari M., Vaez-Gharamaleki Y. Low potential detection of doxorubicin using a sensitive electrochemical sensor based on glassy carbon electrode modified with silver nanoparticles-supported poly(chitosan): A new platform in pharmaceutical analysis // Microchem. J. 2021. V. 165. P. 106101. https://doi.org/10.1016/j.microc.2021.106101
Hasanzadeh M., Hashemzadeh N., Shadjou N., Eivazi-Ziaei J., Knoubnasabjafari M., Jouyban A. Sensing of doxorubicin hydrochloride using graphene quantum dot modified glassy carbon electrode // J. Mol. Liq. 2016. V. 221. P. 354. https://doi.org/10.1016/j.molliq.2016.05.082
Ehsani M., Soleymani J., Hasanzadeh M., Vaez-Gharamaleki Y., Khoubnasabjafaru M., Jouyban A. Sensitive monitoring of doxorubicin in plasma of patients,MDA-MB-231 and 4T1 cell lysates using electroanalysis method // J. Pharm. Biomed. Anal. 2021. V. 192. P. 113701. https://doi.org/10.1016/j.jpba.2020.113701
Materon E.M., Wong A., Fatibello-Filho O., Faria R.C. Development of a simple electrochemical sensor for the simultaneous detection of anticancer drugs // J. Electroanal. Chem. 2018. V. 827. P. 64. https://doi.org/10.1016/j.jelechem.2018.09.010
Deepa S., Kumara Swamy B.E., Vasantakuma Pai K. A surfactant SDS modified carbon paste electrode as an enhanced and effective electrochemical sensor for the determination of doxorubicin and dacarbazine its applications: A voltammetric study // J. Electroanal. Chem. 2020. V. 879. P. 114748. https://doi.org/10.1016/j.jelechem.2020.114748
Kalambate P.K., Li Y., Shen Y., Huang Y. Mesoporous Pd⋅⋅⋅Pt core–shell nanoparticles supported on multi-walled carbon nanotubes as a sensing platform: Application in simultaneous electrochemical detection of anticancer drugs doxorubicin and dasatinib // Anal. Methods. 2019. V. 11. P. 443. https://doi.org/10.1039/C8AY02381F
Er E., Erk N. Construction of a sensitive electrochemical sensor based on 1T-MoS2 nanosheets decorated with shape-controlled gold nanostructures for the voltammetric determination of doxorubicin // Microchim. Acta. 2020. V. 187. P. 223. https://doi.org/10.1007/s00604-020-4206-y
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


