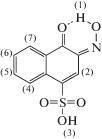
Журнал аналитической химии, 2022, T. 77, № 1, стр. 11-19
Производные нитрозонафтола как аналитические реагенты на ионы кобальта
Н. К. Мадусманова a, *, Л. М. Халилова b, Э. Ш. Жумаева b, Д. А. Гафурова b, З. А. Сманова b, **, Х. С. Тожимухамедов b
a Алмалыкский филиал Ташкентского технического университета имени Ислама Каримова
110111 Ташкентcкая обл., Алмалык, ул. Улугбека, Узбекистан
b Национальный университет Узбекистана имени Мирзо Улугбека, химический факультет
700174 Вузгородок, Ташкент, Узбекистан
* E-mail: nazira.imomova@mail.ru
** E-mail: Smanova.chem@mail.ru
Поступила в редакцию 22.05.2021
После доработки 28.06.2021
Принята к публикации 30.06.2021
- EDN: NTIQPN
- DOI: 10.31857/S0044450222010091
Аннотация
Синтезированы новые нитрозопроизводные β-нафтола. Изучено их строение методами ПМР- и ИК-спектроскопии. Показана возможность их использования для иммобилизации на волокнистых носителях и в качестве аналитических реагентов для определения ионов металлов, в частности кобальта(II). Предложена методика определения кобальта(II) в сточных водах.
Общеизвестно [1], что работа промышленных предприятий и транспорта приводит к интенсивному загрязнению окружающей среды. Производство продукции черной и цветной металлургии, добыча твердого и жидкого топлива, работа горно-обогатительных комплексов сопровождаются выбросами тяжелых токсичных металлов (ТТМ) и их соединений: Cr, Cu, Co, Ni, Zn, Pb, Mo, Hg и др. Основными источниками загрязнения атмосферы являются твердые топлива и газы теплоэнергетических предприятий, мусоросжигательные установки, токсичные выбросы черной и цветной металлургии и др. [2].
В настоящее время сжигается до 5 млрд тонн горючих ископаемых. Почти все металлы периодической системы можно найти в золе угля и нефти в концентрациях, экономически оправдывающих их извлечение. Одним из распространенных видов антропогенных загрязнителей является поступление в почву ТТМ [3, 4].
Современные требования, предъявляемые к анализу объектов окружающей среды, предусматривают разработку новых высокочувствительных и экспрессных методов определения токсичных металлов. Возможность быстрого и надежного определения низких содержаний тяжелых токсичных металлов имеет большое значение при анализе различных объектов окружающей среды. В последние годы активно разрабатываются методы с использованием простых приспособлений для быстрого обнаружения и оценки содержания веществ in situ [5].
Для определения кобальта, одного из загрязнителей окружающей среды, предложен целый ряд фотометрических [6–8] и тест-методов [9, 10], недостатками которых являются сложность синтеза или низкие чувствительность и селективность. Таким образом, разработка простых высокочувствительных методов аналитического контроля содержания кобальта в различных объектах по-прежнему актуальна.
Анализ литературы [11–15] показал, что применение в химическом анализе реагентов, иммобилизованных на поверхности различных носителей, является весьма перспективным. Так, реагенты на основе1-(2-пиридилазо)-2-нафтола, иммобилизованные на ткани с группами РО3Н2 [12], родамин 6Ж на оптическом волокне с полимерной мембраной [13] повышают чувствительность и избирательность методик. Снижение предела обнаружения достигается концентрированием определяемых металлов из относительно большого объема раствора в фазе сорбента. В отличие от экстракционного концентрирования, сорбционные методы не требуют использования органических растворителей, а поэтому безопасны для здоровья людей [16, 17]. Сорбенты нетоксичны и хорошо отделяются от раствора фильтрованием, что способствует повышению экспрессности анализа.
Цель данной работы – разработка cорбционно-спектроскопической методики определения кобальта, основанной на иммобилизации на волокнистый носитель синтезированных органических реагентов на основе производных нитрозонафтолов, оценка метрологических характеристик разработанной методики и ее применение в анализе природных объектов. В качестве матрицы для иммобилизации производных нитрозонафтолов использовали полиакрилонитрильное волокно, модифицированное гексаметилендиамином, гидроксиламином и этилендиамином (данные сорбенты синтезированы на кафедре химии полимеров НУУз), являющееся по сравнению с силикагелями и бумагами более прочным, однородным и химически стойким [18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы, реагенты, сорбенты. Стандартные растворы металлов готовили растворением металлов х. ч. в разбавленных (1 : 1) кислотах с последующим разбавлением дистиллированной водой [19].
Стандартный раствор кобальта готовили растворением 0.4037 г хлорида кобальта х. ч. Полученный раствор переносили в мерную колбу емк. 1 л и разбавляли бидистилированной водой до метки; 1 мл раствора содержал 0.1 мг Со2+.
Серию буферных растворов готовили из 1 М растворов уксусной кислоты, НСI, NaOH, NH3, ацетата натрия [20, 21].
Аппаратура. рН растворов измеряли рН-метром И-500 с точностью 0.01 ед. рН. ИК-спектры реагента, носителя и иммобилизованного органического реагента регистрировали на спектрометре Avatarsystem 360 FT-IR фирмы “Nikolet Justrument Corporation” (США), а также на приборе SPECORD UR-10. Электронные спектры поглощения исследуемых растворов реагентов и их комплексов с ионами металлов регистрировали на спектрофотометре СФ-46 в кювете толщиной 1.0 см. Для получения спектров диффузного отражения с твердой поверхности и изучения зависимости коэффициента отражения (R), функции коэффициента отражения F(R) от различных факторов использовали регистрирующий спектрофотоколориметр Пульсар, принцип действия которого основан на одновременном измерении коэффициента отражения или пропускания при 24 фиксированных длинах волн в видимой области спектра (380–720 нм) за одну вспышку импульсной лампы с последующей математической обработкой результатов измерений с помощью встроенной микроЭВМ. Предварительные исследования показали пригодность в качестве носителей сорбентов типа СМА-1 [22, 23]. При выборе реагента руководствовались требованиями, сформулированными в работе [24]. Однако в ряде случаев батохромный сдвиг полосы поглощения иммобилизованных реагентов по сравнению с реагентами в растворе не ухудшает контрастности их реакций с ионами металлов. Для иммобилизации и определения кобальта выбрали органические реагенты, которые, кроме прочих ценных химико-аналитических свойств, отличаются доступностью и простотой синтеза.
Методика проведения иммобилизации. Носители использовали в форме дисков диаметром 2 см и массой 50–100 мг. Полученные носители промывали 50 мл 0.1 М НCl, затем 10 мл ацетона, далее диски погружали на 4–10 мин в стаканы с 10 мл раствора органического реагента с концентрацией 1.0 × 10–5–1.0 × 10–2 М, промывали 50 мл дистиллированной водой и хранили во влажном состоянии в чашках Петри. Влияние рН, концентрации металла, буферной смеси и содержания реагента в твердой фазе изучали при скорости потока раствора 5 мл/мин. Концентрацию реагента на носителе определяли спектрофотометрически по изменению поглощения растворов при оптимальной для каждого реагента длине волны до и после иммобилизации.
Синтез 3-гидрокси-4-нитрозо-2-нафтойной кислоты осуществляли нитрозированием 1.88 г (0.01 М) 3-гидрокси-2-нафтойной кислоты в присутствии 4 г 0.1 М раствора NaOH добавлением 6.9 г 0.1 М раствора NaNO2, 65 мл 25%-ной H2SO4 и 150 мл дистиллированной воды при оптимизированных условиях, приведенных в табл. 1. После того как смесь становилась прозрачной, ее охлаждали до 0°С в смеси лед + NaCl + вода и при постоянном перемешивании добавляли 0.007 М раствор NaNO2. В слабощелочной среде в течение 1 ч добавляли 6.0 мл (ρ = 1.14 г/мл) 0.014 М H2SO4, после охлаждения полученную реакционную смесь отфильтровывали и промывали дистиллированной водой, высушивали в течение 16 ч под вакуумом. Выход продукта составил 1.73 г (82%). Полученное вещество желтого цвета и плавится при 181°С, а при более высокой температуре полностью разлагается, хорошо растворяется в спиртах и эфирах.
Таблица 1.
Физико-химические характеристики синтезированных реагентов
| Реагент | Состав (мол.) | Продолжитель-ность реакции, ч | Температура реакции, °С | Выход продукта, % |
|---|---|---|---|---|
| 3-Гидрокси-4-нитрозо-2-нафтойная кислота | ГНК : С5Н11NO2 : NaOH : NaNО2 : H2SO4 (1 : 1 : 2 : 2 : 5) |
4 | –3 | 82 |
| 4-Бром-2-нитрозо-1-нафтол | 2Г1НА : NaNO2 : H2SO4 : NaOH (1 : 2 : 2 : 1) |
2.5 | 0 | 62.4 |
| 4-Гидрокси-3-нитрозонафталин-1-сульфокислота | ГНК: NaOH: NaNO2 : H2SO4 (1 : 1 : 2 : 2.5) |
3 | –3 | 82 |
Индивидуальность вещества доказывали тонкослойной хроматографией на пластинке Silufol в системе этиловый спирт–ацетон (2 : 1), при этом Rf = 0.72.
Синтез 4-бром-2-нитрозо-1-нафтола (схема 1 ). 0.01 моль 4-бром-1-нафтола и раствор, содержащий 0.01 моль NaOH, при постоянном перемешивании нагревали при 30°С. После того как раствор становился прозрачным, его охлаждали до ‒2°С в смеси лед + NaCl + вода и при постоянном перемешивании в реакционную смесь добавляли 0.01 моль амилнитрита. В слaбощелочной среде к смеси добавляли 0.02 моль H2SO4 по каплям в течение 1 ч. После охлаждения образовавшийся осадок отфильтровали и высушивали в вакуумном эксикаторе. Выход продукта 1.3 г (65%). Полученный продукт коричневого цвета, плавящийся при 132°С. Синтезированный о-нитрозопродукт не растворяется в воде, хорошо растворяется в этиловом спирте, бензоле, ацетоне и эфирах.
Схема 1 . Синтез 4-бром-2-нитрозо-1-нафтола.
Методом тонкослойной хроматографии проверяли чистоту продукта в системе этиловый спирт–ацетон (2 : 1), при этом Rf = 0.67, что соответствует 4-бром-2-нитрозо-1-нафтолу.
Синтез 4-гидрокси-3-нитрозонафталин-1-сульфокислоты (схема 2 ). Для нитрозирования 0.01 моль 4-гидроксинафталин-1-сульфокислоты (кислота Невил-Винтера) смешивали с 0.1 моль раствора NaOH при нагревании; после того как раствор становился прозрачным, его охлаждали до 0°С в смеси лед + NaCl + вода и при постоянном перемешивании добавляли 0.01 моль NaNO2. В слaбощелочной среде к смеси добавляли 0.02 моль H2SO4 по каплям в течение 1 ч и наблюдали появление желтого осадка. Образовавшийся осадок охлаждали, отфильтровывали и высушивали в вакуумном эксикаторе. Выход продукта составил 2 г (80%). Полученное вещество золотистого цвета хорошо растворяется в воде и разлагается при температуре 218°С и выше.
Схема 2 . Синтез 4-гидрокси-3-нитрозонафталин-1-сульфокислоты.
Продукт таутомеризуется и может находиться в виде моноксима (схема 3 ):
Схема 3 . Таутомерное равновесие между формами 4‑гидрокси-3-нитрозонафталин-1-сульфокислоты.
Индивидуальность вещества доказывали тонкослойной хроматографией на пластинке Silufol в системе вода–ацетон (2 : 1). Полученное значение Rf = 0.68 соответствует 4-гидрокси-3-нитрозонафталин-1-сульфокислоте и нафтохинон монооксиму.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтезированы органические реагенты – производные нитрозонафтола: 3-гидрокси-4-нитрозо-2-нафтойная кислота, 4-бром-2-нитрозо-1-нафтол, 4-гидрокси-3-нитрозонафталин-1-сульфокислота внедрением в молекулу реагента атомов брома, сульфогруппы и др. [25]. При переходе от нитрозонафтола к соответствующим галогензамещенным, например 4-бром-2-нитрозо-1-нафтолу, реагенты становятся более специфичными, их избирательность улучшается, так как они приобретают способность взаимодействовать в более кислых средах с меньшим числом ионов.
Внедрение комплексообразующих и солеобразующих заместителей приводит к повышению дентатности реагента и за счет этого к улучшению его хромофорных свойств: введение хромофорных заместителей углубляет окраску комплексных соединений. Кроме того, основность и, возможно, конформация молекулы изменяются за счет изменения характера атома азота.
Синтезированные производные нитрозонафтола взаимодействуют с ионами некоторых металлов: Fe(II, III), Cu, Co, Ni. Высокие коэффициенты распределения при оптимизированных условиях сорбции позволяют проводить эффективное предварительное концентрирование и выделение следовых количеств определяемых элементов из нейтральной среды. В табл. 1 приведены основные физико-химические характеристики синтезированных реагентов при оптимизированных условиях.
Введение сульфогруппы в молекулу нитрозонафтола способствует повышению растворимости реагента в воде. Так, синтезированный реагент 4-гидрокси-3-нитрозонафталин-1-сульфокислота, в отличие от нитрозонафтола, хорошо растворяется в воде и образует с ионами кобальта(II) интенсивно окрашенный синий комплекс. Некоторые катионы с этим реагентом образуют нерастворимые соединения по аналогии с нерастворимыми сульфатами.
Повышение избирательности при введении в молекулу нитрозонафтола различных функциональных групп иногда связывают со стерическими факторами. При рН 4–5 нитрозонафтол дает реакцию со многими элементами, в том числе с ионами Cu, Zn и Al. Введение изопентильного радикала создает пространственные препятствия для размещения иона алюминия в хелатном кольце. В то же время медь и цинк, которые проявляют более сильное сродство к атому азота, реагируют с 2-нитрoзo-4-изoпентилнaфтoлом-1. Роль стерического фактора подтверждают свойства 2‑нитрoзo-4-изoпентилнaфтoла-1: этот реактив взаимодействует с металлами подобно незамещенному нитрозонафтолу, так как изoпентильный радикал в этом случае находится довольно далеко от гетероциклического атома азота [26].
Структура синтезированных реагентов доказана данными ИК- и ПМР-спектроскопии.
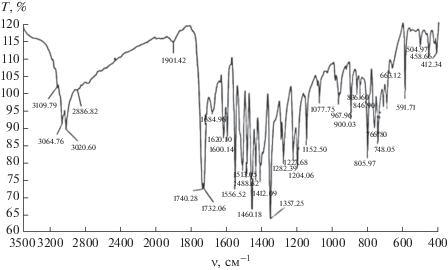
Анализ ИК-спектров 3-гидрокси-4- итрозо-2-нафтойной кислоты показал, что в области υС=O = = 3023.64–2886.82 см–1; υс=c = 1585.46–1644.83 cм–1; δN=O = 1464.84–1621.56 см–1; υС–N = 1070.65 cм–1 проявляются валентные колебания, характерные для групп С–О, ароматической С=С, N=O, интенсивная полоса C–N соответственно. Также имеются полосы поглощения, характерные для ароматических оксимов в области υоксим = 1644.83 см–1; а также для аренов в области υС–Н = 3003.64–3062 см–1.
В ПМР-спектре 3-гидрокси-4-нитрозо-2-нафтойной кислоты наблюдаются семь сигналов протонов 12.2 м. д. (1), 12.68 м. д. (2), 8.94 м. д. (3), 7.65 м. д. (4), 7.38 м. д. (5), 8.15 м. д. (6), 8.1 м. д (7), которые пронумерованы следующим образом:
В ИК-спекрах 4-бром-2-нитрозо-1-нафтола имеются полосы поглощения, характерные для валентных колебаний группы С=О υС=O = = 3823.64–2686.82 см–1, ароматической группы С=С υс=c = 1585.46–1644.83 cм–1, интенсивная полоса поглощения группы C–N при υС–N = = 1070.65 cм–1, полоса, обусловленная валентными колебаниями группы N=O при υN=O = = 1464.84–1621.56 см–1.
Колебания в области υСВr = 475–500 см–1 характерны для связи С–Br в аренах, валентные колебания ароматической оксимной группы проявляются при υоксим = 1644.83 см–1.
В ПМР-спектрах 4-бром-2-нитрозо-1-нафтола наблюдаются сигналы, характерные для ароматических ядер протонов, при 8.0, 5.46, 8.3, 7.65, 7.75, 8.5 м. д.
В ПМР-спектрах 4-гидрокси-3-нитрозонафталин-1-сульфокислоты имеются семь сигналов, характерных для ароматических ядер протонов: 1-й протон 12.3 м. д., 2-й протон 6.5 м. д., 3-й протон 2.0 м. д., 4-й протон 7.6 м. д., 5-й протон 7.7 м. д., 6-й протон 7.55 м. д., 7-й протон 7.4 м. д.:
В ИК-спектрах 4-гидрокси-3-нитрозонафталин-1-сульфокислоты имеются полосы поглощения, обусловленные валентными колебаниями группы С=О υС=O = 3040.41–3104.78 см–1 ; ароматической связи С=С υс=c = 1589.63–1624.96 cм–1; группы C–N υС–N = 1055.52–1123.75 cм–1; группы N=O δN=O = 1430.74–1624.96 см–1; ароматической оксимной группы υоксим = 1624.89 см–1; характерными колебаниями связи С–Н аренов υС–Н = = 3040.41–3420.66 см–1.
Улучшение избирательности достигается также иммобилизацией органических реагентов. Благодаря геометрическим особенностям закрепления на поверхности носителя в ряде случаев реагенты изменяют свои комплексообразующие свойства, в частности дентатность. Можно полагать, что сорбенты с иммобилизованными на них органическими реагентами наиболее эффективно извлекают ионы металлов, образующие с иммобилизованными реагентами ионные ассоциаты или комплексы с соотношением металл : реагент (1 : 1). В этом случае сводятся к минимуму стерические затруднения, обусловленные фиксацией реагента на поверхности сорбента.
Волокно СМА-1 получали действием сульфата гидроксиламина в присутствии гидразина на полиакрилонитрильное (ПАН) волокно. Полученный модифицированный полимер не растворяется в органических растворителях, растворяющих ПАН, что свидетельствует о достаточно хорошей сшивке гидразином [23]. Степень превращения оценивали определением СОЕ образцов по HCl: эта величина для СМА-1 достигает 3.5–5.5 мг-экв/г.
Установлено, что максимальный аналитический сигнал достигается при иммобилизации реагентов на сорбенте СМА-1 (рис. 1–3). Изучили влияние времени выдерживания и кислотности раствора на прочность связывания реагента на поверхности сорбента. Установлено, что максимальное закрепление (до 90%) реагента на носителе происходит при рН 5–7 в течение 7–10 мин. Исследовали различные модифицированные сорбенты на основе полиакрилонитрила; для дальнейших исследований выбрали систему полиакрилонитрильное волокно СМА-1 (модифицированное гексаметилендиамином)–органический реагент (табл. 2).
Рис. 1.
Спектры отражения сорбента СМА-1 (1) и иммобилизованных на него реагентов 4-бром-2-нитрозо-1-нафтола (2), 3-гидрокси-4-нитрозо-2-нафтойной кислоты (3), 4-гидрокси-3-нитрозонафталин-1-сульфокислоты (4).

Рис. 2.
Спектры отражения сорбента СМА-1 (1), иммобилизованной 3-гидрокси-4-нитрозо-2-нафтойной кислоты (2) и ее комплекса с кобальтом (3).

Рис. 3.
Спектры поглощения 3-гидрокси-4-нитрозо-2-нафтойной кислоты до (1) и после (2) иммобилизации на носителе СМА-1 при рН 4–6; масса сорбента 50 мг.

Таблица 2.
Выбор сорбента для иммобилизации органического реагента
| Сорбент | ΔR1 | ΔR2 | ΔRср |
|---|---|---|---|
| СМА-2 | 0.31 | 0.30 | 0.31 |
| ТМ (АН-1) | 0.35 | 0.34 | 0.34 |
| ПАН КДМ | 0.30 | 0.30 | 0.30 |
| МХ-1 | 0.39 | 0.39 | 0.39 |
| КУ-28 | 0.25 | 0.23 | 0.26 |
| Нитрон | 0.11 | 0.10 | 0.12 |
| СМА-1 | 0.41 | 0.41 | 0.41 |
При сравнении ИК-спектров исследованных органических реагентов, индивидуальных и иммобилизованных на поверхности сорбента, найден ряд характерных полос, соответствующих их функционально-аналитическим группам ФАГ. В спектрах органических реагентов проявляются полосы поглощения в областях 3200–3500 см–1, 1500–1630 см–1, 1200–1300 см–1 и 800–1030 см–1, относящиеся к валентным и деформационным колебаниям групп –ОН, =NС, –N=О и –СООН [27].
Полосы поглощения в области 3200–3500 см–1 свидетельствуют об образовании межмолекулярных водородных связей (табл. 3). При комплексообразовании иона металла с реагентом смещение полос поглощения происходит в области 1580–1600, 3200 и 1226 см–1 (∆ν = 14–30 см–1) и появляется новая полоса поглощения в области 600–800 см–1, характерная для связи –О–Ме (рис. 4–6).
Влияние ионной силы раствора на сорбцию кобальта(II) изучали в среде хлорида натрия. Установили, что NaCl вплоть до концентрации 0.1 М не влияет на коэффициент сорбции ионов кобальта(II), увеличение концентрации соли до 0.5 М приводит к уменьшению коэффициента распределения.
Как видно из представленных формул реагентов, две функционально-аналитические группы могут быть вовлечены в комплексообразование с одним ионом металла. Металлокомплексы образуются за счет гидрокси- и нитрозогрупп органических реагентов, т.е. образуют комплексы n → π* типа, отличающиеся высокой стабильностью. Умеренная стабильность комплексов ионов металлов с иммобилизованными органическими реагентами способствует лучшему извлечению ионов металлов [28]. Предварительные эксперименты показали, что сорбированные ионы кобальта количественно извлекаются из исследуемых растворов. Комплексы кобальта устойчивы во времени и их спектрофотометрические характеристики приведены в табл. 4.
Таблица 3.
Характеристические частоты (см–1) и их отнесение в ИК-спектрах 4-гидрокси-3-нитрозонафталин-1-сульфокислоты и ее комплекса с кобальтом(II)
| Соединение | ν–СOОH | ν–N=О | ν–ОH | N–СN | ν–О–Со |
|---|---|---|---|---|---|
| Реагент | 1200 | 1628 | 3450 | 2244 | – |
| Иммобилизованный реагент | 1172 | 1629 | 3448 | 2244 | – |
| Комплекс | 1171 | 1600 | 3441 | 2204 | 598 |
Таблица 4.
Спектрофотометрические характеристики реагентов и их комплексов с ионом кобальта(II)
| Реагент | λR, нм | λMeR, нм | Ме : R | pH | Время иммобили-зации, мин |
Концентрация реагента на носителе, М |
|---|---|---|---|---|---|---|
| 3-Гидрокси-4- нитрозо-2-нафтойная кислота | 440 | 540 | 1 : 1 | 2.5–4.5 | 8 | 1.02 × 10–4 |
| 4-Гидрокси-3-нитрозонафталин-1-сульфокислота | 440 | 600 | 1 : 1 | 4.0–5.0 | 8 | 1.46 × 10-4 |
Для установления возможности сорбционно-спектроскопического определения кобальта в реальных объектах готовили модельные смеси, имитирующие различные по составу воды (табл. 5). Как видно из данных табл. 5, cорбционно-спектроскопическое определение кобальта с использованием иммобилизованной 3-гидрокси-4-нитрозо-2-нафтойной кислоты в модельных смесях возможно, относительное стандартное отклонение (sr) не превышает 0.10, что свидетельствует о хорошей воспроизводимости разработанных методик.
Таблица 5.
Результаты сорбционно-спектроскопического определения кобальта(II) с 3-гидрокси-4-нитрозо-2-нафтойной кислотой, иммобилизованной на СМА-1 в модельных смесях (n = 5, Р = 0.95, λ = 540 нм, рН 3.5, 30 ± 5°C)
| Состав анализируемой смеси, мкг | Найдено, $\bar {x}$ ± Δx, мкг |
s | sr |
|---|---|---|---|
| Cо (5.0) + Ni (2.0) + Zn (15.0) | 4.94 ± 0.12 | 0.08 | 0.02 |
| Cо (5.0) + Cu (5.0) + Fe (15.0) + Ni (10.0) | 4.90 ± 0.18 | 0.46 | 0.09 |
| Cо (2.0) + Cu (1.0) + Fe (13.0) + Ni (10.0) | 1.84 ± 0.32 | 0.48 | 0.26 |
На основе полученных данных разработали методику определения кобальта с помощью иммобилизованной 3-гидрокси-4-нитрозо-2-нафтойной кислоты в сточных водах и сравнили результаты, полученные по предложенной и фотометрической методикам (табл. 6).
Таблица 6.
Результаты (мкг/мл) определения кобальта(II) в сточных водах сoрбциoнно-cпектрoскопическим и фoтoметрическим методами (n = 5, Р = 0.95, λ = 540 нм, рН 3.5, 30 ± 5°C)
| Oбъект анaлиза | Введено | Найдено | |||
|---|---|---|---|---|---|
| сoрбциoнная cпектрoскопия | sr | фoтoметрия | sr | ||
| Сточная вода пос. Ангрен | 0.75 | 0.74 ± 0.005 | 0.06 | 0.8 ± 0.01 | 0.08 |
| Сточная вода г. Алмалык | 0.50 | 0.58 ± 0.004 | 0.10 | 0.6 ± 0.01 | 0.12 |
* * *
Таким образом, высокая избирательность синтезированных реагентов по отношению к иону кобальта, простота и скорость концентрирования в сочетании с инструментальным определением без десорбции металла прямо на поверхности твердого волокнистого сорбента обусловливают экспрессность анализа и возможность использования предложенной методики в практике химического анализа при определении ионов кобальта в водах.
Список литературы
Шачнева Е.Ю. Воздействие тяжелых токсичных металлов на окружающую среду // Научный потенциал регионов на службу модернизации. 2012. № 2. Т. 3. С. 127.
Медведев И.Ф., Деревягин С.С. Тяжелые металлы в экосистемах. Саратов: Ракурс, 2017. 178 с.
Теплая Г.А. Тяжелые металлы как фактор загрязнения окружающей среды // Астраханский вестник экологического образования. 2013. № 1. Т. 23. С. 182.
Женихов Н.А., Дианова Д.Г. Металлы в окружающей среде и их влияние на здоровье человека // Актуальные проблемы гуманитарных и естественных наук. 2017. № 1. Т.4. С. 72.
Hana R. Pohl, Nickolette Roney, Henry G. Abadin Metal ions affecting the neurological system // Metal Ions Life Sci. 2011. T. 8. P. 247.
Поляков Е.В., Егоров Ю.В. Современные методы определения физико-химического состояния микроэлементов в природных водах // Успехи химии. 2003. № 11. С. 1103.
Коренман И.М. Органические реагенты в неорганическом анализе. М.: Химия, 1980. 448 с.
Починок Т.Б., Темердашев З.А. Молекулярная абсорбционная спектроскопия. Краснодар: КубГУ, 2016. 157 с.
Другов Ю.С., Муравьев А.Г., Родин А.А. Экспресс-анализ экологических проб. Практическое руководство. М.: БИНОМ. Лаборатория знаний, 2010. С. 111.
Качин С.В. Твердофазная колориметрия. Красноярск: Краснояр. гос. ун-т, 1988. 103 с.
Didukh S., Losev V., Mukhin A., Trofimchuk A., Nes-te-renko P. Determination of cobalt in soils and natural waters using silica gel modified with polyhexamethylene guanidine and nitroso-n-salt. // J. Chem. Edu. Res. Prac. 2018. V. 2. № 1. P. 1.
Власова Ю.Г. Химические сенсоры. М.: Наука, 2011. 398 с.
Саввин С.Б., Дедкова В.П., Швоева О. П. Сорбционно-спектроскопические и тест-методы определения ионов металлов на твердой фазе ионообменных материалов // Успехи химии. 2000. № 3. Т. 69. С. 203.
Дидух-Шадрина С.Л., Лосев В.Н., Мазняк Н.В., Трофимчук А.К. Применение кремнезема с иммобилизованной 2-нитрозо-1-нафтол-4-сульфокислотой для сорбционно-фотометрического определения палладия // Журн. аналит. химии. 2019. № 7. Т. 74. С. 574.
Гавриленко Н.А., Саранчина Н.В. Аналитические свойства 1-(2-пиридилазо)-2-нафтола, иммобилизованного в полиметакрилатную матрицу // Журн. аналит. химии. 2009. № 3. Т. 64. С. 243.
Мадусманова Н.К., Сманова З.А., Жураев И.И. Свойства нового аналитического реагента 2-гидрокси-3-нитрозонафталдегида // Журн. аналит. химии. 2020. № 75. Т. 1. С. 92. (Madusmanova N.K., Smanova Z.A., Zhuraev I.I. Properties of the new analytical reagent 2-hydroxy-3-nitrosonaphthaldehyde // J. Anal. Chem. 2020. № 75. V. 1. Р. 135.)
Гафурова Д.А., Хакимжанова Д.А., Мухамадиев М.Г., Мусаев У.Н. Сорбция Cr(VI) на анионообменном волокнистом материале на основе нитрона // Журн. прикл. химии. 2002. № 1. Т. 75. С. 71. (Gafurova D.A., Khakimzhanov B.Sh., Mukhamediev M.G., Musaev U.N. Sorption of Cr(VI) on the anion-exchange fibrous material based on nitron // Russ. J. Appl. Chem. 2002. V. 75. № 1. Р. 71.)
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия. 1979. 480 с.
Коростылев П.П. Приготовление растворов для химико-аналитических работ. М.: Наука, 1981. 202 с.
Вайсберг М., Проскауэр Э., Ридберг Дж., Тупс 3. Органические растворители. М.: Иностр. лит. 1958. С. 120.
Волков А.И., Жарский И.М. Справочник по аналитической химии. М.: Букмастер, 2015. 320 с.
Гафурова Д.А., Шахидова Д.Н., Мухамедиев М.Г., Мухамедов Г.И. Механизм каталитического влияния гидроксиламина на реакцию полиакрилонитрила с азотсодержащими основаниями // Журн. физ. химии. 2014. № 11. Т. 88. С. 1851.
Гафурова Д.А., Шахидова Д.Н., Мухамедиев М.Г. Физико-химические особенности взаимодействия нитрона c гидразином // Пластические массы. 2013. № 9. С. 47.
Reddy K.V., Reddy D.N., Reddy K.H. Derivative spectrophotometric determination of cobalt(II) and nickel(II) using 2-cetylpyridine-4-methyl-3-thiosemicarbazone (APMT) // J. Chem. Res. 2011. V. 3. P. 835.
Нурмухаммадов З.Ш., Сманова З.А., Тожимухамедов Х.С., Инатова М.С. Синтез и свойства нового аналитического реагента, 2-гидрокси-3-нитрозонафталин-1-карбальдегида // Журн. орг. химии 2014. Т. 50. № 6. С. 918. (Nurmukhammadov Z.Sh., Smanova Z.A., Tadzhimukhamedov Kh.S., Inatova M.S. Synthesis and properties of a new analytical reagent, 2-hydroxy-3-nitrosonaphthalene-1-carbaldehyde // Russ. J. Org. Chem. 2014. V. 50. № 6. Р. 918.)
Саввин С.Б., Кузнецов В.В., Шереметьев С.В., Михайлова А.В. Оптические химические сенсоры (микро-и нано системы) для анализа жидкостей // Рос. хим. журн. 2008. Т. 52. № 2. С. 7.
Беллами Л. Новые данные по ИК-спектрам сложных молекул. М.: Мир, 1971. 318 с.
Казицина Л.А., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР-спектроскопии в органической химии. М.: Книга по требованию, 2012. 262 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии