Журнал аналитической химии, 2022, T. 77, № 10, стр. 911-922
Перспективы использования аналитических систем на основе треугольных нанопластинок серебра для спектрофотометрического определения восстановителей
А. А. Фурлетов a, *, В. В. Апяри a, А. В. Гаршев a, b, С. Г. Дмитриенко a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, ГСП-1, Россия
b Московский государственный университет имени М.В. Ломоносова, факультет наук о материалах
119991 Москва, Ленинские горы, 1, стр. 73, ГСП-1, Россия
* E-mail: aleksei_furletov@mail.ru
Поступила в редакцию 29.01.2022
После доработки 21.02.2022
Принята к публикации 22.02.2022
- EDN: GFBSMK
- DOI: 10.31857/S004445022210005X
Аннотация
Изучены возможности использования аналитических систем на основе треугольных нанопластинок серебра для спектрофотометрического определения восстановителей. Установлено, что взаимодействие треугольных нанопластинок серебра с L-аскорбиновой кислотой в присутствии нитрата серебра(I) сопровождается батохромным смещением и увеличением интенсивности полосы поверхностного плазмонного резонанса наночастиц, что может быть положено в основу способов определения восстановителей. Предполагаемый механизм взаимодействия включает восстановление ионов Ag+ до металлического серебра под действием определяемого соединения и его осаждение на поверхности наночастиц-затравок. Изучено влияние рН, времени взаимодействия, концентрации реагентов и посторонних соединений на величину аналитического сигнала. Предел обнаружения L-аскорбиновой кислоты в выбранных условиях равен 0.5 мг/л, диапазон определяемых содержаний составляет 1.7–60 мг/л. Предложенный в работе подход применен для определения L-аскорбиновой кислоты в листовом зеленом чае и яблочном соке.
Благодаря удачному сочетанию необычных физических, химических и биологических свойств наночастицы серебра в последние годы находят все более широкое применение во многих областях науки и техники. В химическом анализе их используют для усиления аналитического сигнала в спектроскопии комбинационного рассеяния и флуоресцентной спектроскопии, для придания каталитических и бактерицидных свойств материалам, а также при разработке различного рода сенсоров, важное место среди которых занимают оптические сенсоры [1–6]. Наиболее распространенным принципом действия таких сенсоров является агрегация наночастиц в коллоидном растворе под действием определяемых соединений [7].
Основная часть научных работ посвящена исследованию и применению в химическом анализе изотропных (сферических или псевдосферических) наночастиц серебра и материалов на их основе [8–17]. Значительно меньшее число работ посвящено синтезу и изучению свойств анизотропных наночастиц серебра, в частности треугольных нанопластинок (ТНП) [18–26]. Между тем особенности их физических и химических свойств, обусловленные явлением локализованного поверхностного плазмонного резонанса (ППР), могли бы сыграть решающую роль в разработке принципиально новых способов определения соединений.
Одна из актуальных задач аналитической химии, где эффективно мог бы реализоваться потенциал ТНП серебра как аналитических реагентов, – это определение восстановителей, среди которых важное место занимает L-аскорбиновая кислота. Она является маркером антиоксидантной активности, кофактором многих ферментов [27] и веществом-предшественником биосинтеза некоторых важных метаболитов [28–30]. Организм человека полностью зависит от L-аскорбиновой кислоты, поступающей вместе с пищей, так как не может синтезировать ее самостоятельно. Поиск недорогих, экспрессных и чувствительных способов определения L-аскорбиновой кислоты в продуктах питания, а также оценка их антиоксидантной активности являются актуальными задачами аналитической химии.
Цель настоящей работы заключалась в оценке перспектив использования аналитических систем на основе треугольных нанопластинок серебра, стабилизированных цитратом натрия и поли(N-винил-2-пирролидоном), для спектрофотометрического определения восстановителей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты, материалы, оборудование. Использовали следующие вещества: азотную кислоту х. ч., 68%-ный водный раствор (ОАО “НАК “Азот”, Россия), L-аскорбиновую кислоту (≥98.0%, Sigma-Aldrich, США), борогидрид натрия (99%, Acros Organics, Бельгия), гидроксид натрия ч. (ООО “АО Реахим”, Россия), нитрат серебра ч. д. а. (ООО “ПЗЦМ-Втормет”, Россия), пероксид водорода 30%-ный водный раствор с добавкой стабилизатора, ACS (Sigma-Aldrich, США), поливинилпирролидон, Mw = 58000 г/моль (99%, Acros Organics, Бельгия), соляную кислоту х. ч., 36%-ный водный раствор (ООО “АО Реахим”, Россия), цитрат натрия (≥99.5%, Sigma, США), ледяную уксусную кислоту х. ч. (ООО “ИРЕА 2000”, Россия). Рабочие растворы веществ готовили растворением их точных навесок или аликвот в деионизованной воде при комнатной температуре. Отдельные эксперименты проводили в ацетатном буферном растворе, который получали in situ добавлением к реакционной смеси 0.1 М CH3COОH и 0.1 М раствора NaOH в различных соотношениях.
Сыпучие твердые вещества взвешивали на аналитических весах “Adventurer” (OHAUS, США). Для отбора аликвот жидких веществ использовали автоматические одноканальные пипет-дозаторы переменного объема “Discovery Comfort” (HTL, Польша). Спектры поглощения и оптическую плотность растворов в диапазоне длин волн 400–1100 нм измеряли в стандартных кварцевых кюветах с длиной оптического пути 1 см на спектрофотометре СФ-103 (Аквилон, Россия). Перемешивание растворов осуществляли с помощью магнитной мешалки “Экрос ПЭ-6100” (Экрос, Россия). Величину pH контролировали с помощью pH-метр-иономера “Эксперт-001” (Эконикс-Эксперт, Россия). Деионизованную воду получали с использованием системы очистки “Simplicity” (Millipore, США).
Электронно-микроскопические исследования проводили с использованием просвечивающего электронного микроскопа с катодом с термополевой эмиссией “Libra 200” (Carl Zeiss, Германия) при ускоряющем напряжении 200 кВ. Информационный предел при регистрации изображений в режиме светлопольной просвечивающей микроскопии был лучше 0.1 нм. Для проведения анализа образцы в виде суспензии наносили на поддерживающую сеточку из меди с пленкой из формвара и нанесенного на него слоя углерода “Formvar®/Carbon Reinforced Copper Grids 3440C-MB” (SPI, США). Перед установкой в микроскоп образцы сушили сначала на воздухе в течение 20–30 мин и затем в вакууме с использованием системы “Turbo Pumping Station Model 655” (Gatan, США) в течение 10–12 ч.
Синтез треугольных нанопластинок серебра. Для получения ТНП серебра использовали методику [31], предложенную в 2005 году научной группой Миркина, с незначительными изменениями.
Всю химическую посуду, которую использовали при проведении эксперимента, предварительно мыли свежеприготовленной “царской водкой”, тщательно промывали дистиллированной водой и затем сушили на воздухе. Для приготовления всех растворов в эксперименте использовали деионизованную воду.
К 0.50 мл водного 0.01 М раствора AgNO3 приливали 4.30 мл деионизованной воды, а затем при интенсивном перемешивании добавляли 2.30 мл 1%-ного раствора цитрата натрия (C6H5O7Na3), 0.60 мл раствора поли(N-винил-2-пирролидона) с концентрацией 20.3 г/л и 1.20 мл 3%-ного H2O2. К полученному раствору быстро добавляли 1.00 мл свежеприготовленного 35 мМ раствора NaBH4. В процессе выдерживания системы в течение 30 мин наблюдали изменение окраски раствора с желтой на синюю, свидетельствующее о формировании ТНП серебра. Полученный раствор ТНП серебра хранили при комнатной температуре. Конечная концентрация ТНП серебра в растворе после синтеза составляла 56 мг/л (0.52 мМ в расчете на атомарное серебро).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие треугольных нанопластинок серебра с L-аскорбиновой кислотой в присутствии нитрата серебра(I). Известно [32], что оптические свойства наночастиц серебра сильно изменяются при покрытии их поверхности другими металлами. Мы предположили, что данное свойство можно использовать для определения восстановителей, которые способны восстанавливать серебро из его солей на поверхности наночастиц. В данной работе такая возможность изучена на примере L-аскорбиновой кислоты, которую добавляли к раствору ТНП серебра, после чего в реакционную смесь по каплям вносили раствор AgNO3 (рис. 1).
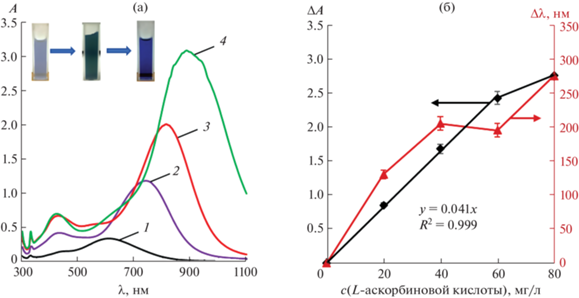
Для изучения зависимости спектральных характеристик растворов ТНП серебра от концентрации L-аскорбиновой кислоты в полипропиленовые пробирки последовательно вводили ТНП серебра, растворы L-аскорбиновой кислоты и A-gNO3. Объем раствора доводили до 10.0 мл с помощью дистиллированной воды. Установлено, что после завершения восстановления Ag+ L-аскорбиновой кислотой происходит батохромный сдвиг полосы поглощения ТНП серебра, а также значительно увеличивается ее интенсивность (рис. 2а).
Рис. 2.
(а): Спектры поглощения треугольных нанопластинок серебра до (1) и после (2–4) взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при различных концентрациях определяемого соединения. с(L‑аскорбиновой к-ты), мг/л: 0 (1), 20 (2), 40 (3), 80 (4); с(ТНП) = 0.04 мМ Ag, c(AgNO3) = 0.225 мМ, pH 6, t = 5 мин. (б): Зависимости ΔA = f(c(L-аскорбиновой к-ты), мг/л) и Δλ (нм) = f(c(L-аскорбиновой к-ты), мг/л). с(ТНП) = 0.04 мМ Ag, c(AgNO3) = 0.225 мМ, pH 6, t = 5 мин.
Предполагаемый механизм взаимодействия ТНП серебра с восстановителями в присутствии нитрата серебра(I) состоит из двух стадий, реализующихся последовательно. На первой стадии происходит восстановление ионов Ag+ до металлического серебра Ag0 под действием L-аскорбиновой кислоты и его осаждение на поверхности присутствующих в растворе ТНП-затравок, что приводит к их укрупнению. На второй стадии происходит образование агрегатов ТНП, что подтверждено просвечивающей электронной микроскопией высокого разрешения в светлом поле (рис. 3). Показано, при проведении реакции в щелочной среде в качестве продукта преимущественно образуются сферические наночастицы серебра, в то время как в нейтральной среде происходит образование треугольных нанопластинок. На микрофотографиях наночастиц после взаимодействия присутствует некоторое количество агрегатов, что может являться причиной батохромного смещения полосы поглощения наночастиц.
Рис. 3.
Микрофотографии треугольных нанопластинок серебра, полученные методом просвечивающей электронной микроскопии в светлом поле, до (а) и после взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при pH 11.0 (б), 7.5 (в), 6.0 (г).

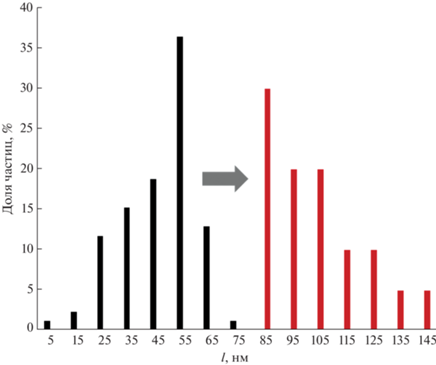
На основании анализа микрофотографий более 100 наночастиц построена гистограмма их распределения по размерам до и после взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) (рис. 4). Как видно, в результате взаимодействия средняя длина ребра ТНП серебра возрастает примерно в два раза, что косвенно подтверждает сделанное ранее предположение о том, что серебро осаждается на поверхности наночастиц-затравок.
Рис. 4.
Гистограмма распределения треугольных нанопластинок серебра по средней длине ребра до (столбцы темного цвета) и после (столбцы светлого цвета) взаимодействия наночастиц с L-аскорбиновой кислотой в присутствии нитрата серебра(I). с(L-аскорбиновой к-ты) = 80 мг/л; с(ТНП) = 0.04 мМ Ag, c(AgNO3) = 0.15 мМ, pH 6, t = 5 мин.
Для выбора аналитического сигнала рассматривали зависимости ΔA = f(c(L-аскорбиновой кислоты), мг/л) и Δλ (нм) = f(c(L-аскорбиновой кислоты), мг/л), где ΔA – разница оптических плотностей в максимуме, Δλ – разница длин волн, при которых наблюдается максимум (рис. 2б). Так как первая зависимость оказалась наиболее близкой к линейной, было решено использовать ΔA в качестве аналитического сигнала для спектрофотометрического определения L-аскорбиновой кислоты.
С целью улучшения аналитических характеристик спектрофотометрического способа определения L-аскорбиновой кислоты исследовали влияние концентрации ТНП серебра, pH раствора, времени взаимодействия и концентрации AgNO3 на величину аналитического сигнала.
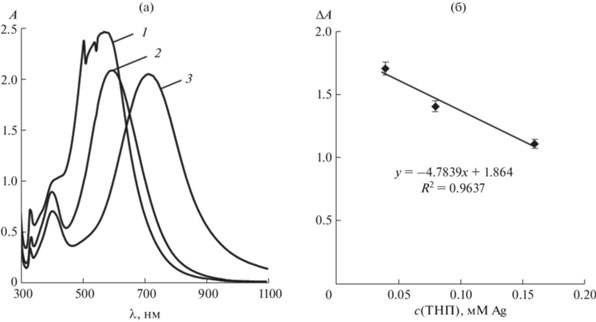
Влияние концентрации треугольных нанопластинок серебра. Для изучения зависимости аналитического сигнала от концентрации наночастиц в полипропиленовые пробирки вводили различные количества ТНП серебра, 1 мл L-аскорбиновой кислоты с концентрацией 1 г/л и 0.15 мл 0.01 М раствора AgNO3. Объем раствора доводили до 10.0 мл дистиллированной водой. Спектры поглощения наночастиц регистрировали через 5 мин после добавления последнего реагента (рис. 5а). Как видно, при концентрации ТНП серебра, равной 0.16 мМ Ag, полоса поглощения имеет нечеткий максимум, что может затруднять измерение аналитического сигнала. Кривые, соответствующие концентрациям 0.04 мМ Ag и 0.08 мМ Ag, имеют четкий пик и почти идентичны по форме и высоте. Наибольший сдвиг полосы ППР наблюдается при концентрации ТНП 0.04 мМ Ag. На рис. 5б приведена зависимость изменения оптической плотности в максимуме полосы ППР от концентрации ТНП, из которой видно, что наибольшее увеличение оптической плотности также наблюдается при концентрации ТНП 0.04 мМ в пересчете на атомарное серебро.
Рис. 5.
(а): Спектры поглощения треугольных нанопластинок серебра после взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при различных концентрациях наночастиц. c(ТНП), мМ Ag: 0.16 (1), 0.08 (2), 0.04 (3); c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = 0.15 мМ, pH 6, t = 5 мин. (б): Зависимость аналитического сигнала (ΔA) от концентрации треугольных нанопластинок серебра. c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = = 0.15 мМ, pH 6, t = 5 мин.
Влияние pH. Для изучения влияния pH раствора на величину аналитического сигнала в пробирки вводили 0.78 мл 0.52 мМ раствора ТНП серебра, 1.00 мл раствора L-аскорбиновой кислоты с концентрацией 1 г/л и 0.15 мл 0.01 М раствора AgNO3. Объем раствора доводили до 10.0 мл с помощью 0.1 М CH3COОH и 0.1 М раствора NaOH, которые добавлялись в различных соотношениях. Спектры поглощения наночастиц после взаимодействия с L-аскорбиновой кислотой представлены на рис. 6а. Видно, что в щелочной среде не только отсутствует батохромный сдвиг полосы локализованного поверхностного плазмонного резонанса ТНП серебра, но, наоборот, наблюдается гипсохромный сдвиг в область 400–410 нм, а интенсивность полосы в этих условиях возрастает незначительно. Кроме полосы поглощения в области 400–410 нм, в спектрах поглощения имеется плечо в характерной для ТНП области 600–620 нм, что говорит о том, что они остаются неизменными в рассматриваемом процессе. Эти результаты, по-видимому, свидетельствуют о том, что в данных условиях не происходит покрытия ТНП слоем серебра, а преимущественно формируются сферические наночастицы серебра в растворе. Данный результат становится понятным с учетом того, что в щелочной среде L-аскорбиновая кислота переходит в отрицательно заряженный аскорбат-ион, который не может эффективно сорбироваться отрицательно заряженными ТНП серебра. Вместо этого происходит гетерогенная нуклеация сферических наночастиц серебра в объеме раствора. Этому процессу способствует также увеличение восстановительной способности L-аскорбиновой кислоты в щелочной среде.
Рис. 6.
(а): Спектры поглощения треугольных нанопластинок серебра до (1) и после (2–6) взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при различных значениях pH. pH: 6.5 (1), 4.5 (2), 6.7 (3), 11.7 (4), 12.4 (5), 12.6 (6); с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = 0.15 мМ, t = 5 мин. (б): Зависимость аналитического сигнала (ΔA) от pH. с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = = 0.15 мМ, t = 5 мин.
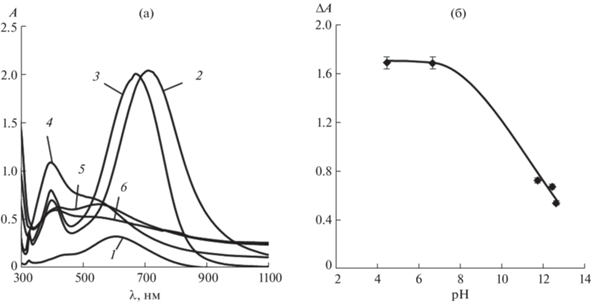
Наибольшая разность оптических плотностей по сравнению с контрольным опытом (pH 6.5) наблюдается для растворов с pH 4.5 и pH 6.7 (рис. 6б). При этом значение pH 6.7 близко к условиям контрольного опыта, в котором буферный раствор не используется, поэтому можно сделать вывод о том, что его добавление не оказывает значительного влияния на величину ΔA.
Влияние времени взаимодействия. Для изучения влияния времени взаимодействия веществ на величину аналитического сигнала в пробирки вводили 0.78 мл 0.52 мМ раствора ТНП серебра, 1.00 мл раствора L-аскорбиновой кислоты с концентрацией 1 г/л, 0.15 мл 0.01 М раствора AgNO3. Объем раствора доводили до 10.0 мл дистиллированной водой. По истечении 0, 2.5, 5, 7.5, 10, 15 и 20 мин после добавления нитрата серебра(I) регистрировали спектры поглощения водных растворов наночастиц (рис. 7а). Можно видеть, что с течением времени наблюдается постепенное смещение полосы локализованного ППР в область бóльших длин волн и увеличение ее интенсивности.
Рис. 7.
(а): Спектры поглощения треугольных нанопластинок серебра до (1) и после (2, 3) взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при различном времени взаимодействия. t, мин: 0 (1), 2.5 (2), 5–20 (3); с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = 0.15 мМ, pH 6. (б): Зависимость аналитического сигнала (ΔA) от времени взаимодействия. с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к-ты) = 70 мг/л, c(AgNO3) = 0.15 мМ, pH 6.
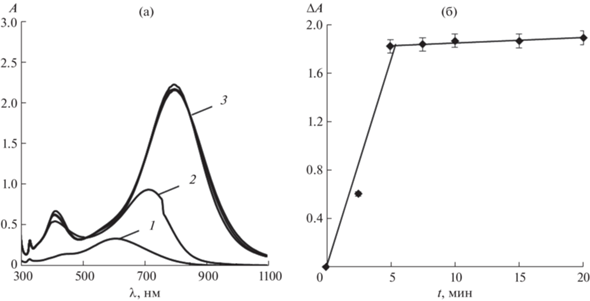
Зависимость аналитического сигнала от времени взаимодействия представлена на рис. 7б. По пересечению условно линейных участков графика видно, что для раствора с концентрацией L-аскорбиновой кислоты 100 мг/л достаточно 5 мин для завершения восстановления ионов Ag+, поэтому это время выбрали для выдерживания растворов до регистрации спектров. Однако стоит отметить, что при значительном понижении концентрации определяемого соединения для взаимодействия ТНП серебра и L-аскорбиновой кислоты требуется больше времени, причем окончание реакции можно фиксировать визуально: по прошествии достаточного количества времени окраска раствора перестает изменяться.
Влияние концентрации нитрата серебра(I). Для изучения влияния концентрации нитрата серебра(I) на величину аналитического сигнала в полипропиленовые пробирки последовательно вводили 0.78 мл 0.52 мМ раствора ТНП серебра, 1.00 мл раствора L-аскорбиновой кислоты с концентрацией 1 г/л и различные количества 0.01 М раствора нитрата серебра(I). Объем раствора доводили до 10.0 мл дистиллированной водой. Из зависимости аналитического сигнала от концентрации AgNO3, представленной на рис. 8б, видно, что максимальное изменение оптической плотности растворов наночастиц, содержащих добавку L‑аскорбиновой кислоты, достигается при концентрации AgNO3 0.30 мМ. Тем не менее при сравнении спектров поглощения соответствующих водных растворов (рис. 8а) видно, что при данной концентрации нитрата серебра(I) максимум полосы поглощения треугольных нанопластинок серебра является размытым. По сравнению с ним, максимум полосы поверхностного плазмонного резонанса наночастиц, соответствующий введенной добавке 0.225 мМ AgNO3, имеет четкий максимум; при этой концентрации нитрата серебра достигается также достаточно большая величина аналитического сигнала. Для дальнейших экспериментов и построения градуировочной зависимости выбрали концентрацию нитрата серебра(I), равную 0.225 мМ.
Рис. 8.
(а): Спектры поглощения треугольных нанопластинок серебра до (1) и после (2–5) взаимодействия с L-аскорбиновой кислотой в присутствии нитрата серебра(I) при его различных концентрациях. c(AgNO3), мМ: 0 (1), 0.075 (2), 0.150 (3), 0.225 (4), 0.300 (5); с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к-ты) = 70 мг/л, pH 6, t = 5 мин. (б): Зависимость аналитического сигнала (ΔA) от концентрации нитрата серебра(I). с(ТНП) = 0.04 мМ Ag, c(L-аскорбиновой к‑ты) = = 70 мг/л, pH 6, t = 5 мин.
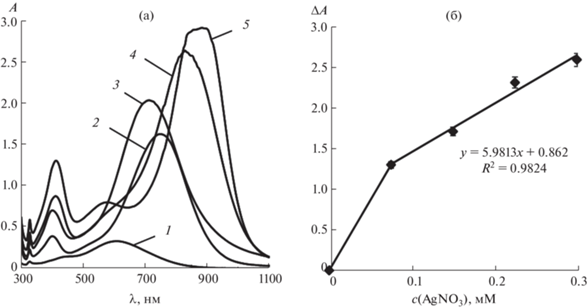
Оценка аналитических характеристик способа. Выбранные условия взаимодействия аскорбиновой кислоты с нитратом серебра в присутствии ТНП положены в основу способа ее спектрофотометрического определения. Для построения градуировочных зависимостей в полипропиленовые пробирки вводили 0.78 мл раствора ТНП серебра с концентрацией 0.52 мМ (в пересчете на атомарное серебро), различные количества раствора L-аскорбиновой кислоты с концентрацией 1 г/л и 0.225 мл 0.01 М водного раствора AgNO3. Объем раствора доводили до 10.0 мл дистиллированной водой. Спектры поглощения наночастиц регистрировали через 5 мин с момента добавления последнего реагента. Установлено, что линейный участок градуировочной зависимости описывается уравнением ΔА = 0.0375(c(L-аскорбиновой кислоты), мг/л) (r2 = 0.975). На основании полученных данных рассчитаны аналитические характеристики методики спектрофотометрического определения L-аскорбиновой кислоты в водном растворе с помощью треугольных нанопластинок серебра. Предел обнаружения рассчитывали по формуле сmin = 3s0/S, где s0 – стандартное отклонение сигнала контрольного опыта, S – тангенс угла наклона градуировочной зависимости. Нижнюю границу определяемых содержаний рассчитывали по формуле сн = 3сmin. Предел обнаружения L-аскорбиновой кислоты в выбранных условиях равен 0.5 мг/л, диапазон определяемых содержаний (ДОС) составляет 1.6–60 мг/л. Из полученных результатов видно, что предложенный способ определения L-аскорбиновой кислоты в растворе обладает приемлемой чувствительностью и широким ДОС. Воспроизводимость результатов определения проверяли при концентрации определяемого соединения 40 мг/л. Относительное стандартное отклонение результатов трех параллельных определений составило 0.04, что вполне удовлетворительно для количественного анализа.
Оценка селективности. Для оценки влияния посторонних катионов и анионов на величину аналитического сигнала при определении L-аскорбиновой кислоты готовили растворы с различными соотношениями определяемого соединения и выбранных ионов. Обнаружено, что определению L-аскорбиновой кислоты (АК) не мешают катионы Na+ (m(АК) : m(Na+) = 1 : 1000), K+ (1 : 1000), Cr3+ (1 : 100), Cu2+ (1 : 100), Co2+ (1 : 100), Al3+ (1 : 100); анионы CH3COO– (1 : 1000), ${\text{NO}}_{3}^{ - }$ (1 : 100), Cl– (1 : 50), ${\text{SO}}_{4}^{{2 - }}$ (1 : 10). Мешают определению катионы Hg2+ (1 : 10), Fe3+ (1 : 1), Ni2+ (1 : 1); анион I– (1 : 1).
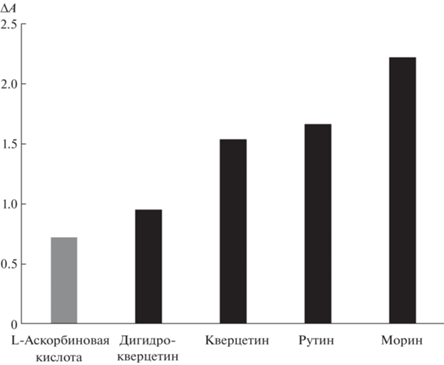
Оценили применимость предложенного подхода к определению других восстановителей. В качестве таких восстановителей выбрали флавоноиды, являющиеся широко распространенными природными антиоксидантами. Результаты экспериментов представлены на рис. 9 в виде гистограммы. Несмотря на некоторые различия в величине аналитического сигнала, он находится в пределах от 0.7 до 2.2 единиц оптической плотности для всех исследованных восстановителей. Это обстоятельство позволяет сделать вывод о возможности применения предложенного метода для определения других восстановителей.
Рис. 9.
Зависимость аналитического сигнала (ΔA) от природы восстановителя. с(ТНП) = 0.04 мМ Ag, c(восстановитель) = 100 мкМ, c(AgNO3) = 0.15 мМ, pH 6, t = 5 мин.
Спектрофотометрическое определение L-аскорбиновой кислоты в реальных объектах. Предложенный подход применили для анализа реальных объектов – листового зеленого чая “Ahmad Tea” и яблочного сока “Сады Придонья”. Для оценки правильности определения АК изучаемые объекты анализировали также независимым методом – кулонометрическим титрованием. Результаты определения представлены в табл. 1. Найденное с помощью предлагаемого способа содержание L-аскорбиновой кислоты совпадает с данными, полученными независимым методом, что свидетельствует о правильности результатов. Степень выделения лежит в пределах 88–105%, а относительное стандартное отклонение не превышает 0.05.
Таблица 1.
Определение L-аскорбиновой кислоты в реальных объектах (n = 3, P = 0.95)
| Объект анализа | Предлагаемый метод | Независимый методa | R, % | ||
|---|---|---|---|---|---|
| найдено | sr | найдено | sr | ||
| Чай зеленый “Ahmad Tea” | (0.13 ± 0.01) мг/г | 0.03 | (0.124 ± 0.001) мг/г | 0.003 | 105 |
| Сок яблочный “Сады Придонья” | (25 ± 3) мг/л | 0.05 | (28.5 ± 0.2) мг/л | 0.003 | 88 |
a Кулонометрическое титрование с бипотенциометрической индикацией конечной точки. Вспомогательный электролит: 0.1 М H2SO4 + 0.2 М KBr. Сила тока предэлектролиза составляла 0.25 мА, сила тока электролиза − 2.5 мА, сила тока конца титрования − 0.25 мА. Диапазон равновесных потенциалов, соответствующих конечной точке титрования, составлял 100–300 мВ.
Сравнение аналитических характеристик с существующими подходами. Аналитические характеристики предложенного и существующих способов определения L-аскорбиновой кислоты приведены в табл. 2. Сравнение приведенных аналитических характеристик позволяет сделать вывод о том, что предложенный подход характеризуется достаточно хорошей чувствительностью и более низкими пределами обнаружения L-аскорбиновой кислоты, чем многие из существующих способов. Ограничением предлагаемого подхода является относительно невысокая селективность, уступающая таким методам, как спектрофлуориметрия. В то же время он не требует использования дорогостоящего оборудования, что является его достоинством.
Таблица 2.
Сравнение аналитических характеристик предложенного и существующих способов определения L-аскорбиновой кислоты
* * *
Показана возможность применения аналитических систем на основе ТНП серебра, стабилизированных цитратом натрия и поли(N-винил-2-пирролидоном), с полосой локализованного ППР в области 620–700 нм в качестве спектрофотометрических реагентов для определения восстановителей, в частности L-аскорбиновой кислоты. Предполагаемый принцип действия таких систем заключается в восстановлении Ag+ до металлического серебра под действием определяемого соединения и его осаждение на поверхности наночастиц-затравок. Изучено влияние рН, времени взаимодействия, концентрации реагентов и посторонних соединений на величину аналитического сигнала и найдены условия проведения аналитической процедуры. Предел обнаружения L-аскорбиновой кислоты составил 0.5 мг/л, диапазон определяемых содержаний − 1.7–60 мг/л. Достоинствами разработанной методики являются простота, экспрессность и хорошие аналитические характеристики.
Электронно-микроскопические исследования наночастиц и оценка возможностей их использования для определения других восстановителей выполнены при финансовой поддержке Министерства образования и науки и Совета по грантам Президента РФ, проект МД-1448.2021.1.3. Оптимизация параметров проведения эксперимента с L-аскорбиновой кислотой, оценка аналитических характеристик способа и анализ реальных объектов выполнены при финансовой поддержке РФФИ в рамках научного проекта № 20-33-90019. Отдельные эксперименты выполнены с использованием оборудования, приобретенного за счет средств Программы развития Московского государственного университета имени М.В. Ломоносова.
Список литературы
Vilela D., González M.C., Escarpa A. Sensing colorimetric approaches based on gold and silver nanoparticles aggregation: Chemical creativity behind the assay. A review // Anal. Chim. Acta. 2012. V. 751. P. 24. https://doi.org/10.1016/j.aca.2012.08.043
Jiang X.C., Yu A.B. Silver nanoplates: A highly sensitive material toward inorganic anions // Langmuir. 2008. V. 24. P. 4300. https://doi.org/10.1021/la7032252
Апяри В.В., Дмитриенко С.Г., Горбунова М.В., Фурлетов А.А., Золотов Ю.А. Наночастицы золота и серебра в методах оптической молекулярной абсорбционной спектроскопии // Журн. аналит. химии. 2019. Т. 74. С. 26. (Apyari V.V., Dmitrienko S.G., Gorbunova M.V., Furletov A.A., Zolotov Yu.A. Gold and silver nanoparticles in optical molecular absorption spectroscopy // J. Anal. Chem. 2019. V. 74. P. 21. https://doi.org/10.1134/s106193481901005210.1134/s1061934819010052)https://doi.org/10.1134/s0044450219010055
Cialla D., März A., Böhme R., Theil F., Weber K., Schmitt M., Popp J. Surface-enhanced Raman spectroscopy (SERS): Progress and trends // Anal. Bioanal. Chem. 2012. V. 403. P. 27. https://doi.org/10.1007/s00216-011-5631-x
Jouyban A., Rahimpour E. Optical sensors based on silver nanoparticles for determination of pharmaceuticals: An overview of advances in the last decade // Talanta. 2020. V. 217. Article 121071. https://doi.org/10.1016/j.talanta.2020.121071
Shiva Prasad K., Shruthi G., Shivamallu C. Functionalized silver nano-sensor for colorimetric detection of Hg2+ ions: Facile synthesis and docking studies // Sensors. 2018. V. 18. P. 2698. https://doi.org/10.3390/s18082698
Szilagyi I., Trefalt G., Tiraferri A., Maroni P., Borkovec M. Polyelectrolyte adsorption, interparticle forces, and colloidal aggregation // Soft. Matter. 2014. V. 10. P. 2479. https://doi.org/10.1039/c3sm52132j
Kappi F.A., Tsogas G.Z., Giokas D.L., Christodouleas D.C., Vlessidis A.G. Colorimetric and visual read-out determination of cyanuric acid exploiting the interaction between melamine and silver nanoparticles // Microchim. Acta. 2014. V. 181. P. 623. https://doi.org/10.1007/s00604-014-1163-3
Shariati-Rad M., Heidari S. Classification and determination of total hardness of water using silver nanoparticles // Talanta. 2020. V. 219. Article 121297. https://doi.org/10.1016/j.talanta.2020.121297
Della Pelle F., Scroccarello A., Scarano S., Compagnone D. Silver nanoparticles-based plasmonic assay for the determination of sugar content in food matrices // Anal. Chim. Acta. 2019. V. 1051. P. 129. https://doi.org/10.1016/j.aca.2018.11.015
Shanmugaraj K., Sasikumar T., Campos C.H., Ilanchelian M., Mangalaraja R.V., Torres C.C. Colorimetric determination of cysteamine based on the aggregation of polyvinylpyrrolidone-stabilized silver nanoparticles // Spectrochim. Acta. A. 2020. V. 236. Article 118281. https://doi.org/10.1016/j.saa.2020.118281
Chen F., Liu L., Zhang W., Wu W., Zhao X., Chen N., Zhang M., Guo F., Qin Y. Visual determination of azodicarbonamide in flour by label-free silver nanoparticle colorimetry // Food. Chem. 2021. V. 337. Article 127990. https://doi.org/10.1016/j.foodchem.2020.127990
Lima M.J.A., Reis B.F. Photogeneration of silver nanoparticles induced by UV radiation and their use as a sensor for the determination of chloride in fuel ethanol using a flow-batch system // Talanta. 2019. V. 201. P. 373. https://doi.org/10.1016/j.talanta.2019.03.118
Trisaranakul W., Chompoosor A., Maneeprakorn W., Nacapricha D., Choengchan N., Teerasong S. A simple and rapid method based on anti-aggregation of silver nanoparticles for detection of poly(diallyldimethylammonium chloride) in tap water // Anal. Sci. 2016. V. 32. P. 769. https://doi.org/10.2116/analsci.32.769
Wang C., Bi X., Wang M., Zhao X., Lin Y. Dual-channel online optical detection platform integrated with a visible light absorption approach for continuous and simultaneous in vivo monitoring of ascorbic acid and copper(II) ions in a living rat brain // Anal. Chem. 2019. V. 91. P. 16010. https://doi.org/10.1021/acs.analchem.9b04783
Yan P., Ding Z., Li X., Dong Y., Fu T., Wu Y. Colorimetric sensor array based on Wulff-type boronate functionalized AgNPs at various pH for bacteria identification // Anal. Chem. 2019. V. 91. P. 12134. https://doi.org/10.1021/acs.analchem.9b03172
Bittar D.B., Catelani T.A., Pezza L., Pezza H.R. A fast method for the determination of lead in honey samples using stabilizer-free silver nanoparticles // Spectrochim. Acta. A. 2018. V. 189. P. 221. https://doi.org/10.1016/j.saa.2017.08.032
Shen J., Sun C., Wu X. Silver nanoprisms-based Tb(III) fluorescence sensor for highly selective detection of dopamine // Talanta. 2017. V. 165. P. 369. https://doi.org/10.1016/j.talanta.2016.12.073
Apyari V.V., Gorbunova M.O., Shevchenko A.V., Furletov A.A., Volkov P.A., Garshev A.V., Dmitrienko S.G., Zolotov Yu.A. Towards highly selective detection using metal nanoparticles: A case of silver triangular nanoplates and chlorine // Talanta. 2018. V. 176. P. 406. https://doi.org/10.1016/j.talanta.2017.08.056
Gorbunova M.O., Baulina A.A., Kulyaginova M.S., Apyari V.V., Furletov A.A., Volkov P.A., Bochenkov V.E., Starukhin A.S., Dmitrienko S.G. Dynamic gas extraction of iodine in combination with a silver triangular nanoplate-modified paper strip for colorimetric determination of iodine and of iodine-interacting compounds // Microchim. Acta. 2019. V. 186. P. 188. https://doi.org/10.1007/s00604-019-3300-5
Furletov A.A., Apyari V.V., Garshev A.V., Volkov P.A., Dmitrienko S.G. Silver triangular nanoplates as a colorimetric probe for sensing thiols: Characterization in the interaction with structurally related thiols of different functionality // Microchem. J. 2019. V. 147. P. 979. https://doi.org/10.1016/j.microc.2019.04.023
Feng H., Dong J., Wu X., Yang F., Ma L., Liu X., Liu Q. Ultra-large local field enhancement effect of isolated thick triangular silver nanoplates on a silicon substrate in the green waveband // Opt. Lett. 2020. V. 45. P. 2099. https://doi.org/10.1364/OL.389241
Chen L., Fu X., Lu W., Chen L. Highly sensitive and selective colorimetric sensing of Hg2+ based on the morphology transition of silver nanoprisms // ACS. Appl. Mater. Interfaces. 2013. V. 5. P. 284. https://doi.org/10.1021/am3020857
Xue B., Wang D., Zuo J., Kong X., Zhang Y., Liu X., Tu L., Chang Y., Li C., Wu F., Zeng Q., Zhao H., Zhao H., Zhang H. Towards high quality triangular silver nanoprisms: Improved synthesis, six-tip based hot spots and ultra-high local surface plasmon resonance sensitivity // Nanoscale. 2015. V. 7. P. 8048. https://doi.org/10.1039/c4nr06901c
He Y., Yu H. A novel triangular silver nanoprisms-based surface plasmon resonance assay for free chlorine // Analyst. 2015. V. 140. P. 902. https://doi.org/10.1039/c4an01774a
Brandon M.P., Ledwith D.M., Kelly J.M. Preparation of saline-stable, silica-coated triangular silver nanoplates of use for optical sensing. // J. Colloid. Interface. Sci. 2014. V. 415. P. 77. https://doi.org/10.1016/j.jcis.2013.10.017
Liang W.-J., Johnson D., Jarvis S.M. Vitamin C transport systems of mammalian cells // Mol. Membr. Biol. 2001. V. 18. P. 87. https://doi.org/10.1080/09687680110033774
Arrigoni O., De Tullio M.C. Ascorbic acid: much more than just an antioxidant // Biochim. Biophys. Acta. 2002. V. 1569. P. 1. https://doi.org/10.1016/s0304-4165(01)00235-5
Ströhle A., Hahn A. Vitamin C and immune function // Med. Monatsschr. Pharm. 2009. V. 32. P. 49. PMID: 19263912.
Robertson W.B., Schwartz B. Ascorbic acid and the formation of collagen // J. Biol. Chem. 1953. V. 201. P. 689. PMID: 13061407.
Métraux G.S., Mirkin C.A. Rapid thermal synthesis of silver nanoprisms with chemically tailorable thickness // Adv. Mater. 2005. V. 17. P. 412. https://doi.org/10.1002/adma.200401086
Rycenga M., Cobley C.M., Zeng J., Li W., Moran C.H., Zhang Q., Qin D., Xia Y. Controlling the synthesis and assembly of silver nanostructures for plasmonic applications // Chem. Rev. 2011. V. 111. P. 3669. https://doi.org/10.1021/cr100275d
Yan X., He L., Zhou C., Qian Z.-J., Hong P., Sun S., Li C. Fluorescent detection of ascorbic acid using glutathione stabilized Au nanoclusters // Chem. Phys. 2019. V. 522. P. 211. https://doi.org/10.1016/j.chemphys.2019.03.008
Sha R., Badhulika S. Facile green synthesis of reduced graphene oxide/tin oxide composite for highly selective and ultra-sensitive detection of ascorbic acid // J. Electroanal. Chem. 2018. V. 816. P. 30. https://doi.org/10.1016/j.jelechem.2018.03.033
Aguirre M.Á., Long K.D., Canals A., Cunningham B.T. Point-of-use detection of ascorbic acid using a spectrometric smartphone-based system // Food. Chem. 2019. V. 272. P. 141. https://doi.org/10.1016/j.foodchem.2018.08.002
Cholula-Díaz J.L., Lomelí-Marroquín D., Pramanick B., Nieto-Argüello A., Cantú-Castillo L.A., Hwang H. Synthesis of colloidal silver nanoparticle clusters and their application in ascorbic acid detection by SERS // Colloids Surf. B. 2018. V. 163. P. 329. https://doi.org/10.1016/j.colsurfb.2017.12.051
Güçlü K., Sözgen K., Tütem E., Özyürek M., Apak R. Spectrophotometric determination of ascorbic acid using copper(II)–neocuproine reagent in beverages and pharmaceuticals // Talanta. 2005. V. 65. P. 1226. https://doi.org/10.1016/j.talanta.2004.08.048
Tan Q., An X., Pan S., Liu H., Hu X. Hydrogen peroxide assisted synthesis of sulfur quantum dots for the detection of chromium(VI) and ascorbic acid // Spectrochim. Acta. A. 2021. V. 247. Article 119122. https://doi.org/10.1016/j.saa.2020.119122
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии