Журнал аналитической химии, 2022, T. 77, № 12, стр. 1120-1132
Оценка возможности применения “электронного носа” для мониторинга отклонений при функциональном ожирении детей в условиях стационара. Неинвазивная диагностика без отбора биопроб
Т. А. Кучменко a, b, *, Е. С. Доровская a, Д. А. Менжулина c, Т. В. Чубаров c
a Воронежский государственный университет инженерных технологий
394036 Воронеж, просп. Революции, 19, Россия
b Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
c Воронежский государственный медицинский университет им. Н.Н. Бурденко
394000 Воронеж, ул. Студенческая, 10, Россия
* E-mail: tak1907@mail.ru
Поступила в редакцию 24.02.2022
После доработки 29.03.2022
Принята к публикации 30.03.2022
- EDN: QHAHXG
- DOI: 10.31857/S0044450222120088
Аннотация
Портативный “электронный нос – диагност” применен для исследования особенностей состава смеси летучих соединений, выделяемых кожей предплечий у детей с ожирением и иными сопутствующими нарушениями метаболизма. В условиях стационара оценены различия и особенности профилей летучих соединений (приоритетно органических) кожи на левом и правом предплечьях у детей с ожирением и зависимость профиля от приема пищи, лекарственных средств, сопутствующих заболеваний и особенностей организма. Проанализировано более 300 профилей пациентов в течение двух лет, в том числе в динамике при повторных плановых госпитализациях. По результатам исследования положительно оценена возможность проведения анализа и сравнения состава газовой смеси соединений, выделяемой кожей на предплечье рук, без предварительного разделения и отбора при помощи массива восьми пьезосенсоров “электронного носа – диагноста”. Оценена корреляция данных электронного носа и результатов стандартных клинических лабораторных исследований. Установлены параметры массива сенсоров и клинических исследований, тесно связанные между собой, в том числе с уровнями мочевины, щелочной фосфатазы, глюкозы. Положительно оценена возможность подхода, основанного на сканировании летучего профиля кожи на предплечье в течение 3−6 мин, для ранжирования детей с ожирением на группы, связанные с важнейшими социально значимыми заболеваниями и состояниями: “норма”, “ожирение с вероятностью развития сахарного диабета 2 типа” и “сахарный диабет 1 типа”. С помощью методов хемометрики оптимизирована методика проведения анализа, обозначены условия исследования и точки контроля. Наиболее информативным является состав летучего метаболома кожи на правом предплечье, сканируемый натощак. Правильность отличия проблемных групп от нормы составляет 100%, правильность ранга внутри патологических групп – 80%. Доля ложных отнесений растет при наличии воспалений в организме любого типа. Перспективность методики оценена в условиях стационара.
По оценкам Всемирной организации здравоохранения (ВОЗ), в мире лишний вес имеют более миллиарда человек. Проблема ожирения актуальна даже для стран, в которых большая часть населения постоянно голодает, а в промышленно развитых странах она уже давно стала серьезным аспектом общественного здоровья [1]. Диагноз ожирение объединяет наследственные и приобретенные заболевания, связанные с избыточным накоплением жировой ткани в организме. Избыточный вес и ожирение у детей и молодых людей являются основными факторами риска развития хронических заболеваний и связаны с повышенным риском ожирения у взрослых [2] и преждевременной смертностью [3, 4]. Всемирная организация здравоохранения признает, что избыточная масса тела и ожирение у детей достигли масштабов эпидемии в большинстве промышленно развитых стран [5].
Согласно отчету группы Европейской инициативы ВОЗ по эпидемиологическому надзору за детским ожирением (COSI) [6] по анализу тенденций развития избыточного веса и ожирения у детей младшего школьного возраста, основной причиной ожирения является малоподвижный образ жизни. Однако еще одна причина ожирения кроется в наличии сложных метаболических нарушений в организме, приводящих к накоплению и отложению избыточного количества жира [7]. Многолетними исследованиями ученых всего мира установлено, что на фоне ожирения способны развиваться ряд опасных заболеваний, такие как сахарный диабет 2 типа, сердечно-сосудистые заболевания, болезни печени и желчевыводящих путей, толстой кишки и патологии пищевода. Еще с 80-х годов прошлого столетия разрабатывались различные методики оценки ожидания и прогноза ожирения населения, начиная с младенчества [8]. Последние два года отличаются объективным снижением активности населения, повышения рисков набора веса из-за стресса и неуверенности в завтрашнем дне. В связи с этим возрастает актуальность быстрого выявления групп риска для детей с развитием ожирения из-за метаболических нарушений, дифференциация их от нарушений веса из-за снижения подвижности. Особенно важно обеспечить доступными средствами и методиками распознавания причин и групп риска участковых педиатров, хотя и для стационаров эндокринологического профиля такие разработки представляют интерес для более раннего выявления групп риска с выбором верного пути лечения и профилактики развития социально значимых заболеваний.
Социальная значимость проблемы ожирения определяется угрозой инвалидизации пациентов молодого возраста и снижением общей продолжительности жизни в связи с частым и ранним развитием тяжелых осложнений.
Выделяют нейрогенные, эндокринные и метаболические механизмы возникновения ожирения. Эндокринные механизмы ожирения – лептиновый, гипотиреоидный, надпочечниковый и инсулиновый. Инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани [9]. Считают, что основные повреждения при этом типе ожирения находятся на уровне клеток-мишеней. Они связаны с уменьшением числа рецепторов для инсулина, обусловливающим резистентность к инсулину и компенсаторный гиперинсулинизм [10].
Всем пациентам с ожирением рекомендованы биохимические исследования: липидограмма крови, уровни ферментов (АлАТ, АсАТ) в сочетании с ультразвуковым исследованием печени. Для диагностики нарушений липидного обмена у всех определяют уровень общего холестерина, уровни холестерина липопротеинов высокой и низкой плотности, триглицеридов в крови. Определение ферментов печени (АлАТ и АсАТ) в сочетании с ультразвуковым исследованием печени рекомендовано всем пациентам с ожирением для скрининга неалкогольной жировой болезни печени. Жировой гепатоз имеют 25–45% подростков с ожирением; с длительностью ожирения может прогрессировать и поражение печени: стеатогепатит, фиброз, цирроз [11]. По результатам изучения распространенности дислипидемии у детей с инсулинозависимым сахарным диабетом (ИЗСД) и ее связи с гликемическим контролем установлено, что аномалии циркулирующих липидов часто встречаются у молодых людей с ИЗСД, но в значительной степени исчезают, если концентрация глюкозы в крови находится под разумным контролем [12].
На сегодняшний день актуальна разработка доступных и быстрых неинвазивных способов диагностики состояния. Это может позволить существенно сузить круг поиска проблем при диагностике на ранних этапах и привести к ускорению процесса лечения. Одним из таких способов может стать диагностика по выделяющимся соединениям – химическому профилю легколетучих биомолекул.
Метаболом, или метаболический профиль, представляет собой совокупность всех низкомолекулярных метаболитов (<1500 Да) биологического образца, являясь уникальным химическим “отпечатком пальцев”, специфичным для процессов, протекающих в живых клетках [13].
Исследования метаболического профиля выполняют, как правило, с использованием гибридного метода анализа – сочетания газовой или жидкостной хроматографии и масс-спектрометрии, спектроскопии ядерного магнитного резонанса. Данные методы имеют ряд ограничений: высокая стоимость и громоздкость приборного оснащения, необходимость привлечения высоко квалифицированного персонала, затраты на обеспечение рабочего состояния. Альтернативным решением может стать применение электронного носа как многообещающего диагностического инструмента будущего.
При анализе динамики изменения количества публикаций на тему применения электронного носа в диагностике установили значимый рост интереса к данной тематике на протяжении последних 20 лет (рис. 1а).
Рис. 1.
Изменение количества публикаций по применению систем “электронный нос” в диагностике (а) и заболевания, которые возможно диагностировать с их помощью (б).

С помощью электронного носа на сегодняшний день уже анализируют такие бипоробы, как выдыхаемый воздух, урина, кровь, пот, слюна, цервикальная слизь [14–18]. Анализируя данные пробы, специалисты в основном диагностируют заболевания желудочно-кишечного тракта, раковые опухоли, респираторные, а также иные воспалительные заболевания (рис. 1б) [19–22].
Диагностика состояния человека по легколетучим соединениям, основана на регистрации маркеров состояния сенсорами. В табл. 1 приведены некоторые маркеры патологических процессов организма, которые с высокой вероятностью могут быть определены при выделении самым большим и постоянно функционирующим органом выделения – кожей.
Таблица 1.
Некоторые газообразные биомолекулы, выделяемые человеком, и их диагностическая значимость
| Аналиты | Характеристика диагностической функции | Орган, отвечающий за синтез | Биопробы для определения | Количество | Литера-тура |
|---|---|---|---|---|---|
| Бензиламин, вода, цикло-пентанон |
Маркер нормального метаболизма | –* | – | (–)** | [23] |
| Этандиаль | Развитие хронических клинических осложнений, связанных с сахарным диабетом, ретинопатией, спазм желчных протоков | – | Моча, кровь | (–) | [24] |
| Пропандиаль | Язвенный колит, болезнь Крона, неалкогольная жировая болезнь печени (НАЖБП) | – | Спинномозговая
жидкость, экскременты, слюна |
(–) | [25] |
| Ацетальдегид | Язвенный колит, болезнь Крона, НАЖБП | Надпочечники, эпидермис, почка, печень, поджелудочная железа и др. | Кровь, экскременты, слюна, пот, моча и др. |
(–) | [25] |
| Этиламинол | Раковые заболевания, язвенный колит |
Мозг, поджелудочная железа | Моча, слюна, экскременты, кровь и др. |
(–) | [26–29] |
| Этанол | Заболевания почек, печени, хронический панкреатит | Мочевой пузырь, печень, поджелудочная железа, сердце, почка, жировая ткань и др. |
Моча, слюна, экскременты, кровь, пот, спинномозговая жидкость, эпидермис |
90 мкмоль | [30] |
| Бутанол-1 | Сахарный диабет 2 типа | Селезенка, печень, почка, поджелудочная железа |
Эпидермис, экскременты, слюна, кровь |
До 2.43 × × 10–6 моль | [31, 32] |
| Бутанол-2 | Повышается у больных сахарным и инсулинозависимым диабетом | Экскременты, слюна |
(–) | ||
| Пентанол-1 | Инфекционное заболевание, НАЖБП, колит | Экскременты, слюна | (–) | [26, 31] | |
| Масляная кислота | Гипогликемия, болезнь Крона,
язвенный колит, кишечные инфекции, НАЖБП |
Толстая кишка, простата, почка |
Моча, слюна, экскременты, кровь, мозговая жидкость |
(20.5 ± 16.5) × × 10–5 моль | [25, 32–35] |
| Триметил-амин | Рак поджелудочной железы, язвенный колит, болезнь Крона, НАЖБП, заболевания почек |
Эпидермис, скелетные мышцы | Кровь, спинномозго-вая жидкость, экскременты, слюна, моча | 1.5 ± 0.5 мкмоль | [36, 25 ] |
| Метиламин | Сахарный диабет, хроническая болезнь почек | – | Слюна, моча, экскременты, кровь, пот |
(–) | [33, 37] |
Изучение смеси газов, выделяемых кожей, может сделать диагностику полностью неинвазивной и практически мгновенной. Исходя из всего описанного выше, на сегодняшний день очень важна и актуальна разработка нового аналитического решения, которое позволит за короткое время на приеме у специалиста определить, имеет ли ожирение пациента связь с первоначальными эндокринными нарушениниями, или же оно связано в большей степени с неправильным пищевым и динамическим поведением. Основой разработки такого подхода может стать применение газовых сенсоров для установления наличия/отсутствия легколетучих маркеров патогенных процессов организма человека, а также детектирование или фиксирование индивидуального профиля газов с установлением отклонений в нем, связанных с нарушениями метаболизма.
Цель работы – разработка способа изучения летучего метаболического профиля у детей с ожирением, выделяемого кожей, с применением массива химических сенсоров и оценка его информативности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пьезокварцевое микровзвешивание. Одним из высокочувствительных и простых методов исследования газовых смесей является метод пьезокварцевого микровзвешивания, который позволяет регистрировать изменения частоты механических колебаний чувствительного элемента — пьезокристалла, вызванные незначительными изменениями массы, наблюдаемыми при адсорбции на тензочувствительной области. С помощью данного метода можно детектировать большой набор легколетучих биомолекул, например спиртов, кетонов, органических кислот, аминосоединений и др. [38].
Для детектирования газового профиля кожи применяли портативный “электронный нос – диагност” (ЭНД) Bio-8 [39] (ООО “Сенсорика-Новые технологии (СНТ)”, Россия) (рис. 2а, 2б). Аналитическая информация ЭНД “Bio-8” представлена в виде: хроночастотограмм; “визуальных отпечатков” максимальных сигналов пьезосенсоров (рис. 2в); кинетических “визуальных отпечатков” (рис. 2г). Перед началом каждого нового измерения контролировали стабилизацию базовой линии каждого сенсора, дрейф должен изменяться не более чем на ±1 Гц/с.
Рис. 2.
“Электронный нос – диагност” Bio-8 (а), методика сканирования летучих молекул кожи (б), интегральные отклики массива сенсоров в виде “визуальных отпечатков” максимальных (в) и кинетических (г) сигналов сенсоров.

Для обеспечения надежности детектирования летучих соединений кожи в течение длительного времени эксперимента применяли два уровня контроля стабильности массива сенсоров “электронного носа-диагноста”:
1) согласно инструкции пользователя прибора применяли внутреннюю стандартизацию массива по стандартным веществам (пропанол-2, этилацетат). Определенный объем паров вносили в прибор, фиксировали аналитический сигнал и сопоставляли полученную форму интегрального аналитического сигнала для каждого из веществ и представленную в инструкции. Допускается для массива отличие сигнала от стандартного значения не более чем на 15%. Режим и периодичность контроля определяются и связаны с интенсивностью измерений и природой объектов анализа.
2) Так как сенсоры в массиве являются микровесами, изменение массы модификаторов на каждом из них определяют повторяемость измерений и контролируются в программном обеспечении (ПО) прибора. Перед эксплуатацией в ПО вносятся значения базовых частот каждого сенсора с допустимым разбросом значений для каждого типа модификатора индивидуально (± (от 100 до 500 Гц)). При превышении допустимых установленных разбросов базовой частоты сенсор подвергают дополнительной регенерации. При критическом отклонении базовой частоты от паспортной сенсоры заменяются с повторной стандартизацией по п. 1.
Количественные параметры микровзвешивания рассчитываются сразу после измерения в ПО прибора (MAGSoft):
• максимальный аналитический сигнал сенсора (ΔFmax, Гц), характеризующий эффективность сорбции органических соединений на фазах сорбентов;
• площадь под хроночастотограммой i-го сенсора (Si, Гц с) для оценки вклада откликов каждого пьезосенсора в суммарный аналитический интегральный сигнал ЭНД;
• площадь “визуального отпечатка” сигналов массива сенсоров ЭНД (ΣSВ.О., Гц с). Определяется суммарной массой адсорбированных фазами модификаторов легколетучих органических веществ за время измерения;
• доля веса сенсора в массиве ɷ(1–8) (%) характеризует вклад сигналов отдельного сенсора в суммарный аналитический сигнал ЭНД.
Качественные параметры микровзвешивания:
• параметр эффективности сорбции Аi/j – отношение максимальных сигналов отдельных пьезосенсоров ΔFi/ΔFj (где i, j – различные покрытия электродов) – позволяет оценить соотношение в пробе концентраций различных классов соединений, идентичен для разбавленных смесей паров коэффициенту селективности – отношению чувствительностей микровзвешивания веществ двумя пленками [40]. Минимаксные значения параметров эффективности сорбции индивидуальных паров являются их качественными характеристиками.
Для расчета корреляции со стандартными клиническими показателями и построения прогнозирующей модели применяли совокупность информационных параметров ЭНД:
| Количественные параметры (25): | Качественные расчетные параметры (30): |
| Сигналы всех сенсоров (8 шт.): ΔFmax (1–8), Гц | Параметры сорбции веществ массивом сенсоров Ai/j (28 шт.) |
| Вклад сигналов отдельного сенсора в суммарный аналитический сигнал (доля веса), ɷ (1–8), % (8 шт.) | Кинетические параметры сорбции на сенсоре с фазой гидроксиапатита (2 шт.): ɑ120/60, ɑ60/80 |
| Si, ΣSВ.О., Гц с | |
| Итого 55 параметров | |
Измерительными элементами являются химические сенсоры с базовыми частотами колебания кварца ЭНД равными 10 ± 1 МГц (ООО “Пьезо”, Москва).
В качестве модификаторов пьезосенсоров выбрали фазы карбоксилированных углеродных нанотрубок (МУНТсоон), нитрата оксида циркония, наноструктурированного биогидроксиапатита Cа5(PO4)3OH (ГА), полиэтиленгликоль сукцината (ПЭГСк), дициклогексан-18-краун-6 (ДЦГ18К6) в составе коммерческого набора Bio© (ООО “СНТ”, Россия).
Считали, что функционирование всех сенсоров с сорбентами подчиняется модели Зауэрбрея, поэтому массу сорбата и покрытия оценивали по основному уравнению модели:
где ΔF – изменение частоты колебаний кварцевой пластины резонатора при нанесении фазы или сорбции паров, Гц; 2.27 × 10–6 – градуировочная константа пьезоэлектрических микровесов Kf при н.у, см2/г; F0 – базовая частота колебаний кварцевой пластины пьезокварцевого резонатора (ПКР), МГц; 0.2 – площадь электродов ПКР, см2.Характеристика объектов исследования. Исследование проходило на базе Воронежской детской клинической больницы ВГМУ им. Н.Н. Бурденко с 09.01.2020 по 26.06.2021.
С помощью прибора “электронный нос – диагност” Bio-8 и выбранного массива сенсоров измерили содержания 380 летучих соединений, выделяемых кожей в области предплечья у детей в разном состоянии с различными заболеваниями в период прохождения ими стационарного обследований и лечения в эндокринологическом отделении.
Каждое измерение длилось 200 с, в течение 80 с производилась нагрузка сенсоров путем поднесения прибора к коже пациента в области предплечья на внутренней стороне, а по истечении данного времени происходило наблюдение за самопроизвольной десорбцией летучих биомолекул из открытой ячейки с продолжением фиксирования их откликов (рис. 2б).
Для правильной оценки состояния и маркировки профиля летучих молекул кожи пациента использовали диагноз врача и результаты обследования медицинской лаборатории. Для каждого человека измеряли летучий профиль на левом и правом предплечьях натощак, после приема пищи, после приема лекарств. Изучен метаболический профиль 35 пациентов в возрасте от 5 до 17 лет с различными эндокринными нарушениями, в том числе 14 – с ожирением и 20 человек добровольцев в возрасте от 7 до 17 лет без нарушений. В общей сложности проведено 380 измерений в группе испытуемых, имеющих отклонения в работе эндокринной системы, при этом для каждого пациента получено от 10 до 20 легколетучих профилей состояния организма в контролируемых временных точках в момент прохождения стационарного лечения. Для трех пациентов исследования проводили с периодичностью 1 год (2019, 2020 и 2021 гг.). Для каждого человека из группы добровольцев без установленных нарушений легколетучий профиль измеряли на каждой руке с 3-кратным повторением в разных состояниях (до, после приема пищи).
Коммерческий набор сенсоров Bio© предварительно обучали по индивидуальным веществам, которые могут свидетельствовать о нарушениях согласно табл. 1, а также учитывали характеристики чувствительности и селективности, установленные ранее для других биопроб [41].
Исследования поддержаны этическим комитетом ВГМУ им. Бурденко и родителями детей при их госпитализации в письменных согласиях в ВДКБ. Добровольцы также подписывали соглашение о добровольном участии в эксперименте.
Стандартные клинические лабораторные исследования. Всем испытуемым на базе клинической лаборатории ВДКБ ВГМУ им. Н.Н. Бурденко проводили стандартные исследования: получали биохимические показатели крови на анализаторе BS-120, выполняли общий анализ мочи и общий анализ крови, проводили глюкозотолерантный тест, определяли половые гормоны и гормоны, вырабатываемые щитовидной железой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе эксперимента полученные данные электронного носа – диагноста для летучего профиля соединений кожи детей, страдающих ожирением, проверяли на возможную корреляцию с результатами стандартных клинических методов исследования. Для этого создали базу данных для 14 детей с ожирением, исследуемых в течение двух лет во время плановых госпитализаций. В базу включили различные параметры электронного носа, характеризующие сорбцию на массиве восьми сенсоров, и результаты лабораторных исследований. Газовый профиль кожи детей изучали на левом и правом предплечьях, которые связаны с сердечно-сосудистой системой и органами с левой стороны тела (левая рука) и органами, расположенными справа, в частности, приоритетно – с желчным пузырем, печенью, кишечником, двенадцатиперстной кишкой. Корреляцию параметров ЭНД и результатов клинических исследований оценивали с учетом данных особенностей по 52 параметрам носа-диагноста и 23 различным показателям клинических исследований. В качестве новых параметров, отражающих особенность природы летучих молекул, предложено применять кинетические параметры процесса сорбции и десорбции для конкретного сенсора в наборе с фазой гидроксиапатита – ɑ120/60, ɑ60/80 [42]. С физической точки зрения параметры показывают во сколько раз изменяется скорость сорбции для нагрузки в течение 60 и 80 с и при самопроизвольной десорбции через 120 с от начала исследования.
При помощи программного обеспечения THE UNSCRAMBLER X V.10.4 оценили результаты оценки корреляции (табл. 2). Установили, что при детектировании летучего профиля кожи на левой руке наиболее значимая корреляция наблюдается между кинетическими параметрами сорбции на модификаторе пьезосенсора с чувствительным слоем ГА ɑ120/60, ɑ60/80 и уровнем мочевины в крови, полученным биохимическим методом анализа. При детектировании летучего профиля кожи на правой руке пациентов установлена максимальная корреляция между качественными параметрами сорбции A1/2, A1/6, которые рассчитывали по максимальным сигналам сенсоров с МУНТсоон разной массы (сенсоры 1 и 7), нитратом оксида циркония (сенсор 2), ПЭГСк (сенсор 6), и уровнем щелочной фосфатазы (обратная сильная корреляционная связь). Кроме того, установлена корреляция между параметрами A5/6, A5/7 (соответственно учитывали отклики сенсора с ГА – сенсор 5) и уровнем глюкозы в крови, полученным при биохимическом анализе крови (прямая сильная корреляционная связь). Это позволило судить о качественной связи между информацией электронного носа – диагноста и некоторыми стандартными клинико-диагностическими лабораторными исследованиями. Установили, что нельзя количественно определить уровень мочевины, щелочной фосфатазы и глюкозы в крови по сигналам электронного носа, поскольку установленный коэффициент корреляции не соответствует критериям проведения количественного анализа, можно установить только качественную зависимость. Такие связи являются значимыми для получения первичной информации об изменениях этих показателей в условиях стационара в течение суток, при этом расчет всех показателей осуществляется по одному−двум измерениям в течение 5 мин без забора крови.
Таблица 2.
Результаты корреляционного анализа аналитической информации “электронного носа – диагноста” и стандартных клинических лабораторных исследований
| Сравниваемые параметры | Левое предплечье | Правое предплечье | ||
|---|---|---|---|---|
| коэффициент корреляции | коэффициент детерминации R2 | коэффициент корреляции | коэффициент детерминации R2 | |
| ɑ120/60 и уровень мочевины | 0.79 | 0.62 | 0.47 | 0.22 |
| ɑ60/80 и уровень мочевины | –0.81 | 0.65 | –0.64 | 0.42 |
| A1/2 и уровень щелочной фосфатазы | –0.82 | 0.64 | –0.81 | 0.66 |
| A1/6 и уровень щелочной фосфатазы | –0.74 | 0.54 | –0.92 | 0.84 |
| A5/6 и уровень глюкозы | 0.82 | 0.67 | 0.82 | 0.66 |
| A5/7 и уровень глюкозы | 0.75 | 0.53 | 0.80 | 0.63 |
На втором этапе исследования осуществляли моделирование данных и оценку возможности ранжирования проб (пациентов) на классы диагнозов по информации электронного носа с набором сенсоров Bio©.
Для классификации проб в соответствии с диагнозом разбили их на две группы: обучающая выборка (197 измерений) и проверочная выборка (77 измерений), в которые вошли данные о сканировании летучих соединений кожи пациентов без ожирения и с диагнозами ожирение, сахарный диабет (СД) 1 и 2 типа эндокринологического отделения.
Пробы обучающей выборки разбили на три группы с метками: “Норма”, “Ожирение с группой риска развития СД 2 типа” и “СД 1 типа”. При этом в выборку не включали данные при экстремальном отклике организма в момент измерения, когда человеку было жарко, и когда он испытывал волнение, стресс.
Построили МГК-модель по всем 34 параметрам электронного носа – диагноста (рис. 3). По графику счетов видно, что пробы делятся на две группы: пробы газового профиля пациентов в первой половине стационарного лечения и пробы во второй половине лечения (рис. 3). Для диагностических целей важна именно область первой половины стационарного лечения, поэтому построили МГК-модель именно для этой части проб выборки, а также установили наиболее информативные параметры электронного носа, которые смогут ранжировать пробы на установленные ранее классы.
Рис. 3.
График счетов проб всей обучающей выборки (132 пробы) без учета времени принятия пищи и точки измерения (левое/правое предплечье).

В ходе оптимизации МГК-модели для более четкого деления проб на группы по схожим признакам установили, что наибольшее влияние на ранжирование проб оказывают параметры, рассчитанные по всем сигналам сенсоров в массиве Bio©: A1/5, A1/8, A2/5, A2/6, A2/8, A3/5, A4/5, A6/8, A7/8, ɷ3, ɷ4, ɷ5, ɷ8.
Согласно основному диагностическому правилу для исключения влияния пищи на результаты анализа практически для всех исследований биопробы отбираются натощак, поэтому из выборки всех данных исключили результаты сканирования газового профиля кожи, полученные после еды. Также учитывали ранжирование отдельно для левого и правого предплечий с учетом их связи с внутренними органами и системами организма (рис. 4а, 4б).
Рис. 4.
Графики счетов для параметров “электронного носа – диагноста” при сканировании летучих соединений кожи на левом (а) и правом (б) предплечье, выполненном натощак.
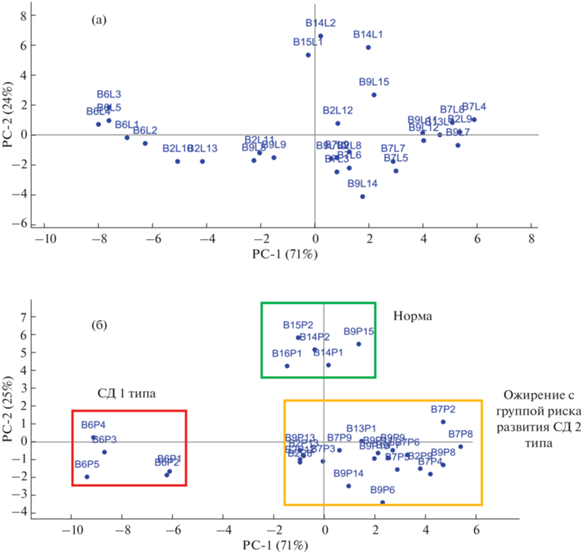
Из графиков счетов, полученных при ранжировании результатов на группы натощак, видно, что разделение на группы лучше происходит по профилю соединений правого предплечья (рис. 4б). С высокой надежностью разделены группы “Норма”, “СД 1 типа” и “Ожирение с группой риска по развитию СД 2 типа”.
Аналогичные модели для иных состояний пациентов (после еды и принятия медикаментов) не позволяют получить надежного ранжирования результатов на группы. Пробы попадают в группу “норма”, потому что перед измерением пациенты получили медикаменты (таблетки, капельницы), которые компенсировали состояние, метаболические сбои и приблизили их к условной норме, в другую группу вместе попали результаты для пациентов с сахарным диабетом 1 типа и пациента с гормональным расстройством. Выбор стороны сканирования (левая/правая) не улучшил ситуацию. Таким образом, наилучшее ранжирование проб на группы происходит при исследовании газового состава смеси молекул, выделяемых кожей на правом предплечье, натощак или спустя 2–3 ч после приема пищи.
Для проверки полученной модели использовали другую выборку данных. Для каждой группы ранжирования создали МГК-модель и осуществили прогнозирование возможного диагноза у пациентов методом SIMCA (табл. 3). В ходе проверки полученной модели установили, что все пациенты, имеющие отклонения в протекании метаболических процессов организма, не попали в группу “норма”. Нет ложноотрицательных результатов, что очень важно для диагностических методов, так как такие ошибки могут привести к тяжелым последствиям и позднему обнаружению проблемы, когда помочь человеку уже сложнее. При этом не решена задача как можно более ранней диагностики отклонений (превентивная диагностика). Доля ложноположительных результатов ранжирования составляет 20%. Ошибка связана с небольшой проверочной выборкой и вызвана сильным влиянием на отнесение к группе воспалительного процесса в организме двух пациентов из выборки. При этом в группу “СД 1 типа” отнесены профили пациентов с отсутствием этого диагноза, но со сложным нарушением метаболитического пути (ожирение 3 степени, риск развития СД 2 типа). Это, строго говоря, не является ошибкой с точки зрения установления функциональных нарушений и их тяжести и может объясняться наличием в пробах одинаковых летучих биомолекул, выделяемых кожей (неспецифические маркеры).
Таблица 3.
Результаты ранжирования на группы результатов сканирования летучих соединений кожи пациентов из проверочной выборки методом SIMCA
| № | Шифр | Наиболее вероятное нарушение, предсказанное по модели | Диагноз по результатам клинических исследований |
|---|---|---|---|
| 1 | В1 | Ожирение с группой риска по развитию СД 2 типа | Ожирение 2 степени, группа риска по развитию СД 2 типа |
| 2 | В8 | Ожирение с группой риска по развитию СД 2 типа | Ожирение 2 степени, группа риска по развитию СД 2 типа |
| 3 | В4Р4 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 4 | В4Р7 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 5 | В4Р10 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 6 | В4Р11 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 7 | В10Р2 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 8 | В10Р4 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 9 | В10Р9 | СД 1 типа | Ожирение 3 степени, группа риска по развитию СД 2 типа |
| 10 | В3Р5 | Ожирение с группой риска по развитию СД 2 типа | Ожирение 2 степени, группа риска по развитию СД 2 типа |
| 11 | В3Р11 | Ожирение с группой риска по развитию СД 2 типа | Ожирение 2 степени, группа риска по развитию СД 2 типа |
Определили летучие соединения – маркеры состояния, которые способны выделяться при различных отклонениях в работе организма. Для этого спроецировали данные по сорбции паров тест-веществ на построенную МГК-модель обучающей и проверочной выборок (рис. 5). Так, надежно установили, что у пациента В6 выделяется этандиаль (глиоксаль). При этом его выделение фиксируется практически во всех точках испытания и чаще, чем у других пациентов, что согласуется с поставленным диагнозом пациента В6 и результатами стандартных клинических исследований: диагностирован сахарный диабет 1 типа, маркером которого является, в том числе этандиаль (глиоксаль).
Рис. 5.
График счетов, который отображает ранжирование биопроб на группы и возможные летучие органические соединения, выделяемые кожей пациентов.

В табл. 4 представлены качественные параметры для веществ-маркеров и газового профиля людей, относящихся к разным группам: сахарный диабет 1 типа, ожирение 3 степени и группа риска по развитию сахарного диабета 2 типа, условная норма. Глиоксаль и молочная кислота, маркеры нарушений углеводного обмена, наиболее часто и с высокой вероятностью выделяются у пациента В6, у которого установлен диагноз – сахарный диабет 1 типа, реже и менее надежно выделение этих маркеров фиксируется у пациента В7 с ожирением 3 степени и находящимся в группе риска по развитию сахарного диабета 2 типа, в группе условной нормы присутствие данных маркеров надежно не зафиксировано.
Таблица 4.
Примеры параметров “электронного носа – диагноста” проб
| Название пробы | Группа здоровья | Параметры “электронного носа” | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A1/5 | A1/8 | A2/6 | A2/8 | A3/5 | A6/8 | A7/8 | ɷ3 | ɷ4 | ɷ5 | ɷ8 | ||
| Глиоксаль | 0.18 | 0.50 | 0.93 | 0.70 | 0.51 | 0.75 | 0.40 | 15.3 | 18.0 | 30.0 | 10.9 | |
| Ацетон | 0.31 | 0.56 | 0.50 | 0.56 | 0.63 | 1.11 | 1.22 | 12.9 | 14.3 | 20.8 | 11.7 | |
| Пентанол-1 | 0.62 | 0.27 | 0.24 | 0.12 | 0.31 | 0.51 | 0.93 | 6.8 | 11.9 | 21.5 | 49.6 | |
| Масляная кислота | 0.39 | 0.48 | 0.65 | 0.60 | 0.68 | 0.92 | 1.32 | 11.5 | 12.0 | 17.0 | 13.7 | |
| Молочная кислота | 0.20 | 0.50 | 0.80 | 0.67 | 0.52 | 0.83 | 0.50 | 14.9 | 17.3 | 28.5 | 11.2 | |
| В6P1 | Сахарный диабет 1 типа | 0.14 | 0.48 | 1.14 | 0.66 | 0.65 | 0.57 | 0.43 | 19.7 | 22.9 | 30.1 | 8.70 |
| В6P2 | 0.14 | 0.48 | 1.05 | 0.64 | 0.65 | 0.61 | 0.41 | 19.5 | 23.1 | 30.1 | 8.6 | |
| В6P3 | 0.13 | 0.42 | 1.02 | 0.61 | 0.55 | 0.59 | 0.38 | 17.5 | 21.8 | 31.7 | 9.6 | |
| В6P4 | 0.13 | 0.41 | 0.96 | 0.58 | 0.55 | 0.60 | 0.36 | 17.3 | 20.8 | 31.8 | 10.1 | |
| В6P5 | 0.11 | 0.42 | 0.91 | 0.61 | 0.54 | 0.67 | 0.39 | 17.7 | 22.3 | 32.7 | 8.8 | |
| В7P1 | Ожирение 3 ст., группа риска, сахарный диабет 2 типа | 0.13 | 0.30 | 1.26 | 0.37 | 0.75 | 0.30 | 0.21 | 20.9 | 24.5 | 27.7 | 12.2 |
| В7P2 | 0.23 | 0.44 | 1.05 | 0.57 | 1.07 | 0.54 | 0.32 | 21.9 | 26.5 | 20.5 | 10.7 | |
| В7P3 | 0.22 | 0.62 | 0.90 | 0.67 | 0.85 | 0.74 | 0.41 | 20.9 | 24.5 | 24.7 | 8.6 | |
| В7P4 | 0.25 | 0.67 | 0.94 | 0.70 | 1.03 | 0.74 | 0.49 | 22.2 | 26.7 | 21.7 | 8.1 | |
| B13P1 | Условная норма | 0.24 | 0.60 | 1.0 | 0.66 | 0.90 | 0.66 | 0.40 | 20.7 | 24.8 | 23.1 | 9.4 |
| B14P1 | Условная норма | 0.27 | 0.49 | 1.3 | 0.42 | 0.87 | 0.33 | 0.36 | 20.3 | 22.8 | 23.4 | 12.8 |
| B14P2 | 0.27 | 0.48 | 1.3 | 0.43 | 0.85 | 0.33 | 0.35 | 20.0 | 21.8 | 23.5 | 13.3 | |
| B15P2 | Условная норма | 0.26 | 0.44 | 1.3 | 0.44 | 0.81 | 0.33 | 0.33 | 19.2 | 21.4 | 23.8 | 14.0 |
| B16P1 | Условная норма | 0.25 | 0.41 | 1.2 | 0.41 | 0.79 | 0.35 | 0.33 | 19.7 | 22.5 | 24.8 | 13.1 |
| ± Δ | 0.02 | 0.02 | 0.02 | 0.03 | 0.03 | 0.02 | 0.02 | 2.0 | 2.0 | 2.0 | 1.0 | |
* * *
Положительно оценена возможность качественного анализа газовой смеси соединений, выделяемой кожей на предплечье рук, без предварительного разделения и отбора при помощи массива восьми пьезосенсоров “электронного носа – диагноста” (портативная модель). Оценена корреляции информации ЭНД и результатов стандартных клинических лабораторный исследований. Установлены коррелирующие параметры массива сенсоров и клинических исследований, тесно связанные между собой: ɑ120/60, ɑ60/80 и уровень мочевины, A1/2, A1/6 и уровень щелочной фосфатазы, A5/6, A5/7 и уровень глюкозы. Показана возможность применения подхода, основанного на сканировании летучего профиля кожи на предплечье в течение 3−6 мин, для ранжирования детей с ожирением на группы, связанные с важнейшими социально значимыми заболеваниями и состояниями с вероятностью развития сахарного диабета 2 типа и диагнозом сахарный диабет 1 типа. С помощью методов хемометрики оптимизирована методика анализа, обозначены условия исследования и точки контроля. Особенно важной задачей в условиях стационара является неинвазивный и безболезненный, быстрый мониторинг изменений. Для этого может быть использован летучий профиль кожи, чему будет посвящена наша следующая статья.
Работа частично выполнена в рамках гранта “УМНИК-2019” г/к №15477ГУ/2020 от 04.07.2020 г.
Список литературы
Всемирная организация здравоохранения. Вопросы и темы здравоохранения. URL: https://www.euro.who.int/ru/health-topics (дата обращения 31.01.2022).
Branca F., Nikogosian H., Lobstein T. The challenge of obesity in the WHO European Region and the strategies for response. Copenhagen: WHO Regional Office for Europe, 2007, P. 76.
Dietz W.H. Health consequences of obesity in youth: Childhood predictors of adult disease // Pediatrics. 1998. V. 101. P. 518.
Elgar F.J. Validity of self-reported height and weight and predictors of bias in adolescents // J. Adolesc. Health. 2005. V. 37. P. 371.
Eisenberg M.E., Ncumark-Sztainer D., Story M. Associations of weight-based teasing and emotional well-being among adolescents // JAMA Pediatrics. 2003. V. 157. P. 733.
Подростковое ожирение и связанное с ним поведение: тенденции и социальные неравенства в Европейском регионе ВОЗ, 2002–2014 годы: наблюдения по итогам совместного межнационального исследования ВОЗ “Поведение детей школьного возраста в отношении здоровья” (HBSC)./ URL: https://apps.who.int/iris/handle/10665/329418 (дата обращения 14.02.2022).
Раков А.Л. Глобальная эпидемия ожирения // Новая аптека. Аптечный ассортимент. 2008 № 6. С. 11.
Wilkinson P.W., Parkin J.M. Fat cells in childhood obesity // The Lancet. 1974. p. 1522. https://doi.org/10.1016/s0140-6736(74)90266-9
Литвицкий П.Ф. Патофизиология: Учебник: 2-е изд., испр. и доп. М.: ГЭОТАР-МЕД, 2003 г. Т. 1. С. 739.
Зайко Н.Н., Быць Ю.В., Атаман А.В. Патологическая физиология: Учебник для студентов мед. вузов / Под ред. Зайко Н.Н., Быця Ю.В. 3-е изд. М.: МЕДпресс-информ, 2002. С. 644.
Giorgio V., Graziano F., Nobili V. Pediatric nonalcoholic fatty liver dis-ease: Old and new concepts on development, progression, metabolic insight and potential treatment targets // BMC Pediatr. 2013. V. 13. P. 40.
Azad K., Parkin J.M., Court S., Laker M.F., Alberti K.G. Circulating lipids and glycaemic control in insulin dependent diabetic children // Arch. Dis. Child. 1994. V. 71. P. 108. https://doi.org/10.1136/adc.71.2.108
Daviss B. Growing pains for metabolomics // The Scientist. 2005. V. 19. № 8. P. 25.
Максимова Е.Н., Марков В.Ф., Бездетнова А.Е., Шашмурин Ю.Г., Маскаева Л.Н., Дьяков В.Ф. Использование химических сенсоров для экспресс-диагностики заболеваний по выдыхаемому воздуху // Бутлеровские сообщения. 2019. Т. 60. № 12. С. 25.
Протощак В.В., Андреев Е.А., Карпущенко Е.Г., Слепцов А.В., Овчинников Д.В., Алентьев С.А., Лазуткин М.В., Мамаенко А.В., Мамаенко Т.В. Рак предстательной железы и обоняние собак: возможности неинвазивной диагностики // Урология. 2019. № 5. С. 22.
Балашова Л.М., Колесниченко И.И., Кантаржи Е.П., Коробкова Н.О., Черкашина Е.Л. Экспресс-скрининг сыворотки крови, слезы и жидкости передней камеры глаза методом мультисенсорной инверсионной вольтамперометрии в офтальмологии // Пролиферативный синдром в биологии и медицине. 2016. С. 95.
Карпищенко С.А., Джагацпанян И.Э., Лавренова Г.В., Малай О.П., Малышева М.И., Дуйкова М.В., Худяков Е.С., Семенова А.И., Волчек А.О. Диагностика халитоза у больных хроническим тонзиллитом с помощью мультисенсорного газоанализатора // Folia ORL et PR. 2020. Т. 26. № 4. С. 74.
Арсеньев А.В., Нефедов А.О., Ганеев А.А., Новиков С.Н., Нефедова А.В., Барчук А.А., Гагуа К.Э., Тарков С.А., Аристидов Н.Ю. Возможности диагностики рака легких с помощью прямого анализа выдыхаемого воздуха с использованием газовых сенсоров полупроводникового электронного носа // Исследования и практика в медицине. 2019. Т. 6. № S. С. 50.
Агейкин А.В., Колесова Е.В., Пронин И.А., Темников В.А. “Электронный нос” как прорыв в неинвазивной диагностике заболеваний // Молодой ученый. 2015. № 23. С. 308.
Обходский А.В., Попов А.С., Сачков В.И., Обходская Е.В. Использование нейронных сетей и технологии электронного носа для диагностики онкологических заболеваний / Молодежь и современные информационные технологии / Cборник трудов XVII Международной научно-практической конференции студентов, аспирантов и молодых ученых, Томск, 17–20 февраля 2020 года. Томск: Национальный исследовательский Томский политехнический университет, 2020. С. 174.
Родионов Е.О., Тузиков С.А., Миллер С.В., Кульбакин Д.Е., Чернов В.И. Методы ранней диагностики рака легкого // Сибирский онкологический журнал. 2020. Т. 19. № 4. С. 112.
Синицына О.В., Мешков Г.Б., Яминский И.В. “Электронный нос” для медицинских приложений: поиск новых материалов для сенсорных элементов // Медицина и высокие технологии. 2016. № 2. С. 40.
Wishart D.S., Tzur D., Knox C. HMDB: The human metabolome database // Nucl. Acids Res. 2007. V. 35. P. 521.
Dhananjayan K., Irrgang F., Muncha G. Determination of glyoxal and methylglyoxal in serum by UHPLC coupled with fluorescence detection // Anal. Biochem. 2019. V. 8. P. 241.
Raman M., Ahmed I., Gillevet P.M., Probert C.S., Ratcliffe N.M., Smith S., Greenwood R. Fecal microbiome and volatile organic compound metabolome in obese humans with nonalcoholic fatty liver disease // Clin. Gastroenterol. Hepatol. 2013. V. 11. P. 868.
Brown D.G., Rao S., Weir T.L., O’Malia J., Bazan M., Brown R.J., Ryan E.P. Metabolomics and metabolic pathway networks from human colorectal cancers, adjacent mucosa, and stool // Cancer Metab. 2016. V. 6. P. 4.
Sinha R., Ahn J., Sampson J.N., Shi J., Yu G., Xiong X., Hayes R.B., Goedert J.J. Fecal microbiota, fecal metabolome, and colorectal cancer interrelations // PLoS One. 2016. V. 25. P. 1.
Goedert J.J., Sampson J.N., Moore S.C., Xiao Q., Xiong X., Hayes R.B., Ahn J., Shi J. Fecal metabolomics: Assay performance and association with colorectal cancer // Carcinogenesis. 2014. V. 35. P. 2089.
Sugimoto M., Wong D.T., Hirayama A., Soga T., Tomita M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles // Metabolomics. 2010. V. 6. P. 78.
Liebich H.M., Woll J. Serum volatile substances: Profile analysis and quantification // J. Chromatogr. 1977. V. 11. № 142. P. 505.
Garner C.E., Smith S., de Lacy Costello B., White P., Spencer R., Probert C.S., Ratcliffe N.M. Volatile organic compounds from feces and their potential for diagnosis of gastrointestinal disease // FASEB J. 2007. V. 21. P. 1675.
Ahmed I., Greenwood R., Costello B., Ratcliffe N., Probert C.S. Investigation of faecal volatile organic metabolites as novel diagnostic biomarkers in inflammatory bowel disease // Aliment Pharmacol. Ther. 2016. V. 43. P. 596.
Marchesi J.R., Holmes E., Khan F., Kochhar S., Scanlan P., Shanahan F., Wilson I.D., Wang Y. Rapid and noninvasive metabonomic characterization of inflammatory bowel disease // J. Proteome Res. 2007. V. 6. P. 546.
Walton C., Fowler D.P., Turner C., Jia W., Whitehead R.N., Griffiths L., Dawson C., Waring R.H., Ramsden D.B., Cole J.A., Cauchi M., Bessant C., Hunter J.O. Analysis of volatile organic compounds of bacterial origin in chronic gastrointestinal diseases // Inflamm. Bowel Dis. 2013. V. 19. P. 2069.
Bjerrum J.T., Wang Y., Hao F., Coskun M., Ludwig C., Gunther U., Nielsen O. Metabonomics of human fecal extracts characterize ulcerative colitis, Crohn’s disease and healthy individuals // Metabolomics. 2015. V. 11. P. 122.
Bain M.A., Faull R., Milne R.W., Evans A.M. Oral L-carnitine: Metabolite formation and hemodialysis // Curr. Drug Metab. 2006. V. 7. P. 811.
Azario I., Pievani A., Del Priore F., Antolini L., Santi L., Corsi A., Cardinale L. Neonatal umbilical cord blood transplantation halts skeletal disease progression in the murine model of MPS-I // Sci. Rep. 2017. V. 25. № 7. P. 73.
Kuchmenko T.A., Lvova L.B. A Perspective on recent advances in piezoelectric chemical sensors for environmental monitoring and foodstuffs analysis // Chemosensors. 2019. V. 7. № 3. P. 39.
Кучменко Т.А., Доровская Е.С., Менжулина Д.А., Умарханов Р.У. Мобильное устройство на основе массива сенсоров для анализа биопроб малого объема. Патент на изобретение 2764964 C1 РФ, 24.01.2022. Заявка № 2021110885 от 16.04.2021.
Кучменко Т.А., Шуба А.А., Умарханов Р.У., Черницкий А.Е. Оценка корреляции сигналов “электронного носа” для носовой слизи и конденсата выдыхаемого воздуха телят с клиническими и лабораторными показателями // Аналитика и контроль. 2019. Т. 23. № 4. С. 557. https://doi.org/10.15826/analitika.2019.23.4.014
Кучменко Т.А., Доровская Е.С., Босикова Ю.Н., Сметанкина А.В., Битюкова В.В. Применение “электронного носа” на пьезосенсорах для сканирования летучих соединений гинекологических проб // Журн. аналит. химии. 2021. Т. 76. № 7. С. 634. (Kuchmenko T.A., Dorovskaya E.S., Bosikova Y.N., Smetankina A.V., Bityukova V.V. Application of an electronic nose based on piezoelectric sensors for scanning volatile compounds of gynecological tests // J. Anal. Chem. 2021. V. 76. № 7. P. 868.)
Кучменко Т.А., Умарханов Р.У., Менжулина Д.А. Биогидроксиапатит – новая фаза для селективного микровзвешивания паров-маркеров воспаления в носовой слизи телят и человека. Сообщение 2. Анализ реальных объектов // Сорбционные и хроматографические процессы. 2021. Т. 21. № 2. С. 216. https://doi.org/10.17308/sorpchrom.2021.21/3355
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


