Журнал аналитической химии, 2022, T. 77, № 4, стр. 354-365
Перспективы использования хромато-масс-спектрометрии для определения липидов в клинической кардиолипидологии
А. В. Алесенко a, *, М. А. Шупик a, У. А. Гутнер a, Д. А. Затейщиков b, **, Л. О. Минушкина b, А. А. Рогожина b, А. Т. Лебедев c, ***, О. А. Малошицкая a, c, С. А. Соколов c, И. Н. Курочкин a, c
a Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119334 Москва, ул. Косыгина, 4, Россия
b Центральная государственная медицинская академия УД ПРФ
121359 Москва, ул. М. Тимошенко, 19, стр. 1А, Россия
c Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 3, Россия
* E-mail: alicealessenko@gmail.com
** E-mail: zd@bk.ru
*** E-mail: mocehops@yandex.ru
Поступила в редакцию 23.05.2021
После доработки 21.06.2021
Принята к публикации 05.07.2021
- EDN: KQGOEG
- DOI: 10.31857/S0044450222040028
Аннотация
Кардиолипидология – новое направление в кардиологии – интенсивно развивается благодаря методу масс-спектрометрии. Особое значение этот метод приобрел для определения молекулярных видов сфинголипидов, метаболизм которых тесно связан с метаболизмом холестерина. Методом хромато-масс-спектрометрии изучены изменения в уровне ряда сфинголипидов, претендующих на роль маркеров сердечно-сосудистых заболеваний (ССЗ) (молекулярных форм сфингомиелинов, церамидов, глюкозилцерамидов, сфингозина и сфинганина), в плазме крови пациентов с наследственными формами раннего атеросклероза (семейной гиперлипидемии, СГЛ). Исследуемая группа (52 человека) состояла из пациентов с острой манифестацией атеросклероза, с постинфарктным кардиосклерозом, с дислипидемией или ранними ССЗ. У больных с семейной СГЛ отмечалось увеличение доли длинноцепочечного сфингомиелина SM18:1/22:0 и уровня церамидов с углеродной цепью С20-1 и С22-1. У больных с высокой клинической вероятностью СГЛ выявлено повышение уровня сфингозина, обладающего проапоптотическими свойствами, который может рассматриваться в качестве маркера дополнительного риска сердечно-сосудистых осложнений. Поиск новых маркеров ССЗ позволит совершенствовать персонифицированный подход к ведению таких больных и улучшить результаты их лечения.
Клиническая липидология – это академическая дисциплина, которая в первую очередь ориентирована на знание патофизиологии, диагностики и клинического лечения липидных и липопротеиновых нарушений при многих патологиях, включая сердечно-сосудистые заболевания (ССЗ). Установлена роль глицерофосфолипидов и сфинголипидов как факторов риска развития ССЗ и сосудистых осложнений при многих других патологиях.
Сердечно-сосудистые заболевания остаются главной причиной смертности в индустриально развитых странах. В настоящее время, несмотря на внедрение высокотехнологичных методов диагностики и лечения атеросклероза и его осложнений, резко увеличились инвалидизация и смертность населения в трудоспособном возрасте, определяемые так называемой “ранней” ишемической болезнью сердца (ИБС). Одним из самых значимых факторов риска атеросклероза является гиперхолестеринемия. При гиперхолестеринемии основой скрининга является обычный анализ липидного спектра, включающий определение уровня общего холестерина, холестерина липопротеидов низкой и высокой плотности, триглицеридов. С другой стороны, во многих ведущих клиниках мира все чаще стали определять сфинголипиды в качестве дополнительных маркеров риска сердечно-сосудистых и многих других заболеваний [1–3]. На сегодняшний день имеются результаты исследований на животных моделях, культуре тканей и у людей [4–6], которые демонстрируют возможность участия сфинголипидов в патогенезе многих ССЗ и других патологиях. Опубликованы работы, демонстрирующие значение сфинголипидов как факторов риска развития сосудистых осложнений у больных сахарным диабетом и метаболическим синдромом [7], а также при дислипидемии и повышении уровня артериального давления [4, 8, 9].
Сфинголипиды – это группа липидов, в состав которых входит молекула алифатического спирта сфингозина. К ним относятся сфингомиелины, цереброзиды, церамиды, сфингозины и сфингозин-1-фосфат (рис. 1).
Рис. 1.
Cхема фрагментации церамидов, сфингомиелинов, сфингозина, сфинганина и галактозтлцерамидов, исследуемых методом масс-спектрометрии. Стрелками обозначены сайты фрагментаций.
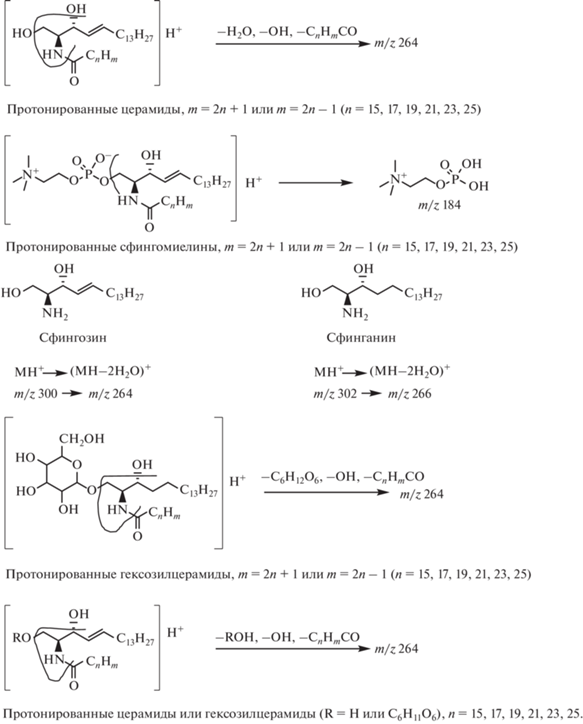
Установлено, что катаболизм сфинголипидов связан с катаболизмом холестерина, однако точный механизм этой связи до сих пор неизвестен. Не исключено, что первопричина накопления холестерина в условиях гиперхолестеринемии может быть связана с нарушениями в метаболизме сфингомиелина. В связи с этим более адекватная коррекция уровня холестерина может определяться нормализацией метаболизма сфинголипидов [4].
Для функции клетки чрезвычайно важны не только холестерин и сфинголипиды как отдельные представители клеточного и мембранного липидома, но и их комплексы. Они представляют динамический дуэт, который образуется в ответ на воздействия, которым подвергается клетка. Однако они могут выступать и в качестве “недружелюбных” партнеров в случае их дисбаланса в результате различных патологий сердечно-сосудистой системы и мозга [10, 11].
Как правило, в виде комплекса холестерин и сфингомиелин существуют в структурах рафтов – специфических мембранных образований, на ко-торых расположены сигнальные комплексы [11, 12]. Тесное взаимодействие между стерольным кольцом холестерина и церамидной последовательностью сфингомиелина приводит к образованию специфического домена. В этих микродоменах холестерин выполняет стабилизирующую функцию, заполняя пустоты между большим объемом сфинголипидов. Холестерин-сфингомиелиновое взаимодействие определяет переход этих доменов в жидко-упорядоченную или желеобразную фазу, что определяет уникальную характеристику рафтов. Другие же домены клеточной мембраны существуют в более дезорганизованных жидких фазах из-за отсутствия холестерин-сфингомиелинового взаимодействия. Содержание холестерина в мембране четко коррелирует с содержанием сфинголипидов [13]. При снижении уровня сфингомиелина и церамида содержание холестерина также падает. Активация сфингомиелиназы ускоряет этерификацию холестерина без увеличения пула клеточного холестерина [14]. При этом сфингозин, который является продуктом ферментативной деградации церамида, ингибирует этерификацию холестерина [15]. Не исключено, что первопричиной накопления холестерина может быть увеличение уровня сфингомиелина.
Таким образом, тестирование уровня сфинголипидов при атеросклерозе может быть таким же значимым и информативным, как и определение уровня холестерина. Применение лекарственных средств, корректирующих патологические изменения в метаболизме сфинголипидов, могут быть более эффективными, чем, например, терапия с использованием статинов. Исследования роли сфинголипидов в развитии ССЗ непременно дадут возможность обнаружить новые мишени из числа ферментов сфинголипидного метаболизма (сфингомиелиназ и церамидаз) и создать новые лекарственные препараты для предупреждения и лечения сердечно-сосудистых заболеваний.
Измерение уровня липидов, в основном общего холестерина, общих триглицеридов, липопротеинов низкой плотности и холестерина липопротеинов высокой плотности, до настоящего времени являлось обычной клинической практикой сердечно-сосудистых заболеваний и гиполипидемической терапии. Более того, детальная оценка липидного состава, т.е. молекулярных видов, которые относятся к классам липидов, практически не используется из-за сложности их диагностики. Однако установлено, что липидом человека включает тысячи единиц молекулярных разновидностей с функциональным разнообразием. Молекулярные виды липидов внутри липидных классов имеет модульную структуру, определяемую большим разнообразием жирных кислот, прикрепленных к общей основной цепи, которая определяет класс липидов. Конъюгированные жирные кислоты могут различаться по длине углеродной цепи, количеству, положению и конфигурации (цис- или транс-) их двойных связей, а также по положению и типу (ацил-, алкил- или винил-) связи с основной цепью. Учитывая все это разнообразие сфинголипидов, метод анализа должен надежно дифференцировать все липиды в соответствии с типом сфингоидного основания, жирнокислотными остатками и типом гидрофобной головы. Современная масс-спектрометрия (МС) позволяет анализировать все это разнообразие липидома человека [16–18]. Она дает возможность достаточно легко получать информацию об элементном составе липида, природе жирных кислот, наличии двойных связей. Сложнее выявить положение двойных связей и кислотных остатков в молекуле липида, включая даже дифференцирование оптических изомеров у центрального атома глицеринового остатка. Поскольку полная характеристика молекулы липида требует продвинутых методов тандемной масс-спектрометрии, зачастую полная структурная идентификация не проводится, а анализ ограничивается установлением класса липида, его молекулярной массы и природы жирнокислотных групп [17].
Наиболее популярными методами ионизации в липидомике являются электрораспыление [19], химическая ионизация при атмосферном давлении [20] и матрично активированная лазерная десорбция/ионизация (МАЛДИ) [16, 21]. Интересные результаты о структуре липидов могут быть получены и методами ионизации на открытом воздухе [22, 23]. В качестве масс-анализаторов используют устройства практически любого типа: секторные [24], квадрупольные [25, 26], времяпролетные [27, 28], ионные ловушки [25, 29–31], а также масс-спектрометры ионного циклотронного резонанса [32].
Развитие методов жидкостной хроматографии ультравысокого разрешения в комбинации с масс-спектрометрией дало толчок к изучению самых разнообразных липидных маркеров, в том числе ассоциированных с ранним развитием атеросклероза [1–4]. Фактически методы жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), благодаря своей информативности, селективности, чувствительности, широчайшему динамическому диапазону, являются на сегодняшний день наиболее эффективными для исследования липидов всех типов, включая минорные компоненты [17, 25, 29, 30].
В настоящее время в липидомике существует два основных подхода. Первый основан на предварительном хроматографическом разделении компонентов образца, как правило, методом ЖХ, и вводе элюата в масс-спектрометр в онлайн режиме, а второй – на прямом вводе всей пробы непосредственно в ионный источник (скорострельная липидомика) [17]. Основным достоинством второго подхода является возможность получения сигнала молекулярного иона конкретного липида с постоянной интенсивностью. Это позволяет проводить любые тандемные эксперименты, необходимые для установления структурных особенностей молекулы. Тем не менее следует учитывать, что при вводе сложных смесей в источник ионизации возможна дискриминация отдельных компонентов [17].
Наиболее информативными, безусловно, являются подходы с использованием тандемной масс-спектрометрии и масс-спектрометрии высокого разрешения. Для установления структуры липидов полезными оказываются все варианты МС/МС, включая спектры ионов-продуктов, ионов-предшественников, выбросов идентичных нейтральных частиц, а также мониторинг выбранных реакций [17]. Структурная близость липидов одного типа позволяет использовать для идентификации и определения методы вычислительной липидомики. В частности, предложен вариант одновременного полуколичественного определения более 800 фосфолипидов в клеточных экстрактах [33]. На основании интенсивностей пиков биомаркеров в экспериментальных образцах можно сравнивать однотипные образцы, выявлять тонкие различия, свидетельствующие о протекании каких-либо эндогенных или экзогенных процессов, осуществлять надежную диагностику заболеваний.
Для сфинголипидов, участие которых в патогенезе сердечно-сосудистых заболеваний в настоящее время интенсивно изучается, возможно полное установление структуры по масс-спектрам как положительных, так и отрицательных ионов. Сфинголипиды достаточно легко ионизируются, а фрагментация ионов дает исчерпывающую информацию об углеводородном составе молекул и о типе гидрофобной части молекулы. Например, все сфинголипиды легко протонируются, а сфингозин-1-фосфаты, сфингомиелины, сульфатиды и ганглиозиды образуют также депротонированные молекулы с удобной регистрацией соответствующих отрицательных ионов. Проведение фрагментации как простых, так и сложных сфинголипидов позволяет узнать тип гидрофильной части молекулы и жирнокислотный состав. Например, сфингомиелины можно легко отличить от других классов липидов по интенсивному пику с m/z 184 в спектрах ДАС (диссоциация, активированная соударениями) их протонированных молекул. Этот пик обусловлен протонированной головной фосфохолиновой группой [17]. На рис. 1 приведена схема фрагментации изученных нами сфинголипидов. Однако, поскольку при фрагментации заряд обычно остается на гидрофильной части молекулы (как, например, в случае сфингомиелинов), для подробного исследования структуры жирных кислот, присоединенных к сфингоидному основанию, необходимо использовать тандемную масс-спектрометрию с регистрацией нескольких поколений фрагментных ионов (метод MСn) [17].
В силу сложности анализируемых молекул и, как следствие, большого количества возможных осколков, образующихся при фрагментации, разработана специальная номенклатура для описания этих осколочных ионов, позволяющая определить состав исходной молекулы по “отпечаткам пальцев” [34, 35].
При исследовании молекул со сфингоидным основанием, а также сфингозин-1-фосфатов методом анализа ионов-предшественников необходимо помнить, что молекулы, содержащие четыре и более двойных связей, образуют более интенсивные ионы-продукты, чем молекулы с меньшим количеством двойных связей. Это означает, что при проведении количественного анализа необходимо использовать стандарты как для молекул без двойных связей, так и для молекул с двойными связями. Кроме того, насыщенные молекулы (например, сфинганины) образуют в условиях популярных вариантов тандемной масс-спектрометрии ДАС с высокой энергией ионы-продукты с m/z 60, которые являются более специфичными, чем обычные продукты дегидратации. Оптимизация условий ионизации и ДАС для молекул со сфингоидными основаниями приводит к надежным результатам их анализа [17]. Однако определение молекул со сфингоидным основанием методом анализа ионов-предшественников сопряжено с определенными сложностями. Во-первых, ионизация может подавляться в присутствии большого количества других молекул в экстракте. Во-вторых, необходимо учитывать влияние эффективных размеров молекулы (т.е. длины цепи и количества двойных связей) на процесс фрагментации. Ионы с меньшим количеством атомов обладают меньшим количеством степеней свободы, поэтому на каждую из них приходится большая энергия, что может приводить к дополнительной фрагментации. При тех же условиях для больших молекул на каждую степень свободы приходится меньше энергии, поэтому фрагментация проходит менее эффективно, что снижает сигнал от этих ионов. Этот эффект хорошо заметен при исследовании С2-церамидов и природных длинноцепочечных церамидов [36]. Однако в природных церамидах с длиной цепи 16–26 атомов углерода этот эффект выражен меньше.
Для определения сфинголипидов широко используются оба варианта ВЭЖХ-анализа: с обращенной фазой (для отделения сфингозина от сфинганина) и с нормальной фазой (для отделения церамидов от сфингомиелинов). Использование хроматографии не всегда эффективно, поскольку, например, сфингозин и сфинганин можно разделить и в условиях прямого ввода образца. Однако если в биологическом образце содержится большое количество сфингозина, то он затрудняет количественное определение сфинганина и требует предварительного хроматографического разделения. Тем не менее есть работы, в которых сфинголипиды эффективно анализируются методом прямого ввода [34, 37]. Преимуществом такого подхода является значительное уменьшение продолжительности анализа одного образца.
Цель настоящего исследования – изучение особенности спектра сфинголипидов у больных, имеющих различную клиническую вероятность семейной гиперлипидемии. Для этого изучали полученные методом ЖХ-МС качественные и количественные характеристики сфинголипидов в образцах крови больных с рядом ССЗ, в частности, семейной гиперхолестеренемии (СГЛ). Следует подчеркнуть, что прогностическая значимость церамидов уже оценивалась в зарубежных исследованиях, однако уровень церамидов определялся у больных с острым коронарным синдромом [2]. В то же время особенности сфинголипидома у больных с наследственными дислипидемиями пока не изучены.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Состав пациентов с наследственными формами раннего атеросклероза. Изучали изменения в уровне ряда сфинголипидов, претендующих на роль маркеров ССЗ (молекулярных форм сфингомиелинов, церамидов, гексозиллцерамида, сфингозина и сфинганина), в плазме крови пациентов с наследственными формами раннего атеросклероза. Группа включала n = 52 человека. Данная группа состояла из пациентов с острой манифестацией атеросклероза, которая завершается инфарктом или инсультом (острый коронарный синдром (ОКС), n = 6); с острым нарушением мозгового кровообращения, атеротромботический вариант (ОНМК, n = 9); постинфарктного кардиосклероза (ПИКС, n = 8), а также из больных с дислипидемией, которая характеризуется либо повышением уровней холестерина и/или триглицеридов, либо снижением уровня холестерина липопротеидов высокой плотности (ЛВП) в плазме, что способствует развитию атеросклероза (n = 28), и одного пациента с периферическим атеросклерозом. Среди перечисленных больных особую группу составляли пациенты с различной клинической вероятностью семейной гиперлипидемии. В эту группу входило 35 больных (15 мужчин (42.9%) и 20 женщин (57.1%), средний возраст 49.8 ± ± 9.96 лет) с дислипидемией или ранними сердечно-сосудистыми заболеваниями, развившимися в возрасте до 55 лет у мужчин и до 60 лет у женщин. Клиническую вероятность семейной дислипидемии оценивали по критериям сети Голландских липидных клиник. Десять больных имели низкую вероятность СГЛ (1–2 балла), у 22 больных диагноз расценивался как вероятная СГЛ (3–5 баллов), у трех больных – возможная или определенная СГЛ (два больных 6 баллов и один больной 9 баллов).
Определяли параметры со следующими референсными значениями: общий холестерин (2.0–5.2 ммоль/л), холестерин липопротеинов низкой плотности (ЛНП) (до 3.3 ммоль/л), липопротеинов высокой плотности (0.91–1.56 ммоль/л), триглицеридов сыворотки крови (0.50–1.70 ммоль/л) на биохимическом анализаторе CLIMA MC-15 (RAL, Испания).
Методы определения сфинголипидов. Липиды из плазмы выделяли по методу Блайя–Дайера.
Масс-спектрометрия. Масс-спектрометрическую идентификацию и определение молекулярных видов сфингомиелинов, церамидов и сфингоидных оснований (сфингозина и сфинганина) проводили на масс-спектрометре TSQ Endura (Thermo Fisher Scientific, Германия) в режиме мониторинга множественных реакций (ММР). На рис. 1 представлена схема фрагментации сфинголипидов, исследуемых методом МС. Для церамидов фрагментацию исходных протонированных и дегидратированных молекул проводили при энергии 20 эВ с образованием фрагмента с m/z 264.2 Да, время измерения сигнала составляло 30 мс. Для сфингомиелинов при энергии 20 эВ в качестве иона продукта выбрали фрагментный ион с m/z 184.1 Да, время измерения сигнала составляло 30 мс. Для сфингозина фрагментацию протонированных молекул проводили при энергии 12.5 эВ с образованием ионов-продуктов с m/z 252.2 Да, время измерения сигнала составляло 30 мс. Для сфинганина при энергии 12.5 эВ с образованием иона-продукта с m/z 266.2 Да время измерения сигнала составляло 30 мс.
Концентрации сфингомиелинов, церамидов и сфингоидных оснований определяли методом внешнего стандарта. В качестве стандартов использовали сингозин d7, сфинганин, сфингомиелин d18:1/16:0, сфингомиелин d18:1/18:0, церамид d18:1/16:0, церамид d18:1/18:1, церамид d18:1/18:0, церамид d18:1/24:1, церамид d18:1/24:0 фирмы “Avanti” (США). Для определения церамидов использовали площади пиков ММР-переходов [М + Н–Н2О]+· → 264.2 Да, для сфингомиелинов [M + H]+· → 184.1 Да, для сфингозина 300.2 → 252.2 Да, для сфинганина 302.2 → → 266.2 Да.
Хроматографическое разделение проводили с использованием системы Ultimate 3000 (Thermo Fisher Scientific, Германия) на колонке Eclipse Plus C8 3.0 × 150 мм (Agilent, США), размер частиц 3,5 мкм. При определении церамидов и сфингомиелинов колонку термостатировали при 35°C, поток – 500 мкл/мин; использовали следующие подвижные фазы: фаза А – 1 мМ раствор формиата аммония в воде + 0.1% (по объему) муравьиной кислоты, фаза Б – 1 мМ раствор формиата аммония в метаноле + 0.1% (по объему) муравьиной кислоты (с 0 до 14 мин градиент фазы Б от 75 до 100%, с 14 по 24 мин 100% фазы Б, с 24 до 26 мин градиент фазы Б от 100 до 75%, с 26 по 30 мин 75% фазы Б). Параметры источника ионизации и квадруполей: температура нагревателя 350°С, температура капилляра 300°С, поток распыляющего газа 50 arb (приборные единицы), поток вспомогательного газа 15 arb, поток обдувочного газа 2 arb, напряжение на капилляре 3.5 кВ, разрешение квадруполей Q1/Q3 1.2/1.2 Да, давление газа в ячейке соударений 2 мТорр.
При определении сфинганина и сфингозина колонку термостатировали при 50°C, поток – 400 мкл/мин; использовали следующие подвижные фазы: фаза А – вода + 0.1% (по объему) муравьиной кислоты, фаза Б – метанол + 0.1% (по объему) муравьиной кислоты (с 0 до 0.7 мин 55% фазы Б, с 0.7 до 6.7 мин градиент фазы Б от 55 до 100%, с 6.7 до 18 мин 100% фазы Б, с 18 до 20 мин градиент фазы Б от 100 до 55%, с 20 по 25 мин 55% фазы Б). Параметры источника ионизации и квадруполей: температура нагревателя 340°C, температура капилляра 300°C, поток распыляющего газа 45 arb, поток вспомогательного газа 13 arb, поток обдувочного газа 2 arb, напряжение на капилляре 3.5 кВ, разрешение квадруполей Q1/Q3 1.2/1.2 Да, давление газа в ячейке соударений 2 мТорр.
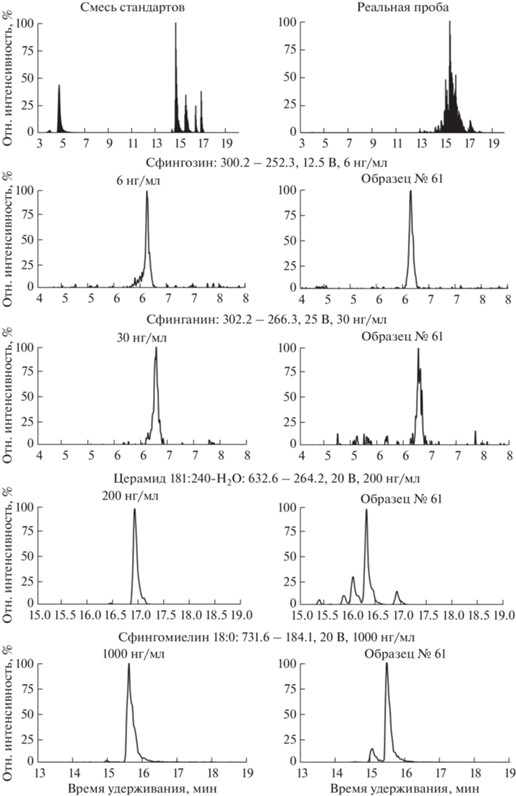
На рис. 2 приведены примеры масс-хроматограмм, полученных при определении сфингозина, сфинганина и молекулярных видов сфингомиелинов и церамидов.
Рис. 2.
Масс-хроматограммы сфингозина, сфинганина, сфингомиелина, церамида и соответствующих стандартов.
Статистическую обработку результатов проводили с помощью пакета программ SPSS версия 23.0. Количественные переменные представлены в виде SE ± SD. Для всех количественных переменных выполняли проверку на соответствие нормальному распределению с использованием теста Шапиро-Уилкса. Распределение всех количественных переменных отличалось от нормального. Достоверность различий оценивали для двух независимых выборок по критерию Манн-Уитни, для трех и более – по критерию Крускал–Уолли.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Измерение клинических параметров. У всех групп больных измеряли уровни холестерина и триглицеридов, которые в настоящее время рассматриваются в качестве основных маркеров атеросклероза. Наблюдали резкие колебания уровней этих липидов в крови индивидуальных пациентов с различными видами осложнений атеросклероза. Значения холестерина изменяются от 3.5 до ~20 единиц. Эти колебания могут отражаться на содержании отдельных классов сфинголипидов.
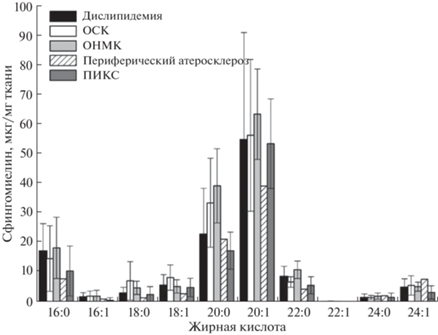
Определение молекулярных видов сфингомиелинов. Рис. 3 иллюстрирует различия в содержании молекулярных видов сфингомиелинов при разнообразных осложнениях ранней клинической манифестации атеросклероза, включая дислипидемию, острый коронарный синдром, острое нарушение мозгового кровообращения и периферический атеросклероз. Определили уровни содержаний сфингомиелинов с длинами цепей жирных кислот от С16 до С24 с насыщенными и одной двойной связью. Более высокие уровни сфингмиелинов с жирными кислотами С16:0, С18:0 и С20:0 зарегистрированы в плазме пациентов с диагнозами дислипидемия, ОКС и ОНМК. Во всех случаях сердечно-сосудистых патологий отмечено низкое содержание сфингомиелинов С24:0 и С24:1.
Рис. 3.
Различия в уровнях молекулярных видов сфингомиелинов при разнообразных осложнениях ранней клинической манифестации атеросклероза.
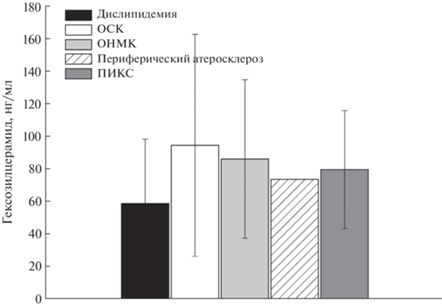
Определение молекулярных видов церамидов. В отличие от сфингомиелинов, длинноцепочечные церамиды (С24:0 и С24:1) в образцах плазмы пациентов присутствуют в значительно большем количестве по сравнению с короткоцепочечными церамидами (рис. 4). Можно предположить, что в случае развития атеросклероза проапоптотические церамиды генерируются именно из молекул cфинголипидов, содержащих длинные углеродные цепи. Известно [15], что окислительный стресс ассоциирован именно с увеличением уровня длинноцепочечных церамидов. Выявлены прямые корреляции уровня холестерина крови и церамидов С24:0 и С24:1. Уровни гексозилцерамидов практически одинаковы для всех типов ССЗ (рис. 5).
Рис. 4.
Различия в уровнях молекулярных видов церамидов при разнообразных осложнениях ранней клинической манифестации атеросклероза.
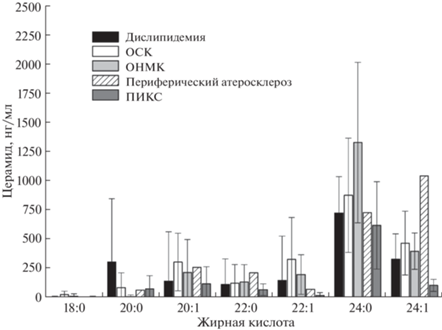
Рис. 5.
Различия в уровнях гексозилцерамидов при разнообразных осложнениях ранней клинической манифестации атеросклероза.
Установлено, что содержание общих сфинголипидов и церамидов в окисленных ЛНП существенно выше, что может служить подтверждением роли сфинголипидов в дестабилизации атеросклеротической бляшки и формировании обострения ИБС и других заболеваний [10].
Определение сфингозина и сфинганина. Наблюдаемая динамика сфингозина при разных осложнениях атеросклероза может свидетельствовать о его активном участии в течении этих заболеваний. Больные с отягощенным семейным анамнезом имели более высокий уровень сфингозина, однако уровень сфинганина при этом был очень низким и практически одинаковым при всех типах ССЗ. Вероятно, эти липиды не участвуют в исследуемом патологическом процессе (рис. 6). Установили связь накопления сфингозина со степенью клинической вероятности семейной гиперлипидемии, т.е. тяжестью заболевания. Как видно из табл. 1, уровень сфингозина у пациентов с отягощенным семейным анамнезом атеросклероза повышен. Участие сфингозина в патогенезе ССЗ установлено нами впервые; повышение его уровня в плазме пациентов с наследственными формами дислипидемии может быть использовано в качестве маркера риска развития ИБС у таких пациентов. Табл. 1 также демонстрирует корреляции между уровнем классических липидов и сфингозина у пациентов с отягощенными и неотягощенными семейными анамнезами. Обращает на себя внимание тот факт, что прямая корреляция между уровнем холестерина ЛНП и сфингозина, выявленная в целом по группе, сильнее проявляется у пациентов с отягощенным семейным анамнезом (r = 0.536, p = 0.022). Накопление сфингозина может отражать его способность активировать процессы пероксидного окисления [38] и агрегации Cu2+-пероксидных везикул, ускоряя процессы окисления ЛНП, делая их более атерогенными. Сфинганин также активирует процессы пероксидного окисления [38]. В нашем исследовании у пациентов с установленной семейной дислипидемией отмечали существенное повышение уровня сфингозина. Уровень сфинганина у пациентов с низкой и высокой вероятностью семейной гиперлипидемии достоверно не отличался. Таким образом, сфингозин может участвовать в патогенезе семейной дислипидемии и служить новым маркером сердечно-сосудистых заболеваний.
Рис. 6.
Различия в уровнях сфингоидных оснований (сфингозина и сфинганина) при разнообразных осложнениях ранней клинической манифестации атеросклероза.
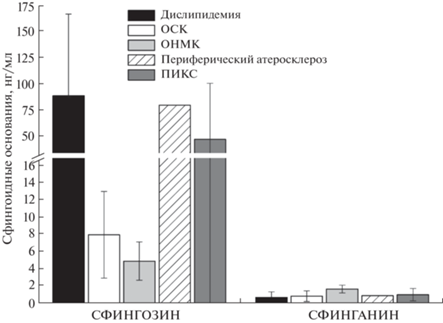
Таблица 1.
Уровень липидов и сфингоидных оснований у пациентов с различной клинической вероятностью семейной гиперлипидемии
| Параметр | Низкая вероятность СГХС (n = 10) | Возможная вероятность СГХС (n = 22) |
Вероятная/ определенная СГХС (n = 3) |
p |
|---|---|---|---|---|
| ОХС, мМ | 6.7 ± 0.6 | 8.0 ± 1.7 | 12.00 ± 5.3 | 0.006 |
| ЛНП, мМ | 4.3 ± 0.4 | 5.4 ± 1.0 | 7.2 ± 1.4 | 0.001 |
| ЛВП, мМ | 1.5 ± 0.4 | 1.4 ± 0.4 | 1.2 ± 0.6 | 0.713 |
| ТГ, мМ | 1.8 ± 1.1 | 2.4 ± 3.2 | 5.8 ± 6.1 | 0.240 |
| Сфингозин, нг/мл | 50.1 ± 62.4 | 83.6 ± 70.8 | 144.4 ± 107.9 | 0.051 0.010 |
| Сфинганин, нг/мл | 0.8 ± 0.4 | 0.9 ± 0.6 | 1.7 ± 1.4 | 0.142 |
* * *
В ряде зарубежных клиник уже в течение более десяти лет проводят определение уровня сфинголипидов в плазме крови в качестве маркеров для ранней диагностики ишемии сердца и гипертонии у людей. Некоторые маркеры из числа сфинголипидов могут быть прогностически более значимыми, чем классические маркеры. Так, сфингозин-1-фосфат оказался более четким маркером периферического атеросклероза, чем уровень холестерина ЛВП. Следует отметить, что интерес к роли липидов в развитии различных патологий, включая сердечно-сосудистые, возрос не только в связи с определяющей ролью липидов в патогенезе этих заболеваний, но и благодаря развитию метода масс-спектрометрии и его успешному применению в липидологии и, в частности, в сфинголипидологии. Применение метода масс-спектрометрии способствовали развитию нового направления в кардиологии – кардиолипидологии. Проведены пилотные липидомные исследования материала атеросклеротических бляшек человека, а также липидома плазмы крови при ИБС, инфаркте миокарда, гипертонической болезни и т.д. В отечественных клиниках такие исследования пока не ведутся. Мы полагаем, что применение современных методов анализа липидома при ССЗ будет способствовать более успешному лечению этих заболеваний.
В настоящей работе впервые методом ЖХ-МС исследованы новые маркеры семейной гиперхолестеренемии из числа сфинголипидов. Определены молекулярные виды сфингомиелинов, церамидов гексозилцерамидов и сфингоидных оснований (сфингозина, сфинганина) в плазме крови пациентов с различными видами ССЗ. Показано, что больные с определенной/вероятной СГЛ имели достоверно более высокий уровень сфингозина по сравнению с больными с низкой клинической вероятностью СГЛ (144.36 ± 107.863 нг/мл и 50.14 ± ± 62.409 нг/мл, р = 0.01). У больных с семейной СГЛ отмечено увеличение доли длинноцепочечного сфингомиелина SM18:1/22:0, а также выявлено существенное увеличение уровня церамидов с длинной углеродной цепью (С20:1 и С22:1). Установлены значимая прямая корреляция уровня ЛПН и сфингозина (r = 0.344, p = 0.047) и значимые обратные корреляции уровня ЛВП и сфинганина (r = –0.52, p = 0.002) и галактозилцерамида (r = = –0.56, p = 0.001). Таким образом, у больных с высокой клинической вероятностью СГЛ повышен уровень сфингозина, обладающего проапоптотическими свойствами, который может рассматриваться в качестве маркера дополнительного риска сердечно-сосудистых осложнений. Уточнение механизмов ускоренного развития атеросклероза, исследование роли наследственных факторов может в этой ситуации позволить совершенствовать персонифицированный подход к ведению таких больных и улучшить результаты их лечения. Учитывая отсутствие данных о популяционных частотах известных наследственных нарушений липидного обмена в Российской Федерации, данное исследование позволит предложить новые критерии для выявления ранних признаков семейной гиперхолестеренемии, используя в качестве маркеров уровень сфингозина и церамидов. Кроме того, появится возможность обнаружить новые лекарственные мишени из числа белков – участников сфинголипидного метаболизма и создать основу для разработки новых лекарственных средства для предупреждения и лечения сердечно-сосудистых заболеваний, которые могут быть более эффективными, чем используемые в настоящее время статины.
Работа выполнена за счет средств гранта РФФИ 19-04-00870А “Сфинголипидомный анализ маркеров сердечно-сосудистых заболеваний”.
Список литературы
Choi R.H., Tatum S.M., Symons J.D., Summers S.A., Holland W.L. Ceramides and other sphingolipids as drivers of cardiovascular disease // Nat. Rev. Cardiol. 2021. Online ahead of print. Doi 1038/s41569-01-00536-1
Алесенко А.В., Лебедев А.Т., Курочкин И.Н. Роль сфинголипидов в сердечно-сосудистых патологиях // Биомедицинская химия. 2018. Т. 64. № 6. С. 487. (Alessenko A.V., Lebedev А.Т., Kurochkin I.N. The role of sphingolipids in cardiovascular pathologies // Biochemistry (Moscow). Suppl. Ser. B: Biomed. Chem. 2019. V. 13. P. 122. https://doi.org/10.18097/PBMC20186406487)
Cai F., Ren F, Zhang Y., Ding X., Fu G., Ren D., Yang L., Chen N., Shang Y., Hu Y., Yi L., Zhang H.J. Screening of lipid metabolism biomarkers in patients with coronary heart disease via ultra-performance liquid chromatography-high resolution mass spectrometry // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2021. V. 1169. P. 122603. https://doi.org/10.1016/j.jchromb.2021.122603
Алесенко А.В., Затейщиков Д.А., Лебедев А.Т., Курочкин И.Н. Участие сфинголипидов в патогенезе атеросклероза // Кардиология. 2019. Т. 59. № 8. С. 77. https://doi.org/10.18087/cardio.2019.8.10270
Zhang D.X., Fryer R.M., Hsu A.K., Zou A.P., Gross G.J., Campbell W.B., Li P.L. Production and metabolism of ceramide in normal and ischemic-reperfused myocardium of rats // Basic Res. Cardiol. 2001. V. 96. № 3. P. 267. https://doi.org/10.1007/s003950170057
Lemaitre P.N., Hoofnagle A., McKnight B., Fretts A., King I.B., Siscovick D., Psaty B. M., Heckbert S.R., Sotoodehnia N. Plasma ceramides and sphingomyelins in relation to heart failure risk // Circ Heart Fail. 2019. V. 12. № 7. e005708. https://doi.org/10.1161/CIRCHEARTFAILURE. 118.005708
Tong X., Peng H., Liu D., Ji L., Niu C., Ren J., Pan B., Hu J., Zheng L., Huang Y. High-density lipoprotein of patients with type 2 diabetes mellitus upregulates cyclooxgenase-2 expression and prostacyclin I-2 release in endothelial cells: relationship with HDL-associated sphingosine-1-phosphate // Cardiovasc. Diabetol. 2013. P. 12. https://doi.org/10.1186/1475-2840-12-27
Spijkers L.J., van den Akker R.F., Janssen B.J., Debets J.J., De Mey J.G., Stroes E.S., van den Born B.J., Wijesinghe D.S., Chalfant C.E., MacAleese L., Eijkel G.B., Heeren R.M., Alewijnse A.E., Peters S.L. Hypertension is associated with marked alterations in sphingolipid biology: A potential role for ceramide // PLoS One. 2011. V. 6. № 7. Article e21817. https://doi.org/10.1371/journal.pone.0021817
Fenger M., Linneberg A., Jorgensen T., Madsbad S., Sobye K., Eugen-Olsen J., Jeppesen J. Genetics of the ceramide/sphingosine-1-phosphate rheostat in blood pressure regulation and hypertension // BMC Genetics. 2011. V. 12. P. 44. https://doi.org/10.1186/1471-2156-12-44
Gulati S., Liu Y., Munkacsi A.B., Wilcox L., Sturley S.L. Sterols and sphingolipids: Dynamic duo or partners in crime? // Prog. Lipid Res. 2010. V. 49. № 4. P. 353. https://doi.org/10.1016/j.plipres.2010.03.003
Subbaiah P.V., Gesquiere L.R., Wang K. Regulation of the selective uptake of cholesterol esters from high density lipoproteins by sphingomyelin // J. Lipid Res. 2005. V. 46. P. 2699. https://doi.org/10.1194/jlr.M500263-JLR200
London M.E. Ceramide selectively displaces cholesterol from ordered lipid domens (rafts): Iimplication for lipid raft structure and function // J. Biol. Chem. 2004. V. 279. № 11. P. 9997–10004. https://doi.org/10.1074/jbc.M309992200
Slotte J.P., Bierman E.L. Depletion of plasma-membrane sphingomyelin rapidly alters the distribution of cholesterol between plasma membranes and intracellular cholesterol pools in cultured fibroblasts // Biochem J. 1988. V. 250. № 8. P. 653–658. https://doi.org/10.1042/bj2500653
Leventhal A.R., Chen W. Tall A.R., Tabas I. Acid sphingometlinase deficient macrophages have defective cholesterol trafficking and efflux // J. Biol. Chem. 2001. V. 276. № 48. P. 44976–44983. https://doi.org/10.1074/jbc.M106455200
Merrill A. Jr., Sullards M.C. Opinion article on lipidomics: Inherent challenges of lipidomic analysis of sphingolipids // Biochim. Biophys. Acta: Mol. Cell Biol. Lipids. 2017. V. 1862. № 8. P. 774–776. https://doi.org/10.1016/j.bbalip.2017.01.009
Han X., Yang K. Gross R.W. Multi-dimensional mass spectrometry-based shotgun lipidomics and novel strategies for lipidomic analyses // Mass Spectrom. Rev. 2012. V. 31. P. 134–178. https://doi.org/10.1002/mas.20342
Лебедев А.Т. Масс-спектрометрия в органической химии. М.: Техносфера, 2015. С. 702.
Заикин В.Г., Борисов Р.С. Масс-спектрометрия как важнейшая аналитическая основа ряда омиксных наук // Масс-спектрометрия. 2021. Т. 18. № 1. С. 4.
Han X., Gross R.W. Shotgun lipidomics: Electrospray ionization mass spectrometric analysis and quantitation of cellular lipidomes directly from crude extracts of biological samples // Mass Spectrom. Rev. 2005. V. 24. P. 367. https://doi.org/10.1002/mas.20023
Xu Y., Brenna J.T. Atmospheric pressure covalent adduct chemical ionization tandem mass spectrometry for double bond localization in monoene- and diene-containing triacylglycerols // Anal. Chem. 2007. V. 79. P. 2525. https://doi.org/10.1021/ac062055a
Dreisewerd K., Muthing J., Rohlfing A., Meisen I., Vukelic Z., Peter-KatalinicJ., Hillenkamp F., Berkenkamp S. Analysis of gangliosides directly from thin-layer chromatography plates by infrared matrix-assisted laser desorption/ionization orthogonal time-of-flight mass spectrometry with a glycerol matrix // Anal. Chem. 2005. V. 77. P. 4098. https://doi.org/10.1021/ac048373w
Porcari A.M., Fernandes G.D., Belaz K.R.A., Schwab N.V., Santos V.G., Alberici R.M., Gromova V.A., Eberlin M.N., Lebedev A.T., Tata A. High throughput MS techniques for caviar lipidomics // Anal. Methods. 2014. V. 6. P. 2436.
Лебедев А.Т. Масс-спектрометрия c ионизацией на воздухе // Успехи химии. 2015. Т. 84. № 7. С. 665. (Lebedev A.T. Ambient ionization mass spectrometry // Russ. Chem. Rev. 2015. V. 84. № 7. P. 665.)
Liu X., Wang J., Hu B., Yan P., Jia S., Du Z., Jiang H. Qualitative distribution of endogenous sphingolipids in plasma of human and rodent species by UPLC-Q-Exactive-MS // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2021. V. 1173. P. 122684. https://doi.org/10.1016/j.jchromb.2021.122684ectrometry
Sullards M.C. Analysis of sphingomyelin, glucosylceramide, ceramide, sphingosine, and sphingosine 1-phosphate by tandem mass spectrometry // Methods Enzymol. 2000. V. 312. P. 32. https://doi.org/10.1016/s0076-6879(00)12898-8
Shaner R.L., Allegood J.C., Park H., Wang E., Kelly S., Haynes C.A., Sullards M.C., Merrill A.H. Jr. Quantitative analysis of sphingolipids for lipidomics using triple quadrupole and quadrupole linear ion trap mass spectrometers // J. Lipid Res. 2009. V. 50. № 8. P. 1692. https://doi.org/10.1194/jlr.D800051-JLR200
Kaya I., Sämfors S., Levin M., Borén J., Fletcher J.S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction // J. Am. Soc. Mass Spectrom. 2020. V. 31. P. 2133. https://doi.org/10.1021/jasms.0c00245
Sugiyama E., Hara A., Uemura K., Taketomi T. Application of matrix-assisted laser desorption ionization time-of-flight mass spectrometry with delayed ion extraction to ganglioside analyses // Glycobiology. 1997. V. 7. № 5. P. 719. https://doi.org/10.1093/glycob/7.5.719
Chen Y., Ying Liu Y., Sullards M.C., Merrill A.H. Jr. An introduction to sphingolipid metabolism and analysis by new technologies // Neuromol. Med. 2010. V. 12. № 4. P. 306. https://doi.org/10.1007/s12017-010-8132-8
Merrill A.H. Jr., Sullards M.C., Allegood J.C., Kelly S., Wang E. Sphingolipidomics: High-throughput, structure-specific, and quantitative analysis of sphingolipids by liquid chromatography tandem mass spectrometry // Methods. 2005. V. 36. № 2. P. 207. https://doi.org/10.1016/j.ymeth.2005.01.009
Houjou T., Yamatani K., Nakanishi H., Imagawa M., Shinuzu T., Taguchi R. Application of matrix-assisted laser desorption ionization time-of-flight mass spectrometry with delayed ion extraction to ganglioside analyses // Rapid Commun. Mass Spectrom. 2004. V. 18. P. 3123. https://doi.org/10.1002/rcm.1737
O’Connor P.B., Budnik B.A., Ivleva V.B., Kaur P., Moyer S.C., Pittman J.L., Costello C.E. A high presure matrix-assisted laser desorption ion source for Fourier transform mass spectrometry designed to accommodate large targets with diverse surfaces // J. Am. Soc. Mass Spectrom. 2004. V. 15. № 1. P. 128. https://doi.org/10.1016/j.jasms.2003.10.005
Forresterm J.S., Milne S.B., Ivanova P.T., Brown H.A. Computational lipidomics: A multiplexed analysis of dynamic changes in membrane lipid composition during signal transduction // Mol. Pharmacol. 2004. V. 65. P. 813. https://doi.org/10.1124/mol.65.4.813
Han X., Yang J., Cheng H., Ye H., Gross R.W. Toward fingerprinting cellular lipidomes directly from biological samples by two-dimensional electrospray ionization mass spectrometry // Anal. Biochem. 2004. V. 330. № 2. P. 317. https://doi.org/10.1016/j.ab.2004.04.004
Domon B., Costello C.E. Structure elucidation of glycosphingolipids and gangliosides using high-performance tandem mass // Biochemistry. 1998. V. 27. № 5. P. 1534. https://doi.org/10.1021/bi00405a021
Yoo H.H., Son J., Kim D.H. Liquid chromatography-tandem mass spectrometric determination of ceramides and related lipid species in cellular extracts // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2006. V. 843. № 2. P. 327. https://doi.org/10.1016/j.jchromb.2006.06.025
Han X., Gross R.W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: A bridge to lipidomics // J. Lipid Res. 2003. V. 44. № 6. P. 1071. https://doi.org/10.1194/jlr.R300004-JLR200
Jiménez-Rojo N., Viguera A.R., Collado M.I., Sims K.H., Constance C., Hill K.S., Shaw W.A., Goñi F.M., Alonso A. Sphingosine induces the aggregation of imine containing peroxidized vesicles // Biochim. Biophys. Acta. 2014. V. 1838. № 8. P. 2071. https://doi.org/10.1016/j.bbamem.2014.04.028
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


