Журнал аналитической химии, 2022, T. 77, № 4, стр. 366-374
Планшетный хемилюминесцентный метод определения микроРНК-141, основанный на применении каталитической сборки шпилек и конъюгата стрептавидина и полипероксидазы
О. Л. Бодулев a, И. Ю. Сахаров a, *
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: sakharovivan@gmail.com
Поступила в редакцию 17.06.2021
После доработки 11.10.2021
Принята к публикации 12.10.2021
- EDN: YBLVKY
- DOI: 10.31857/S0044450222040053
Аннотация
В настоящее время микроРНК привлекают повышенное внимание исследователей как перспективные маркеры различных заболеваний человека. В данной работе представлен гетерогенный хемилюминесцентный метод количественного определения онкомаркера микроРНК-141, основанный на бесферментной амплификационной реакции, получившей название каталитическая сборка шпилек (КСШ). Для дополнительного повышения чувствительности метода применена детектирующая система с двойной амплификацией сигнала, включающая применение конъюгата стрептавидина с полипероксидазой хрена и реакции усиленной хемилюминесценции. Благодаря применению стратегии тройной амплификации метод характеризуется высокой чувствительностью и низким пределом обнаружения. Найдено, что данный метод определения микроРНК-141 за счет применения КСШ характеризуется высокой специфичностью. Указанные особенности метода позволяют надеяться на его успешное применение в клинической диагностике.
МикроРНК – это эндогенные короткие (17–25 нуклеотидов) РНК-олигонуклеотиды, осуществляющие регуляцию экспрессии генов животных и растений [1]. Большой интерес вызывают также вирусные микроРНК [2, 3]. Исследования последних лет показали, что при широком спектре заболеваний регистрируются изменения концентрации микроРНК в тканях, клетках и биологических жидкостях (кровь, моча, слюна и т.д.) [4–6]. При исследовании различных онкологических патологий экспериментально продемонстрирована вариативность уровня ряда микроРНК у больных [7–9]. Модифицированный профиль экспрессии микроРНК отмечен также у больных с сердечно-сосудистыми заболеваниями [10, 11] и болезнями нервной системы [12]. Хотя такого рода исследования только “набирают свои обороты”, уже сейчас очевидна значимость определения микроРНК при ранней диагностике заболеваний человека.
Подводя итог, можно отметить особую актуальность исследований по разработке новых методов определения микроРНК. Такие методы основываются на реакции гибридизации нуклеиновых кислот и могут быть подразделены на гомогенные и гетерогенные. Хотя гомогенные методы занимают меньше времени и проще в исполнении, гетерогенные методы характеризуются более высокими чувствительностью и специфичностью и в связи с этим применяются чаще. Различные материалы, такие как наночастицы металлов, магнитные частицы, углеродные нанотрубки, стекла с различными покрытиями и микропланшеты используются в качестве твердых носителей в гетерогенных методах определения микроРНК [13–16].
Следует заметить, что концентрация микроРНК в биологических объектах крайне низкая (в фемто-пикомолярном концентрационном диапазоне) [17, 18], и их определение в клинических образцах является нетривиальной задачей. Первые попытки конструирования методов определения микроРНК без применения их амплификации привели к тому, что такие методы оказались низкочувствительными [19–21]. Введение в схему анализа амплифицирующего(их) этапа(ов) позволило резко повысить чувствительность определения микроРНК. В первую очередь здесь необходимо отметить полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), широко используемую для копирования последовательности РНК. Метод ОТ-ПЦР считается “золотым стандартом” среди методов определения микроРНК, в связи с чем часто используется для подтверждения данных, полученных другими методами [16]. Однако этот метод неидеален и не лишен ряда недостатков, связанных, в первую очередь, с необходимостью варьировать температуру при проведении анализа, что требует использования дорогостоящего оборудования. Дополнительным недостатком этого метода является синтез довольно большого числа неспецифических продуктов, осложняющий интерпретацию результатов определения [22, 23]. Кроме того, при копировании микроРНК в ОТ-ПЦР из-за небольшой длины последовательностей микроРНК требуется проведение дополнительных стадий для ее увеличения, что усложняет определение [14, 15]. Указанные недостатки метода ОТ-ПЦР требуют поиска альтернативных способов амплифицирования микроРНК.
В настоящее время активно развиваются изотермические методы амплификации [16, 24, 25]. Известно, что в некоторых изотермических методах амплификации используются ферменты, а в других не применяются. Получение ложноотрицательных и ложноположительных результатов при определении микроРНК многие авторы связывают с применением ферментов. Более того, изотермические методы амплификации, не требующие ферментов, обычно дешевле и проще в исполнении.
Наиболее известным бесферментным методом изотермической амплификации является метод каталитической сборки шпилек (КСШ) [26]. Высокая эффективность, простота и экономичность данного метода – неоспоримые его преимущества. Описано определение олигонуклеотидных аналитов, основанное на амплификационном КСШ, с различными методами детектирования [27–30].
Выше отмечено, что одним из главных требований к методам определения микроРНК является низкий предел обнаружения. Именно на этой задаче фокусируется внимание большинства исследователей. Известно, что различие в уровнях экспрессии микроРНК в норме и при патологии часто невелико [31], что еще раз подтверждает справедливость требования к высокой чувствительности методов определения микроРНК.
В настоящей работе описан чувствительный и специфичный метод определения микроРНК-141 (маркер нескольких типов онкологических заболеваний [32]), основанный на реакции КСШ, используемой для амплификации микроРНК. Для повышения чувствительности детектирующая система метода включала реакцию усиленной хемилюминесценции и применение конъюгата стрептавидина, ковалентно связанного с полипероксидазой хрена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты. Люминол х. ч. (чистота 97%), 4-морфолинопиридин х.ч. (чистота 97%), Твин 20 ос. ч., казеин х. ч. и трис-HCl ос. ч. (чистота >99.9%) (Sigma-Aldrich Chemical Co., США); пероксид водорода ос.ч. (Н2О2, 30%) (Химмед, Россия). Антитела против флуоресцеина (Флу) приобретали в “Биалекса” (Россия). 3-(10'-Фенотиазинил)пропионовую кислоту синтезировали как описано в работе [33]. Концентрацию H2O2 определяли спектрофотометрическим методом (ε240 = 43.6 M–1 см–1). Требуемые разведения H2O2 проводили в день использования. Применяли конъюгат стрептавидина с полипероксидазой хрена (SA-PolyHRP80) (SDT GmbH, Германия); 96-луночные черные полистирольные микропланшеты (с высокой сорбционной способностью) (Corning, США). Все микроРНК и ДНК-олигонуклеотиды синтезированы в ООО “Синтол” (Россия).
Иммобилизация антител против флуоресцеина на поверхности планшета. В лунки планшета вносили по 50 мкл раствора антител против флуоресцеина (6 мкг/мл), растворенных в 50 мМ карбонатном буферном растворе с pH 9.5, и инкубировали в течение ночи при 4°C. После трехкратной промывки планшета с помощью 10 мМ трис-HCl с 300 мМ NaCl, pH 7.2 (ТБС), поверхность лунок обрабатывали 100 мкл раствора казеина (1 мг/мл в ТБС) в течение 1 ч при 37°C. Далее лунки планшета промывали трижды ТБС с 0.05% Твин 20 (ТБСТ), высушивали на воздухе и хранили в холодильнике при 4°C.
Определение микроРНК-141. Перед использованием растворы зондов Ш1 и Ш2 с концентрацией 100 нМ в ТБС нагревали до 88°C в течение 15 мин, после чего охлаждали при комнатной температуре в течение 1 ч как описано ранее [34]. Затем 50 мкл 30 нМ зонда Ш1 в ТБС вносили в лунки планшета с иммобилизованными антителами против флуоресцеина. После инкубации в течение 1 ч при 37°C, лунки планшета промывали ТБСТ, после чего в лунки вносили по 50 мкл раствора микроРНК-141 (0–100 пМ) и зонда Ш2 (1–5 нМ) в ТБС, содержащем 0–600 мМ NaCl. Инкубацию проводили в течение 30–120 мин при 25°C. После отмывки планшета ТБСТ в лунки вносили по 50 мкл раствора конъюгата стрептавидина с полипероксидазой хрена (разведение 1 : 200 000) в ТБС с 1 мг/мл казеина. Данную реакцию проводили в течение 1 ч при 37°C. После отмывки планшета ТБСТ в лунки вносили по 100 мкл свежеприготовленного субстратного раствора пероксидазы (80 мМ трис-HCl, pH 8.3, 0.17 мМ люминол, 8.75 мM 4-морфолинопиридина, 2.1 мM 3-(10'-фенотиазинил)пропионовая кислота и 1.75 мM H2O2 [35]). Интенсивность хемилюминесценции регистрировали при комнатной температуре с помощью микропланшетного люминометра SpectraMax L (Molecular Devices, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Дизайн метода определения микроРНК-141. Для проведения гетерогенного определения микроРНК-141 зонд Ш1 иммобилизовали на поверхности полистирольного планшета. Для этого зонд Ш1, модифицированный с 3'-конца флуоресцеином, взаимодействовал с антителами против флуоресцеина, предварительно сорбированными в лунках планшета. К иммобилизованному Ш1 в лунки планшета добавляли микроРНК-141 и зонд Ш2, модифицированный с 3'-конца биотином. Химические структуры используемых шпилек (Ш1-Флу и Ш2-биотин, рис. 1) смоделированы согласно теории реакции КСШ [26, 36]. В процессе протекания данной реакции происходила амплификация аналитического сигнала, напрямую зависящего от концентрации микроРНК-141 в реакционной среде. На первом этапе амплификационного цикла молекула аналита за счет комплементарного взаимодействия реагировала с зондом Ш1 (рис. 2). При этом происходил переход Ш1 из закрытой в открытую конформацию с одновременным освобождением последовательности, ранее формировавшей стебель шпильки. Освобожденная последовательность способна гибридизоваться с зондом Ш2-биотин, в результате чего происходило вытеснение аналита из дуплекса. Высвобождение молекулы аналита позволяет ей запустить следующий аналогичный цикл амплификации. В конечном счете одна молекула микроРНК приводила к появлению на поверхности лунки большего числа дуплексов Ш1–Ш2. Следует подчеркнуть, что в отсутствие микроРНК-141 шпильки не должны взаимодействовать друг с другом.
Рис. 1.
Вторичная структура шпилечных олигонуклеотидов Ш1-Флу и Ш2-биотин, используемых в каталитической сборке шпилек. Точками обозначены контакты комплементарных нуклеотидов. Изображение структур получено на сервере UNAFold.
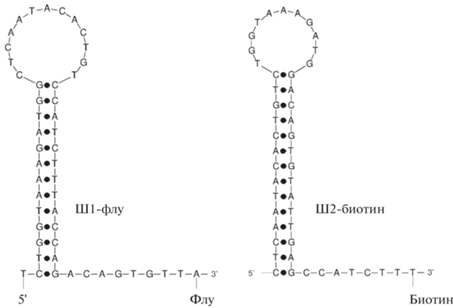
Рис. 2.
Схема хемилюминесцентного метода определения микроРНК-141, основанного на амплификационном методе каталитической сборки шпилек. Ат – антитела к флуоресцеину, Флу – флуоресцеин, полиПХ – полипероксидаза хрена.
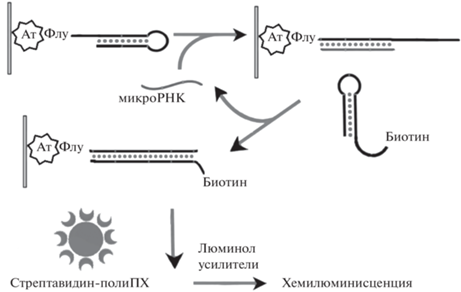
Так как сформированные дуплексы содержали в своей структуре биотин, для оценки их концентрации использовали систему двух последовательных реакций, а именно: (1) реакцию с конъюгатом стрептавидина и полипероксидазы и (2) реакцию усиленной хемилюминесценции с использованием фенотиазиновых усилителей. Следует отметить, что данная стратегия детектирования биотинилированных олигонуклеотидов была нами разработана ранее и показала себя как чрезвычайно чувствительная [37, 38], что является необходимым условием при разработке методов определения микроРНК, находящихся в биологических образцах в следовых количествах [17, 18].
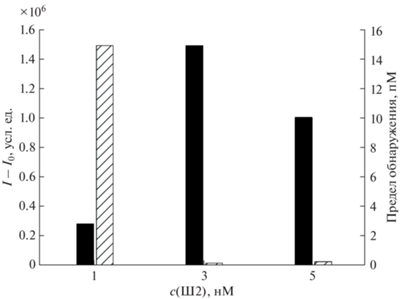
Оптимизация условий детектирования микроРНК-141. Ранее показано [39], что для получения максимального сигнала иммобилизацию Ш1-Флу на планшете следует проводить при концентрации зонда, равной 30 нМ. При данной фиксированной концентрации зонда Ш1 варьировали концентрацию зонда Ш2 в реакционном растворе. С изменением концентрации зонда Ш2 в интервале 1–5 нМ получили набор градуировочных кривых для определения микроРНК-141. При этом найдено, что при увеличении концентрации зонда Ш2 зависимость интенсивности регистрируемой хемилюминесценции имеет выраженный оптимум, который наблюдался при проведении КСШ с использованием 3 нМ зонда Ш2 (рис. 3). Также отмечено, что повышение концентрации зонда Ш2 приводит к резкому понижению величины предела обнаружения, рассчитанной по методу 3σ. Таким образом, в дальнейших исследованиях концентрация зонда Ш2 составила 3 нМ.
Рис. 3.
Эффект концентрации зонда Ш2 в реакционном растворе на величину хемилюминесцентного сигнала (I – I0) (черные столбцы) и предел обнаружения (штрихованные столбцы) амплифицированного метода определения микроРНК-141. Реакцию каталитической сборки шпилек проводили в 10 мМ трис-HCl c pH 7.2, содержащем 300 мМ NaCl при 25°C в течение 1 ч. Величину хемилюминесцентного сигнала (I – I0) рассчитывали как разницу между зарегистрированными сигналами в присутствии (10 пМ микроРНК-141) и в отсутствие аналита.
Известно, что конформация олигонуклеотидов и эффективность их взаимодействия сильно зависят от солевого состава среды. В связи с этим изучили влияние концентрации NaCl на величины аналитических параметров разрабатываемого метода анализа. Так, при проведении реакции амплификации в 10 мМ трис-HCl c pH 7.2 значение сигнала во всем использованном диапазоне концентрации аналита практически не превышает значение фона, т.е. в отсутствие NaCl реакция КСШ с использованием зондов Ш1 и Ш2 не протекает. По мере увеличения концентрации NaCl наблюдали повышение величины регистрируемого сигнала, который достигал максимального значения при концентрации NaCl 300 мМ (рис. 4). В то же время кривая зависимости предела обнаружения микроРНК-141 от концентрации NaCl имеет экстремум, при этом его значение минимально при использовании 10 мМ буферного раствора трис-HCl c pH 7.2, содержащего 300 мМ NaCl (рис. 4).
Рис. 4.
Эффект концентрации NaCl в реакционном растворе на величину хемилюминесцентного сигнала (I – I0) (черные столбцы) и предел обнаружения (штрихованные столбцы) амплифицированного метода определения микроРНК-141. Реакцию каталитической сборки шпилек проводили в 10 мМ трис-HCl с pH 7.2, содержащем 300 мМ NaCl при 25°C в течение 1 ч; [Ш2] = 3 нМ. Величину хемилюминесцентного сигнала (I – I0) рассчитывали как разница между зарегистрированными сигналами в присутствии (10 пМ микроРНК-141) и отсутствие аналита.
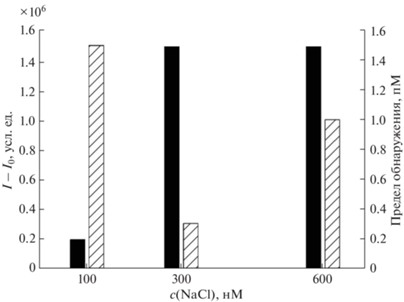
Таким образом, оптимизация условий определения микроРНК-141 показала, что гетерогенную амплификационную реакцию КСШ следует проводить в 10 мМ трис-HCl c pH 7.2, содержащем 300 мМ NaCl, при этом концентрация зонда Ш2 в реакционном растворе должна составлять 3 нМ.
Аналитические параметры метода. Градуировочная зависимость интенсивности хемилюминесценции от концентрации микроРНК-141 в оптимизированных условиях представляет собой кривую (рис. 5), которая описывается уравнением f = y0+ a(1 – e–bx), где y0 = 2.4 × 105, a = 2.4 × × 107 и b = 4.3 × 10–3 (R2 = 0.9943). Следует отметить, что градуировочные кривые подобного характера описаны ранее для ряда аналитических методов, основанных на применении КСШ [40, 41]. Предел обнаружения и диапазон определяемых содержаний для разработанного метода составили 300 фМ и 1 пМ–100 пМ соответственно. Данные значения близки к значениям аналогичных параметров метода определения микроРНК-141 с применением каталитической сборки шпилек с некомплементарным противостоянием нуклеотидов (Mismatched Catalytic Hairpin Assembly) в качестве амплифицирующей реакции [34].
Рис. 5.
Градуировочная кривая определения микроРНК-141 планшетным хемилюминесцентным методом, основанным на амплификационной реакции каталитической сборки шпилек (n = 6). Реакцию КСШ проводили в 10 мМ трис-HCl с pH 7.2, содержащем 300 мМ NaCl при 25°C в течение 1 ч; [Ш2] = 3 нМ.
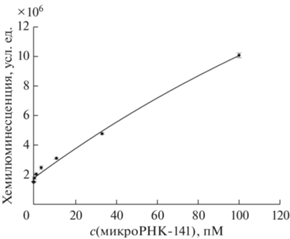
Анализ полученной кривой показал, что при изменении концентрации микроРНК-141 в пределах рабочего диапазона величина интенсивности хемилюминесценции возрастает в 5–6 раз. В то же время для многих подобных амплификационных методов определения микроРНК [31, 41–44] аналогичный или даже менее выраженный рост аналитического сигнала наблюдается при варьировании концентрации аналита на 6–7 порядков. Это указывает на высокую чувствительность разработанного нами метода.
Разработанный метод определения микроРНК-141 характеризуется также высокой воспроизводимостью результатов. Как видно из рис. 6, в пределах диапазона определяемых содержаний значение относительного стандартного отклонения аналитического сигнала $\left( {s_{{\text{r}}}^{{\text{y}}}} \right)$ не превышает 5% и снижается с повышением концентрации аналита. Используя значения $s_{{\text{r}}}^{{\text{y}}}$ и коэффициент чувствительности метода S (тангенс угла наклона касательной к градуировочной кривой), рассчитали значения относительного стандартного отклонения результатов определения концентрации аналита $\left( {s_{{\text{r}}}^{{\text{x}}}} \right)$ [43]. Значения $s_{{\text{r}}}^{{\text{x}}},$ так же как и значения $s_{{\text{r}}}^{{\text{y}}},$ c увеличением концентрации микроРНК-141 понижаются (рис. 6).
Рис. 6.
Зависимости значений относительного стандартного отклонения сигнала ($s_{{\text{r}}}^{{\text{y}}}$ черные столбцы) и относительного стандартного отклонения результатов определения концентрации микроРНК-141 ($s_{{\text{r}}}^{{\text{x}}},$ заштрихованные столбцы), характеризующие основанный на применении каталитической сборки шпилек и конъюгата стрептавидина и полипероксидазы хемилюминесцентный метод, от концентрации аналита.
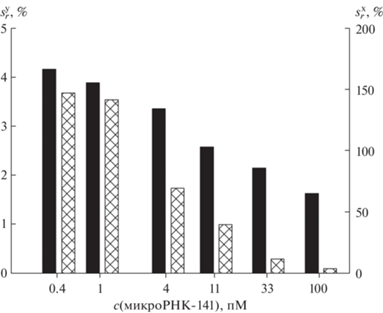
Отметим, что высокая воспроизводимость результатов определения аналита предложенным методом напрямую связана с его высокой чувствительностью. Так, значения $s_{{\text{r}}}^{{\text{x}}},$ рассчитанные по ранее опубликованным данным определения микроРНК методом с низкой чувствительностью (с рабочим диапазоном, охватывающим 6–7 порядков величины концентрации аналита) [44, 45], достигали 400% при концентрации аналита 10 пМ. При той же концентрации микроРНК-141 значение $s_{{\text{r}}}^{{\text{x}}}$ для предложенного нами метода оказалось в восемь раз ниже.
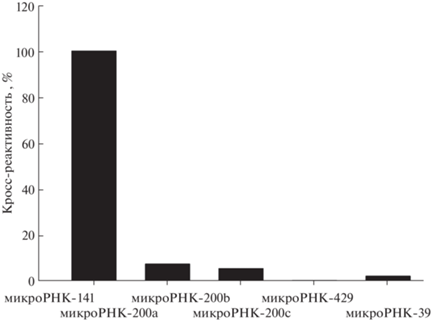
Специфичность метода. Известно, что последовательности различных микроРНК обладают высокой степенью гомологии [46], поэтому разрабатываемые методы анализа данных аналитов должны быть высокоспецифичными. Для оценки специфичности разработанного нами метода использовали четыре микроРНК семейства микроРНК-200, обладающих наиболее высокой гомологией с последовательностью микроРНК-141, а именно микроРНК-200a, микроРНК-200b, микроРНК-200c и микроРНК-429 [47]. Как видно из рис. 7, кросс-реактивность разработанного метода для микроРНК-200а и микроРНК-200b составила лишь 7 и 5% соответственно. Для микроРНК-200c и микроРНК-429 кросс-реактивность еще ниже (менее 3%). Полученные результаты позволяют охарактеризовать предлагаемый метод как высокоспецифичный. По-видимому, высокая специфичность метода заложена в применении КСШ, т. к. и другие методы с КСШ характеризуются высокой специфичностью [24].
* * *
Таким образом, представлен высокочувствительный гетерогенный метод определения микроРНК-141. Высокая чувствительность метода обусловлена использованием стратегии тройной амплификации сигнала, основанной на применении конъюгата стрептавидина с полипероксидазой и реакции усиленной хемилюминесценции в сочетании с амплификационным методом КСШ. Высокая чувствительность предложенного метода в совокупности с высокой специфичностью позволяют предположить, что он будет востребован для определения микроРНК в клинической диагностике. Использование в данном методе коммерчески доступных стандартизированных микропланшетов делает его высокопроизводительным, а применение биоанализаторов для иммуноферментного анализа позволяет его легко автоматизировать.
Работа выполнена в рамках проекта РФФИ № 21-54-53007 и научно-исследовательской программы “Молекулярный дизайн, структурно-функциональный анализ и регуляция ферментных систем, клеточных конструкций, бионаноматериалов: фундаментальные основы и приложения в технологии, медицине, охране окружающей среды” (грант АААА-А21-121011290089-4).
В качестве объектов исследования в работе не использовали людей или животных.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Wang J., Chen J., Sen S. MicroRNA as biomarkers and diagnostics // J. Cell. Physiol. 2016. V. 231. № 1. P. 25.
Loureiro D., Tout I., Narguet S., Benazzouz S.M., Mansouri A., Asselah T. miRNAs as potential biomarkers for viral hepatitis B and C // Viruses. 2020. V. 12. № 12. P. 1440.
Barbu M.G., Condrat C.E., Thompson D.C., Bugnar O.L., Cretoiu D. Toader O.D., Suciu N., Voinea, S.C. MicroRNA involvement in signaling pathways during viral infection // Front. Cell Development Biol. 2020. V. 8. P. 143.
Abdallah R., Taly V., Zhao S., Pietrasz D., Bachet J.-B., Basile D., Mas L., Zaanan A., Laurent-Puig P., Taieb J. Plasma circulating tumor DNA in pancreatic adenocarcinoma for screening, diagnosis, prognosis, treatment and follow-up: A systematic review // Cancer Treatment Rev. 2020. V. 87. P. 102028.
Guo Q., Yu Y., Zhang H., Cai C., Shen Q. Electrochemical sensing of exosomal microRNA based on hybridization chain reaction signal amplification with reduced false-positive signals // Anal. Chem. 2020. V. 92. № 7. P. 5302.
Li X., Zhao J., Xu R., Pan L., Liu Y.-M. Mass spectrometric quantification of microRNAs in biological samples based on multistage signal amplification // Analyst. 2020. V. 145. № 5. P. 1783.
Зборовская И.Б., Комельков А.В. МикроРНК-155-5р в патогенезе онкологических заболеваний // Успехи мол. онкологии. 2017. Т. 4. № 3. С. 27. (Zborovskaya I.B., Komel’kov A.V. MicroRNA-155-5p in pathogenesis of cancer // Adv. Pathol. Oncology. 2017. V. 4. № 3. P. 27.)
Leong S.M., Tan K.M.-L., Chua H.W., Huang M.-C., Cheong W.C., Li M.-H., Tucker S., Koay E. S.-C. Paper-based microRNA expression profiling from plasma and circulating tumor cells // Clin. Chem. 2017. V. 63. № 3. P. 731.
Torrente-Rodríguez R.M., Montiel V.R.-V., Campuzano S., Farchado-Dinia M., Barderas R., San Segundo-Acosta P., Montoy, J.J., Pingarron J.M. Fast electrochemical miRNAs determination in cancer cells and tumor tissues with antibody-functionalized magnetic microcarriers // ACS Sensors. 2016. V. 1. № 7. P. 896.
Corsten M.F., Dennert R., Jochems S., Kuznetsova T., Devaux Y., Hofstra L., Wagner D.R., Staessen J.A., Heymans S., Schroen B. Circulating MicroRNA-208b and MicroRNA-499 reflect myocardial damage in cardiovascular disease // Circ. Cardiovasc. Genet. 2010. V. 3. № 6. P. 499.
Жиров И.В., Баулина Н.М., Насонова С.Н., Осьмак Г.Ж., Матвеева Н.А., Миндзаев Д.Р., Фаворова О.О., Терещенко С.Н. Полнотранскриптомный анализ экспрессии микрорнк в мононуклеарных клетках у пациентов с острой декомпенсацией хронической сердечной недостаточности различной этиологии // Терапевтический архив. 2019. Т. 91. № 9. С. 62. (Zhirov I.V., Baulina N.M., Nasonova S.N., Os-mak G.Zh., Matveyeva N.A., Mindzaev D.R., Favorova O.O., Tereshchenko S.N. Full-transcriptome analysis of miRNA expression in mononuclear cells in patients with acute decompensation of chronic heart failure of various etiologies // Therapeutic Archive. 2019. V. 91. № 9. P. 62.)
Wen M.M. Getting miRNA therapeutics into the target cells for neurodegenerative diseases: A mini-review // Front. Mol. Neurosci. 2016. V. 9. P. 129.
Kilic T., Erdem A., Ozsoz M., Carrara S. microRNA biosensors: opportunities and challenges among conventional and commercially available techniques // Biosens. Bioelectron. 2018. V. 99. P. 525.
Gilboa T., Garden P.M., Cohen L. Single-molecule analysis of nucleic acid biomarkers – A review // Anal. Chim. Acta. 2020. V. 1115. P. 61.
Pritchard C.C., Cheng H.H., Tewari M. MicroRNA profiling: Approaches and considerations // Nature. 2012. V. 13. № 5. P. 358.
Deng R., Zhang K., Li J. Isothermal amplification for microRNA detection: From the test tube to the cell // Acc. Chem. Res. 2017. V. 50. № 4. P. 1059.
Iguchi T., Niino N., Tamai S., Sakurai K., Mori K. Absolute quantification of plasma MicroRNA levels in cynomolgus monkeys, using quantitative real-time reverse transcription PCR // J. Vis. Exp. 2018. V. 132. e56850.
Yuan R., Yu X., Zhang Y., Xu L., Cheng W., Tub Z., Ding S. Target-triggered DNA nanoassembly on quantum dots and DNAzyme-modulated double quenching for ultrasensitive microRNA biosensing // Biosens. Bioelectron. 2017. V. 92. P. 342.
Wu T., Xu T., Chen Y., Yang Y., Xu L.-P., Zhang X., Wang S. Renewable superwettable biochip for miRNA detection // Sens. Actuators B: Chem. 2018. V. 258. P. 715.
Tian T., Wang J., Zhou X. A review: MicroRNA detection methods // Org. Biomol. Chem. 2015. V. 13. № 8. P. 2226.
Bodulev O.L., Sakharov I.Yu. Chemiluminescent determination of microRNA-141 using target-dependent activation of the peroxidase-mimicking DNAzyme // Anal. Lett. 2019. V. 52. № 5. P. 813.
Hu B., Wang Y., Sun S., Luo G., Zhang S., Zhang J., Chen L., Huang Z. Specificity enhancement of deoxyribonucleic acid polymerization for sensitive nucleic acid detection // Anal. Chem. 2020. V. 92. № 24. P. 15872.
Зырина Н.В., Антипова В.Н. Неспецифический синтез нуклеиновых кислот в реакциях изотермической амплификации // Биохимия. 2021. Т. 86. № 7. P. 1066. (Zyrina N.V., Antipova V.N. Nonspecific synthesis in the reactions of isothermal nucleic acid amplification // Biochemistry (Moscow). 2021. V. 86. № 7. P. 887.)
Бодулев О.Л., Сахаров И.Ю. Изотермические методы амплификации нуклеиновых кислот и их применение в биоанализе // Биохимия. 2020. Т. 85. № 2. С. 174. (Bodulev O.L., Sakharov I.Yu. Isothermal nucleic acid amplification techniques and their use in bioanalysis // Biochemistry (Moscow). 2020. V. 85. № 2. P. 147.)
Zhao Y., Chen F., Li Q., Wang L., Fan C. Isothermal amplification of nucleic acids // Chem. Rev. 2015. V. 115. № 22. P. 12491.
Liu J., Zhang Y., Xie H., Zhao L., Zheng L., Ye H. Applications of catalytic hairpin assembly reaction in biosensing // Small. 2019. V. 15. № 42. P. 1902989.
Jiang Z., Wang H., Zhang X., Liu C., Li Z. An enzyme-free signal amplification strategy for sensitive detection of microRNA via catalyzed hairpin assembly // Anal. Methods. 2014. V. 6. № 23. P. 9477.
Zhang H., Wang K., Bu S., Li Z., Ju C., Wan J. Colorimetric detection of microRNA based on DNAzyme and nuclease-assisted catalytic hairpin assembly signal amplification // Mol. Cell. Probes. 2018. V. 38. P. 13.
Hun X., Meng Y., Wang S., Zhang H., Luo X. Mismatched catalytic hairpin assembly coupling hydroxylamine-O-sulfonic acid as oxide for DNA assay // Sens. Actuators B: Chem. 2018. V. 254. P. 347.
Zhou Q., Tang D. Catalytic hairpin assembly-mediated surface charge density on the electrode for sensitive potentiometric detection of microRNA-21 in IgA-nephropathy // Biochem. Eng. J. 2018. V. 140. P. 9.
Trinh M. P., Carballo J. G., Adkins G. B., Guo K., Zhong W. Physical and chemical template-blocking strategies in the exponential amplification reaction of circulating microRNAs // Anal. Bioanal. Chem. 2020. V. 412. № 11. P. 2399.
Gao Y., Feng B., Han S., Zhang K., Chen J., Li C., Chen L. The roles of MicroRNA-141 in human cancers: From diagnosis to treatment // Cell. Physiol. Biochem. 2016. V. 38. № 2. P. 427.
Han F., Zhao J. Colorimetric fluoride-anion sensor based on intramolecular hydrogen bonding and enol–keto tautomerization of a phenothiazine derivative // Helv. Chim. Acta 2008. V. 91. № 4. P. 635.
Bodulev O.L., Zhao S., Sakharov I.Yu. Improving the sensitivity of the miRNA assay coupled with the mismatched catalytic hairpin assembly reaction by optimization of hairpin annealing conditions // Anal. Chem. 2021. V. 93. № 17. P. 6824.
Sakharov I.Yu., Demiyanova A.S., Gribas A.V., Uskova N.A., Efremov E.E., Vdovenko M.M. 3-(10'-Phenothiazinyl) propionic acid is a potent primary enhancer of peroxidase-induced chemiluminescence and its application in sensitive ELISA of methylglyoxal-modified low density lipoprotein // Talanta. 2013. V. 115. P. 414.
Yin P., Choi H.M., Calvert C.R., Pierce N.A. Programming biomolecular self-assembly pathways // Nature. 2008. V. 451. № 7176. P. 318.
Bodulev O.L., Burkin K.M., Efremov E.E., Sakharov I.Yu. One-pot microplate-based chemiluminescent assay coupled with catalytic hairpin assembly amplification for DNA detection // Anal. Bioanal. Chem. 2020. V. 412. № 21. P. 5105.
Solovjev A.M., Kurzeev S.A., Sakharov I.Yu. Chemiluminescent microplate-based assay of DNA based on isothermal circular strand-displacement polymerization reaction (ICSDPR) // Talanta. 2020. V. 215. Article 120895.
Kolosova A.Yu., Sakharov I.Yu. Triple amplification strategy for the improved efficiency of a microplate-based assay for the chemiluminescent detection of DNA // Anal. Lett. 2019. V. 52. № 8. P. 1352.
Ji D., Mou X., Kwok C.K. Label-free and ratiometric detection of microRNA based on target-induced catalytic hairpin assembly and two fluorescent dyes // Anal. Methods. 2019. V. 11. № 37. P. 4808.
Wang L.-J., Ren M., Wang H.-X., Qiu J.-G., Jiang B.H., Zhang C.-Y. Construction of a quencher-free cascade amplification system for highly specific and sensitive detection of serum circulating miRNAs // Anal. Chem. 2020. V. 92. № 12. P. 8546.
Jiang L., Yang Y., Lin Y., Chen Z., Xing C., Lu C., Yang H., Zhang S. An electrochemical sensor based on enzyme-free recycling amplification for sensitive and specific detection of miRNAs from cancer cells // Analyst. 2020. V. 145. № 9. P. 3353.
Дёрффель К. Статистика в аналитической химии. М.: Мир, 1994. С. 268. (Doerffel K. Statistics in Analytical Chemistry. M.: Mir, 1994. P. 268.).
Zhao L.-L., Pan H.-Y., Zhang X.-X., Zhou Y.-L. Ultrasensitive detection of microRNA based on a homogeneous label-free electrochemical platform using G-triplex/methylene blue as a signal generator // Anal. Chim. Acta. 2020. V. 1116. P. 62.
Meng T., Zhao D., Ye H., Feng Y., Wang H., Zhang Y. Construction of an ultrasensitive electrochemical sensing platform for microRNA-21 based on interface impedance spectroscopy // J. Coll. Interface Sci. 2020. V. 578. P. 164.
Kozomara A., Birgaoanu M., Griffiths-Jones S. miRBase: from microRNA sequences to function // Nucl. Acids Res. 2019. V. 47. № D1. P. D155.
Lao T.D., Truong P.K., Le T.A.H. miRNA-141 as the biomarker for human cancers // Asian J. Pharm. Res. Health Care. 2018. V. 10. P. 42.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии