Журнал аналитической химии, 2022, T. 77, № 5, стр. 454-461
Микроэкстракционное концентрирование хлоруксусных кислот с флотационным выделением экстракта
В. А. Крылов a, *, П. В. Мосягин a, Р. Г. Сироткин a
a Национальный исследовательский Нижегородский государственный университет
им. Н.И. Лобачевского (ННГУ), химический факультет
603950 Нижний Новгород, просп. Гагарина, 23, ГСП-20, Россия
* E-mail: k658995@mail.ru
Поступила в редакцию 22.06.2021
После доработки 24.09.2021
Принята к публикации 24.09.2021
- EDN: CBNVGQ
- DOI: 10.31857/S0044450222050073
Аннотация
Разработана методика жидкостно-жидкостного микроэкстракционного концентрирования моно-, ди- и трихлоруксусной кислот (ХУК) с флотационным выделением экстракта. В качестве экстрагента использовали метил-трет-бутиловый эфир, который эмульгировали с помощью ультразвукового воздействия. Концентрирование осуществляли в ампуле объемом 27 мл, оснащенной капилляром для отбора микроколичеств экстракта. Ионохроматографическое определение ХУК проводили после замены органической матрицы экстракта на водную. Показаны преимущества флотационного способа деэмульсификации по сравнению с центрифужным: коэффициенты концентрирования хлоруксусных кислот в 2–2.2 раза больше, пределы обнаружения ХУК понижены до 5 × 10–4–4 × × 10–3 мг/л, а время выделения экстракта уменьшено в 3.3 раза.
Жидкостно-жидкостное микроэкстракционное концентрирование с диспергированием экстрагента широко применяется в аналитической практике [1–7]. Это важный этап предварительной подготовки образцов, повышающий эффективность определения примесей без использования больших количеств реагентов, зачастую весьма токсичных. При разработке способов микроэкстракционного концентрирования примесей часто стремятся к увеличению коэффициента концентрирования K. Это достигается уменьшением объема экстрагента или увеличением объема водной фазы (пробы), что следует из соотношения:
где D – коэффициент распределения примеси, Vо и Vв – объемы экстрагента и водной фазы соответственно.Следует отметить, что уменьшение объема экстрагента ведет к снижению степени извлечения примеси R и соответственно к уменьшению абсолютного количества аналита в экстракте:
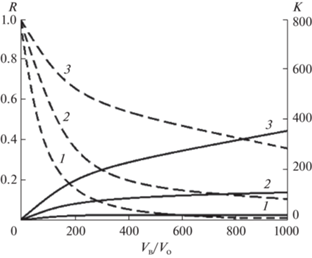
Зависимость коэффициента концентрирования К и степени извлечения R от соотношения объемов водной и органической фаз для различных коэффициентов распределения показана на рис. 1. Как видно, начиная с определенных значений отношения Vв/Vо происходит небольшое увеличение K, а степень извлечения примеси заметно падает, что ведет к уменьшению абсолютного количества примесного вещества, вводимого в аналитический прибор, падению аналитического сигнала и возрастанию (ухудшению) предела обнаружения примеси. Любой аналитический прибор характеризуется определенным объемом дозатора. Введение объема пробы, меньшего, чем объем дозатора, приведет к ее разбавлению. Таким образом, желательно, чтобы объем концентрата приближался к объему дозатора; для лабораторных ионных хроматографов он составляет в среднем 50–100 мкл.
Рис. 1.
Зависимость коэффициента концентрирования K и степени извлечения R от соотношения объемов водной и органической фаз Vв/Vо при значениях коэффициента распределения D 20 (1), 100 (2), 500 (3).
Другой возможностью снижения предела обнаружения является увеличение объема исходной пробы. Обычно объем проб не превышает 5–10 мл, что определяется возможностями центрифужного извлечения экстракта. Другими проблемами метода центрифугирования являются трудность автоматизации методики концентрирования и риск разрушения стеклянных концентраторов при центрифугировании.
В последнее десятилетие за рубежом появились работы, посвященные флотационной деэмульсификации [8–14]. Объем пробы воды практически не лимитируется и в цитируемых работах достигает 35 мл. Это способствует снижению пределов обнаружения примесей. Принцип флотационной деэмульсификации заключается в пропускании пузырьков газа через эмульсию экстрагента в пробе и сорбции на поверхности пузырьков частиц эмульгированного экстрагента. Достигнув поверхности водной фазы, пузырьки газа схлопываются и легкие экстрагенты (с плотностью меньше, чем у воды) агрегируются в отдельный верхний слой, а тяжелые (с плотностью больше, чем у воды) оседают на дно концентратора. Газ подается в емкость насосом [8–10, 12–14] или может генерироваться непосредственно в пробе химическим путем, например, добавлением в подкисленную водную фазу раствора гидрокарбоната натрия [11]. Описаны устройства с расположенным в донной части концентратора резиновым уплотнением (септой), через которое газ вводится с помощью металлической иглы [10]. Для флотационной деэмульсификации применяют азот [8, 12], воздух [9, 10, 13, 14], углекислый газ [11].
Целью настоящей работы является разработка методики жидкофазного эмульсионного микроэкстракционного концентрирования ХУК с флотационным выделением экстракта для их последующего ионохроматографического определения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Рабочие растворы хлоруксусных кислот готовили из соответствующих реактивов и деионизованной воды (монохлоруксусная кислота (МХУК) ч. ТУ 6-09-13-674-78, дихлоруксусная кислота (ДХУК) ч. ТУ 6-09-11-1926-85, трихлорукусная кислота (ТХУК) ч. ТУ 6-091926-77); для приготовления элюента использовали гидроксид калия х. ч. (ГОСТ 24363-80) и тирозин х. ч. (ТУ 6-09-5093-84); для микроэкстракционного концентрирования использовался метил-трет-бутиловый эфир (МТБЭ) х. ч. (ТУ 2632-118-44493179-08).
Оборудование. Жидкостный ионный хроматограф LC-20ADsp фирмы “Shimadzu” (Япония) с петлей-дозатором объемом 50 мкл, весы аналитические Shimadzu AUX320, насос ПУ-2Э, ультразвуковая ванна ПСБ-Галс 133505 с мощностью генератора ультразвука 50 Вт и рабочей частотой 35 кГц, стеклянный концентратор для флотационной деэмульсификации емк. 27 мл, микродозаторы HTL 20–200 мкл и DragonLAB TopPette Pipettor 2-20.
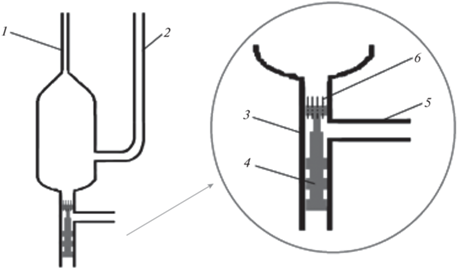
Устройство для флотационной деэмульсификации. На рис. 2 дана схема разработанного концентратора с флотационным выделением экстракта. Устройство применяли для микроэкстракции примесей легким экстрагентом. В верхней части концентратора находится капилляр 1 диаметром 2.50 ± 0.05 мм для отбора микроэкстракта. Отвод 2 служит для добавления воды и транспортировки поверхностного слоя экстракта в капилляр 1. К донной части концентратора припаян моллированный ввод 3 внутренним диаметром 8.15 ± 0.05 мм, в котором находится фторопластовый шток 4. Отвод 5 преназначен для подсоединения насоса и подачи воздуха. Барботирование воздуха через эмульсию экстрагента осуществляется через восемь кварцевых капилляров 6 длиной 10 мм и внутренним диаметром 0.2 мм, находящихся в верхней части штока 4.
Методика микроэкстракционного концентрирования. Анализируемый образец воды объемом 23 мл помещали в концентратор. Для перевода ХУК в молекулярную форму добавляли 1.25 мл конц. H2SO4 [15, 16]. Объем свободного пространства над пробой не превышал 0.5 мл. Для повышения эффективности концентрирования в пробу добавляли высаливатель – сульфат натрия [15, 16]. Затем в концентратор шприцем вводили 1 мл МТБЭ с одновременным воздействием ультразвуком. Барботирование воздуха через образовавшуюся эмульсию осуществляли с помощью насоса ПУ-2Э. Температура концентрирования составляла (23 ± 0.5)°С. Для замены органической матрицы экстракта (МТБЭ) на водную фазу проводили испарение эфира в чашке Петри со скоростью 4 × 10–4 мл/(см2 с). Площадь зеркала испарения составляла 2.5 см2. Конечную массу концентрата уменьшали до уровня 1‒2 мг. К остатку добавляли 50 мкл элюента и перемешивали стеклянной палочкой, после чего отбирали микрошприцем и вводили в хроматограф [16].
Ионохроматографическое определение хлоруксусных кислот. Использовали аминокислотный элюент на основе тирозина (1 мМ тирозина/1 мМ KOH, скорость потока 2 мл/мин) и кондуктометрическое детектирование. Аналитическая колонка 4 × 150 мм содержала центрально-привитой анионит “Канк-Аст” в OH--форме, подавительная колонка 4 × 150 мм была заполнена катионитом КУ-2 × 8 в H+-форме. Температура термостата колонок составляла 32°С.
Чистота использованной воды. Для приготовления рабочих растворов ХУК и элюента использовали деионизованную воду, которую получали очисткой бидистиллированной воды на анионите АРА-8п в OH–-форме и катионите КРС-2п в H+-форме [17]. Чистоту полученной воды контролировали по удельной электропроводности, которая не превышала 2 мкСм/см. Ионохроматографический анализ деионизованной воды показал, что концентрация в ней исследуемых примесей ниже пределов прямого обнаружения (0.05–0.25 мг/л). Очищенную воду хранили в емкостях из полиэтилена не более недели.
Чистота экстрагента и вспомогательных реактивов. Чистоту использованных реактивов и экстрагента, а также воздуха лаборатории на присутствие ХУК подтверждали результатами холостого опыта. Пробу заменяли соответствующим объемом деионизованной воды, в которую добавляли используемые реактивы и экстрагент. Концентрирование возможных загрязнений проводили по описанной выше методике. Содержание ХУК в полученных экстрактах оказалось ниже достигнутых пределов обнаружения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
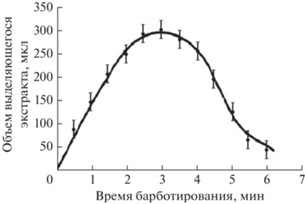
Влияние времени барботирования на эффективность деэмульсификации. На рис. 3 показана зависимость объема отделяемого экстракта от времени барботирования. Расход барботируемого воздуха составлял 25 мл/мин. После 3 мин барботирования выделяется 300 мкл экстракта. Потери МТБЭ обусловлены его растворимостью в воде ‒ в присутствии высаливателя она составляет 2% (соответствует 460 мкл МТБЭ). 240 мкл экстрагента уносилось потоком барботируемого воздуха. Таким образом, потери растворителя при флотационной микроэкстракции (ФМЭ) составляют 0.7 мл или 70%. Это меньше, чем приводится в литературе (свыше 90%) [8, 10].
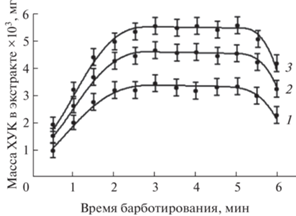
Зависимость массы исследованных примесей в экстракте от времени барботирования показана на рис. 4. После выделения максимального объема экстракта масса ХУК в экстракте в интервале времени от 3 до 5 мин практически не менялась. Последующее снижение массы примесей в экстракте объясняется превышением концентрации примесей над равновесной из-за испарения МТБЭ и их переходом в водную фазу. Время барботирования 3 мин выбрано в качестве оптимального.
Рис. 4.
Зависимость массы хлоруксусных кислот в экстракте от времени барботирования. 1 – три-, 2 – моно-, 3 – дихлоруксусная кислота.
Эффективность микроэкстракционного концентрирования и извлечения аналитов. Для оценки эффективности разработанной методики рассчитали коэффициенты концентрирования K исследуемых компонентов:
где сэксп ‒ концентрации аналита в экстракте после замены матрицы на водную объемом 50 мкл, св(исх) ‒ концентрация в исходном водном растворе.В табл. 1 приведены значения коэффициентов концентрирования ХУК, достигнутые с применением разных способов извлечения экстракта. Из приведенных данных следует, что использование флотационной деэмульсификации позволило увеличить коэффициенты концентрирования ХУК в 2–2.2 раза. Важно отметить, что при использовании флотации для выделения экстракта необходимо 3 мин, а с применением центрифугирования – 10 мин [16].
Таблица 1.
Коэффициенты концентрирования K, достигнутые при использовании флотационного и центрифужного способов выделения экстракта (n = 3, P = = 0.95)
| Аналит | Флотационное выделение Vпробы = 23 мл | Центрифугирование Vпробы = 4.1 мл |
|---|---|---|
| МХУК | 89 ± 9 | 48 ± 5 |
| ДХУК | 75 ± 9 | 35 ± 3 |
| ТХУК | 65 ± 7 | 30 ± 3 |
Пределы обнаружения хлоруксусных кислот. В табл. 2 приведены достигнутые пределы обнаружения ХУК. Пределы обнаружения ХУК с применением микроэкстракции $c_{{{\text{мин}}}}^{{{\text{ФМЭ}}}}$ и $c_{{{\text{мин}}}}^{{{\text{ЦМЭ}}}}$ рассчитывали делением предела прямого обнаружения $c_{{{\text{мин}}}}^{{{\text{ПРЯМ}}}},$ найденного по 3s-критерию, на соответствующий коэффициент концентрирования K. В табл. 2 представлены также значения нижней границы определяемых содержаний ХУК. Диапазон определяемых содержаний ХУК составил: для монохлоруксусной кислоты 20–0.002, для дихлоруксусной кислоты – 20–0.003, для трихлоруксусной кислоты 100–0.01 мг/л.
Таблица 2.
Пределы обнаружения хлоруксусных кислот
| Аналит | $c_{{{\text{мин}}}}^{{{\text{ПРЯМ}}}}$ × 102, мг/л | $c_{{{\text{мин}}}}^{{{\text{ЦМЭ}}}}$ × 102, мг/л | $c_{{{\text{мин}}}}^{{{\text{ФМЭ}}}}$ × 102, мг/л | $c_{{\text{н}}}^{{{\text{ФМЭ}}}}$ × 102, мг/л | ПДК | |
|---|---|---|---|---|---|---|
| СанПиН, c × 102, мг/л |
ВОЗ, c × 102, мг/л |
|||||
| МХУК | 5 | 0.1 | 0.05 | 0.2 | 5 | 2 |
| ДХУК | 7 | 0.2 | 0.09 | 0.3 | ‒ | 5 |
| ТХУК | 25 | 0.8 | 0.40 | 1.0 | 500 | 20 |
Как видно из табл. 2, применение флотационного выделения экстракта позволило снизить пределы обнаружения исследованных аналитов в два раза по сравнению с центрифужным выделением экстракта. Разработанная методика позволяет определять в 10–500 раз меньшие концентрации аналитов, чем нормированные СанПиН и ВОЗ [18, 19]. Это дает возможность проводить высокочувствительное определение ХУК в воде задолго до наступления критической экологической ситуации.
Анализ реальных образцов воды. Проанализировали реальные образцы воды различного происхождения. Концентрацию сВ рассчитывали по формуле:
Проанализировано четыре образца водопроводной воды централизованной системы питьевого водоснабжения Нижнего Новгорода (табл. 3). Концентрация монохлоруксусной и дихлоруксусной кислот составила (1.0‒2.0) × 10–2 мг/л. В родниковой и скваженной воде хлоруксусные кислоты не обнаружены. Полученные данные подтверждают возможность образования ХУК в водопроводной воде, обеззараженной хлорированием.
Таблица 3.
Результаты анализа воды (n = 3, P = 0.95)
| Тип воды | № образца | Содержание ХУК в образцах воды, c × 102, мг/л | ||
|---|---|---|---|---|
| МХУК | ДХУК | ТХУК | ||
| Водопроводная | 1 | 1.0 ± 0.2 | 1.3 ± 0.3 | <0.4 |
| 2 | 1.1 ± 0.2 | 1.4 ± 0.3 | ||
| 3 | 1.5 ± 0.3 | 2.0 ± 0.4 | ||
| 4 | 1.0 ± 0.2 | 1.4 ± 0.3 | ||
| Вода из подземной скважины | 1 | <0.05 | <0.09 | <0.4 |
| 2 | <0.05 | <0.09 | ||
| Родниковая | 1 | <0.05 | <0.09 | <0.4 |
| 2 | <0.05 | <0.09 | ||
Подтверждение правильности определения примесей. Правильность анализа подтверждали методом добавок ХУК в реальную водопроводную воду. Из табл. 4 видно, что систематическая погрешность статистически незначима по сравнению со случайной.
Таблица 4.
Результаты определения хлоруксусных кислот способом добавок (n = 3, P = 0.95)
| Аналит | Найдено без добавки, cx × 102, мг/л | Введено, cдоб × 102, мг/л | Найдено с добавкой, ссум × 102, мг/л |
|---|---|---|---|
| МХУК | 1.0 ± 0.2 | 0.6 | 1.5 ± 0.3 |
| 1.2 | 2.2 ± 0.4 | ||
| ДХУК | 1.3 ± 0.3 | 1.0 | 2.3 ± 0.4 |
| 2.5 | 3.8 ± 0.5 |
Сравнение с результатами других работ. Пределы обнаружения ХУК по разработанной методике меньше, чем в работах [20, 21] с определением методом ионной хроматографии с кондуктометрическим детектированием примесей (табл. 5). При определении моно- и дихлоруксусной кислот разработанная методика может конкурировать с двумерной ионной хроматографией с предварительным удалением мешающих компонентов из пробы [22, 23], с ионной хроматографией с масс-спектрометрическим детектированием [24, 25], а также с газовой хроматографией с масс-спектрометрическим детектированием, где использовалось микроэкстракционное концентрирование [26, 27]. Пределы обнаружения различаются не более чем в два раза.
Таблица 5.
Сравнительная характеристика методов определения хлоруксусных кислот
| Объем исходной пробы воды, мл | Метод пробоподготовки | Экстрагент, (объем, мкл) | Аналит | Метод детектирования* (вводимый объем, мкл) |
cмин × 103, мг/л | Литература |
|---|---|---|---|---|---|---|
| 0.1 | – | – | МХУК | ИХ-КД (100) | 8 | [20] |
| ДХУК | 16 | |||||
| ТХУК | 80 | |||||
| 10 | Предварительное осаждение ионов Cl- и ${\text{SO}}_{4}^{{2 - }},$ ввод большого объема пробы | – | МХУК | ИХ-КД с градиентным элюированием (500) | 3.7 | [21] |
| ДХУК | 3.6 | |||||
| ТХУК | 35.4 | |||||
| 500 | Удаление карбонатов из проб | – | МХУК | Двумерная ИХ-КД (100 [14], 750 [15]) | 0.30, 1.7 | [22, 23] |
| ДХУК | 0.34, 0.7 | |||||
| ТХУК | 0.46, 0.7 | |||||
| 40 | – | – | МХУК | ИХ-МС (100) | 1 | [24] |
| ДХУК | ||||||
| ТХУК | ||||||
| 100 | Твердофазное микроэкстракционное концентрирование | Десорбция аналитов сверхчистой водой (1000) | МХУК | ИХ-МС (50) | 0.30 | [25] |
| ДХУК | 0.24 | |||||
| ТХУК | 0.09 | |||||
| 7 | Дериватизация ХУК с твердофазной микроэкстракцией сорбентом C18 | Десорбция аналитов МТБЭ (20) | МХУК | ГХ-МС (20) | 0.69 | [26] |
| 3 | Микроэкстракция н-октанолом с дериватизацией | н-Октанол (2) | МХУК | ГХ-МС (2) | 1.2 | [27] |
| ДХУК | 0.19 | |||||
| ТХУК | 0.25 | |||||
| 23 | Микроэкстракционное концентрирование с флотационным выделением экстракта | МТБЭ (1000) | МХУК | ИХ-КД (50) | 0.5 | Данная работа |
| ДХУК | 0.9 | |||||
| ТХУК | 4 |
* * *
Разработанная методика отличается простотой исполнения: отсутствуют некоторые стадии удаления мешающих компонентов и дериватизации ХУК. Методика апробирована при анализе водопроводной воды централизованной системы питьевого водоснабжения (Нижний Новгород), а также воды подземных источников. Случайная погрешность определения не превышает 25%. Статистическая незначимость систематической погрешности подтверждена методом добавок.
Список литературы
Rezaee M., Assadi Y., Milani Hosseini M.-R., Aghaee E., Ahmadi F., Berijani S. Determination of organic compounds in water using dispersive liquid–liquid microextraction // J. Chromatogr. A. 2006. V. 1116. P. 1.
Ozcan S., Tor A., Aydin M.E. Determination of selected polychlorinated biphenyls in water samples by ultrasound-assisted emulsification-microextraction and gas chromatography-mass-selective detection // Anal. Chim. Acta. 2009. V. 647. P. 182.
Fontana A.R., Wuilloud R.G., Martinez L.D., Altamirano J.C. Simple approach based on ultrasound-assisted emulsification-microextraction for determination of polibrominated flame retardants in water samples by gas chromatography–mass spectrometry // J. Chromatogr. A. 2009. V. 1216. P. 147.
Saleh A., Yamini Y., Faraji M., Rezaee M., Ghambarian M. Ultrasound-assisted emulsification microextraction method based on applying low density organic solvents followed by gas chromatography analysis for the determination of polycyclic aromatic hydrocarbons in water samples // J. Chromatogr. A. 2009. V. 1216. P. 6673.
Ma J.J., Du X., Zhang J.W., Li J.C., Wang L.Z. Ultrasound-assisted emulsification–microextraction combined with flame atomic absorption spectrometry for determination of trace cadmium in water samples // Talanta. 2009. V. 80. P. 980.
Крылов В.А., Крылов А.В., Мосягин П.В., Маткивская Ю.О. Жидкофазное микроэкстракционное концентрирование примесей // Журн. аналит. химии. 2011. Т. 66. С. 341. (Krylov V.A., Krylov A.V., Mosyagin P.V., Matkivskaya Yu.O. Liquid-phase microextraction preconcentration of impurities // J. Anal. Chem. 2011. V. 66. P. 331.)
Дмитриенко С.Г., Апяри В.В., Толмачева В.В., Горбунова М.В. Дисперсионная жидкостно-жидкостная микроэкстракция органических соединений. Обзор обзоров // Журн. аналит. химии. 2020. Т. 75. № 10. С. 867. (Dmitrienko S.G., Apyari V.V., Tolmacheva V.V., Gorbunova M.V. Dispersive liquid–liquid microextraction of organic compounds: An Overview of Reviews// J. Anal. Chem. 2020. V. 75. № 10. P. 1237.)
Hosseini M.H., Rezaee M., Mashayekhi H.A., Akbarian S., Mizani F., Pourjavid M.R. Determination of polycyclic aromatic hydrocarbons in soil samples using flotation-assisted homogeneous liquid-liquid microextraction // J. Chromatogr. A. 2012. V. 1265. P. 52.
Hosseini M.H., Rezaee M., Akbarian S., Mizani F., Pourjavid M.R., Arabieh M. Homogeneous liquid-liquid microextraction via flotation assistance for rapid and efficient determination of polycyclic aromatic hydrocarbons in water samples // Anal. Chim. Acta.2013. V. 762. P. 54.
Hosseini M.H., Heydari R., Alimoradi M. Vortex and air assisted liquid–liquid microextraction as a sample preparation method for high-performed liquid chromatography determinations // Talanta.2014. V. 130. P. 171.
Molaei S., Saleh A., Ghoulipour V., Seidi S. Dissolved carbon dioxide flotation: an effective way for phase separation in emulsification microextraction method // J. Chromatogr. A. 2015. V. 1388. P. 280.
Zhang L., Wang C., Li Z., Zhao C., Zhang H., Zhang D. Extraction of acetanilides in rice using ionic liquid-based matrix solid phase dispersion-solvent flotation // Food Chem. 2018. V. 245. P. 1190.
Moavenian B., Hosseini M.H., Arabieh M., Pourjavid M.R., Sohrabi M.R. Extraction of lead from water using homogeneous liquid–liquid microextraction via flotation assistance method and UV-Vis spectrophotometric determination // J. Water Chem. Technol. 2018. V. 40. № 5. P. 291.
Rezaee M., Saberyan K., Tajer-Mohammad-Ghazvini P. Determination of malathion by homogeneous liquid-liquid micro extraction via flotation assistance combined with gas chromatography in water samples // Bull. Chem. Soc. Ethiop. 2019. V. 33. № 1. P. 1.
Pawlecki-Vonderheide A.M., Munch D.J., Munch J.W. Research associated with the development of EPA method 552.2 // J. Chromatogr. Sci. 1997. V. 35. № 7. P. 293.
Сироткин Р.Г., Крылов В.А., Елипашева Е.В., Грубов Р.Е., Лутошкина К.А. Ионохроматографическое определение хлоруксусных кислот с предварительным микроэкстракционным концентрированием // Аналитика и контроль. 2020. Т. 24. № 1. С. 31.
Гребенюк В.Д., Мазо А.А. Обессоливание воды ионитами. М.: Химия, 1980. 254 с.
СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. М.: Минздрав России, 2002. 103 с.
Guidelines for Drinking-water Quality. 4th Ed. World Health Organization. http://www.who.int/water_sanitation_health/publications/dwq-guidelines-4/en/ (10.06.2020).
Nair L.M., Saari-Nordhaus R., Anderson J.M. Determination of haloacetic acids by ion chromatography // J. Chromatogr. A. 1994. V. 671. P. 309.
Fu H.-T., Zhao L.-M., Luo M., Zhang H.-Y., Zhang J. Determination of chloracetic acids in drinking water by ion chromatography using silver oxide as precipitant eliminating interference of chlorate in matrix // Chinese J. Anal. Chem. 2008. V. 36. № 10. P. 1407.
Teh H.B., Li S.F.Y. Simultaneous determination of bromate, chlorite and haloacetic acids by two-dimensional matrix elimination ion chromatography with coupled conventional and capillary columns // J. Chromatogr. A. 2015. V. 1383. P. 112.
Verrey D., Louyer M.-V., Thomas O., Baures E. Direct determination of trace-level haloacetic acids in drinking water by two-dimensional ion chromatography with suppressed conductivity // Microchem. J. 2013. V. 110. P. 608.
Righi E., Fantuzzi G., Predieri G., Aggazzotti G. Bromate, chlorite, chlorate, haloacetic acids, and trihalomethanes occurrence in indoor swimming pool waters in Italy // Microchem. J. 2014. V. 113. P. 23.
Prieto-Blanco M.C., Alpendurada M.F., Lopez-Mahia P., Muniategui-Lorenzo S., Prada-Rodriguez D., Macha-do S., Goncalves C. Improving methodological aspects of the analysis of five regulated haloacetic acids in water samples by solid-phase extraction, ion-pair liquid chromatography and electrospray tandem mass spectrometry // Talanta. 2012. V. 94. P. 90.
Ferreira A.M.C., Laespada M.E.F., Pavon J.L.P., Cordero B.M. In situ derivatization coupled to microextraction by packed sorbent and gas chromatography for the automated determination of haloacetic acids in chlorinated water // J. Chromatogr. A. 2013. V. 1318. P. 35.
Saraji M., Bidgoli A.A.H. Single-drop microextraction with in-microvialderivatization for the determination of haloacetic acids in water sample by gas chromatography–mass spectrometry // J. Chromatogr. A. 2009. V. 1216. P. 1059.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии