Журнал аналитической химии, 2022, T. 77, № 5, стр. 462-470
Хромато-масс-спектрометрическое определение полициклических ароматических углеводородов в почвах и донных отложениях с пробоподготовкой по технике QuEChERS
З. А. Темердашев a, *, Т. Н. Мусорина a, С. К. Овсепян a, И. Г. Корпакова a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: temza@kubsu.ru
Поступила в редакцию 26.07.2021
После доработки 17.08.2021
Принята к публикации 22.09.2021
- EDN: YNIFHI
- DOI: 10.31857/S0044450222050164
Аннотация
Работа посвящена хромато-масс-спектрометрическому определению полиароматических углеводородов (ПАУ) в почвах и донных отложениях с применением пробоподготовки с извлечением аналитов в растворитель и одновременной очисткой экстрактов посредством дисперсионной твердофазной экстракции (QuEChERS). Объектами исследования служили образцы песка, суглинистых почв и илистых донных отложений, а аналитами – 20 ПАУ. Для минимизации влияния матричных эффектов оптимизированы условия пробоподготовки, изучено ультразвуковое воздействие на извлечение аналитов. Степень извлечения ПАУ из песка и илистых донных отложений варьировала в пределах 80–105%, суглинистых почв – 60–99%. Идентификацию и определение ПАУ проводили методом газовой хромато-масс-спектрометрии с детектированием аналитов в режиме заданных ионов. Показано, что пробоподготовка по технике QuEChERS способствует более длительной эксплуатации оборудования с сохранением чувствительности детектирования аналитов. Методика апробирована на образце почвы, отобранной на территории Таманского терминала навалочных грузов.
Определение полициклических ароматических углеводородов (ПАУ) относится к числу приоритетных задач экологического мониторинга, поскольку эти токсиканты обладают канцерогенной, мутагенной и тератогенной активностью [1]. К природным источникам поступления ПАУ в окружающую среду относятся извержения вулканов, лесные пожары, горючие ископаемые, они образуются при протекании биогенных процессов, при низкотемпературном изменении органических молекул [2]. Антропогенные источники ПАУ – сжигание полимерных материалов, их термическая деградация, деятельность перерабатывающих предприятий, выбросы авто- и авиатранспорта [3].
Наиболее наглядный показатель загрязненности окружающей среды – концентрация ПАУ в почвах и донных отложениях, обладающих высокой аккумулирующей способностью. Обычно на содержание ПАУ анализируют поверхностные слои почв, с увеличением глубины почвенного профиля их концентрация заметно снижается. Иммобилизация ПАУ почвами обусловлена их органической частью, в том числе гуминовыми веществами, способными к связыванию гидрофобных соединений за счет π–π взаимодействий между имеющимися ароматическими фрагментами [4]. Контроль ПАУ в донных отложениях является неотъемлемой частью экологического мониторинга водных систем ввиду низкой растворимости данных соединений в воде. ПАУ практически консервируются в донных отложениях, так как они в основном находятся в агрегированном виде на поверхности различных взвешенных, со временем оседающих микрочастиц [5].
Для определения ПАУ в объектах окружающей среды применяют методы высокоэффективной жидкостной [6–8] и газовой [9, 10] хроматографии. Для достоверной идентификации и определения ПАУ в аналитической практике используют различные способы детектирования аналитов, одним из которых является газовая хромато-масс-спектрометрия (ГХ-МС) [11]. Использование ГХ-МС в режиме заданных ионов (SIM) позволяет снизить влияние матрицы и повысить интенсивность сигнала, а применение капиллярных колонок способствует эффективному разделению близких по свойствам изомерных соединений.
Для извлечения ПАУ из почвенной матрицы традиционно используют аппарат Сокслета, однако данный способ экстракции весьма продолжителен, требует больших расходов растворителя [12]. Известны также альтернативные методы извлечения аналитов, более экспрессные и требующие меньшего расхода реагентов: ультразвуковая (УЗ) [13] и микроволновая экстракция [14], жидкостная экстракция под действием высокого давления [15], сверхкритическая флюидная экстракция [16], экстракция субкритической водой [17], дисперсионная жидкостно–жидкостная микроэкстракция [18].
Присутствие в матрицах почв и донных отложений широкого спектра органических веществ усложняет детектирование, поэтому, наряду с оптимизацией условий эффективного извлечения и концентрирования аналитов, особое внимание необходимо уделять очистке экстракта от компонентов матрицы, мешающих процедуре анализа. Твердофазная экстракция (ТФЭ) аналитов путем их распределения между подвижной и неподвижной фазами позволяет решать эту проблему [19]. Варьируя материал сорбента и систему растворителей при ТФЭ можно добиться высокой эффективности очистки экстракта и извлечения целевых компонентов. Для очистки почвенных экстрактов при определении ПАУ широко применяют силикагель [20] или его смеси с другими сорбентами, например оксидом алюминия [21]. Для этих же целей используют модифицированный октадецильными группами (С18) силикагель, его обычно сочетают с первичным и вторичным амином (PSA) [22]. Указанные сорбенты также можно использовать самостоятельно [23], в некоторых случаях для этих целей применяют диатомовую землю, клиноптилолит и флорисил [24].
Перспективной техникой подготовки почв является метод QuEChERS (Quick, Easy, Cheap, Effective, Rugged, Safe – быстро, просто, дешево, эффективно, надежно, безопасно) [25], предполагающий извлечение аналитов в растворитель в присутствии высаливателей и последующую очистку экстрактов посредством дисперсионной твердофазной экстракции [26]. Способ широко применяют при проведении экологического мониторинга, он обладает высокой производительностью, эффективностью и стабильностью. Метод QuEChERS позволяет извлекать аналиты из образцов со сложными матрицами за счет введения соответствующего сорбента либо смеси сорбентов в экстракт и распределения компонентов экстракта между двумя несмешивающимися фазами в образовавшейся дисперсной системе [27]. Диспергирование сорбента в матрицу образца посредством перемешивания, встряхивания, завихрения либо ультразвукового воздействия приводит к увеличению поверхности его контакта с сорбируемым веществом, что способствует повышению скорости массообменных процессов и быстрому установлению межфазного равновесия [28]. Использование дисперсионной ТФЭ в методе QuEChERS позволяет снизить объем используемых реагентов и сократить время анализа в сравнении с динамическим режимом сорбционной очистки экстрактов.
Цель данного исследования – хромато-масс-спектрометрическое определение ПАУ в почвах и донных отложениях различного типа с применением пробоподготовки по технике QuEChERS.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследований. Использовали реальные воздушно-сухие образцы песка (Темрюкский залив), суглинистых почв и илистых донных отложений (Куликово-Курчанская группа лиманов, Темрюкский район), отобранные при производственном экологическом контроле лицензионного участка ООО “НК “Приазовнефть”, а также образец почвы, отобранный на территории Таманского терминала навалочных грузов.
Материалы и реактивы. Использовали комплект индивидуальных стандартных образцов предприятия (СОП) состава растворов ПАУ в ацетонитриле, включающий нафталин (СОП 0109-03), 2-метилнафталин (СОП 0101-03), аценафтилен (СОП 0101-03), бифенил (СОП 0107-03), аценафтен (СОП 0103-03), флуорен (СОП 0113-03), фенантрен (СОП 0111-03), антрацен (СОП 0102-03), флуорантен (СОП 0112-03), пирен (СОП 0110-03), бенз[а]антрацен (СОП 0105-03), хризен (СОП 0114-03), бенз[b]флуорантен (СОП 0115-03), бенз[а]пирен (СОП 0106-03), бенз[k]флуорантен (СОП 0116-03), дибенз[а,h]антрацен (СОП 0108-03), бенз[g,h,i]перилен (СОП 0117-03) (НПО “Экрос”, Санкт-Петербург, Россия). Также использовали аналитические стандарты бенз[e]пирен (CAS 192-97-2) и индено[1,2,3-c,d]пирен (CAS 193-39-5) в циклогексане и трифенилен (CAS 217-59-4) (Sigma-Aldrich, США).
Для анализа исследуемых объектов использовали ацетонитрил 99.9% для ВЭЖХ (Sigma-Aldrich, США), силикагель “Sorbfil”, фракция 5–50 мкм (ООО “Имид”, Россия).
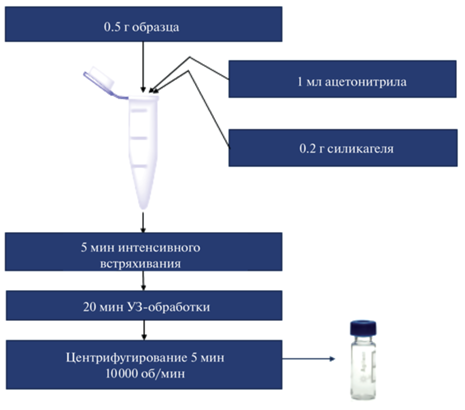
Пробоподготовка. Для установления оптимальных условий пробоподготовки по технике QuEChERS к навеске 0.5 г образца почвы (донных отложений) прибавляли 0.05–0.3 г силикагеля и 1 мл ацетонитрила. Полученную смесь интенсивно встряхивали в течение 5 мин, после этого пробу подвергали УЗ-обработке генератором ультразвуковых колебаний (УЗ-ванна) с частотой излучения 35 кГц (Сапфир, Россия) в течение 5–30 мин для интенсификации извлечения ПАУ. Затем в течение 5 мин центрифугировали смесь на центрифуге Mini Spin plus (Eppendorf, Германия) при скорости вращения ротора 10 000 об./мин, после чего переносили экстракт в виалу для хроматографирования.
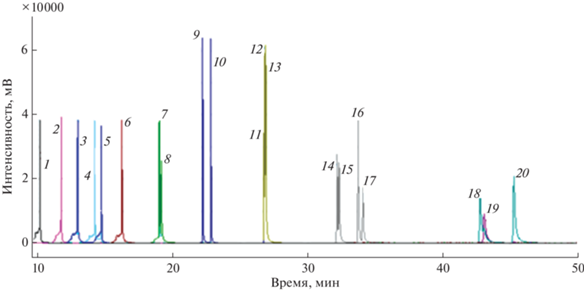
Хромато-масс-спектрометрический анализ. Для хроматографических исследований использовали систему, состоящую из газового хроматографа GC–2010 Plus с кварцевой капиллярной колонкой Zebron ZB-5MS (длина 60 м, внутренний диаметр 0.25 мм, толщина тонкого слоя 5% полисиларилен + 95% диметилполисилоксан 0.25 мкм) и моноквадрупольного масс-спектрометрического детектора GCMS–QP2020 (Shimadzu, Япония). Для идентификации компонентов примененяли интегрированные библиотеки масс-спектров Wiley8 – Mass Spectral Library и NIST-17.1. Хроматографирование экстрактов осуществляли в оптимизированных для определения 20 ПАУ в почвах и донных отложениях условиях [18] (табл. 1). Хроматограмма смеси исследуемых ПАУ с концентрацией каждого из них 200 нг/мл, полученная в режиме заданных ионов, представлена на рис. 1.
Таблица 1.
Условия хроматографического определения ПАУ в ацетонитрильных экстрактах почв и донных отложений
| Параметр | Значение |
|---|---|
| Объем вкола | 2 мкл |
| Температура испарителя | 280°С |
| Скорость потока | 1.35 мл/мин |
| Режим ввода | Split |
| Коэффициент деления потока | 1 : 5 |
| Температурный режим | 60°C/1 мин – нагрев 15°C/мин – до 170°C/3 мин – нагрев 10°C/мин – до 280°C/8 мин – нагрев 10°C/мин – до 290°C/25 мин |
| Задержка работы детектора | 7 мин |
| Способ ионизации | Электронный удар, 70 эВ |
| Температура ионного источника | 200°С |
| Температура интерфейса | 280°С |
| Масс-анализатор | Моноквадруполь с предфильтром |
| Режим сканирования | SIM |
Рис. 1.
Хроматограмма раствора смеси ПАУ с концентрацией каждого из 20 аналитов 200 нг/мл. 1 – нафталин, 2 – 2‑метилнафталин, 3 – бифенил, 4 – аценафтилен, 5 – аценафтен, 6 – флуорен, 7 – фенантрен, 8 – антрацен, 9 – флуорантен, 10 – пирен, 11 – бенз[a]антрацен, 12 – хризен, 13 – трифенилен, 14 – бенз[b]флуорантен, 15 – бенз[k]флуорантен, 16 – бенз[e]пирен, 17 – бенз[a]пирен, 18 – индено[1,2,3-c,d]пирен, 19 – дибенз[a, h]антрацен, 20 – бенз[g,h,i]перилен.
Для определения ПАУ в анализируемых образцах строили градуировочные зависимости с использованием растворов ПАУ с концентрациями каждого 500, 250, 200, 150, 100, 50, 10, 5, 2.5, 2, 1.5, 1, 0.5, 0.2, 0.1 нг/мл, приготовленных последовательным разбавлением смеси индивидуальных ПАУ. Рассчитанные коэффициенты аппроксимации для каждого аналита (n = 5, P = 0.95) составили не менее 0.99. Линейность отклика аналитического сигнала наблюдали для фенантрена, антрацена, флуорантена, пирена, бенз[a]антрацена, хризена, трифенилена, бенз[b]флуорантена, бенз[k]флуорантена, бенз[e]пирена, бенз[a]пирена, индено[1,2,3-c,d]пирена, дибенз[a, h]антрацена, бенз[g, h, i]перилена в диапазоне 1.0–500 нг/мл; для нафталина, 2-метилнафталина, аценафтилена, бифенила, аценафтена и флуорена он составил 2.0–500 нг/мл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
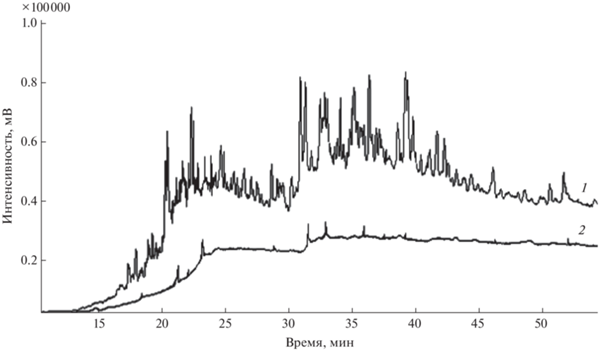
Влияние матрицы образцов на ГХ-МС-определение ПАУ. ГХ-МС-определение ПАУ в почвах и донных отложениях осложнено присутствием в анализируемых многокомпонентных матрицах соэкстрагируемых веществ, снижающих эффективность хроматографической колонки и загрязняющих ионный источник, что приводит к резкому падению чувствительности определения аналитов от вкола к вколу. Необходимость введения стадии очистки экстрактов почв (донных отложений) подтверждают данные регистрации их матричных компонентов в режиме полного ионного тока (рис. 2, хроматограмма I). Для устранения влияния матричных компонентов изучили возможность включения стадии очистки по технике QuEChERS в пробоподготовку исследуемых образцов при последующем ГХ-МС-анализе. Применение силикагеля для очистки экстракта позволило значительно снизить матричную нагрузку на хроматографическую систему (рис. 2, хроматограмма II), но определение следовых содержаний ПАУ в экстракте при хроматографировании в режиме полного ионного тока оказалось практически невозможным.
Рис. 2.
Хроматограмма экстракта илистых донных отложений Куликово-Курчанской группы лиманов в режиме полного ионного тока до (1) и после (2) очистки экстракта силикагелем.
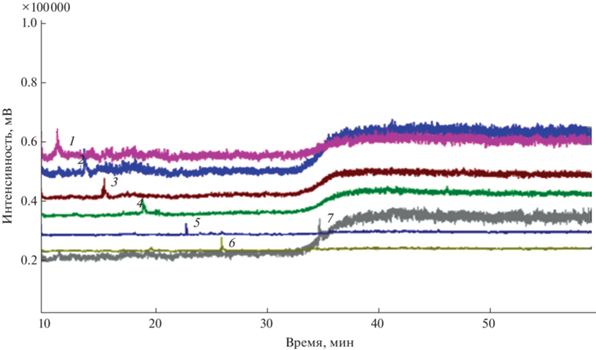
Данную проблему можно решить путем применения режима сканирования заданных ионов, о чем свидетельствует хроматограмма очищенного силикагелем экстракта образца донных отложений (рис. 3). ГХ-МС-анализ в режиме SIM позволил получить достаточно высокое соотношение сигнал/шум и снизить влияние компонентов матрицы.
Рис. 3.
Хроматограмма очищенного силикагелем экстракта образца илистых донных отложений Куликово-Курчанской группы лиманов, снятая в режиме сканирования заданных ионов. 1 – 2-метилнафталин, 2 – бифенил, 3 – флуорен, 4 – фенантрен, 5 – пирен, 6 – бенз[a]антрацен, 7 – бенз[a]пирен.
Оптимизация пробоподготовки испытуемых образцов по технике QuEChERS. Минимизацию потерь аналитов достигали извлечением и сорбционной очисткой экстракта в одной пробирке. Эффективность данного процесса оценивали методом введено–найдено добавлением в испытуемый образец (0.5 г) по 50 нг каждого из 20 индивидуальных ПАУ. Затем после выдерживания образцов в течение 2 ч ПАУ извлекали 1 мл ацетонитрила. Методику пробоподготовки отрабатывали на образцах илистых донных отложений, характеризующихся наиболее сложным компонентным составом матрицы с исходным содержанием ПАУ, не превышающим минимально определяемые по методике [18] концентрации аналитов. Наименьшие потери “легких” ПАУ (нафталина, 2-метилнафталина, аценафтилена, бифенила, аценафтена, флуорена и фенантрена) наблюдали при использовании 300 мг силикагеля, в случае ПАУ с 4–6 бензольными кольцами – 200 мг сорбента (табл. 2). Увеличение площади поверхности контакта исследуемого образца с сорбентом за счет изменения навески силикагеля с 50 до 300 мг/0.5 г илистых донных отложений позволило снизить мешающее влияние матричных компонентов, препятствующих свободному переходу аналитов в экстрагент, и повысило степени извлечения ПАУ в 1.5 раза. Степени извлечения аналитов при использовании навесок силикагеля массой 200 и 300 мг/0.5 г илистых донных отложений менялись разнонаправленно по отношению к индивидуальным ПАУ и различались не более чем на 8%. Для дальнейших исследований в качестве оптимальной использовали навеску 200 мг силикагеля.
Таблица 2.
Степень извлечения (%) ПАУ из образца илистых донных отложений при различных навесках силикагеля (n = 5, P = 0.95)
| ПАУ | Навеска силикагеля, мг | |||
|---|---|---|---|---|
| 50 | 100 | 200 | 300 | |
| Нафталин | 50 ± 15 | 57 ± 14 | 67 ± 15 | 72 ± 18 |
| 2-Метилнафталин | 52 ± 13 | 67 ± 16 | 72 ± 19 | 78 ± 16 |
| Аценафтилен | 48 ± 6 | 55 ± 9 | 55 ± 9 | 62 ± 11 |
| Бифенил | 50 ± 7 | 75 ± 8 | 86 ± 7 | 94 ± 8 |
| Аценафтен | 48 ± 12 | 65 ± 18 | 63 ± 17 | 70 ± 15 |
| Флуорен | 59 ± 8 | 82 ± 9 | 82 ± 11 | 83 ± 9 |
| Фенантрен | 60 ± 9 | 79 ± 7 | 80 ± 10 | 79 ± 8 |
| Антрацен | 46 ± 11 | 52 ± 13 | 69 ± 15 | 69 ± 7 |
| Флуорантен | 53 ± 6 | 79 ± 8 | 77 ± 6 | 69 ± 8 |
| Пирен | 53 ± 9 | 75 ± 10 | 72 ± 10 | 66 ± 14 |
| Бенз[а]антрацен | 58 ± 10 | 54 ± 4 | 64 ± 9 | 62 ± 8 |
| Хризен | 43 ± 12 | 60 ± 15 | 66 ± 19 | 64 ± 12 |
| Трифенилен | 45 ± 9 | 49 ± 6 | 54 ± 6 | 53 ± 8 |
| Бенз[b]флуорантен | 41 ± 9 | 83 ± 10 | 84 ± 9 | 79 ± 8 |
| Бенз[k]флуорантен | 45 ± 10 | 68 ± 10 | 66 ± 7 | 62 ± 9 |
| Бенз[е]пирен | 58 ± 10 | 75 ± 8 | 76 ± 13 | 71 ± 12 |
| Бенз[а]пирен | 63 ± 8 | 86 ± 8 | 97 ± 9 | 91 ± 9 |
| Индено[1,2,3–c,d]пирен | 63 ± 9 | 83 ± 17 | 86 ± 11 | 80 ± 17 |
| Дибенз[a,h]антрацен | 72 ± 9 | 99 ± 10 | 99 ± 10 | 100 ± 13 |
| Бенз[g,h,i]перилен | 55 ± 6 | 71 ± 7 | 73 ± 5 | 66 ± 6 |
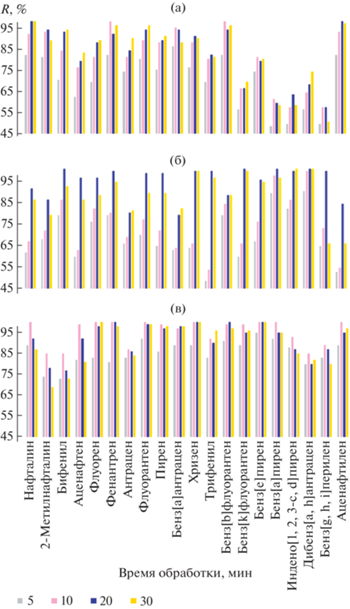
Ультразвуковое воздействие на извлечение ПАУ с использованием техники QuEChERS. О влиянии времени УЗ-обработки судили по значениям степеней извлечения ПАУ из образцов суглинистой почвы и илистых донных отложений Куликово-Курчанской группы лиманов, а также песка Темрюкского залива (рис. 4). Все 20 ПАУ из песка эффективно извлекались в течение 10 мин УЗ-обработки. Степени извлечения аналитов из образцов почв сопоставимы в интервале от 10 до 30 мин. Из илистых донных отложений наиболее эффективно ПАУ экстрагируются при УЗ-обработке в течение 20 мин, при меньшем времени обработки полнота извлечения аналитов не достигается. Бóльшая продолжительность УЗ-обработки образцов для извлечения ПАУ из суглинистой почвы и илистых донных отложений объясняется малой степенью накопления аналитов в песках ввиду обедненности их органического слоя. С учетом полученных результатов в качестве оптимальной выбрали продолжительность УЗ-воздействия 20 мин для всех типов исследуемых образцов.
Рис. 4.
Зависимость степени извлечения ПАУ от продолжительности УЗ-обработки образцов суглинистой почвы (а), илистых донных отложений Куликово-Курчанской группы лиманов (б) и песка Темрюкского залива (в).
Оптимизированная подготовка образцов песка, суглинистых почв и илистых донных отложений к ГХ-МС-анализу, основанная на ультразвуковой экстракции с одновременной очисткой экстракта методом дисперсионной ТФЭ по технике QuEChERS, схематично представлена на рис. 5.
Практическая значимость разработанной схемы заключается в минимизации влияния сложных для анализа матриц реальных образцов на разрешающую способность и чувствительность хромато-масс-спектрометрического определения ПАУ в почвах (донных отложениях). Необходимость и целесообразность стадии очистки исследовали периодическим контролем с использованием градуировочного раствора смеси ПАУ. В случае хроматографирования подготовленных без очистки экстрактов после 35 вколов площади пиков ПАУ контрольного раствора уменьшились на 30%. При анализе подготовленных по технике QuEChERS с УЗ-обработкой экстрактов снижение чувствительности детектора практически не наблюдается – изменения площади пиков колебались в пределах 10%.
Анализ реальных образцов. Сочетание УЗ-обработки и техники QuEChERS при определении ПАУ методом газовой хромато-масс-спектрометрии апробировали на образце почвы, отобранной на территории Таманского терминала навалочных грузов. Правильность полученных данных сопоставляли с результатами анализа образца методом ВЭЖХ с флуориметрическим детектированием (ФЛД) по аттестованной методике [29] (табл. 3).
Таблица 3.
Результаты (мкг/кг) определения ПАУ в образце почвы (Таманский терминал навалочных грузов) (n = 3, P = 0.95)
| ПАУ | ГХ-МС | ВЭЖХ-ФЛД [29] |
|---|---|---|
| Нафталин | 8.4 ± 4.1 | <20 |
| Флуорен | 3.1 ± 1.5 | 2.1 ± 0.8 |
| Фенантрен | 6.5 ± 3.2 | 6.8 ± 2.0 |
| Антрацен | <2.0 | 0.9 ± 0.3 |
| Флуорантен | 6.6 ± 3.4 | 8.4 ± 2.5 |
| Пирен | 5.7 ± 2.7 | 6.3 ± 3.3 |
| Хризен | 2.8 ± 1.3 | 2.5 ± 0.6 |
| Трифенилен | <2.0 | 2.1 ± 0.8 |
| Бенз[b]флуорантен | 5.6 ± 2.7 | 3.2 ± 1.1 |
| Бенз[k]флуорантен | 2.6 ± 1.3 | 1.8 ± 0.6 |
| Бенз[а]пирен | 2.2 ± 1.1 | 1.9 ± 0.4 |
| Дибенз[a,h]антрацен | <2.0 | 0.25 ± 0.09 |
| Бенз[g,h,i]перилен | 4.4 ± 2.2 | 3.2 ± 1.2 |
Присутствие в образце большого количества различных ПАУ, по-видимому, обусловлено возможными загрязнениями почвы экотоксикантами при перевалке угля и высокой транспортной загруженностью исследуемой территории Таманского терминала навалочных грузов.
Можно сделать вывод, что пробоподготовка с применением техники QuEChERS может быть использована при определении ПАУ в образцах почв (донных отложений) с различными матрицами. Данная техника является относительно простой и экспрессной, позволяет проводить извлечение аналитов и очистку экстракта в одну стадию. Степень извлечения ПАУ из образцов песка и илистых донных отложений варьирует в пределах 80–105%, суглинистых почв – 60–99%.
Работа выполнена в рамках гранта РФФИ (№ 19-43-230003 р_а) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Baird M.W., Hooven L.A., Mahadevan B. Carcinogenic polycyclic aromatic hydrocarbon-DNA adducts and mechanism of action // Environ. Mol. Mutagen. 2005. V. 45. P. 106.
Patel A.B., Shaikh S., Jain K.R., Desai C., Madamwar D. Polycyclic aromatic hydrocarbons: Sources, toxicity, and remediation approaches // Front. Microbiol. 2020. V. 11. № 562813. P. 1.
Nikitha T., Satyaprakash M., Vani Satya S., Sadhana B., Padal S.B. A Review on polycyclic aromatic hydrocarbons: Their transport, fate and biodegradation in the environment // Int. J. Curr. Microbiol. App. Sci. 2017. V. 6. № 4. P. 1627.
Xu D., Zhu S., Chen H., Li F. Structural characterization of humic acids isolated from typical soils in China and their adsorption characteristics to phenanthrene // Coll. Surfaces A: Physicochem. Eng. Aspects. 2006. V. 276. P. 1.
Baran A., Tarnawski M., Urbański K., Klimkowicz-Pawlas A., Spałek I. Concentration, sources and risk assessment of PAHs in bottom sediments // Environ. Sci. Pollut. Res. 2017. V. 24. P. 23180.
Huang Y., Wei J., Song J., Chen M., Luo Y. Determination of low levels of polycyclic aromatic hydrocarbons in soil by high performance liquid chromatography with tandem fluorescence and diode-array detectors // Chemosphere. 2013. V. 92. P. 1010.
Zhang J., Yang J., Yu F., Liu X., Yu Y. Polycyclic aromatic hydrocarbons in urban Greenland soils of Nanjing, China: Concentration, distribution, sources and potential risks // Environ. Geochem. Health. 2020. V. 42. P. 4327.
Manousi N. Zachariadis G.A. Recent advances in the extraction of polycyclic aromatic hydrocarbons from environmental samples // Molecules. 2020. V. 25. № 2182. P. 1.
Carvalho F.I.M., Dantas Filho H.A., Dantas K.G.F. Simultaneous determination of 16 polycyclic aromatic hydrocarbons in groundwater by GC-FID after solid-phase extraction // SN Appl. Sci. 2019. V. 1. № 7. Article 804.
Ericsson M., Colmsjö A. Dynamic microwave-assisted extraction coupled on-line with solid-phase extraction: determination of polycyclic aromatic hydrocarbons in sediment and soil // J. Chromatogr. A. 2002. V. 964. P. 11.
Soukarieh B. Hawari K., Husseini M., Budzinski H., Jaber F. Impact of Lebanese practices in industry, agriculture and urbanization on soil toxicity. Evaluation of the polycyclic aromatic hydrocarbons (PAHs) levels in soil // Chemosphere. 2018. V. 210. P. 85.
De la Rosa J.M., Paneque M., Hilber I., Blum F., Knicker H.E., Bucheli T.D. Assessment of polycyclic aromatic hydrocarbons in biochar and biochar-amended agricultural soil from Southern Spain // J. Soils Sediments. 2015. V. 16. P. 557.
Ozcan S., Tor A., Aydin M.E. Determination of polycyclic aromatic hydrocarbons in soil by miniaturized ultrasonic extraction and gas chromatography-mass selective detection // Clean. 2009. V. 37. P. 811.
Sánchez-Uría J.E., Del Castillo-Busto E. Analytical performance of microwave-assisted solvent extraction (MASE) for the routine determination of PAHs in polluted soils by gas chromatographic-mass spectrometry (GC-MS) // Rev. Int. Contam. Ambie. 2018. V. 34. P. 355.
Barco-Bonilla N., Martínez Vidal J.L., Garrido Frenich A., Romero-Gonzalez R. Comparison of ultrasonic and pressurized liquid extraction for the analysis of polycyclic aromatic compounds in soil samples by gas chromatography coupled to tandem mass spectrometry // Talanta. 2009. V. 78. P. 156.
Librando V., Hutzinger O., Tringali G., Aresta M. Supercritical fluid extraction of polycyclic aromatic hydrocarbons from marine sediments and soil samples // Chemosphere. 2004. V. 54. P. 1189.
Latawiec A.E., Reid B.J. Sequential extraction of polycyclic aromatic hydrocarbons using subcritical water // Chemosphere. 2010. V. 78. P. 1042.
Темердашев З.А., Мусоринa Т.Н., Червонная Т.А. Хромато-масс-спектрометрическое определение полициклических ароматических углеводородов в почвах и донных отложениях с применением техники дисперсионной жидкостно-жидкостной микроэкстракции // Журн. аналит. химии. 2020. Т. 75. С. 702. (Temerdashev Z.A., Musorina T.N., Chervonnaya T.A. Determination of polycyclic aromatic hydrocarbons in soil and bottom sediments by gas chromatography–mass spectrometry using dispersive liquid–liquid microextraction // J. Anal. Chem. 2020. V. 75. P. 1000.)
Dąbrowska H., Dabrowski L., Biziuk M., Gaca J., Namiesnik J. Solid-phase extraction clean-up of soil and sediment extracts for the determination of various types of pollutants in a single run // J. Chromatogr. A. 2003. V. 1003. P. 29.
Wang Z., Chen J., Qiao X., Yang P., Tian F., Huang L. Distribution and sources of polycyclic aromatic hydrocarbons from urban to rural soils: A case study in Dalian, China // Chemosphere. 2007. V. 68. P. 965.
Wang R., Liu G., Chou C.-L., Liu J., Zhang J. Environmental assessment of PAHs in soils around the Anhui coal district, China // Arch. Environ. Contam. Toxicol. 2009. V. 59. P. 62.
Hamid R.S. GC/MS monitoring of selected PAHs in soil samples using ultrasound-assisted QuEChERS in tandem with dispersive liquid-liquid microextraction // Int. J. Educ. Through Art. 2015. V. 3. P. 288.
Martinez E., Gros M., Lacorte S., Barceló D. Simplified procedures for the analysis of polycyclic aromatic hydrocarbons in water, sediments and mussels // J. Chromatogr. A. 2004. V. 1047. P. 181.
Nikolic J.S., Stankov Jovanovic V.P., Dimitrijevic M.V., Cvetkovic D.J., Stanojevic L.P., Nikolic L.B., Mitic V.D. Dispersive solid-phase extraction clean up combined with Soxhlet extraction for the determination of 16 PAHs in soil samples by GC-MS // Int. J. Environ. Anal. Chem. 2017. V. 97. P. 112.
Федотов П.С., Малофеева Г.И., Савонина Е.Ю., Спиваков Б.Я. Твердофазная экстракция органических веществ: нетрадиционные методы и подходы // Журн. аналит. химии. 2019. Т. 74. С. 163. (Fedotov P.S., Malofeeva G.I., Savonina E.Y., Spivakov B.Y. Solid-phase extraction of organic substances: Unconventional methods and approaches // J. Anal. Chem. 2019. V. 74. P. 205.)
Santana-Mayor A., Socas-Rodríguez B., Herrera-Herrera A.V., Rodríguez-Delgado M.A. Current trends in QuEChERS method. A versatile procedure for food, environmental and biological analysis // Trends Anal. Chem. 2019. V. 116. P. 214.
Perestrelo R., Silva P., Porto-Figueira P., Pereira J.A.M., Silva C., Medina S., Câmara J.S. QuEChERS – fundamentals, relevant improvements, applications and future trends // Anal. Chim. Acta. 2019. V. 1070. P. 1.
Sajid M., Nazal M.K., Ihsanullah I. Novel materials for dispersive (micro) solid-phase extraction of polycyclic aromatic hydrocarbons in environmental water samples: A review // Anal. Chim. Acta. 2021. V. 1141. P. 246.
ФР. 1.31.2007.03548. Методика выполнения измерений массовой доли полициклических ароматических углеводородов в пробах почв и донных отложений пресных и морских водных объектов. Ростов-на-Дону, 2007. 9 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии