Журнал аналитической химии, 2022, T. 77, № 5, стр. 406-411
Автоматическое экспресс-определение четырех кардиомаркеров в плазме крови пациентов с кардиопатологиями
Н. Л. Нечаева a, *, О. Н. Сорокина a, Т. С. Константинова a, А. Д. Васильева a, Л. В. Юрина a, Н. А. Бызова b, А. Е. Бугрова a, С. Н. Подойницын a, А. В. Еременко a, И. Н. Курочкин a, c
a Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
110334 Москва, ул. Косыгина, 4, Россия
b Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Ленинский просп., 33, стр. 2, Россия
c Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: laboratoria.ibcp@gmail.com
Поступила в редакцию 23.06.2021
После доработки 02.08.2021
Принята к публикации 02.08.2021
- EDN: KRZBED
- DOI: 10.31857/S0044450222050103
Аннотация
Предложен метод одновременного экспресс-определения четырех белков – кардиомаркеров (С-реактивный белок, цистатин C, миоглобин и Д-димер) в плазме крови пациентов с кардиопатологиями. Изменение концентрации каждого из белков в отдельности может указывать на определенные патологические процессы в организме человека, а одновременное повышение концентрации всех четырех маркеров свидетельствует о возможном развитии острой кардиопатологии. Экспресс-анализ основан на методе иммуномагнитной аффинной сепарации целевых белков из образцов крови с использованием флуоресцентной метки для каждого исследуемого белка. Предложенный метод автоматизирован и оптимизирован для определения физиологических и патологических концентраций целевых маркеров крови. Разработана автоматическая биоаналитическая платформа на основе предлагаемого метода, которая позволяет проводить экспресс-определение кардиомаркеров в 17 мкл плазмы крови за 14 мин.
Широкий спектр заболеваний может демонстрировать сходные симптомы и для постановки точного диагноза требуется проведение дифференциальной диагностики патологического состояния. Так, например, можно перечислить целый ряд причин боли в груди. Они могут возникать в связи с заболеваниями сердца, легких, желудочно-кишечного тракта, и в этом случае важно как можно более точно определить происхождение боли. Одним из самых информативных видов анализа для диагностики является анализ крови на специфические маркеры (сердечно-сосудистые, воспалительные, почечные, онкологические и др.). Экспресс-тесты крови, доступные для индивидуального применения, или экспресс-анализ в больнице могут сделать предварительную диагностику более дифференцированной и эффективной. В клинической практике требуется быстрый и точный анализ крови на инфекционные маркеры, заболевания почек и сердца. Ранняя диагностика таких биомаркеров может значительно снизить риск возникновения возможных осложнений и упростить лечение и реабилитацию пациента. Четыре белка плазмы человека – C-реактивный белок (СРБ), цистатин C (Цис-С), миоглобин (МГ) и Д-димер (Д-Дм) – отражают воспалительный или тромбоэмболический статус пациента и играют роль кардиомаркеров [1, 2]. Миоглобин – цитоплазматический белок скелетных мышц и миокарда с молекулярной массой 17.9 кДа. Физиологическая концентрация МГ в крови составляет от 6 до 85 нг/мл [3]. Избыток МГ позволяет оценить разрушение мышечной ткани, динамику процесса и эффективность лечения. Устойчивый избыток МГ в крови указывает на его продолжающееся высвобождение из мышечной ткани, так как его полувыведение из крови (через почки) составляет около 9 мин [4]. Цистатин C – это низкомолекулярный (13.4 кДа) белок, ингибитор цистеиновых протеаз, который продуцируется всеми ядросодержащими клетками организма. Повышение уровня Цис-С в крови может указывать на умеренную почечную недостаточность и сердечно-сосудистую дисфункцию у пожилых пациентов [5]. Физиологический уровень Цис-С в плазме крови находится в диапазоне от 600 до 1200 нг/мл. С-реактивный белок – это белок с молекулярной массой 25 кДа, который участвует в воспалительных и иммунологических процессах. Физиологическая концентрация СРБ в плазме крови составляет около 1000 нг/мл, но может резко возрасти при острой фазе воспаления до 500 мкг/мл [6, 7]. Клинические исследования показали, что высокие значения СРБ (4.0–6.0 мкг/мл) связаны с риском сердечно-сосудистых дисфункций [8]. Д-димер представляет собой продукт разложения фибрина с молекулярной массой 180 кДа, уровень которого в крови увеличивается после фибринолиза. В клинической практике Д-Дм используется для контроля коагуляции и фибринолиза [9]. Физиологический диапазон Д-Дм составляет от 0 до 250 нг/мл [10]. Повышение концентрации Д-Дм указывает на активацию коагуляции (диссеминированное внутрисосудистое свертывание, тромбоз глубоких вен, легочная тромбоэмболия, массивное повреждение тканей или хирургическое вмешательство, сердечная недостаточность, опухолевые заболевания). И коагуляция, и фибринолиз приводят к увеличению уровня Д-Дм, в отличие от других подобных маркеров. Повышенное содержание каждого белка может указывать на серьезные проблемы со здоровьем, а их одновременное обнаружение позволит прояснить всю картину заболевания. Быстрое и точное одновременное определение этих четырех биомаркеров может упростить дифференциальную диагностику и выбрать корректную стратегию лечения.
Экспресс-определению сердечных биомаркеров в микрообъеме пробы посвящено немало работ. Так, описан [11] иммуносенсор для обнаружения Д-Дм в модельной системе с малым временем отклика (20 с), однако оно не включает затраты времени на промывку и регенерацию датчика. В работе [12] описан электрохимический биосенсор для определения МГ в 1 мкл неразбавленной плазмы в течение 30 мин. Этот иммуносенсор работает в широком диапазоне концентраций МГ – от значений, характерных для здоровых доноров, до типичных для пациентов с острым инфарктом миокарда. Тем не менее особый интерес представляют работы, в которых обсуждается одновременное определение нескольких биомаркеров.
Мультиплексное определение может быть реализовано с помощью маркировки аналитов разными маркерами [13]. Используя два разных маркера можно определять два разных аналита. Например, иммуноанализ с использованием антител, меченных хелатными комплексами европия(III) и самария(III), использовали для определения МГ и сердечного тропонина T с последующим флуоресцентным детектированием методом флуориметрии с временным разрешением. Одновременное определение СРБ и Д-Дм в плазме крови человека проводят методом спектроскопии отражения с предварительной градуировкой с использованием биотинилированных антител [14]. Каждый шаг занимает 20 мин, таким образом, весь анализ смеси двух аналитов длится примерно 45 мин. Описано также определение нескольких кардиомаркеров менее чем за 30 мин, но только в модельной системе [15]. Креатинкиназу MB, СРБ, Д-Дм и ассоциированный с беременностью протеин-А плазмы определяли одновременно в буферном растворе с помощью интегрированной акустической платформы. Иммунохроматографический анализ (ИХА) также показал убедительные результаты [16]. Авторы описали ИХА-тест для быстрой количественной оценки трех биомаркеров (тропонин I, белок, связывающий жирные кислоты, и СРБ) в сыворотке всего за 10 мин. В интегрированном чипе [17] происходит связывание белков-маркеров на поверхности сенсора и регистрируется электрический сигнал, что позволяет одновременно определять три сердечных биомаркера: тропонин T, креатинкиназу MM и креатинкиназу MB. Встроенный чип позволяет достичь предела обнаружения 1 пг/мл для трех сердечных биомаркеров из 2 мкл крови за 45 мин.
Несмотря на быстрое развитие точных методов определения, разделение и концентрирование целевых аналитов остается актуальной задачей. Магнитные частицы (МЧ) используются в качестве твердофазных носителей для аффинной сепарации и концентрирования аналита. В настоящее время МЧ, функционализированные антителами, широко используются в аналитической химии как для разделения сложных смесей, так и для специфического определения различных соединений [18–21]. Применение МЧ позволяет преодолеть проблему диффузионных ограничений, типичную для гетерогенной иммунореакции. Комбинация МЧ с различными методами определения приводит к сокращению продолжительности анализа и снижению пределов обнаружения за счет уменьшения объема образца и концентрирования определяемого вещества в зоне измерения соответственно [22–24].
В настоящей работе представлена автоматическая бионалитическая платформа (АБП) для проведения одновременного флуоресцентного определения методом иммуноанализа на магнитных частицах четырех кардиомаркеров в плазме крови пациентов с кардиопатологиями.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ковалентная иммобилизация антител на магнитных частицах с помощью поверхностной функциональной аминогруппы (–NH2). Поверхность МЧ функционализировали моноклональными антителами путем ковалентного связывания через глутаровый альдегид согласно протоколу производителя (Силекс, Россия). 1.75 мл смеси 0.025 М натрий-фосфатного буферного раствора, 22% глутаральдегида и 6 мг/мл МЧ в конечном объеме инкубировали в течение 3 ч при комнатной температуре при постоянном перемешивании. Затем МЧ промывали 0.025 М натрий-фосфатным буферным раствором (pH 7.4). После этого 1 мл раствора антител Ат1 (анти-МГ клон 4E2cc, анти-СРБ клон C2cc, анти-Д-Дм клон DD189cc, анти-Цис-С клон Cyst24cc), содержащего аскорбиновую кислоту (5 мМ), добавляли в суспензию МЧ до конечной концентрации 0.5 мг/мл и инкубировали полученную смесь при постоянном перемешивании в течение 2 ч при комнатной температуре. Для пассивации свободной поверхностей магнитных частиц к суспензии добавляли 0.5% бычьего сывороточного альбумина (БСА) и инкубировали в течение 3 ч при постоянном перемешивании. Несвязанные антитела и другие избыточные реагенты удаляли из суспензии многократной промывкой 0.05 мМ фосфатным буферным раствором (ФСБ) с pH 7.4. Затем МЧ ресуспендировали в 1 мл ФСБ с 0.1% БСА для получения стоковой суспензии 10 мг/мл. Для предотвращения бактериального загрязнения к готовой суспензии добавляли 20 мкл 1%-ного раствора азида натрия. Модификацию МЧ моноклональными антителами контролировали неконкурентным гетерогенным иммуноферментным анализом (ИФА) на магнитных частицах в качестве твердой фазы.
Синтез флуоресцентных конъюгатов. Антитела конъюгировали флуоресцентной меткой следующим образом: 200 мкл 0.1 мМ раствора антител Ат2 (анти-МГ клоны 7C3cc, анти-СРБ C6cc, анти-Д-Дм DD255cc и анти-Цис-С Cyst19cc) в 50 мМ ФСБ с pH 7.4 смешивали с 0.5 мМ раствором сложного эфира N-гидроксисукцинимида бордипиррометенового флуорофора BDP 558/568 (Фл) в диметилсульфоксиде и инкубировали в течение 2 ч в темноте при комнатной температуре при непрерывном перемешивании. Избыточные непрореагировавшие реагенты с низкой молекулярной массой удаляли диализом против ФСБ. Концентрацию антител в конъюгатах определяли спектрофотометрически с антивидовыми моноклональными антителами мыши, конъюгированными пероксидазой хрена, на микропланшетах, покрытых антигеном, при λ = 450 нм. Молярное отношение флуоресцентной метки к антителу в конъюгатах составляло 1.2–1.5.
Автоматизированная биоаналитическая платформа для одновременного определения биомаркеров. Автоматизированная биоаналитическая платформа для определения биомаркеров на МЧ методом иммуноанализа была изготовлена в лаборатории совместно с Троицким инженерным центром и позволяет одновременно определять антигены (Аг) МГ, Цис-С, СРБ и Д-Дм в плазме крови. Такая платформа состоит из чипа с реагентами, столика-манипулятора, микронасосов Cavro® XCalibur Pump (XC) (Tecan Trading AG, Швейцария) и системы детекции флуоресценции с длиной волны возбуждения 532 нм (зеленый твердотельный диодный лазер). Все действия манипулятора, насосов и детектора флуоресценции контролировались программой автоматического управления, разработанной авторами. Общая продолжительность процедуры, включая введение образца, смешивание, инкубацию, промывку и детектирование сигнала, составила 14 мин.
Автоматизированная биоаналитическая платформа (рис. 1) работает следующим образом. Чип с реагентами (1) устанавливается на платформу столика-манипулятора (2) и запускается компьютерная программа автоматического управления биоаналитической платформой. Для каждого аналита имеется отдельная лунка с МЧ, меченными специфическими антителами. Четыре отдельные лунки чипа подключены к промывочной насосной системе (3) для инкубации и промывки аналитов. Наконечник (4) разносит плазму крови в лунки для образцов. Объемы плазмы, необходимые для анализа, зависят от средней концентрации и молекулярной массы белка в плазме крови. Объемы образцов и флуоресцентного конъюгата представлены в табл. 1. Для проведения автоматического анализа аналиты разделены на две группы с высокой (СРБ и Цис-С) и низкой (МГ и Д-Дм) концентрацией в крови. Образец плазмы для определения МГ и Д-Дм разбавляют в два раза флуоресцентными конъюгатами, а в случае СРБ и Цис-С – в десять раз. Такая схема разбавления позволяет учесть разницу концентраций аналитов в два порядка. После добавления образца плазмы крови к MЧ и флуоресцентному конъюгату на поверхности МЧ формируется комплекс Ат1–Аг–Ат2-Фл. Не связавшиеся в комплекс реагенты удаляются с помощью промывки лунок раствором ФСБ, при этом МЧ удерживаются в лунке внешним магнитным полем от постоянного магнита (NdFeB).
Рис. 1.
Схема работы автоматизированной биоаналитической платформы для одновременного количественного анализа. 1 – чип с реагентами, 2 – платформа манипулятора, 3 – система промывочных насосов, 4 – наконечник, 5 – детектор флуоресценции.
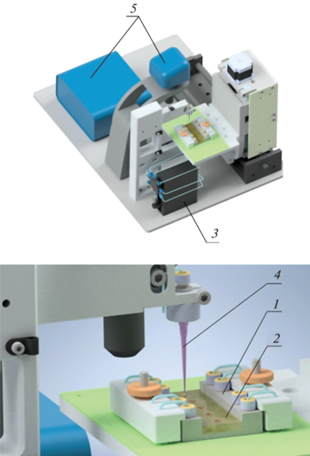
Таблица 1.
Условия одновременного автоматического определения четырех аналитов
| Условие | МГ | Цис-С | СРБ | Д-Дм |
|---|---|---|---|---|
| Объем образца плазмы, мкл | 5 | 1 | 1 | 10 |
| Объем флуоресцентного конъюгата, мкл | 5 | 8 | 8 | 10 |
| Концентрация флуоресцентного конъюгата, мкг/мл | 10 | 8 | 8 | 10 |
| Время инкубации, мин | 5 | 5 | 3 | 10 |
| Интенсивность лазерного излучения для физиологических концентраций, мВт | 20 | 4 | 4 | 30 |
| Интенсивность лазерного излучения для патологических концентраций, мВт | 4 | 1.2 | 1.2 | 12 |
Образцы плазмы крови были предоставлены городской клинической больницей № 51 и проанализированы в больнице на автоматическом анализаторе Siemens.
Флуоресцентные измерения с поверхности МЧ выполняли с использованием флуоресцентного анализатора (5) – спектрометра innoRam (BWTech) с лазером 532 нм (максимальная мощность 40 мВт), оснащенного видеомикроскопом BAC102. Объектив PL L 10/0.40 фокусирует лазерный луч в пятно шириной 210 мкм. Интенсивность излучения лазера оптимизировали для каждого аналита (см. табл. 1). Все эксперименты проводили в трехкратной повторности. Рассчитывали среднее значение и доверительный интервал.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
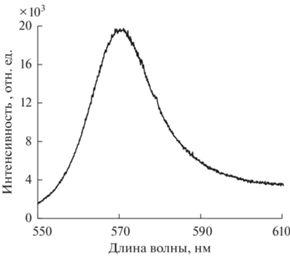
Биомаркеры определяли одностадийным методом иммуноанализа на МЧ с флуоресцентным детектированием. Спектр флуоресценции красителя BDP 558/568 представлен на рис. 2. В качестве аналитического сигнала в разработанной методике использовали максимальную интенсивность спектров флуоресценции. Принцип анализа и схема его проведения подробно описаны в работе [25 ] .
Пределы обнаружения аналитов предлагаемым методом составляют: для МГ 5.7 нг/мл (0.32 нмоль/л), для Цис-С – 143 нг/мл (10.7 нмоль/л), для СРБ – 67 нг/мл (2.7 нмоль/л), для Д-Дм – 61 нг/мл (0.34 нмоль/л) [25 ] .
Автоматизация может упростить мультиплексное обнаружение за счет сокращения затрат времени на рутинные процедуры, такие как промывка и перенос реагентов, а также за счет выполнения нескольких процессов одновременно.
Ранее одновременное определение четырех кардиомаркеров в плазме крови с помощью автоматизированной биоаналитической платформы проводили в плазме крови доноров с физиологическими концентрациями кардиомаркеров. В настоящей работе аналитические возможности платформы расширены и выполнено определение патологических концентраций аналитов. Расширение диапазона определяемых содержаний границ стало возможным за счет дополнительной регистрации флуоресцентного сигнала в условиях, отличных от условий регистрации сигнала от образцов с физиологическими параметрами (табл. 1). Такой подход позволяет получать количественные данные о концентрации белков за пределами их физиологических значений без проведения дополнительных операций по разведению образца, в отличие от анализа методом ИФА. Исследовали образцы крови пациентов с кардиопатологией. Результаты автоматизированного определения концентраций кардиомаркеров в образцах крови 17 пациентов с кардиопатологией представлены в табл. 2 в сравнении с показателями концентраций маркеров, предоставленных ГКБ № 51.
Таблица 2.
Результаты (нг/мл) одновременного определения кардиомаркеров в плазме крови пациентов с кардиопатологией с использованием разработанной автоматической биоаналитической платформы и данные, полученные в больнице № 51
| № пробы |
СРБ | Цис-С | МГ | Д-Дм | ||||
|---|---|---|---|---|---|---|---|---|
| АБП | больница | АБП | больница | АБП | больница | АБП | больница | |
| 1 | 25000 ± 500 | 62 060 | 1500 ± 100 | 1170 | 135 ± 10 | 141 | 500 ± 50 | – |
| 2 | 800 ± 100 | 730 | 1800 ± 100 | 1770 | 51 ± 7 | 58 | 500 ± 50 | 233 |
| 3 | 19300 ± 500 | 16 010 | 2600 ± 100 | 2170 | 51 ± 7 | 53 | 3220 ± 100 | 3728 |
| 4 | 1450 ± 100 | 1380 | 1150 ± 50 | – | 47 ± 7 | – | 550 ± 50 | 586 |
| 5 | 13700 ± 500 | 14 970 | 1600 ± 100 | – | 52 ± 7 | – | 10000 ± 500 | 23 312 |
| 6 | 15000 ± 500 | 41 500 | 1150 ± 50 | 1150 | 67 ± 7 | 64 | 2900 ± 100 | 2915 |
| 7 | 1780 ± 100 | 1790 | 790 ± 50 | 760 | 41 ± 7 | 42 | 200 ± 30 | 377 |
| 8 | 1600 ± 100 | 2030 | 950 ± 50 | 990 | 44 ± 7 | 41 | 1400 ± 100 | 1509 |
| 9 | 18000 ± 500 | 11 170 | 1070 ± 50 | 960 | 44 ± 7 | 49 | 700 ± 50 | 621 |
| 10 | 25000 ± 500 | 45 170 | 1600 ± 100 | 1350 | 74 ± 10 | 74 | 680 ± 50 | 582 |
| 11 | 16500 ± 500 | 16 640 | 2300 ± 100 | 2111 | 88 ± 10 | 70 | 10000 ± 500 | – |
| 12 | 2000 ± 100 | 470 | 1320 ± 50 | 1320 | 42 ± 7 | 42 | 600 ± 50 | – |
| 13 | 12000 ± 500 | 8700 | 1700 ± 100 | 1650 | 44 ± 7 | 46 | 200 ± 30 | 206 |
| 14 | 3700 ± 300 | 3550 | 1100 ± 50 | 830 | 55 ± 7 | 30 | 600 ± 50 | – |
| 15 | 1700 ± 100 | 4700 | 1700 ± 100 | – | 40 ± 7 | – | 420 ± 50 | 566 |
| 16 | 6000 ± 300 | 4930 | 1030 ± 50 | 1020 | 60 ± 7 | 61 | 950 ± 50 | 956 |
| 17 | 25000 ± 500 | 64 030 | 900 ± 50 | 700 | 54 ± 7 | 56 | 1300 ± 100 | 981 |
Из табл. 2 видно, что с учетом стандартной погрешности определения результаты, полученные с использованием разработанной биоаналитической платформы, соответствуют данным ГКБ № 51. Диапазон определяемых концентраций в плазме крови с помощью АБП для СРБ составляет 200–25 000 нг/мл, для Цис-С 770–2600 нг/мл, для МГ 14–135 нг/мл, для Д-Дм 8–10 000 нг/мл.
Разработанный способ флуоресцентного иммуноанализа с использованием магнитных микрочастиц позволяет проводить автоматизированное одновременное определение четырех кардиомаркеров в диапазоне как физиологических концентраций, так и за их пределами с использованием 17 мкл плазмы крови в течение 14 мин. Результаты автоматизированного экспресс-определения кардиомаркеров от 17 пациентов, выполненного на разработанной автоматической установке, коррелируют со значениями, полученными на автоматическом анализаторе Siemens в больнице № 51. Предлагаемый прототип может быть преобразован в стационарный прибор для экспресс-анализа крови и дифференциальной диагностики.
Работа выполнена за счет средств госзаданий АААА-А19-119071890024-8 и AAAA-A19-119110790066-5 и гранта РФФИ 20-21-00080.
Авторы выражают благодарность больнице № 51 за предоставленные образцы плазмы крови.
Список литературы
Suzuki T., Lyon A., Saggar R., Heaney L.M., Aizawa K., Cittadini A., Mauro C., Citro R., Limongelli G., Ferrara F., Vriz O., Morley-Smith A., Calabrò P., Bossone E. Editor’s choice-biomarkers of acute cardiovascular and pulmonary diseases // Eur. Hear. J. Acute Cardiovasc. Care. 2016. V. 5. P. 416.
Tripoliti E.E., Ioannidou P., Toumpaniaris P., Ram-mos A., Pacitto D., Lourme J.C., Goletsis Y., Naka K.K., Errachid A., Fotiadis D.I.I. Point-of-care testing devices for heart failure analyzing blood and saliva samples // IEEE Rev. Biomed. Eng. 2020. V. 13. P. 17.
Stone M.J., Waterman M.R., Harimoto D., Murray G., Willson N., Platt M.R., Blomqvist G., Willerson J.T. Serum myoglobin level as diagnostic test in patients with acute myocardial infarction // Br. Heart J. 1977. V. 39. P. 375.
Klocke F.J., Copley D.P., Krawczyk J.A., Reichlin M. Rapid renal clearance of immunoreactive canine plasma myoglobin // Circulation. 1982. V. 65. P. 1522.
Shlipak M.G., Katz R., Sarnak M.J., Fried L.F., Newman A.B., Stehman-Breen C., Seliger S.L., Kestenbaum B., Psaty B., Tracy R.P., Siscovick D.S. Cystatin C and prognosis for cardiovascular and kidney outcomes in elderly persons without chronic kidney disease // Ann. Int. Med. 2006. V. 145. P. 237.
Pepys M.B., Hirschfield G.M. C-reactive protein: A critical update // J. Clin. Invest. 2003. V. 111. P. 1805.
Simental-Mendía L.E., Sahebkar A., Rodríguez-Morán M., Zambrano-Galván G., Guerrero-Romero F. Effect of magnesium supplementation on plasma C-reactive protein concentrations: A systematic review and meta-analysis of randomized controlled trials // Curr. Pharm. Des. 2017. V. 23. P. 4678.
Ridker P.M., Cook N. Clinical usefulness of very high and very low levels of C-reactive protein across the full range of framingham risk scores // Circulation. 2004. V. 109. P. 1955.
Adam S.S., Key N.S., Greenberg C.S. D-dimer antigen: current concepts and future prospects // Blood. 2009. V. 113. P. 2878.
La’ulu S.L., Dominguez C.M., Roberts W.L. Performance characteristics of the AxSYM D-dimer assay // Clin. Chim. Acta. 2008 V. 390. P. 148.
Ibupoto Z.H., Mitrou N., Nikoleli G.P., Nikolelis D.P., Willander M., Psaroudakis N. The development of highly sensitive and selective immunosensor based on antibody immobilized ZnO nanorods for the detection of D-dimer // Electroanalysis. 2014. V. 26. P. 292.
Suprun E., Bulko T., Lisitsa A., Gnedenko O., Ivanov A., Shumyantseva V., Archakov A. Electrochemical nanobiosensor for express diagnosis of acute myocardial infarction in undiluted plasma // Biosens. Bioelectron. 2010. V. 25. P. 1694.
Wang L., Xu M., Huang R., Chang X., Chen C., Li L., Zhang Z., Han Y. A dual-label time-resolved fluorescence immunoassay for the simultaneous determination of cardiac troponin T and myoglobin // SLAS Technol. 2017. V. 22. P. 130.
Koukouvinos G., Petrou P., Misiakos K., Drygiannakis D., Raptis I., Stefanitsis G., Martini S., Nikita D., Goustouridis D., Moser I., Jobst G., Kakabakos S. Simultaneous determination of CRP and D-dimer in human blood plasma samples with white light reflectance spectroscopy // Biosens. Bioelectron. 2016. V. 84. P. 89.
Mitsakakis K., Gizeli E. Detection of multiple cardiac markers with an integrated acoustic platform for cardiovascular risk assessment // Anal. Chim. Acta. 2011. V. 699. № 1. P. 1.
Byzova N.A., Zherdev A.V., Vengerov Y.Y., Starovoitova T.A., Dzantiev B.B. A triple immunochromatographic test for simultaneous determination of cardiac troponin I, fatty acid binding protein, and C-reactive protein biomarkers // Microchim. Acta. 2017. V. 184. P. 463.
Zhang G.J., Luo Z.H.H., Huang M.J., Ang J.J., Kang T.G., Ji H. An integrated chip for rapid, sensitive, and multiplexed detection of cardiac biomarkers from fingerprick blood // Biosens. Bioelectron. 2011. V. 28. P. 459.
Xie L., Jiang R., Zhu F., Liu H., Ouyang G. Application of functionalized magnetic nanoparticles in sample preparation // Anal. Bioanal. Chem. 2014. V. 406 P. 377.
Lee E.A., Yim H., Heo J., Kim H., Jung G., Hwang N.S. Application of magnetic nanoparticle for controlled tissue assembly and tissue engineering // Arch. Pharm. Res. 2014. V. 37. P. 120.
Li C., Ma C., Wang F., Xi Z., Wang Z., Deng Y., He N. Preparation and biomedical applications of core-shell silica/magnetic nanoparticle composites // J. Nanosci. Nanotechnol. 2012. V. 12. P. 2964.
Colombo M., Carregal-Romero S., Casula M.F., Gutiérrez L., Morales M.P., Böhm I.B., Heverhagen J.T., Prosperi D., Parak W.J. Biological applications of magnetic nanoparticles // Chem. Soc. Rev. 2012. V. 41. P. 4306.
de Ávila B.E.F., Escamilla-Gómez V., Lanzone V., Campuzano S., Pedrero M., Compagnone D., Pingarrón J.M. Multiplexed determination of amino-terminal pro-B-type natriuretic peptide and C-reactive protein cardiac biomarkers in human serum at a disposable electrochemical magnetoimmunosensor // Electroanalysis. 2014. V. 26. P. 254.
Yang Z., Wang H., Guo P., Ding Y., Lei C., Luo Y. A multi-region magnetoimpedance-based bio-analytical system for ultrasensitive simultaneous determination of cardiac biomarkers myoglobin and C-reactive protein // Sensors (Switzerland). 2018. V. 18. P. 1765.
Nechaeva N.L., Sorokina O.N., Konstantinova T.S., Vasilyeva A.D., Yurina L.V., Byzova N.A., Bugrova A.E., Yanovich S.V., Eremenko A.V., Kurochkin I.N. Simultaneous express immunoassay of multiple cardiac biomarkers with an automatic platform in human plasma // Talanta. 2021. V. 224. Article 121860.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии