Журнал аналитической химии, 2022, T. 77, № 6, стр. 522-532
Пероксидаза хрена – аналитические возможности при определении зеараленона
Э. П. Медянцева a, *, Р. М. Бейлинсон a, А. И. Николаенко a, Г. К. Будников a
a Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, Кремлевская ул., 18, Россия
* E-mail: emedyant@gmail.com
Поступила в редакцию 18.06.2021
После доработки 15.09.2021
Принята к публикации 15.09.2021
- EDN: HDRJJL
- DOI: 10.31857/S0044450222060111
Аннотация
Показана возможность использования фермент-субстратной системы пероксидаза хрена (ПХ)–фенол при разработке амперометрического иммуноферментного сенсора (ИФС) для определения микотоксина зеараленона (ЗЕА). Предложены новые амперометрические ИФС на основе печатных графитовых электродов, в том числе модифицированных композитом фуллерен/наночастицы золота и ПХ, для определения ЗЕА в диапазоне концентраций от 1 × 10–11 до 1 × 10–6 М, сн составила 5 × 10–12 М. Оценена константа связывания иммунных комплексов (Kа = (5.3 ± 0.2) × 108 моль–1) и процент перекрестных реакций, который составляет для патулина <2.5%, для дезоксинилваленола <1.3%. Разработана и апробирована методика определения микотоксина ЗЕА с помощью предлагаемых ИФС в пищевых продуктах на уровне и ниже ПДК с sr не более 0.063.
Среди микотоксинов своими канцерогенными, эстрогенными и тератогенными свойствами, а также широкой распространенностью выделяется зеараленон (ЗЕА) (схема 1 ), который синтезируется грибами из рода Fusarium (F. graminearum, F. tricinctum), относится к лактонам резорциловой кислоты и характеризуется анаболическим и эстрогенным действием.
Схема 1 . Структурная формула зеараленона (6,10-гидрокси-6-оксо-1-ундецил-b-лактона резорциловой кислоты).
Зеараленон является микотоксином, который в основном заражает зерновые культуры и может накапливаться в них до сбора урожая. Этот микотоксин обнаруживают в продуктах питания и кормах для животных в широком диапазоне концентраций в зависимости от состояния окружающей среды и условий хранения. С потреблением продуктов питания и кормов, загрязненных ЗЕА, могут быть связаны острые и хронические отравления и даже раковые заболевания [1].
Арбитражными методами количественного определения микотоксинов являются газожидкостная хроматография (для Т-2 токсина), ВЭЖХ с УФ-детектированием (для дезоксиниваленола), ВЭЖХ с флуоресцентным детектированием (для афлатоксинов и ЗЕА). Эти методы отличаются экспрессностью, удобны для проведения серийных анализов и позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К числу скрининг-методов относятся методы тонкослойной хроматографии, флуоресцентный метод определения микотоксинов в загрязненном зерне [2–4].
В настоящее время ведутся разработки биохимических, в том числе иммунохимических, методов определения микотоксинов. Такие методы анализа удобны для первичного скрининга больших партий продукции благодаря своей простоте, экспрессности и относительно невысокой стоимости. Однако работы по применению био- и иммуносенсоров для определения микотоксинов пока немногочисленны [5–8]. Интерес к методам иммунохимического анализа связан еще и с возможностью относительно простого варьирования селективности анализа по отношению к ряду соединений, в основном за счет использования антител (Ат) с различной специфичностью.
Устройства, действие которых основано на сочетании принципов биокаталитических, иммунохимических взаимодействий и вольтамперометрической регистрации аналитического сигнала, связанных с использованием ферментов, позволяют разрабатывать простые и доступные в экономическом плане способы определения микотоксинов [8, 9]. В литературе встречаются лишь единичные упоминания об использовании ПХ в качестве метки для определения микотоксина зеараленона [10]. В описываемом варианте иммуносенсора [10] использовали в качестве модификатора углеродные нанотрубки. Это позволило достичь предела обнаружения на уровне n × 10–9 М, что не всегда удовлетворяет требованиям определения следовых количеств микотоксинов.
Современный подход к совершенствованию и разработке новых амперометрических био- и иммуносенсоров, в том числе и для определения микотоксинов, связан с использованием наноматериалов различной природы для модифицирования поверхности первичных преобразователей. Среди углеродных наноматериалов в качестве модификаторов чаще всего применяют углеродные нанотрубки [8, 11–13]. Другие углеродные материалы в составе иммуносенсоров пока используются весьма ограниченно. В частности, пока немногочисленны сведения о применении фуллерена. Наночастицы золота (НЧ Au) – один из наиболее изученных и хорошо зарекомендовавших себя наноматериалов, однако применение нанокомпозита на основе фуллерена и НЧ Au в качестве модификатора поверхности электродов для определения микотоксинов в литературе не описано.
Ранее установлено [8, 9], что микотоксины (афлатоксин В1, патуллин, охратоксин) оказывают ингибирующий эффект на ферменты (холинэстеразу, щелочную фосфатазу, тирозиназу). Кроме того, в цитируемых работах исследована возможность использования ферментов разных классов для создания иммуносенсоров для определения ЗЕА. В большинстве случаев исследуемый микотоксин ингибировал каталитическую активность иммобилизованных ферментов (холинэстеразы, тирозиназы), что не позволило достичь требуемой селективности определений.
Одним из часто используемых ферментов при создании иммуносенсоров является пероксидаза хрена (ПХ). Например, ПХ успешно использовали в определении афлатоксина В1 и охратоксина [14, 8 ]. Сведения о влиянии ЗЕА на каталитическую активность ПХ отсутствуют, поэтому представляется актуальным изучение действия микотоксина в системах антиген (Аг) (ЗЕА)–Ат–фермент. Информация о действии ЗЕА на фермент-субстратную систему ПХ–фенол позволит судить об аналитических возможностях этого фермента и различных вариантах его применения для решения проблемы селективного определения отдельного микотоксина на фоне сложных органических матриц.
Цель настоящей работы – оценка возможности использования ПХ в качестве метки при создании иммуносенсоров на основе планарных электродов, модифицированных наноструктурированными материалами различной природы, при определении микотоксина ЗЕА в пищевых продуктах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве основы разрабатываемых иммуносенсоров служили печатные графитовые электроды конструкции “3 в 1”, состоящие из рабочего, вспомогательного электродов и электрода сравнения, полученные на полимерной подложке методом печатных технологий (изготовлены на кафедре аналитической химии Казанского федерального университета). Материалом поверхности рабочего электрода, на которой иммобилизовали модификатор и фермент, являются графитовые чернила (GwentElectronicMaterials, США). Вспомогательный электрод изготовлен также из графитовых чернил. Электрод сравнения – паста AgCl/Ag [15]. Объем рабочей ячейки системы составлял 2.0 мл. Все измерения с использованием этих электродов проводили с помощью потенциостата/гальваностата фирмы “µAutolabTypeIII” (Нидерланды). Поверхность электрода электрохимически стабилизировали и очищали путем циклического изменения потенциала в диапазоне от 0 до 1000 мВ, для этого снимали 5–7 циклических вольтамперограмм в 0.01 М растворе КCl при скорости развертки 100 мВ/с.
Для приготовления дисперсии фуллерена в аминопроизводном полиэфирополиоле (H20-NH2) и НЧ Au в хитозане использовали ультразвуковую ванну модели “S30H” с частотой 37 КГц (Elmasonic, Германия).
Наличие наноматериалов на поверхности электродов доказывали получением изображений на атомно-силовом микроскопе (АСМ) марки “Solver P47H” (ЗАО “НТ-MДТ”, Россия). Для доказательства наличия НЧ Au использовали однолучевой спектрофотометр марки “BioSpectrometrKinetic” (Eppendorf, Германия).
В качестве субстрата использовали фенол х.ч., растворы которого готовили по точной навеске в рабочем буферном растворе и использовали в течение трех часов. Применяли: пероксидазу из корней хрена с активностью 250–330 U/mg (SigmaAldrich, США); моноклональные Ат против ЗЕА с исходной концентрацией 1.0 мг/мл (SigmaAldrich, США); 1%-ный раствор глутарового альдегида (ГА) (ICN, США) и полиэфирополиола H20-NH2 (1%-ный) (получен на кафедре неорганической химии Казанского федерального университета); фуллерен, функционализированный гидроксильными группами (Aldrich, США). Использовали хроматографически чистый препарат микотоксина ЗЕА (раствор ЗЕА в бензоле) из государственного стандартного образца (изготовитель: ГНУ ВНИИВСГЭ, Москва, Россия). Для получения рабочих растворов из стандартного образца ЗЕА проводили вакуумную отгонку органического растворителя (бензола) при комнатной температуре. Полученный препарат ЗЕА использовали для приготовления рабочих растворов путем их растворения в бидистиллированной воде. Применяли фосфатный (рН 6.86 ± 0.05 и 7.0 ± 0.2), трис-НСl (рН 7.60 ± 0.05), ацетатный (рН 4.00 ± 0.05 и 5.50 ± 0.05) буферные растворы. Значения рН водных растворов определяли рН-метром рН-150 со стеклянным электродом, градуированным по стандартным буферным растворам.
В качестве рабочих электродов использовали: иммуносенсор с пероксидазой хрена в качестве метки (ИФС № 1); иммуносенсор на основе электродов, модифицированных фуллереном С60 (ИФС № 2); иммуносенсор на основе электродов, модифицированных композитом фуллерен С60/НЧ Au (ИФС № 3)
Получение биочувствительной части иммуноферментного сенсора. На поверхность рабочего электрода наносили ПХ совместно с Ат против ЗЕА. Для этого готовили смесь, содержащую фермент, Ат, полиэфирополиол H20-NH2, фосфатный буферный раствор (50 мМ, pH 7.0 ± 0.2) и 1%-ный раствор ГА. Глутаровый альдегид добавляли в последнюю очередь и после энергичного перемешивания на поверхность электродов наносили по 1 мкл этой смеси. Полученные таким образом биосенсоры оставляли на ночь в закрытой чашке Петри при +4°С. На следующий день сенсоры промывали водой, высушивали на воздухе и в дальнейшем хранили в холодильнике в течение не более 15 дней. Предлагаемый способ иммобилизации способствует сохранению каталитической активности ПХ и Ат в течение не менее 15 дней со дня изготовления ИФС. Погрешность измерения аналитического сигнала от электрода к электроду не превышает 5–8%, что указывает на хорошую воспроизводимость поверхности биочувствительной части сенсора.
Определение концентрации зеараленона, несвязанного в иммунный комплекс, для расчета констант связывания. Концентрацию ЗЕА, не связавшегося в иммунный комплекс, определяли в растворе после образования иммунного комплекса Ат–Аг (ЗЕА) на поверхности иммуносенсора после его инкубации в течение 10 мин в растворе микотоксина. Оставшуюся после образования иммунного комплекса Aт–ЗЕА концентрацию микотоксина определяли амперометрическим биосенсором (ферментным электродом) на основе щелочной фосфатазы и 1-нафтил фосфата при потенциале Е = +0.35 В, для которого ранее установлено наличие ингибирующего эффекта данного микотоксина [16]. Полученные данные использовали для построения графика в координатах Скэтчарда.
Получение наночастиц золота. Наночастицы различных металлов все чаще используют для модификации поверхности электродов с целью придания им определенных свойств. Наночастицы золота хорошо зарекомендовали себя как модификаторы. Представляло интерес оценить влияние модификации поверхности электродов, служащих основой биосенсоров, фуллереном и нанокомпозитами фуллерен/НЧ металлов (Аu) на аналитические характеристики.
На сегодняшний день известно достаточно много способов получения наночастиц золота. Мы остановились на способе [17], поскольку он достаточно простой, позволяет синтезировать наночастицы золота из доступных реагентов в мягких условиях и не занимает много времени. Оптимальные условия получения наночастиц золота представлены ниже (ПЭГ – полиэтиленгликоль):
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ данных работ [5, 6] и предварительных исследований влияния ЗЕА на каталитическую активность ферментных препаратов (см. выше) позволилпредложить амперометрический иммуноферментный сенсор на основе графитового печатного электрода и биочувствительной части, включающей Ат против ЗЕА, ПХ, полиэфирополиол H20-NH2, фосфатный буферный раствор и раствор ГА.
В качестве субстратов пероксидазы могут выступать различные соединения, однако наиболее часто используют фенолы [18]. Это связано с тем, что большинство разработанных пероксидазных био- и иммуносенсоров с ПХ в качестве метки предназначено именно для определения содержания фенолов в объектах окружающей среды как загрязнителей и токсичных соединений. В то же время в рассматриваемых нами условиях использование фенола как субстрата позволит получить устойчивый во времени, хорошо выраженный и воспроизводимый сигнал. Таким образом, фермент-субстратную пару пероксидаза–фенол при определенных условиях можно использовать в качестве регистрирующей системы в иммуноферментных сенсорах.
Из литературы известно [19], что фенол подвергается электрохимическому окислению, а под действием ПХ и в присутствии пероксида водорода – ферментативному катализу (гидроксилазная активность) с образованием в качестве продукта ферментативной реакции хинона (оксидазная активность) (схема 2 ).
Электрохимическая реакция:
Ферментативная реакция:
Схема 2 . Ферментативный катализ фенола под действием пероксидазы хрена и в присутствии пероксида водорода.
Пик при потенциале 0.35 В соответствует квазиобратимому окислению пероксида водорода, а пик при потенциале 0.75 В относится, вероятнее всего, к электрохимическому окислению фенола до соответствующего хинона (рис. 1), что подтверждается экспериментальными и литературными данными [20].
Рис. 1.
Вольтамперограммы электроокисления фенола (1 × 10–3 М) – субстрата пероксидазы хрена: фоновый электролит – фосфатный буферный раствор с pH 7.0, концентрация пероксида водорода 5 × 10–5 М (1), в присутствии микотоксина зеараленона (1 × 10–8 М) (2) и в отсутствие микотоксина зеараленона (3). Иммуносенсор № 1.

На скорость ферментативной реакции в значительной степени влияют условия, при которых эта реакция протекает: природа и рН фонового электролита, концентрации субстрата и пероксида водорода. Известно [21], что ПХ проявляет достаточную каталитическую активность при рН от 4.0 до 8.0, поэтому исследовали влияние рН на величину отклика иммуносенсора в ацетатных (50 мМ) (рН 4.0–5.5), фосфатных (рН 6.86–7.5), трис-НСl буферных растворах (рН 7.6–8.0). Как видно из рис. 2, наибольшая активность иммобилизованной ПХ (максимум на графике) наблюдается в фосфатном буферном растворе с рН 7.0. Это связано с тем, что в этих условиях максимально возможное количество фенола подвергается ферментативному превращению и электрохимическому окислению.
Рис. 2.
Зависимость отклика иммуносенсора № 1 от рН. Концентрация фенола 1 × 10–3 М, пероксида водорода – 5 × 10–5 М.

Для проявления максимальной активности ПХ необходимо создать оптимальные концентрации субстрата и пероксида водорода. При избытке субстрата происходит торможение каталитической активности этого фермента. Концентрацию субстрата и пероксида водорода варьировали от 5 × 10–3 М до 1 × 10–5 М (рис. 3). Оптимальная концентрация фенола составила 1 × 10–3 М, пероксида водорода 5 × 10–5 М, фоновый электролит – фосфатный буферный раствор с рН 7.0.
Рис. 3.
Зависимость величины аналитического сигнала от концентрации фенола (а) и пероксида водорода (б). рН 7.0.

Действие зеараленона на каталитическую активность иммобилизованной пероксидазы. Изучение действия ЗЕА на ПХ показало, что этот микотоксин не является эффектором данного ферментного препарата, поэтому оказалось возможным использование ПХ в качестве метки в составе соответствующего иммуноферментного сенсора для регистрации иммунохимических взаимодействий: Ат против ЗЕА–ЗЕА.
Разработанный ИФС (рис. 4) представляет собой графитовый печатный электрод, на поверхности которого проводили соиммобилизацию ПХ и иммунореагента (Ат против ЗЕА).
Рис. 4.
Схема действия иммуноферментного сенсора на основе иммобилизованных антител (Ат) против зеараленона (ЗЕА) и пероксидазы хрена (ПХ): 1 – совместно иммобилизованные фермент (ПХ) и Ат, 2 – антиген (Аг) в растворе ЗЕА, 3 – образующийся иммунный комплекс и варианты подхода субстрата к активной поверхности фермента. Т – первичный преобразователь (в нашем случае печатный графитовый электрод), Е – фермент (ПХ), Ат – антитела к ЗЕА, Аг – ЗЕА, S – субстрат, Р – продукт.

Установлено, что при соиммобилизации Ат с ПХ на поверхности электрода в присутствии в растворе ЗЕА аналитический сигнал уменьшается в области концентраций (1 × 10–10–1 × 10–6 М), что, по-видимому, связано с образованием иммунного комплекса Ат–Аг, который является стерическим препятствием при подходе субстрата к активному центру фермента. Это приводит к тому, что в ферментативном процессе участвует меньшее количество молекул субстрата по отношению к контрольному опыту, и величина аналитического сигнала снижается.
Наибольшего ингибирующего эффекта и, следовательно, возможности проводить регистрацию аналитического сигнала с меньшей погрешностью удалось достичь при использовании Ат в разведении 1 : 50 (максимальная степень ингибирования (80.2 ± 0.5)%). Разведения Ат 1 : 1, 1 : 10, 1 : 20, 1 : 100 обеспечивают более узкий интервал определяемых концентраций (1 × 10–9–1 × 10–6 М) и соответственно более низкие степени ингибирования (68.0–72.0) ± 0.4%. Поскольку ИФС, основанный на разведении Ат 1 : 50, обладал лучшими аналитическими характеристиками, именно данную концентрацию Ат выбрали для последующих иммуноопределений. Аналитические характеристики ИФС для определения ЗЕА представлены в табл. 1. Правильность результатов определения ЗЕА, полученных с использованием разработанного ИФС, подтверждена методом введено–найдено (табл. 2).
Таблица 1.
Влияние разведения антител на аналитические характеристики определения зеараленона с помощью иммуноферментного сенсора № 1 (субстрат фенол, cs = 1 × 10–3 М, рН 7.0, n = 5, P = 0.95)
| Разведение Ат (Аг) |
Область рабочих концентраций, М | Уравнение градуировочной зависимости: I* = (А ± δ) + (В ± δ)(–lg c) |
сн, М | ||
|---|---|---|---|---|---|
| (А ± δ) | (В ± δ) | r | |||
| 1 : 1 | 1 × 10–6–1 × 10–9 | 18 ± 3 | –102.1 ± 0.3 | 0.9937 | 6 × 10–10 |
| 1 : 10 | 1 × 10–6–1 × 10–9 | 16 ± 2 | –94.1 ± 0.5 | 0.9870 | 5 × 10–10 |
| 1 : 20 | 1 × 10–6–1 × 10–9 | 17 ± 3 | –100.4 ± 0.3 | 0.9828 | 8 × 10–10 |
| 1 : 50а | 1 × 10–6–1 × 10–10 | 19 ± 2 | –110.9 ± 0.4 | 0.9989 | 7 × 10–11 |
| 1 : 100 | 1 × 10–6–1 × 10–9 | 16 ± 3 | –95.3 ± 0.4 | 0.9889 | 5 × 10–10 |
Таблица 2.
Результаты определения зеараленона с помощью иммуноферментных сенсоров (n = 3, P = 0.95)
| Введено, М | Найдено, М | sr | Процент открытия, % |
|---|---|---|---|
| ИФС № 1 | |||
| 4 × 10–8 | (4.1 ± 0.2) × 10–8 | 0.049 | 98–105 |
| 6 × 10–9 | (5.8 ± 0.3) × 10–9 | 0.052 | 92–102 |
| ИФС № 2 на основе электродов, модифицированных фуллереном С60 | |||
| 5 × 10–7 | (5.1 ± 0.3) × 10–7 | 0.059 | 94–106 |
| 8 × 10–10 | (7.8 ± 0.3) × 10–10 | 0.038 | 96–101 |
| ИФС № 3 на основе электродов, модифицированных композитом фуллерен С60/НЧ Au | |||
| 5 × 10–8 | (4.8 ± 0.3) × 10–8 | 0.063 | 94–106 |
| 2 × 10–10 | (2.1 ± 0.1) × 10–10 | 0.048 | 95–105 |
Иммуносенсор, модифицированный фуллереном С60, для определения зеараленона. Современной тенденцией развития биосенсорных технологий является использование различных наноструктурированных материалов, в частности углеродных наноматериалов, – структур, представляющих собой новую аллотропную форму углерода в виде замкнутых, каркасных, макромолекулярных систем. Добавление углеродных наноматериалов с высокой удельной площадью поверхности значительно повышает эффективность обнаружения самых различных веществ, в том числе и с помощью биосенсоров [22].
Чаще других среди углеродных наноматериалов в настоящее время используют углеродные нанотрубки [23, 24]. Гораздо реже для этих целей применяют фуллерены и их производные [25, 26]. При этом остаются нерешеннымы проблемы как сохранения, так и целенаправленного изменения основных свойств наноуглеродных материалов и вариантов их комбинирования в составе биосенсоров, например, за счет сохранения соответствующих наноразмеров путем использования различных веществ для получения устойчивых во времени дисперсий [27].
В качестве модификаторов поверхности электродов мы использовали фуллерен С60. Фуллерен – это наносферы углерода, полициклические структуры сферической формы диаметром 40 нм, состоящие из атомов углерода, связанных в шести- и пятичленные циклы. Фуллерены обладают высокой химической стабильностью и могут рассматриваться в качестве перспективных кандидатов для усиления сигнала в биосенсорах.
В настоящее время синтезированы различные стабильные производные C60, которые расширяют область их применения, в частности, за счет модификации поверхности различными полярными группами (например, амидо-, гидроксильной и карбоксильной), что приводит к получению водорастворимых и биосовместимых соединений.
Для получения дисперсий графитовых наноматериалов можно применять различные вещества, в том числе и гиперразветвленные полимеры (ГРПО) – сверхразветвленные молекулы, обладающие биоподобными структурными фрагментами и комплексом заданных практически полезных свойств [28]. Для получения дисперсии фуллерена С60 использовали водорастворимое аминопроизводное на платформе ГРПО Н20-NH2.
Для получения модифицированной поверхности печатных электродов на их поверхность методом капельного испарения наносили полученную дисперсию фуллерена в Н20-NH2 и ПХ совместно с Ат против ЗЕА (см. выше о получении биочувствительной части ИФС).
Изучение действия ЗЕА на модифицированный фуллереном ИФС показало, что характер действия этого соединения на иммобилизованную ПХ существенно не изменился. Модификация фуллереном позволила расширить диапазон определяемых концентраций изучаемого микотоксина, улучшить коэффициент корреляции (табл. 3). Максимальное снижение каталитической активности фермента при действии ЗЕА на модифицированный иммуносенсор в этих условиях стало несколько больше и составило (83.0 ± 0.9)% в изученной области концентраций.
Таблица 3.
Аналитические характеристики определения зеараленона с помощью иммуносенсоров (рН 7.0, n = 5, P = 0.95)
| Иммуносенсор | Область рабочих концентраций, М | Уравнение градуировочной зависимости, I* = (А ± δ)(–lg c) + (В ± δ) | сн, М | ||
|---|---|---|---|---|---|
| (А ± δ) | (В ± δ) | r | |||
| № 1 | 1 × 10–6–1 × 10–10 | 19 ± 2 | –110.9 ± 0.4 | 0.9989 | 7 × 10–11 |
| № 2 | 1 × 10–6–5 × 10–11 | 22 ± 2 | –130 ± 3 | 0.9948 | 1 × 10–11 |
| № 3 | 1 × 10–6–1 × 10–11 | 59 ± 1 | 2.9 ± 0.1 | 0.9969 | 5 × 10–12 |
Правильность определения ЗЕА в указанных диапазонах концентраций с помощью разработанных иммуносенсоров оценивали способом введено–найдено (табл. 2).
Наночастицы золота как модификаторы поверхности печатных электродов. Наличие в растворах НЧ Au определенного размера (методику получения см. в “Экспериментальной части”) подтверждали соответствующими оптическими спектрами. Показано, что в оптических спектрах растворов НЧ Au имеются плазмонные полосы поглощения с максимумами, характерными для поглощения сферических НЧ Аu в присутствии хитозана при λ = 580 нм (размер частиц около 50 нм) [29].
Предварительные исследования показали, что модификация поверхности электродов суспензиями фуллерена С60 и композитом С60/НЧ Аu изменяет аналитические возможности биосенсоров. Удобный метод визуального анализа изменения поверхности электродов при модификации фуллереном и НЧ Au – атомно-силовая микроскопия. Использование АСМ позволяет получить изображение модифицированной поверхности электродов на разных стадиях получения биочувствительной части сенсоров в разных условиях (рис. 5). Судя по АСМ-изображениям поверхности электрода, при нанесении НЧ Аu поверхность становится более развитой, НЧ достаточно однородны и равномерно распределены по поверхности электрода.
Рис. 5.
АСМ-изображения в режимах топографии и фазового контраста в 2D проекции (а) поверхности графитового печатного электрода, модифицированного наночастицами золота в растворе хитозана (0.75%), и в 3D проекции (б).
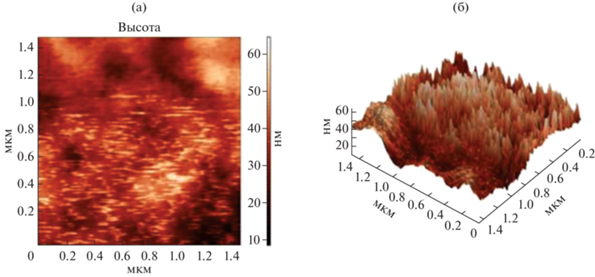
Варьирование количества раствора НЧ Au, наносимых на поверхность печатного электрода, позволило установить, что 1 мкл раствора позволяет получить более воспроизводимую однородную поверхность, обеспечивающую получение достаточного по величине аналитического сигнала, поэтому в дальнейшем использовали именно такое количество раствора НЧ Au (рис. 6). Затем на этой модифицированной поверхности проводили иммобилизацию Ат и ПХ.
Рис. 6.
Зависимость величины аналитического сигнала (тока) от количества наночастиц золота, наносимых на рабочую поверхность электрода.

Влияние модификации поверхности электродов фуллереном С60 и наночастицами золота на аналитические возможности иммуносенсора. Изучение действия ЗЕА на модифицированный композитом С60/НЧ Au ИФС № 3 показало, что эффект уменьшения соответствующего аналитического сигнала наблюдается в более широких областях концентраций по сравнению с немодифицированным аналогом (табл. 2). Процент уменьшения каталитической активности при действии на ИФС № 3 составляет (90.0 ± 0.6)% в изученной области концентраций. Использование модификации композитом С60/НЧ Au позволило улучшить аналитические характеристики разработанного сенсора.
Правильность определения ЗЕА в указанных диапазонах концентраций с помощью разработанных иммуносенсоров оценивали способом введено–найдено (табл. 1).
Оценка констант связывания иммунных комплексов и специфичности иммунохимических взаимодействий на ИФС № 3. При разработке методов ИХА, базирующихся на реакции Аг–Ат, знание физико-химических параметров специфических взаимодействий очень важно, поскольку дает возможность оценить чувствительность и специфичность метода и осуществить подбор реагентов для анализа. Графическая обработка экспериментальных данных в координатах Скэтчарда позволяет не только определить константу образования иммунных комплексов, но и рассчитать концентрацию активных Ат (Аг) в системе.
Выполнили серию опытов по определению концентрации свободного и связанного микотоксина при различных начальных концентрациях ЗЕА и постоянной концентрации Ат в системе. Характер взаимодействия микотоксин–Ат, представленный в координатах Скэтчарда, свидетельствует о преимущественном существовании одной популяции Ат с достаточно высокой специфичностью к определяемому микотоксину. Такой характер кривой характерен для моноклональных Ат. Значение константы связывания для Ат к ЗЕА (Kа1 = (5.3 ± 0.2) × 108 моль–1) лежит в оптимальном интервале величин констант связывания [16]. Данные о прочности связывания рассматриваемых иммунологических пар на сегодняшний день в литературе отсутствуют. В то же время полученные нами величины констант образования иммунных комплексов свидетельствуют о достаточно прочном связывании Аг с соответствующими Ат, что позволяет использовать разработанные ИФС для высокочувствительного и селективного определения микотоксина ЗЕА.
Неспецифическое перекрестное взаимодействие Ат является одной из основных проблем при разработке новых вариантов иммуноанализа. Качество Ат зачастую является основным препятствием для увеличения чувствительности иммуноопределения, а также для сокращения продолжительности анализа за счет процедуры пробоподготовки.
В настоящей работе мы исследовали возможности перекрёстной реактивности Ат против ЗЕА к другим микотоксинам – патулину и дезоксиниваленолу, обнаруживаемым в тех же продуктах питания, что и ЗЕА. Установили, что используемые Ат обладают перекрестной реактивностью к исследуемым антигенам в очень незначительной степени (патулин <2.5%, дезоксиниваленол <1.3%). Это подтверждает специфичность исследуемых Ат лишь к соответствующиму Аг, что позволяет селективно определять ЗЕА независимо от других микотоксинов.
Определение зеараленона в пищевых продуктах. Предложенные ИФС могут быть использованы для определения содержания ЗЕА в пищевых продуктах. Наибольшей продуцирующей способностью грибы обладают на кукурузе, овсе, рисе, сорго.
Грибы F. graminearu, продуцирующие ЗЕА, распространены в южной части Российской Федерации, а также во многих странах, выращивающих кукурузу на зерно. Споры гриба обитают в почве, откуда они попадают на вегетирующие растения и при благоприятных условиях (высокая влажность) прорастают, поражая колос или початок и образуя продукты своей жизнедеятельности – микотоксины.
Разработанный иммуносерсор применили для определения ЗЕА в кукурузе и ячмене и продуктах переработки кукурузной муки. При пробоподготовке образцов использовали рекомендации, предложенные в работе [30] для выделения именно ЗЕА при хроматографическом анализе.
Методика извлечения (выделения) зеараленона из круп. Навеску образца массой 1 г (крупа, зерно) растирали в порошок, который суспендировали в смеси ацетонитрила и воды (5 : 1) для определения ЗЕА. Согласно данным [31], при этом должно достигаться достаточно полное извлечение определяемых компонентов. Смесь перемешивали магнитной мешалкой в течение не менее 30 мин. Затем центрифугировали в течение 20 мин при скорости 7 тысяч об/мин, надосадочную жидкость использовали для приготовления рабочих водных растворов путем последовательного разбавления для последующего определения ЗЕА с помощью ИФС, модифицированного композитом фуллерен/НЧ Au – ИФС № 3).
Предварительно установили, что при повторном экстрагировании смеси, оставшейся после однократного экстрагирования, получается раствор, не вызывающий изменения аналитического сигнала, т.е. не содержащий компонентов, уменьшающих каталитическую активность иммобилизованной пероксидазы. Таким образом, полное извлечение микотоксина из образца происходит уже в результате однократной экстракции. Аналитический сигнал приобретает постоянное значение через 30 мин при перемешивании экстрагирующей смеси с образцом.
Установлено, что содержание органического растворителя, используемого для наиболее полного извлечения ЗЕА из образцов круп, не превышает (8–10)% от объема анализируемого раствора. Такое содержание ацетонитрила не сказывается на каталитической активности ПХ, т.е. не оказывает ни ингибирующего, ни активирующего действия. Это позволяет использовать получаемый экстракт для определения ЗЕА в образцах.
Методика определения содержания зеараленона в образцах крупы. В ячейку емк. 2000 мкл вносили растворы образца, полученного как описано выше, фенола (с = 1 × 10–3 М), пероксида водорода (с = 5 × 10–5 М), фосфатный буферный раствор (рН 7.0) и ИФС № 3. Растворы инкубировали в течение 10 мин. Затем измеряли значение тока при потенциале +0.75 В.
Содержание ЗЕА в образцах определяли по градуировочному графику (см. табл. 3, ИФС № 3). Отдельные образцы пищевых продуктов, содержащих кукурузу, протестировали также методом поляризационного флуоресцентного анализа (табл. 4), который в настоящее времени достаточно часто используется для определения микотоксинов. Сравнение результатов двух методов по F- и t-критериям показало, что методы равноточны (Fрасч < Fтабл), расхождение между средними величинами незначимы.
Таблица 4.
Результаты определения зеараленона в образцах, содержащих кукурузу (ИФС № 3, субстрат фенол, cs = 1 × 10–3 М, n = 5, P = 0.95, tтабл = 2.78, Fтабл = 6.39)
| Объект анализа | Производитель | Метод анализа | Найдено ЗЕА, М (мг/кг) |
sr | t | F |
|---|---|---|---|---|---|---|
| Кукурузная мука | ООО “Гарнец”, Россия | ПФИА | Не найденоа | |||
| ИФА | Не найденоа | |||||
| Кукурузные хлебцы “Здоровей” |
ООО “Первый комбинат детского и диетического питания”, Россия | ПФИА | (6.42 ± 0.30) × 10–5 (0.025) |
0.047 | 2.21 | 5.15 |
| ИФС | (6.31 ± 0.30) × 10–5 (0.020) |
0.048 |
Найденное количество микотоксина ЗЕА в анализируемых образцах пищевых продуктов практически во всех случаях ниже ПДК. Следует, однако, отметить, что содержание ЗЕА в детском питании не допускается.
Сравнение аналитических характеристик разработанного амперометрического ИФС и аналогичных методов, описанных в литературе (табл. 5), показало, что разработанный иммуносенсор превосходит другие методы определения ЗЕА. Можно сделать вывод, что разработанный ИФС может быть использован для контроля качества ряда пищевых продуктов и в особенности детского питания.
Таблица 5.
Сравнительная характеристика способов определения зеараленона в кукурузе и продуктах на ее основе
| Метод определения зеараленона | Предел обнаружения | Литература |
|---|---|---|
| Экспресс-иммунохроматографическая полоска (ICTS) | 1.0 нг/мл | [36 ] |
| Флуороиммуноанализ (FLISA) | 0.012 нг/мл | [36 ] |
| Электрохимический иммуносенсор | 0.77 нг/г | [11] |
| ИФС | 0.0159 нг/мл | Данная работа |
* * *
Таким образом, показана возможность использования фермент-субстратной системы ПХ–фенол при разработке амперометрического ИФС для определения ЗЕА, действие которого основано на сочетании иммунологической, ферментативной и электрохимической реакций, приводящих к эффектам уменьшения аналитического сигнала, что наиболее точно соответствует термину “квазиингибирование”. Предложены новые амперометрические ИФС на основе печатных графитовых электродов, модифицированных композитом фуллерен/НЧAu и ПХ для определения микотоксина ЗЕА, позволяющие расширить диапазон определяемых концентраций, снизить cн, улучшить коэффициент корреляции. Условия функционирования разработанных биосенсоров: рН буферного раствора 7.0 ± 0.2, концентрация субстрата фенола 1 мМ, концентрация пероксида водорода 50 мкМ. Разработанные иммуносенсоры позволяют определять ЗЕА в следующих концентрационных интервалах: ИФС № 1 – от 1 × × 10–10 М до 1 × 10–6 М, ИФС № 2 – от 5 × 10–11 М до 1 × 10–6 М, ИФС № 3 – от 1 × 10–11 М до 1 × 10–6 М. Нижняя граница определяемых содержаний на уровне (1–7) × 10–11(–12) М. Оценена константа связывания иммунного комплекса: Kа = (5.3 ± ± 0.2) × 108 моль–1, процент перекрестных реакций составляет для патулина <2.5%, для дезоксинилваленола <1.3% – ИФС № 3. Разработаны методики определения ЗЕА с помощью предлагаемых ИФС в пищевых продуктах (кукурузной муке, кукурузных хлебцах) на уровне ниже ПДК с sr не более 0.048.
Список литературы
Haque M.A., Wang Y., Shen Z., Li X., He C. Mycotoxin contamination and control strategy in human, domestic animal and poultry: A review // Microb. Pathog. 2020. V. 142. Article 104095.
Yang Y., Li G., Wu D., Liu J., Li X., Luo P., Hu N., Wang H., Wu Y. Recent advances on toxicity and determination methods of mycotoxins in foodstuffs // Trends Food Sci. Technol. 2020. V. 96. P. 233.
Silva A.S., Brites C., Pouca A.V., Barbosa J., Freitas A. UHPLC-ToF-MS method for determination of multi-mycotoxins in maize: Development and validation // Curr. Res. Food. Sci. 2019. V. 1. P. 1.
González–Jartín J.M., Alfonso A., Rodríguez I., Sainz M.J., Vieytes M.R., Botana L.M. A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer // Food Chem. 2019. V. 275. P. 703.
Goud K.Y., Sunil K.V., Hayat A., Gobi K.V., Song H., Kim K.-H., Marty J.L. A highly sensitive electrochemical immunosensor for zearalenone using screen-printed disposable electrodes // J. Electroanal. Chem. 2019. V. 832. P. 336.
Fernández O., Vicario A., Villarroel–Rocha J., Sapag K., Messina G.A., Raba J., Bertolino F.A. Mesoporous immunosensor applied to zearalenone determination in Amaranthus cruentus seeds // Microchem. J. 2018. V. 141. P. 388.
Oliveira I.S., Junior A.G.S., Andrade C.A.S., Oliveira M.D.L. Biosensors for early detection of fungi spoilage and toxigenic and mycotoxins in food // Curr. Opin. Food Sci. 2019. V. 29. P. 64.
Варламова Р.М., Медянцева Э.П., Хамидуллина Р.Р., Будников Г.К. Амперометрические тирозиназные биосенсоры на основе модифицированных наноматериалами электродов для определения афлатоксина М1 // Журн. аналит.химии. 2019. Т. 74. № 7. С. 71. (Varlamova R.M., Medyantseva E.P., Hamidullina R.R., Budnikov H.C. Amperometric tyrosinase biosensors based on modified nanomaterials electrodes for the determination of aflatoxin M1 // J. Anal. Chem. 2019. V. 74. P. 59.)
Медянцева Э.П., Тхи Тхань Май Н., Варламова Р.М., Тарасова Е.Ю., Сахапова Г.Р., Николаева О.В., Будников Г.К. Амперометрические биосенсоры на основе щелочной фосфатазы и углеродных нанотрубок для определения некоторых микотоксинов // Заводск. лаборатория. Диагностика материалов. 2014. Т. 80. № 2. С. 5.
Panini N.V., Bertolino F.A., Salinas E., Messina G.A., Raba Panini J. Immunosensor in a continuous-flow/stopped-flow systems // Biochem. Eng. J. 2010. V. 51. P. 7.
Feng W., Ji P. Enzymes immobilized on carbon nanotubes // Biotechnol. Adv. 2011. V. 29. P. 889.
Le V.T., Vasseghian Y., Dragoi E.N., Moradi M., Mousavi Khaneghah A. A review on graphene-based electrochemical sensor for mycotoxins detection // Food Chem. Toxicol. 2021. V. 148. Article 111931.
Yadav N., Yadav S.S., Chhillar A.K., Rana J.S. An overview of nanomaterial based biosensors for detection of Aflatoxin B1 toxicity in foods // Food Chem. Toxicol. 2021. V. 152. Article 112201.
Alonso-Lomillo M.A., Domнnguez-Renedo O., Torno-de Romõn L., Arcos-Martnez M.J. Horseradish peroxidase-screen printed biosensors for determination of Ochratoxin A // Anal. Chim. Acta. 2011. V. 688. P. 49.
Май Тхи Тхань Х., Медянцева Э.П., Варламова Р.М., Сахапова Г.Р., Николаева О.В. Определение зеараленона амперометрическими биосенсорами на основе модифицированных углеродными нанотрубками электродов // Вестник Казанск. технологич. ун-та. 2012. № 15. С. 149.
Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилов Е.М. Теория и практика иммуноферментного анализа. М.: Высшая школа, 1991. 288 с.
Tarozaitq R., Juskйnas R., Kurtinaitienй M., Jagminienй A., Vaskelis A. Gold colloids obtained by Au(III) reduction with Sn(II): Preparation and characterization // Chemija. 2006. V. 17. № 2–3. P. 1.
Андреева В.А. Фермент пероксидаза: Участие в защитном механизме растений. М.: Наука, 1988. 128 с.
Gibson D.M., Lin E.H. The inhibition of peroxidase and indole-3-acetic acid oxidase activity by British antilewisite // Arch. Biochem. Biophys. 1978. V. 186. № 3. P. 317.
Мустафанова Г.К., Конурбаев А.Е., Баешов А. Исследование электрохимического поведения фенола в водных растворах и установление оптимальных условий окисления фенола // Технические науки – от теории к практике. 2016. Т. 12. Вып. 60. С. 167.
Рогожин В.В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб: ГИОРД, 2004. С. 22.
Штыков С.Н. Нанообъекты и нанотехнологии в химическом анализе: Проблемы аналитической химии. М.: Наука, 2015. Т. 20. 431 с.
Лау А.К.-Т., Хуссейн Ф., Лафди Х. Нано- и биокомпозиты. М.: БИНОМ, Лаборатория знаний, 2015. 390 с.
Mahmoudpour M., Dolatabadi J.E.N., Torbati M., Tazehkan A.P., Homayouni-Rad A., Guardia, M. Nanomaterials and new biorecognition molecules based surface plasmon resonance biosensors for mycotoxin detection // Biosens. Bioelectron. 2019. V. 143. Article 111603.
Camargo J.R., Baccarin M., Raymundo-Pereira P.A., Campos A.M., Oliveira G.G., Fatibello-Filho O., Oliveira J.O.N., Janegitz B.C. Electrochemical biosensor made with tyrosinase immobilized in a matrix of nanodiamonds and potato starch for detecting phenolic compounds // Anal. Chim. Acta. 2018. V. 1034. P. 137.
Shetti N.P., Mishra A., Basu S., Aminabhavi T.M. Versatile fullerenes as sensor materials // Mater. Today Chem. 2021. V. 20. Article 100454.
You H., Mu Z., Zhao M., Zhou J., Yuan Y., Bai L. Functional fullerene-molybdenum disulfide fabricated electrochemical DNA biosensor for Sul1 detection using enzyme-assisted target recycling and a new signal marker for cascade amplification// Sens. Actuators B: Chem. 2020. V. 305. Article 127483.
Yates C.R., Hayes W. Synthesis and applications of hyperbranched polymers // Eur. Polym. J. 2004. V. 40. P. 1257.
Шашканова О.Ю., Ермолаева Т.Н. Новый метод диагностики аутоиммунных заболеваний, основанный на аффинной реакции на поверхности пьезокварцевого сенсора // Сорбционные и хроматографические процессы. 2009. Т. 9. Вып. 5. С. 677.
ГОСТ 28001-88. Зерно фуражное, продукты его переработки, комбикорма. Методы определения микотоксинов: Т-2 токсина, ЗЕА (Ф-2) и ОТ. М.: Издательство стандартов, 1988. С. 72.
Zhanga F., Liua B., Shenga W., Zhanga Y., Liua Q., Lia S., Wanga S. Fluoroimmunoassays for the detection of zearalenone in maize using CdTe/CdS/ZnS quantum dots // Food Chem. 2018. V. 255. P. 421.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии





