Журнал аналитической химии, 2022, T. 77, № 9, стр. 828-836
Определение амитриптилина методом поляризационного флуоресцентного иммуноанализа
Э. П. Медянцева a, *, Э. Р. Газизуллина a, Д. В. Брусницын a, С. В. Федоренко b, А. Р. Мустафина b, С. А. Еремин c
a Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
b Институт органической и физической химии им. А.Е. Арбузова, Федеральный исследовательский центр
Казанский научный центр Российской академии наук
420088 Казань, ул. Ак. Арбузова, 8, Россия
c Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: emedyant@gmail.com
Поступила в редакцию 08.10.2021
После доработки 30.12.2021
Принята к публикации 05.01.2022
- EDN: UXHLEH
- DOI: 10.31857/S0044450222070088
Аннотация
Разработан способ определения трициклического антидепрессанта амитриптилина с помощью поляризационного флуоресцентного иммуноанализа на фоне буферного раствора, урины и грудного молока с относительным стандартным отклонением не более 0.050. Синтезированы трейсеры путем нековалентной сорбции амитриптилина на поверхности силикатных наночастиц, допированных комплексами рутения(II). Для эффективного функционирования предложенного способа подобраны оптимальные концентрации трейсера и антител путем разведения. Подбор количеств реагентов осуществляли на основании получаемых значений интенсивности флуоресценции и поляризации флуоресценции. Согласно требованиям чувствительности трейсера выбрано разведение 1 : 2, интенсивность флуоресценции которого 10-кратно превышает фоновое значение, при этом оптимальное значение поляризации флуоресценции фиксируется на уровне 32. Оптимальное разведение антител, которое соответствует 70%-ному значению поляризации флуоресценции от максимального сигнала, составило 1 : 200. Диапазон рабочих концентраций амитриптилина составил 1 × 10–10–1 × 10–5 М, нижние границы определяемых содержаний на уровне (7−8) × 10–11 М. Полученные результаты перспективны для контроля содержания амитриптилина как в фармацевтическом препарате, так и в биологических жидкостях для установления эффективности проводимых терапевтических назначений и в медико-криминалистических целях.
Депрессия – психическое расстройство, характеризующееся общим эмоциональным подавленным состоянием в течение длительного периода, сопровождающееся апатией, нарушением сна и аппетита, снижением самооценки, в некоторых случаях и суицидальными мыслями [1]. В зависимости от тяжести депрессии составляется план лечения пациента, включающий в себя только психотерапию или психотерапию в сочетании с фармакотерапией, основу которой составляют антидепрессанты, регулирующие активность биогенных аминов [2].
Развитие депрессии связывают с дефицитом нейромедиаторов аминов в синаптических щелях центральной нервной системы. Антидепрессанты повышают уровень нейромедиаторов путем ингибирования активности ферментов, которые их расщепляют, блокирования их обратного нейронального захвата или увеличения числа высвобождаемых нейромедиаторов от участков пресинаптических нервных окончаний [3]. Мониторинг содержания антидепрессантов, в частности трициклических (ТЦА), в биологических материалах человека осуществляется в основном хроматографическими методами [4–7].
В то же время актуально применение поляризационного флуоресцентного иммуноанализа (ПФИА), который представляет собой конкурентный гомогенный метод иммуноанализа, основанный на конкуренции определяемого антигена и трейсера (меченого антигена) за ограниченное число центров связывания специфических антител [8]. Метод позволяет экспрессно определять лекарственные соединения с высокими чувствительностью и селективностью, а также с минимальной пробоподготовкой и использованием малых объемов проб и реагентов. Это связано как с контролем качества выпускаемой фармацевтической продукции, так и с медицинским и ветеринарным применением.
В последнее время активно разрабатываются способы поляризационного флуоресцентного иммунохимического определения в продуктах животного происхождения антибиотиков: хлорамфеникола [9], гентамицина [10], гентамицина и канамицина [11], клинафлоксацина [12], орбифлоксацина [13] и цефалексина [14], поскольку неправильное и чрезмерное применение антибиотиков для лечения и профилактики инфекционных заболеваний крупного рогатого скота, птиц и пчел приводит к кумуляции этих веществ в мышечных тканях животных, молоке, яйцах и меде с последующим негативным воздействием на здоровье человека и появлением антибиотикорезистентных микроорганизмов [15].
Нарастает и проблема загрязнения воды фармакологически активными соединениями, так как препараты пагубно влияют на экосистему уже при достаточно низких концентрациях [16]. Экологический мониторинг с использованием ПФИА позволяет эффективно и быстро определять содержание лекарственных соединений в сточных и поверхностных водах без какой-либо сложной предварительной обработки (применяют только фильтрацию) [17–19].
Анализ литературы показал, что в качестве трейсеров в основном используют антигены, меченные флуоресцеинизотиоцианатом или его производными. Нековалентная модификация силикатных рутениевых наночастиц амитриптилином для поляризационного флуоресцентного определения трициклического антидепрессанта использована впервые, что может расширить аналитические возможности метода.
Цель настоящего исследования заключалась в разработке поляризационного флуоресцентного иммунохимического определения трициклического антидепрессанта (амитриптилина) в биологических жидкостях (урина, грудное молоко) с использованием силикатных наночастиц [Ru(dipy)3]Cl2@SiO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Многофункциональный планшетный анализатор “PolarStarOmega” и 96-луночный планшет (BMGLabtech, Германия) применяли для измерений методом ПФИА. Планшетный анализатор в базовой конфигурации позволяет проводить измерения интенсивности флуоресценции, поляризации флуоресценции, люминесценции, регистрировать УФ-спектры поглощения.
Рутениевые силикатные наночастицы (НЧ) ([Ru(dipy)3]Cl2@SiO2) и трейсеры на основе амитриптилина, меченного данными НЧ, синтезированы, охарактеризованы и предоставлены ст. науч. сотр. С.В. Федоренко (ИОФХ им. А.Е. Арбузова КНЦ РАН). НЧ SiO2 и [Ru(dipy)3]Cl2@SiO2 получали по известным методикам [20, 21]. Водную дисперсию [Ru(dipy)3]Cl2@SiO2 использовали в качестве флуоресцентной метки.
Методика синтеза трейсеров № 1, № 2, № 3. Водную дисперсию [Ru(dipy)3]Cl2@SiO2 (4 г/л, 1 мл) центрифугировали (15000 об/мин, 20 мин, 4°С), отделяли 0.86 мл супернатанта. К 0.14 мл дисперсии добавляли по 0.2 мл раствора амитриптилина в этаноле (сисх = 0.06 М) для трейсера № 1 (по 0.05 и 0.25 мл для трейсеров № 2 и № 3 соответственно). Подвергали ультразвуковому воздействию в течение 20 мин. После 6.5, 4.5 или 4 ч перемешивания при комнатной температуре соответственно в случае трейсера № добавляли 0.66 мл воды, в случае трейсеров № 2 и № 3 доводили до 1.2 мл водой. Затем центрифугировали (15 000 об/мин, 20 мин, 4°С). Промывали 10-кратно водой от излишка амитриптилина с попеременным использованием ультразвука и центрифугирования. Конечную дисперсию доводили до объема 1 мл.
Количество адсорбированного на силикатной поверхности рутениевых НЧ амитриптилина определяли путем оценки его концентрации в смывах. Остаточную концентрацию аминотриптилина оценивали с использованием градуировочных зависимостей тока от концентрации амитриптилина, полученных с помощью амперометрических иммуносенсоров на основе печатных графитовых электродов, модифицированных гибридными наноматериалами: оксидом графена с цианидными гексарениевыми кластерами (K4[{Re6S8}(CN)6]):
Иммуносенсоры опускали в электрохимическую ячейку, содержащую аликвоту смыва и фосфатный буферный раствор с рН 7.5. Регистрировали аналитический сигнал (ток окисления гексарениевых кластеров I*), по величине которого рассчитывали концентрацию амитриптилина.
Изучение смывов показало, что для трейсера № 1 характерно вымывание амитриптилина на уровне 0.6 × 10–4 М, для трейсера № 2 – 1.3 × 10–4 М, для трейсера № 3 – 1.1 × 10–4 М.
В качестве модификаторов поверхности использовали оксид графена и восстановленный оксид графена (Sigma Aldrich, США), цианидные гексарениевые халькогенидные кластеры K4[{Re6S8}(CN)6]·8H2O (синтезированы, охарактеризованы и предоставлены лабораторией “Синтеза кластерных соединений и материалов” Института неорганической химии им. А.В. Николаева СО РАН). Для более прочного закрепления на поверхности электрода углеродные модификаторы наносили в составе аминопроизводного на платформе полиэфирополиола второй генерации (Н20-NH2) (модифицированы на кафедре неорганической химии КФУ, Россия).
В работе использовали тетраэтилортосилан (98%), водный раствор аммиака (28−30%), [Ru(dipy)3]Cl2, Triton X-100 фирмы “Acros Organics” (США), н-гептанол (98%), циклогексан (99%) фирмы “Acros” (США).
Поликлональные антитела (Ат) против ТЦА предоставлены MicroPharm Ltd (Великобритания).
Объект анализа: лекарственное соединение амитриптилин (Sigma-Aldrich, США) и содержащий его фармацевтический препарат “Амитриптилин” производства “ЗиО-Здоровье” (Подольск, Россия). Серию стандартных растворов лекарств готовили по точно взятой навеске с последующим минимальным количеством разбавлений в диапазоне от 10–10 до 10–4 М.
Фосфатные буферные растворы с рН 6.0−7.5 и боратный буферный раствор с рН 8.0−9.0 готовили из препаратов х. ч. и ч. д. а. (ЗАО “Лаверна”, Россия).
Для приготовления модельной урины с pH 6.0 применяли мочевину, креатинин, хлорид натрия, хлорид аммония, сульфат натрия, хлорид кальция, хлорид калия, гидрофосфат калия марок ч. и х. ч. (ООО НПФ “Татхимпродукт”, ООО АО “Реахим”, Россия).
Для пробоподготовки грудного молока использовали концентрированную соляную кислоту и хлорид калия марки х. ч. (ООО НПФ “Татхимпродукт”, Россия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Явление поляризации флуоресценции связано с одновременным протеканием таких процессов, как поглощение или эмиссия квантов света и вращательная диффузия молекул в растворе. В результате возбуждения флуорофоров плоскополяризованным светом степень поляризации испускаемого излучения определяется углом поворота молекулы за промежуток времени между поглощением и последующим испусканием фотона. Так, ориентация больших по размерам молекул практически не меняется, и наблюдается высокая степень поляризации флуоресценции, а при вращении небольших молекул, успевающих равновероятно принимать любую ориентацию, – низкая.
Таким образом, ПФИА позволяет исследовать взаимодействия сильно отличающихся по размерам молекул, в частности, антигена (Аг) с Ат. Несвязанный трейсер вращается в растворе быстро, излучаемый им свет сильно деполяризован, значение поляризации флуоресценции низкое. Взаимодействие трейсера со специфическим Ат приводит к образованию комплекса, который в растворе вращается медленнее, свет поляризован, поляризация флуоресценции высокая. Добавление целевого аналита приводит к снижению поляризации флуоресценции, что обусловлено связыванием Аг с Ат и, следовательно, увеличением количества свободного трейсера в растворе [22].
Оптимальные условий проведения поляризационного флуоресцентного иммуноанализа. Характеристика флуоресцентных наночастиц. В ПФИА имеется перечень требований к выбору флуоресцентной метки: высокая интенсивность флуоресценции, химическая и фотоустойчивость, наличие функциональных групп для связывания с Аг, отсутствие влияния на протекание иммунохимической реакции. В связи с этим в качестве метки выбрали силикатные НЧ (диаметр – 46 нм, рис. 1), допированные высоколюминесцентными комплексами [Ru(dipy)3]Cl2@SiO2, свойства которых согласуются со многими перечисленными выше требованиями.
Рис. 1.
(а): Схема адсорбции амитриптилина на силикатной поверхности рутениевых наночастиц; ПЭМ-микрофотографии: (б) – амитриптилин-[Ru(dipy)3]Cl2@SiO2 и (в) − амитриптилин-SiO2.

Данные атомно-эмиссионной спектроскопии для силикатных НЧ: содержание (±10%) Si (251.6 нм) 53.5 мг/л и Ru (267.9 нм) 1.96 мг/л. Мольное соотношение Si : Ru составило 1 : 100.
В спектрах поглощения водной дисперсии НЧ [Ru(dipy)3]Cl2@SiO2 имеются полосы при 244, 252, 285, 424, 451 нм, характеристичные для комплекса Ru(II).
Наночастицы [Ru(dipy)3]Cl2@SiO2 характеризуются относительно небольшим отрицательным ζ-потенциалом (−20.7 мВ при рН ∼7.0) по сравнению с аналогичными НЧ, не содержащими [Ru(dipy)3]2+ (−48 мВ при рН ∼7.0), что обусловлено частичной компенсацией заряда силикатной поверхности катионами комплекса.
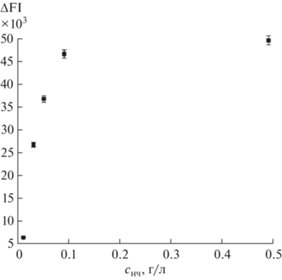
Тестирование флуоресцентных наночастиц. Интенсивность флуоресценции (FI) НЧ уменьшается с увеличением разбавления, что видно из рис. 2, причем при разбавлении в более чем 100 раз наблюдается резкое падение FI. FI 10-кратно разбавленных НЧ в 25 раз превышает фоновое значение FI (FI0), при этом степень поляризации флуоресценции (FP) равна 32, поэтому сНЧ = 0.49 г/л выбрана в качестве рабочей.
Рис. 2.
Зависимость ΔFI = FI – FI0 от концентрации флуоресцентных наночастиц, фосфатный буферный раствор с рН 7.5.
Характеристика реагентов для иммуноанализа. В качестве реагентов для иммуноанализа использовали поликлональные Ат против ТЦА и трейсер на основе нековалентно амитриптилин-модифицированных силикатных НЧ. Модификацию осуществляли путем адсорбции амитриптилина на силикатную поверхность за счет электростатических или координационных взаимодействий, что является перспективным способом получения композитных НЧ.
Поскольку амитриптилин имеет полосы поглощения в области 200−300 нм, как и комплекс трис-дипиридила рутения(II), то метод УФ-спектроскопии не позволяет однозначно рассчитать концентрацию адсорбированного ТЦА.
В качестве модельной системы для изучения адсорбции амитриптилина выбрали немодифицированные силикатные НЧ SiO2 (диаметр – 47 нм, рис. 1).
В соответствие с микрофотографиями, полученными методом просвечивающей электронной микроскопии (ПЭМ) (рис. 1), адсорбция амитриптилина на силикатной поверхности [Ru(dipy)3]Cl2@SiO2 и SiO2 не приводит к изменениям ПЭМ полученных образцов-по причине низкой концентрации амитриптилина на силикатной поверхности, необходимой для метода ПФИА.
Косвенным подтверждением адсорбции ТЦА могут служить данные динамического светорассеяния, в частности, изменение дзета-потенциала с −48 до −37 мВ для SiO2 и с −20.7 до −8 мВ для НЧ [Ru(dipy)3]Cl2@SiO2.
Для определения остаточного количества антидепрессанта в смывах использовали градуировочные зависимости тока от концентрации амитриптилина, полученные с помощью амперометрических иммуносенсоров на основе печатных графитовых электродов, модифицированных гибридными наноматериалами: оксидом графена с цианидными гексарениевыми кластерами (K4[{Re6S8}(CN)6]):
Иммуносенсоры опускали в электрохимическую ячейку, содержащую аликвоту смыва и фосфатный буферный раствор с рН 7.5. Регистрировали аналитический сигнал (ток окисления гексарениевых кластеров I*), по величине которого рассчитывали концентрацию амитриптилина.
Изучение смывов показало, что для трейсера № 1 характерно вымывание амитриптилина на уровне 0.6 × 10–4 М, для трейсера № 2 – 1.3 × 10–4 М, для трейсера № 3 – 1.1 × 10–4 М.
По методике, подробно описанной в “Экспериментальной части”, определили концентрации амитриптилина в трейсерах № 1, 2 и 3: 6.9 × 10–11, 1.4 × 10–11 и 7.5 × 10–11 М соответственно.
Таким образом, можно судить о достаточной адсорбции амитриптилина на силикатной поверхности рутениевых НЧ, необходимой для функционирования трейсера.
Тестирование иммунореагентов. В ячейках планшета проводили последовательное разведение трейсеров в буферном растворе. Регистрировали FI и FP. Согласно требованиям чувствительности трейсера (S менее 5 FP) [23, 24] для трейсера № 1 выбрали разведение 1 : 1, для трейсера № 2 – 1 : 2, для трейсера № 3 – 1 : 5, FI которого 10‑кратно превышает FI0, при этом оптимальное значение FP фиксируется на уровне 32.
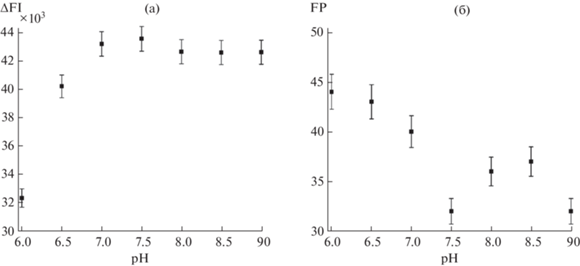
Изучено влияние рН буферного раствора на активность флуорофора. Оптимальные значения FP регистрируются при рН 7.5 и 9.0 (рис. 3б), однако максимум FI наблюдается только при рН 7.5 (рис. 3а), поэтому последний выбран в качестве рабочего рН, что также согласуется с данными, полученными для люминесцентных НЧ на основе [Ru(dipy)3]2+ [25].
Следующим этапом проводили последовательное разведение Ат в фосфатном буферном растворе с рН 7.5 при фиксированной концентрации трейсеров (рис. 4), после чего измеряли FP. Оптимальным выбрано разведение, соответствующее 70%-ному значению FP от максимального сигнала – 1 : 200 (для всех трейсеров) [25].
Рис. 4.
Кривые зависимости поляризации флуоресценции от разведения антител при фиксированной концентрации трейсеров № 1 (1), № 2 (2) и № 3 (3), фосфатный буферный раствор с рН 7.5.

Иммунохимическое определение антидепрессантов в режиме поляризационного флуоресцентного иммуноанализа. В лунки планшета к Аг добавляли аликвоты растворов трейсера и Ат в выбранных ранее разведениях, доводили до 200 мкл фосфатным буферным раствором с рН 7.5 и регистрировали зависимость изменения FP от концентрации лекарственного соединения. Время инкубации – 5 мин.
Наибольшая чувствительность характерна для трейсера № 2, содержащего наименьшее количество Аг. При сканировании диапазона концентраций амитриптилина от 10–11 до 10–4 М наблюдался линейный участок с высокой чувствительностью в интервале от 1 × 10–10 до 1 × 10–5 М (рис. 5, табл. 1), выбранный в качестве области рабочих концентраций.
Рис. 5.
Градуировочные зависимости для определения амитриптилина методом поляризационного флуоресцентного иммуноанализа с использованием трейсеров № 1 (1), № 2 (2) и № 3 (3), фосфатный буферный раствор с рН 7.5.
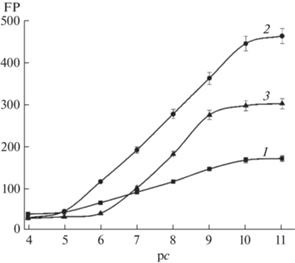
Таблица 1.
Аналитические возможности определения амитриптилина методом поляризационного флуоресцентного иммуноанализа с использованием различных трейсеров на фоне фосфатного буферного раствора с рН 7.5 (n = 5, Р = 0.95)
| Область рабочих концентраций, М | Уравнение градуировочной зависимости FP = (A ± δ) + (B ± δ)(−lg c) | сн, М | ||
|---|---|---|---|---|
| A ± δ | B ± δ | r | ||
| С использованием трейсера № 1 | ||||
| 1 × 10–10–1 × 10–5 | −85 ± 4 | 25 ± 1 | 0.9990 | 6 × 10–11 |
| С использованием трейсера № 2 | ||||
| 1 × 10–10–1 × 10–5 | −363 ± 18 | 80 ± 4 | 0.9993 | 7 × 10–11 |
| С использованием трейсера № 3 | ||||
| 1 × 10–9–1 × 10–6 | −436 ± 22 | 78 ± 4 | 0.9955 | 8 × 10–10 |
Для проверки правильности результатов использовали способ введено-найдено (табл. 2). Относительное стандартное отклонение (sr) не превышает 0.042.
Таблица 2.
Результаты определения амитриптилина методом поляризационного флуоресцентного иммуноанализа (трейсер № 2, n = 5, Р = 0.95)
| Введено, М | Найдено, М | sr |
|---|---|---|
| Фосфатный буферный раствор с рН 7.5 | ||
| 1 × 10–8 | (1.04 ± 0.05) × 10–8 | 0.042 |
| 1 × 10–7 | (1.00 ± 0.04) × 10–7 | 0.036 |
| Модельная урина | ||
| 1 × 10–8 | (1.01 ± 0.05) × 10–8 | 0.047 |
| 1 × 10–7 | (0.99 ± 0.04) × 10–7 | 0.040 |
| Грудное молоко | ||
| 1 × 10–8 | (1.05 ± 0.05) × 10–8 | 0.049 |
| 1 × 10–7 | (1.01 ± 0.04) × 10–7 | 0.041 |
Определение лекарственного вещества в урине. Выведение антидепрессантов из организма происходит через мочевыделительную систему, поэтому актуальна разработка методик их определения в урине в режиме ПФИА.
Амитриптилин определяли в модельном растворе урины (pH 6.0) (табл. 3) [26] (рН мочи в норме от 5.0 до 6.5).
Таблица 3.
Аналитические возможности определения амитриптилина методом поляризационного флуоресцентного иммуноанализа на фоне модельной урины и грудного молока (трейсер № 2, n = 5, Р = 0.95)
| Область рабочих концентраций, М | Уравнение градуировочной зависимости FP = (A ± δ) + (B ± δ)(−lg c) | сн, М | ||
|---|---|---|---|---|
| A ± δ | B ± δ | r | ||
| Модельная урина | ||||
| 1 × 10–10–1 × 10–5 | −403 ± 20 | 92 ± 5 | 0.9993 | 8 × 10–11 |
| Грудное молоко | ||||
| 1 × 10–9–1 × 10–5 | −451 ± 23 | 97 ± 5 | 0.9983 | 7 × 10–10 |
Методика определения. В ячейки планшета к Аг добавляли аликвоты растворов трейсера и Ат в выбранных ранее разведениях, модельной урины, доводили до метки фосфатным буферным раствором с рН 7.5 и регистрировали зависимость изменения FP от концентрации лекарственного соединения. Время инкубации – 5 мин.
Определение лекарственного вещества в грудном молоке. Амитриптилин может назначаться при тяжелой форме послеродовой депрессии и способен проникать в грудное молоко. Кормление возможно при отсутствии побочных эффектов у младенца [27]. Таким образом, вопрос о мониторинге содержания амитриптилина в грудном молоке с помощью ПФИА является актуальным.
Амитриптилин определяли на фоне грудного молока (табл. 3).
Пробоподготовка. Пробу грудного молока (1500 мкл) помещали в центрифужную пробирку, приливали 50 мкл концентрированной соляной кислоты для гидролиза белка и центрифугировали в течение 20 мин при скорости 6000 об/мин. Затем добавляли навеску (0.5 г) хлорида щелочного или щелочноземельного металла (хлорида калия) для осаждения белка и отстаивали в течение 5 мин. После повторного центрифугирования при аналогичных условиях центрифугат фильтровали через двойной бумажный фильтр. Полученный фильтрат является подготовленной пробой [28].
Методика определения. В ячейки планшета к Аг добавляли аликвоты растворов трейсера и Ат в выбранных ранее разведениях, грудного молока, доводили до метки фосфатным буферным раствором с рН 7.5 и регистрировали зависимость изменения FP от концентрации лекарственного соединения. Время инкубации – 5 мин.
Для проверки правильности результатов использовали способ введено−найдено (табл. 2). Относительное стандартное отклонение (sr) не превышает 0.050.
Поскольку в литературе отсутствуют сведения о поляризационном флуоресцентном иммунохимическом определении амитриптилина с использованием рутениевых силикатных наночастиц в качестве метки, предложенные методики анализа перспективны для решения поставленных в работе задач, что подтверждают также данные по сопоставлению аналитических возможностей существующих и предложенного способов определения антидепрессанта (табл. 4).
Таблица 4.
Аналитические характеристики определения трициклических антидепрессантов разными методами
| Метод | Интервал рабочих концентраций, нг/мл | Предел обнаружения, нг/мл | Литература |
|---|---|---|---|
| Газовая хроматография | 10–1000 | 1–3 | [29] |
| Жидкостная хроматография с тандемной масс-спектрометрией | 160–2000 | 50 | [30] |
| Высокоэффективная жидкостная хроматография | 5–800 | 2–4 | [31] |
| Масс-спектрометрия | Не указано | 5.2–8.6 | [32] |
| Капиллярный электрофорез | 500–30 000 | 20–150 | [33] |
| Спектрофотометрия | 1–5 | 0.19–0.90 | [34] |
| ПФИА с трейсером № 2 | 0.03–3139 | 0.02 | Данная работа |
Исследование выполнено в рамках Программы развития Междисциплинарной научно-образовательной школы Московского университета “Будущее планеты и глобальные изменения окружающей среды”.
Авторы благодарят ЦКП-САЦ ФИЦ КазНЦ РАН за техническую поддержку проведенных исследований. Работа А.Р. Мустафиной и С.В. Федоренко осуществлялась за счет средств субсидии, выделенной ФИЦ КазНЦРАН для выполнения государственного задания в сфере научной деятельности (рег. № АААА-А18-118041760011-2).
Список литературы
Thokchom M., Ray S. A study to assess the level of depression among depressed patients // Eur. J. Mol. Clin. Med. 2020. V. 7. № 11. P. 33.
Vardanyan R., Hruby V. Antidepressants / Synthesis of Best-Seller Drugs. Academic Press, 2016. Ch. 7. P. 111.
Ghafoor R., Rasool F. Antidepressants and antipsychotics: Anaesthetic implications // Anaesth. Intensive Care Med.: Pharmacol. 2017. V. 18. № 7. P. 340.
Feng Y., Zheng M., Zhang X., Kang K., Kang W., Lian K., Yang J. Analysis of four antidepressants in plasma and urine by gas chromatography-mass spectrometry combined with sensitive and selective derivatization // J. Chromatogr. A. 2019. V. 1600. P. 33.
Kasagic-Vujanovic I., Jancic-Stojanovic B. Quality by design oriented development of hydrophilic interaction liquid chromatography method for the analysis of amitriptyline and its impurities // J. Pharm. Biomed. Anal. 2019. V. 173. P. 86.
Fernandez-Lopez L., Pellegrini M., Rotolo M.C., Maldonado A.L., Falcon M., Mancini R. Development and validation of a method for analysing of duloxetine, venlafaxine and amitriptyline in human bone // Forensic Sci. Int. 2019. V. 299. P. 154.
Karami M., Yamini Y. On-disc electromembrane extraction-dispersive liquid-liquid microextraction: A fast and effective method for extraction and determination of ionic target analytes from complex biofluids by GC/MS // Anal. Chim. Acta. 2020. V. 1105. P. 95.
Chen Y., He Q., Shen D., Jiang Z., Eremin S.A., Zhao S. Fluorescence polarization immunoassay based on a new monoclonal antibody for the detection of the diisobutyl phthalate in yoghurt // Food Control. 2019. V. 105. P. 38.
Eremin S.A., Khan O.Y., Pisarev V.V., Zvereva E.A., Zherdev A.V., Dzantiev B.B. Fluorescence polarization immunoassay, for express control of antibiotic levels: design and characteristics for chloramphenicol, as an example // Antibiot. Chemother. 2016. V. 61. № 9. P. 22.
Beloglazova N.V., Shmelin P.S., Eremin S.A. Sensitive immunochemical approaches for quantitative (FPIA) and qualitative (lateral flow tests) determination of gentamicinin milk // Talanta. 2016. V. 149. P. 217.
Li C., Zhang Y., Eremin S.A., Yakup O., Yao G., Zhang X. Detection of kanamycin and gentamicin residues in animal-derived food using IgY antibody based ic-ELISA and FPIA // Food Chem. 2017. V. 227. P. 48.
Chen J., Lv S., Wang Q., Xu Z., Yang J., Shen Y., Wang H., Sun Y., Lei H. A specific and high-throughput fluorescence polarization immunoassay for surveillance screening of clinafloxacin in milk // Food Anal. Methods. 2014. V. 8. № 6. P. 14.
Mi T., Liang X., Ding L., Zhang S., Eremin S.A., Beier R.C., Shena J., Wang Z. Development and optimization of a fluorescence polarization immunoassay for orbifloxacin in milk // Anal. Methods. 2014. V. 6. № 11. P. 3849.
Beloglazova N.V., Eremin S.A. Design of a sensitive fluorescent polarization immunoassay for rapid screening of milk for cephalexin // Anal. Bioanal. Chem. 2015. V. 407. № 28. P. 8525.
Фарафонова О.В., Васильев С.В., Еремин С.А., Ермолаева Т.Н. Определение аминогликозидных антибиотиков в пищевых продуктах методом поляризационного флуоресцентного иммуноанализа // Международный научно-исследовательский журнал. 2015. Т. 7. № 38. С. 65.
Ferreira J.C.R., Neuffer D., do Amaral K.J. Evaluation of the use of activated carbon powder for removal of emerging micropollutants from sewage wastewater // Env. Ecol. Res. 2017. V. 5. № 3. P. 178.
Oberleitner L., Eremin S.A., Lehmann A., Garbe L.A., Schneider R.J. Fluorescence polarization immunoassays for carbamazepine – comparison of tracers and formats // Anal. Methods. 2015. V. 7. № 14. P. 5854.
Oberleitner L., Dahmen-Levison U., Garbe L.A., Schneider R.J. Application of fluorescence polarization immunoassay for determination of carbamazepine in wastewater // J. Env. Manage. 2017. V. 193. P. 92.
Raysyan A., Moerer R., Coesfeld B., Eremin S.A., Schneider R.J. Fluorescence polarization immunoassay for the determination of diclofenac in wastewater // Anal. Bioanal. Chem. 2021. V. 413. № 4. P. 999.
Mustafina A.R., Fedorenko S.V., Konovalova O.D., Menshikova A.Yu., Shevchenko N.N., Soloveva S.E., Konovalov A.I., Antipin I.S. Novel highly charged silica-coated Tb(III) nanoparticles with fluorescent properties sensitive to ion exchange and energy transfer processes in aqueous dispersions // Langmuir. 2009. V. 25. № 5. P. 3146.
Fedorenko S.V., Bochkova O.D., Mustafina A.R., Burilov V.A., Kadirov M.K., Holin C.V., Nizameev I.R., Skripacheva V.V., Menshikova A.Y., Antipin I.S., Konovalov A.I. Dual visible and near-infrared luminescent silica nanoparticles. Synthesis and aggregation stabili-ty // J. Phys. Chem. C. 2010. V. 114. № 14. P. 6350.
He Q., Cui X., Shen D., Chen Y., Jiang Z., Lv R., Eremin S.A., Zhao S. Development of a simple, rapid and high-throughput fluorescence polarization immunoassay for glycocholic acid in human urine // J. Pharm. Biomed. Anal. 2018. V. 158. P. 431.
Beloglazova N.V., Eremin S.A. Rapid screening of aflatoxin B1 in beer by fluorescence polarization immunoassay // Talanta. 2015. V. 142. P. 170.
Zhang H., Yang S., Beier R.C., Beloglazova N.V., Lei H., Sun X., Ke Y., Zhang S., Wang Z. Simple, high efficiency detection of microcystins and nodularin-R in water by fluorescence polarization immunoassay // Anal. Chim. Acta. 2017. V. 992. P. 119.
Wang Y., Zhao G., Li X., Liu L., Cao W., Wei Q. Electrochemiluminescent competitive immunosensor based on polyethyleneimine capped SiO2 nanomaterials as labels to release ${\text{Ru }}\left( {{\text{bpy}}} \right)_{3}^{{2 + }}$ fixed in 3D Cu/Ni oxalate for the detection of aflatoxin B1 // Biosens. Bioelectron. 2018. V. 101. P. 290.
Pietrzyńska M., Voelkel A. Stability of simulated body fluids such as blood plasma, artificial urine and artificial saliva // Microchem. J. 2017. V. 134. № 6. P. 197.
Аргунова И.А. Послеродовая депрессия. На стыке общей врачебной практики, акушерства и психиатрии // Российский семейный врач. 2010. Т. 14. № 1. С. 4.
Слепченко Г.Б., Мартынюк О.А., Шелеметьева О.В. Разработка методик определения в грудном молоке витаминов группы В // Изв. Томск. политех. ун-та. 2008. Т. 312. № 3. С. 58.
Tabani H., Shokri A., Tizro S., Nojavan S., Varanusupakul P., Alexovič M. Evaluation of dispersive liquid–liquid microextraction by coupling with green-based agarose gel-electromembrane extraction: An efficient method to the tandem extraction of basic drugs from biological fluids // Talanta. 2019. V. 199. P. 329.
Ide A.H., Nogueira J.M.F. New-generation bar adsorptive microextraction (BAE) devices for a better eco-user-friendly analytical approach – Application for the determination of antidepressant pharmaceuticals in biological fluids // J. Pharm. Biomed. Anal. 2018. V. 153. P. 126.
Safari M., Shahlaei M., Yamini Y., Shakorian M., Arkan E. Magnetic framework composite as sorbent for magnetic solid phase extraction coupled with high performance liquid chromatography for simultaneous extraction and determination of tricyclic antidepressants // Anal. Chim. Acta. 2018. V. 1034. P. 204.
de Oliveira F.M., Scheel G.L., Augusti R., Tarley C.R.T., Nascentes C.C. Supramolecular microextraction combined with paper spray ionization mass spectrometry for sensitive determination of tricyclic antidepressants in urine // Anal. Chim. Acta. 2020. V. 1106. P. 52.
Rysavá L., Dvorák M., Kubán P. The effect of membrane thickness on supported liquid membrane extractions in-line coupled to capillary electrophoresis for analyses of complex samples // J. Chromatogr. A. 2019. V. 1596. P. 226.
Farnoudian-Habibi A., Massoumi B., Jaymand M. A novel strategy for spectrophotometric simultaneous determination of amitriptyline and nortriptyline based on derivation with a quinonoid compound in serum samples // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2016. V. 168. P. 235.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии