Журнал аналитической химии, 2022, T. 77, № 9, стр. 798-827
Использование эффекта возникающей флуоресценции в химическом и биохимическом анализе
А. Ю. Оленин a, *, В. В. Ягов a
a Институт геохимии и аналитической химии имени В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: olenin@geokhi.ru
Поступила в редакцию 19.10.2021
После доработки 16.02.2022
Принята к публикации 24.02.2022
- EDN: JYOCRD
- DOI: 10.31857/S0044450222090080
Аннотация
В последнее время в люминесцентном анализе широко применяется термин “turn-on fluorescence”, которому на русском языке соответствует название “возникающая флуоресценция” (ВФ). В настоящей работе представлен обзор реагентов и аналитов, а также дана оценка возможностей ВФ в химическом и биохимическом анализе, в том числе реальных объектов сложного химического состава. Далеко не все эффекты, объединенные под названием “turn-on fluorescence”, являются качественно новыми; одна из целей настоящей работы состояла в согласовании терминологии, применяемой в современных англоязычных публикациях, с терминологией, принятой в отечественной литературе по люминесценции. Реагент с ВФ – это хороший люминофор со структурным “дефектом”, снижающим квантовый выход: незамкнутым циклом, нарушением в системе сопряженных связей или присоединенным тушителем. В ходе реакции с аналитом “дефект” устраняется и образуется интенсивно люминесцирующий продукт. Типы “дефектов” и реакций их “исправления” положены в основу предлагаемой классификации реагентов с ВФ.
Флуоресцентные методы – важная область аналитической химии, особую динамику развития которой определяют работы по созданию химических сенсоров и биомедицинские исследования [1–32]. Явление флуоресценции присуще многим ароматическим соединениям; оно может служить средством прямого инструментального анализа благодаря высокой чувствительности и специфичности, связанной с возможностями спектральной селекции по возбуждению и испусканию, а также временной селекции. Люминесцентные методы нашли широкое практическое применение для определения неорганических катионов [20–22, 33–39], биополимеров [40, 41], активных форм кислорода [33, 34, 42, 43], загрязнителей окружающей среды [21, 39, 44–46], взрывчатых веществ [47], фосфорорганических токсикантов [48], биомаркеров [49], для контрастирования биообъектов [18, 29, 30, 33, 50–52], для исследования распределения медицинских препаратов [24, 53–57], контроля качества пищевых продуктов [58]. В последние 15 лет наблюдается бурный рост числа работ, в которых встречается термин “turn-on fluorescence”, который практически не использовался до 2005 г. В настоящее время новая статья, посвященная “turn-on fluorescence”, появляется в среднем каждые 1.5 дня (рис. 1).
Рис. 1.
Динамика количества публикаций, включающих термин “turn-on fluorescence”, в ведущих наукометрических базах данных.

Можно сформулировать две главные цели обзора. Во-первых, это обобщение и анализ современной литературы, включающей термин “turn-on fluorescence”. Фактического материала опубликовано довольно много, в разных областях. Во-вторых, попытка упорядочить термины, используемые авторами различных работ. Зачастую одним и тем же термином описывают различные явления и, наоборот, для аналогичных по своей сути процессов используют несколько названий.
В обзоре на русском языке [59] в качестве эквивалента “turn-on luminescent sensor” предложен термин “включающийся” люминесцентный молекулярный сенсор (ЛМС). Рассмотрены молекулы, содержащие флуорофор и макроциклический лиганд, способный к селективному связыванию неорганического катиона. Как отмечают авторы, “наиболее перспективными с практической точки зрения считаются ЛМС, которые сильно люминесцируют только в составе комплекса, т.е. после селективного связывания субстрата, а в отсутствие субстрата не люминесцируют либо показывают очень слабую люминесценцию”. Это определение “включающихся” ЛМС в точности соответствует теме настоящего обзора с тем отличием, что мы не будем ограничиваться комплексообразованием, а попытаемся охватить все типы аналитически полезных реакций, приводящих к усилению флуоресценции.
Следует отметить различие в употреблении казалось бы эквивалентных терминов “sensor” и “сенсор” в работах по люминесценции. Если на русском языке “люминесцентный сенсор” воспринимается как устройство, то в англоязычной литературе “luminescent sensor” – это, как правило, молекула, реагент для люминесцентного анализа.
В традиционных для русскоязычной литературы терминах “turn-on fluorescence” можно перевести как “возникающая флуоресценция” (ВФ), в отличие от типичных систем, в которых добавление аналита вызывает сдвиг максимума спектра излучения без существенного изменения квантового выхода. Для подобных систем в англоязычной литературе используют термин “ratiometric fluorescent sensor” [18], который подразумевает измерение отношения интенсивности пика чистого реагента к интенсивности пика реагента с аналитом. Родственный по смыслу термин “turn-off fluorescence” относится к случаю, когда аналит тушит свечение люминофора.
В настоящее время большинство публикаций содержит не только необходимую информацию о методе определения аналита, такую как описание процесса пробоподготовки, получения градуировочных зависимостей, определения аналитических характеристик, но и примеры практического использования для анализа реальных объектов, многие из которых являются сложными и требуют понимания их специфики.
За последние пять лет опубликованы десятки обзорных статей по ВФ, посвященных физико-химическим основам явления [60–63]; материалам, проявляющим этот эффект [61, 64–68]; областям практического использования, таким как контрастирование биологических объектов [64, 69, 70], экология [65, 70], химическая и биологическая сенсорика [64, 66, 69, 71]. Применение в аналитической химии рассмотрено в единичных публикациях, например, в работе [67] описано флуоресцентное детектирование аминов. Систематический обзор, посвященный применению явления ВФ в аналитической химии, в настоящее время отсутствует.
ХИМИЧЕСКИЕ РЕАКЦИИ, ПРИВОДЯЩИЕ К “ВОЗНИКАЮЩЕЙ ФЛУОРЕСЦЕНЦИИ”
“Turn-on” или ВФ-реагент – это либо чуть-чуть “недоделанный”, либо слегка испорченный хороший люминофор. “Чуть-чуть” и “слегка” надо понимать в том смысле, что указанные недостатки должны исчезнуть в результате быстро протекающей реакции с аналитом в мягких условиях. “Недоделка” обычно состоит в наличии в молекуле подготовленного к замыканию в цикл, но все же незамкнутого фрагмента. Самый известный и широко используемый способ устранения такого рода “дефекта” люминофора – образование хелатного комплекса с неорганическим катионом. К другому роду “несовершенств” молекул люминофора можно отнести ковалентно или координационно связанные с ними тушители, отравляющие люминесцентную жизнь ароматической системы. Нарушение системы сопряженных связей за счет одиночных гидрированных фрагментов можно рассматривать и как недоделку, и как излишество: в любом случае способность светиться реагенту может вернуть аналит-окислитель. В идеале создатель хорошего turn-on реагента должен так срежиссировать структуру ароматического соединения, чтобы особенности аналита делали его единственным героем, который способен вернуть свет потушенному люминофору.
Можно выделить три основных типа химических превращений, приводящих к ВФ: удлинение ковалентной цепи сопряжения, удаление внутримолекулярного тушителя и комплексообразование.
Наиболее существенное изменение структура органического реагента претерпевает в ходе реакций, сопровождающихся удлинением цепи сопряжения. Чаще всего увеличение размеров ароматического фрагмента, понимаемого как система сопряженных связей, происходит за счет образования новых циклов. При определении ряда органических и неорганических соединений усиление люминесценции реагента происходит вследствие встраивания фрагмента аналита в молекулу люминофора. Такого рода процессы будем называть структурной циклизацией (СЦ). Этот подход применим для аналитов, содержащих несколько реакционноспособных функциональных групп, присутствующих в молекулах гидразина [72], аминокислот [73–75] и т.п. Наиболее часто в литературе встречаются реакции конденсации, такие как формирование оснований Шиффа, циклизация с участием гетероатомов (как правило, азота и серы) и подобные им.
Наряду с реакциями СЦ описаны системы, в которых аналит лишь косвенно участвует в трансформации ароматической системы в качестве окислителя или восстановителя. Авторы работ по окислительной (ОЦ) или восстановительной циклизации (ВЦ) используют в качестве исходных веществ молекулы-предшественники люминофоров, в которых под действием аналита происходит замыкание цикла (как правило, содержащего один или несколько гетероатомов). Аналит, окислитель или восстановитель, выполняет роль “спускового крючка” процесса. Во многих работах, ставящих в качестве конечной задачи химический анализ, синтез такого реагента является ключевым элементом исследования.
Разумеется, окислительно-восстановительные реакции (ОВР) могут усиливать флуоресценцию без образования новых циклов [34, 76]. Например, возможна ароматизация вследствие дегидрирования (hydrogen abstraction), окислительного гидроксилирования ароматических соединений или, наоборот, восстановления функциональных групп, которые тушат люминесценцию. В системах, содержащих неорганические аналиты, возможен перевод катиона в подходящую для люминесценции валентную форму. Относя такие процессы к ОВР, мы имеем в виду только те реакции, которые не сопровождаются существенными изменениями в скелете люминофора.
Удаление внутримолекулярного тушителя – самый популярный тип реакций с ВФ. В ряде случаев аналит способен к реакции элиминирования (Э) функциональных групп-тушителей, содержащихся в органическом соединении. В результате интенсивность флуоресценции существенно возрастает (рис. 2).
Рис. 2.
Схема возникновения флуоресценции за счет удаления тушащей функциональной группы из молекулы флуорофора (L) под действием аналита (А).

В англоязычной литературе (см. например, [77]) для таких реакций часто используется термин “deprotection”. Удаление тушителя может происходить по разным механизмам, это направление интенсивно развивается в последнее время. Синтезировано большое количество новых реагентов, причем многие из них относятся к люминофорам с аномально большим стоксовым сдвигом, вызванным переносом протона в возбужденном состоянии ESIPT [62, 78–82]. Нередко используют реакции, сочетающие увеличение размера ароматической системы с удалением тушителей.
Помимо перестройки системы ковалентных связей, ВФ может быть вызвана комплексообразованием ароматического реагента с аналитом. Чаще всего речь идет о взаимодействии металл–лиганд, однако имеются примеры усиления свечения при образовании комплексов органических реагентов с анионами или нейтральными молекулами.
В реакциях комплексообразования (КО), сопровождающихся ВФ, нередко по аналогии с описанными выше превращениями для ковалентных связей происходит увеличение протяженности цепи сопряжения и удаление тушителей. Увеличение протяженности π-системы связано с образованием дополнительного цикла при связывании неорганического катиона ароматическим хелатом. Удаление металла-тушителя реализуется в реакциях конкурентного КО. Нелюминесцирующий комплекс M1L1 ароматического хелата L1 с катионом-тушителем M1 может быть ВФ-реагентом для определения ионов металлов M2 (рис. 3). Для определения катиона M2 необходимо, чтобы он был способен вытеснить M1 из комплекса M1L1 и усилить (или хотя бы не так сильно, как M1, тушить) флуоресценцию L1. Работоспособными также являются системы, основанные на конкуренции между лигандами. Для определения лиганда L2 необходимо, чтобы комплекс L2M1 был прочнее, чем L1M1, и чтобы лиганд L1 был способен к флуоресценции в свободном состоянии.
Для определения анионов применяют также системы с люминесцирующими разнолигандными комплексами.
ОПРЕДЕЛЕНИЕ АНАЛИТОВ РАЗЛИЧНОЙ ПРИРОДЫ НА ОСНОВЕ ЭФФЕКТА “ВОЗНИКАЮЩЕЙ ФЛУОРЕСЦЕНЦИИ”
Методы качественного и количественного анализа, основанные на ВФ, в период после 2010 г. интенсивно развивались. Не последнюю роль в этом сыграла насыщенность оборудованием лабораторий, целью которых являются решение как фундаментальных, так и прикладных задач, наличие в них высококвалифицированного персонала. Можно выделить три основные группы аналитов – неорганические (табл. 1), органические (табл. 2) и биоорганические (табл. 3), для определения которых может быть применен метод ВФ.
Таблица 1.
Методики количественного флуоресцентного определения неорганических аналитов на основе “возникающей флуоресценции”
| Аналит (тип реакции) |
Реагент (реакционная среда*) |
Продукт | λex, нм | λem (λmax), нм | Диапазон линейности, M | Минимальная определяемая концентрация, M | Литера- тура |
|---|---|---|---|---|---|---|---|
| Ca2+ (КО) |
 (H2O)
(H2O)
|
 |
–** | 510 | 1 × 10−4–1 × 10−3 | – | [125] |
| Al3+ (КО) |
 (H2O, MeOH)
(H2O, MeOH)
|
 |
420 | 460 | 1 × 10−6–4 × 10−5 | 6 × 10−8 | [83] |
| Al3+ (КО) |
 (H2O−CH3CN)
(H2O−CH3CN)
|
 |
350 | 541 | – | 1.7 × 10−8 | [81] |
| Al3+ (КО) |
 (H2O)
(H2O)
|
 |
385 | 481 | 5 × 10−8–1.2 × 10−6 | 4.2 × 10−8 | [82] |
| Fe3+ (КО) |
 (H2O)
(H2O)
|
 |
510 | 578 | 5 × 10−6–2.5 × 10−5 | 1.9 × 10−7 | [84] |
| Zn2+ (КО) |
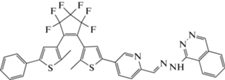 (H2O – ТГФ)
(H2O – ТГФ)
|
 |
400 | 594 | – | – | [85] |
| Zn2+ (КО) |
 (H2O)
(H2O)
|
 |
475 | 534 | 5 × 10−7–2 × 10−5 | 1 × 10−7 | [126] |
| Zn2+ (КО) |
 (H2O, MeoH)
(H2O, MeoH)
|
 |
420 | 510 | 1.0 × 10−6–4 × 10−5 | 3.7 × 10−7 | [83] |
| Cu2+ (КО) |
 (CH3CN)
(CH3CN)
|
 |
338, 365 |
443–468 | 2 × 10−6–8 × 10−6 | 1.8 × 10−8 | [86] |
| Cu2+ (КО) |
 (H2O)
(H2O)
|
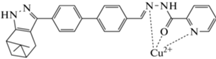 |
365 | 460 | 1.0 × 10−6–2.0 × 10−5 | 1.7 × 10−7 | [87] |
| Cu2+ (КО) |
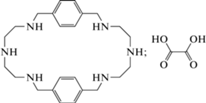 (H2O)
(H2O)
|
 |
485 | 528 | 1.0 × 10−6–1.2 × 10−4 | 6 × 10−7 | [88] |
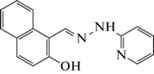
| Sn2+ (КО) |
 (H2O)
(H2O)
|
 |
280 | 397 | 1 × 10−7–6 × 10−5 | 1.2 × 10−7 | [89] |
| Hg2+ (КО) |
 (H2O)
(H2O)
|
 |
365 | 460 | 1 × 10−6–2 × 10−5 | 1.5 × 10−7 | [87] |
| Hg2+ (КО) |
 (H2O−ДМСО)
(H2O−ДМСО)
|
 |
270 | 330, 470 |
1.25 × 10−4–1.25 × 10−3 | 4.5 × 10−7 | [90] |
| Hg2+ (Э) |
 (H2O−CH3OH)
(H2O−CH3OH)
|
 |
390 | 544 | 1 × 10−8–1 × 10−6 | 8.2 × 10−9 | [127] |
| Au3+ (ОВР) |
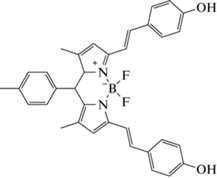 (H2O, CH3OH)
(H2O, CH3OH)
|
 |
540 | 590 | 2.5 × 10−6–7.5 × 10−6 | 9.4 × 10−9 | [92] |
| ${\text{HSO}}_{4}^{ - }$ (КО) |  (H2O–ТГФ)
(H2O–ТГФ)
|
 |
400 | 491 | – | – | [85] |
| HCN (ОЦ) |
 (H2O–ТГФ)
(H2O–ТГФ)
|
 |
365 | 477 | 1 × 10−7–1 × 10−6 | 6.4 × 10−9 | [128] |
| HClO (ОЦ) |
 (H2O–ДМСО)
(H2O–ДМСО)
|
 |
550 | 630 | 1 × 10−7–2 × 10−6 | 4 × 10−8 | [94] |
| HClO (ОЦ) |
 (H2O–EtOH)
(H2O–EtOH)
|
 |
485 | 508 | 1 × 10−6–2.5 × 10−4 | 1.2 × 10−7 | [95] |
| HClO (ОВР) |
 (H2O–CH3CN)
(H2O–CH3CN)
|
 |
630 | 738 | 1 × 10−6–3 × 10−5 | 9 × 10−8 | [76] |
| N2H4 (СЦ) |
 (H2O)
(H2O)
|
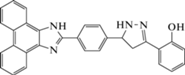 |
380 | 440, 565 | 1 × 10−6–1 × 10−4 | 7.4 × 10−8 | [72] |
| Hg2+ (Э) |
 (CH3CN)
(CH3CN)
|
 |
350 | 390, 458, 510 | 1 × 10−6–1 × 10−5 1 × 10−5–4 × 10−5 |
4 × 10−8 | [80] |
 (Э) (Э)
|
 (H2O−глицерин)
(H2O−глицерин)
|
 |
– | 490 | 1 × 10−6–1 × 10−4 | 1 × 10−8 | [106] |
| Hg2+ (КО) |
 (H2O−циклогексанол)
(H2O−циклогексанол)
|
 |
530 | 580 | – | 5.7 × 10−10 | [104] |
| ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$ (Э) |
ZrO2:Yb,Er@ZrO2−FG*** (H2O) |
 |
975 | 620, 730**** | 2 × 10−8–1 × 10−6 | 2 × 10−8 | [129] |
| ${{{\text{P}}}_{2}}{\text{O}}_{7}^{{4 - }}$ (КО) |
 (H2O)
(H2O)
|
 |
316 | 445 | 2 × 10−6–4 × 10−5 | 4.5 × 10−7 | [107] |
| ${{{\text{P}}}_{2}}{\text{O}}_{7}^{{4 - }}$ (КО) |
 (H2O)
(H2O)
|
 |
340 | 450 | 2 × 10−6–1.8 × 10−4 | 2.5 × 10−8 | [105] |
| HClO (Э) |
 (H2O)
(H2O)
|
 |
510 | 700 | 1 × 10−7–4 × 10−6 | 4 × 10−9 | [96] |
| H2S (Э, ВЦ) |
 (H2O)
(H2O)
|
 |
526 | 652 | 2 × 10−5–7 × 10−5 | 3.8 × 10−8 | [100] |
| H2S (Э, ВЦ) |
 (H2O)
(H2O)
|
 |
465 | 520 | 1 × 10−6–1 × 10−4 | 1.5 × 10−7 | [101] |
| H2S (Э) |
 (H2O)
(H2O)
|
 |
450 | 560 | 1 × 10−6–5 × 10−5 | 8 × 10−8 | [97] |
| N2H4 (Э, ВЦ) |
 (H2O−ДМФА)
(H2O−ДМФА)
|
 |
420 | 522 | 1.4 × 10−7–1.2 × 10−4 | 4 × 10−8 | [102] |
| N2H4 (Э, ВЦ) |
 (H2O−EtOH)
(H2O−EtOH)
|
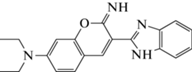 |
430 | 519 | 1 × 10−7–1 × 10−5 | 2.6 × 10−8 | [103] |
| N2H4 (Э) |
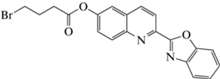 (H2O−EtOH)
(H2O−EtOH)
|
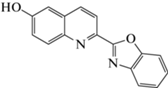 |
360 | 387, 521 | 1 × 10−6–5 × 10−5 | 5.8 × 10−9 | [98] |
| N2H4 (Э) |
 (H2O−ДМСО)
(H2O−ДМСО)
|
 |
580 | 610 | 1 × 10−6–5 × 10−5 | 1.6 × 10−7 | [99] |
| H2O2 (Э) |
 (H2O−ДМСО)
(H2O−ДМСО)
|
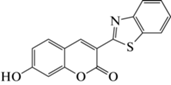 |
475 | 495 | 1 × 10−6–1 × 10−4 | 4.7 × 10−7 | [130] |
| H2O2 (Э) |
 (H2O)
(H2O)
|
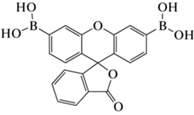 |
488 | 510 | 5 × 10−5–5 × 10−3 | 1 × 10−7 | [131] |
| HO2 (Э) |
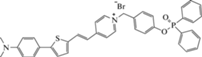 (H2O−ДМСО)
(H2O−ДМСО)
|
 |
418 | 635 | 3 × 10−5–7 × 10−5 | 2.2 × 10−8 | [112] |
* Состав растворителя, в котором происходит флуоресцентное определение аналита. ** “–” – нет данных. *** Водный золь наночастиц ZrO2:Yb,Er@ZrO2, стабилизированных красителем fast green FCF (FG-3). **** Для построения градуировочной зависимости использована суммарная интенсивность излучения при 620 и 730 нм.
Таблица 2.
Методики количественного флуоресцентного “turn-on” определения органических аналитов
| Аналит (тип реакции) |
Реагент (реакционная среда*) |
Продукт | λex, нм | λem (λmax), нм | Диапазон линейности, M** | Минимальная определяемая концентрация, M | Литера-тура |
|---|---|---|---|---|---|---|---|
 (КО)
(КО)
|
 (H2O)
(H2O)
|
 |
516 | 613 | – | – | [108] |
 (КО)
(КО)
|
 (H2O–ДМСО) (H2O–ДМСО)
|
 |
450 | 515 | 1 × 10−6–5 × 10−5 | 3.7 × 10−8 | [109] |
 (КО)
(КО)
|
 (H2O–ДМСО)
(H2O–ДМСО)
|
 |
450 | 515 | 1 × 10−6–5 × 10−5 | 5.2 × 10−8 | [109] |
 (КО)
(КО)
|
 (H2O)
(H2O)
|
 |
330 | 450 | 5 × 10−6–1 × 10−4 | 4 × 10−7 | [110] |
 (КО)
(КО)
|
ДНК, модифицированная 2-аминопурином; Hg2+ (H2O) |
 |
300 | 368 | 4 × 10−10–4 × 10−8 | 1.6 × 10−10 | [111] |
 (ОВР)
(ОВР)
|
 (H2O–CH3CN)
(H2O–CH3CN)
|
 |
400 | 560 | 1 × 10−6–4 × 10−5 | 6 × 10−9 | [112] |
 (КО)
(КО)
|
 (H2O)
(H2O)
|
 |
499 | 513 | 4 × 10−6–1.2 × 10−5 | 3 × 10−9 | [133] |
 (Э)
(Э)
|
 (H2O–EtOH)
(H2O–EtOH)
|
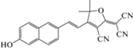 |
480 | 640 | 1 × 10−6–4 × 10−5 | 7.2 × 10−6 | [113] |
 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
390 | 485 | 5 × 10−7–1 × 10−5 | 2.6 × 10−8 | [114] |
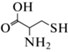 (Э, ОВР)
(Э, ОВР)
|
 (H2O–CH3CN)
(H2O–CH3CN)
|
 |
460 | 515 | 1 × 10−7–9 × 10−7 | 1.8 × 10−8 | [73] |
 (Э, ОВР)
(Э, ОВР)
|
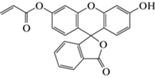 (H2O)
(H2O)
|
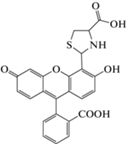 |
365 | 525 | 1 × 10−7–1 × 10−5 | 6.2 × 10−8 | [74] |
 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
471 | 637 | – | 2.5 × 10−7 | [75] |
 (Э)
(Э)
|
 (H2O–EtOH)
(H2O–EtOH)
|
 |
520 | 615 | 3 × 10−5–2 × 10−4 | 1.6 × 10−6 | [115] |
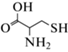 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
– | 674 | 1 × 10−7–1 × 10−5 | 9.6 × 10−7 | [116] |
 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
414 | 590 | 1 × 10−6–3 × 10−5 | 7 × 10−7 | [117] |
 (Э, ОВР)
(Э, ОВР)
|
 (H2O–ДМСО)
(H2O–ДМСО)
|
 |
370 | 470 | – | – | [118] |
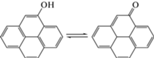
 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
365 | 512 | 2 × 10−6–2 × 10−5 | 6.2 × 10−8 | [119] |
 (Э)
(Э)
|
 (H2O)
(H2O)
|
 |
540–565 | 605–660 | 1 × 10−6–4 × 10−5 | 1.9 × 10−8 | [120] |
 (Э)
(Э)
|
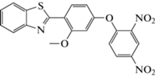 (H2O-ДМСО)
(H2O-ДМСО)
|
 |
337 | 420 | 1 × 10−6–1.5 × 10−5 | 4.5 × 10−8 | [134] |
 (КО)
(КО)
|
 (H2O)
(H2O)
|
 |
350 | 470 | 5 × 10−8–4 × 10−5 | 1.2 × 10−8 | [135] |
Таблица 3.
Методики количественного определения биоорганических аналитов на основе “возникающей флуоресценции”
| Аналит (тип реакции) |
Реагент (реакционная среда*) |
Продукт | λex, нм | λem (λmax), нм | Диапазон линейности | Минимальная определяемая концентрация | Литература |
|---|---|---|---|---|---|---|---|
| Щелочная фосфатаза (Э) | NaYF4:Yb3+,Tm3+@MnO2;  (H2O)
(H2O)
|
NaYF4:Yb3+,Tm3+@Mn2+;  |
980 | 471 | 0.25−150 мЕд/мл |
0.045 мЕд/мл | [124] |
| Эстераза печени свиньи (Э) |  (H2O)
(H2O)
|
 |
542 | 606 | 1−100 мЕд/мл |
0.45 мЕд/мл | [121] |
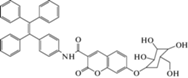
| β-Галактозидаза (Э) |
 (H2O−ДМСО)
(H2O−ДМСО)
|
 |
380 | 445 | 50−400 мЕд/мл | 0.084 мЕд/мл | [122] |
Одной из причин ВФ органического соединения является КО с катионами металлов [81, 83–91]. В большинстве случаев аналиты представляют собой катионы переходных металлов. В функциональных группах органического соединения (лиганда) имеются электронодонорные фрагменты, содержащие гетероатомы (азот, кислород): гидроксил [81, 83, 84], карбонил [81, 87, 89], аминогруппы [81, 85, 86, 88–90] или иминогруппы (гидразины) [83, 87], атомы азота гетероциклов [83–85, 87]. Наряду с ними в комплексообразовании принимают участие фрагменты лигандов, содержащие двойные связи C=N как в основной цепи [81, 83, 85, 86, 91], так и в гетероциклических фрагментах [83–85, 87].
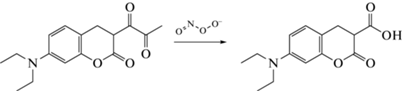
Нефлуоресцирующие замещенные пиколингидразиды способны к образованию комплексов с ионами Cu2+ и Hg2+ [87] (схема 1 ).
Схема 1 . Формирование комплексов пиколингидразидов с ионами Cu2+ и Hg2+.
Максимум полосы флоресценции этих комплексов как для Cu2+, так и Hg2+ лежит в одной области, что не позволяет одновременно определять их с использованием описывемого метода.
Комплексообразование аналита с исходным соединением может приводить к последующему удалению из молекулы фрагментов (функциональных групп), тушащих флуоресценцию [80] (схема 2 ).
Схема 2 . Формирование комплексов ионов Hg2+ и производных тиомочевины.
Подобное поведение аналита делает это превращение похожим на реакции, в которых он выполняет роль агента, способствующего удалению из молекулы тушащих флуоресценцию функциональных групп.
Окислительно-восстановительные реакции с участием ионов Au3+ также могут быть использованы для трансформаций органических соединений, приводящих к формированию флуорофоров с существенно бо́льшим квантовым выходом [92] (схема 3 ).
Схема 3 . Получение производных органических красителей, обладающих высоким квантовым выходом, путем окислительно-восстановительных реакций с ионами Au3+.
Интересной разновидностью реакций КО является связывание анионов с ароматическими реагентами. К этому типу относится взаимодействие замещенного гидразина с анионом гидросульфата [85] и ассоциация ионов дигидрофосфата с производными карбазолов [93]. Природа ВФ при образовании межмолекулярного комплекса аниона с органическим соединением остается не вполне понятной. Указание на образование водородных связей само по себе не объясняет эффекта: в упомянутых работах определение проводили в водно-органических растворах, соответственно можно говорить лишь о замене одних водородных связей другими.
В ряде случаев окислительные свойства аналита могут быть использованы для получения целевого продукта с удлиненной цепью сопряжения. Так гипохлорит-ион определяют по ВФ на основе реакций с образованием новых кислород- или азотсодержащих циклов [94, 95] (схема 4 ).
Схема 4 . Реакции окислительной гетероциклизации с участием гипохлортит-ионов.
Приведенные химические превращения сочетают расширение системы сопряженных связей с удалением тушащих функциональных групп. Авторами работ [94, 95] разработаны методики определения гипохлорит-ионов в области низких концентраций.
Этерификация гидроксильных групп в ароматических соединениях обычно снижает интенсивность излучения по отношению к исходным фенолам. В ряде работ [96–99] авторы используют реакции разрушения сложных эфиров с целью повышения квантового выхода флуоресценции.
Формирование новых структурных фрагментов, обладающих интенсивной флуоресценцией, возможно за счет реакций циклизации, происходящих при участии аналита [97, 100–103]. К отдельному типу взаимодействий можно отнести реакции конкурентного комплексообразования, приводящие к существенному увеличению флуоресценции ее продуктов [104, 105].
Наличие в окружающей среде аниона пероксинитрита способствует окислению дикетонового фрагмента до карбоксила [106] (схема 5 ).
Схема 5 . Окисление дикетонов ионами пероксинитрита.
Интенсивность флуоресценции в области 490 нм возрастает на два порядка при наличии в пробе пероксинитрита на уровне 10 мкМ. Анион пероксинитрита образуется при реакции оксида азота(II) с анион-радикалом ${\text{O}}_{2}^{ - }$. Эта методика может быть использована для их определения.
Винильные производные орто-замещенных фенолов не обладают интенсивной флуоресценцией. Их взаимодействие с сероводородом или сульфид-ионом приводит к формированию гетероциклических кислородсодержащих соединений [100, 101] (схема 6 ).
Схема 6 . Реакции гетероциклизации, происходящие с участием сульфидов.
В отличие от исходных соединений, продукты реакции под действием внешнего излучения способны к флуоресценции, что может быть положено в основу методики определения сероводорода или сульфидов на микромолярном уровне.
Взаимодействие гидразина с нефлуоресцирующими простыми и сложными эфирами фенолов приводит к циклизации и освобождению ОН-групп [98, 99, 102, 103]. В результате образуются продукты, обладающие интенсивной флуоресценцией (схема 7 ).
Схема 7 . Реакции элиминирования подавляющих флуоресценцию фрагментов с участием гидразина.
Наличие следовых количеств катионов Hg2+ может быть зафиксировано за счет обменной реакции комплексов Cu2+ с замещенными родаминами [104] (схема 8 ).
Схема 8 . Конкурентное комплексообразование между ионами Cu2+ и Hg2+.
Интенсивность флуоресценции при замещении центрального иона меди(II) ионом ртути(II) возрастает примерно на порядок в области следовых концентраций. Предел обнаружения методики составляет менее 1 нМ.
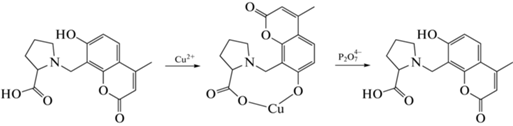
Авторы работы [107] предложили подобный синтетический подход. Исходное соединение – краситель,обладающий собственной интенсивнойфлуоресценцией,обрабатывают соединениямимеди. Полученныйтаким образом нефлуоресцирующий комплекс способен к селективной реакции с ионами пирофосфата (схема 9 ).
Схема 9 . Определение ионов пирофосфата за счет разрушения нефлуоресцирующих комплексов меди.
В ходе этого взаимодействия происходит необратимое связывание ионов меди и пирофосфата, удаление полученного продукта из ближней сферы коррелирует с количественным содержанием пирофосфата в области следовых концентраций. Примеры ВФ, описанные в работах [104, 107], соответствуют схеме, представленной на рис. 3.
Использование гетерогенных систем – золей неорганических наночастиц, содержащих на поверхности привитой слой, имеет свои особенности. До взаимодействия с аналитом такие системы могут либо вовсе не обладать собственной флуоресценцией, либо она может существенно тушиться за счет безызлучательного переноса энергии возбужденного состояния. Трехкомпонентный нанокомпозит, включающий наночастицы магнетита, наночастицы золота и изотиоционат флуоресцина, обладает собственной флуоресценцией с максимумом в области 520 нм. В присутствии ионов Pb2+ и тиосульфата происходит резкое увеличение интенсивности флуоресценции [91]. Этот эффект авторы связывают с вытеснением с поверхности нанокомпозита в объем раствора изоцианата флуоресцина с сопутствующим снижением вероятности безызлучательного переноса энергии между возбужденным состоянием красителя и наночастицами золота.
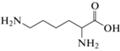
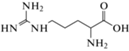
Изложенные выше общие принципы неорганического и органического анализа практически не различаются. Комплексообразование между флуорофором и аналитом, приводящее к существенному увеличению интенсивности свечения, с успехом может быть применено в органическом анализе. Так, продукт тройного взаимодействия макроциклического лиганда с ионами никеля и щавелевой кислотой используют для определения последней [108]. Деление анализа на органический и неорганический в этом случае весьма условно, так как в предыдущем разделе обзора описан сходный комплекс ионов меди c оксалатом [88]. При образовании комплексов аргинина и лизина с замещенными гидразонами интенсивность флуоресценции последних возрастает более чем на порядок в области концентраций аминокислот на уровне единиц–десятков мкМ [109]. Формирование межмолекулярных комплексов фолиевой кислоты с замещенными флуоренами повышает квантовый выход флуоресценции последних на два порядка величины [110]. Модифицированная 2-аминопурином ДНК в сочетании с ионами ртути способна к селективному взаимодействию с цистеином, продуктом которого является тройной комплекс, обладающий достаточно высокими значениями квантового выхода флуоресценции [111]. Это позволяет количественно определять цистеин (в том числе в биообъектах) на наномолярном уровне.
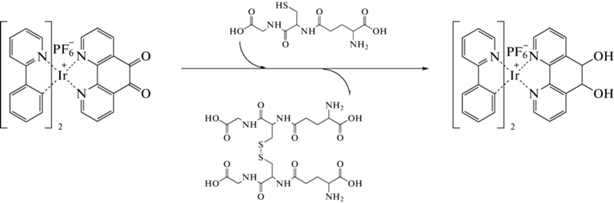
Химические реакции с участием органических аналитов способны приводить к образованию продуктов, обладающих интенсивной флуоресценцией. Так, ОВР между фенантролиновыми комплексами иридия и глутатионом представляет собой триггерный хемилюминесцентный процесс, количественные характеристики которого могут быть использованы в органическом анализе [112] (схема 10 ).
Схема 10 . Определение глутатиона за счет окислительно-восстановительной реакции, приводящей к комплексами иридия, обладающим интенсивной флуоресценцией.
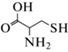
Как отмечено выше в связи с определением гидразина, сложноэфирные группы, связанные непосредственно с бензольным кольцом или полициклическим ароматическим фрагментом, часто снижают квантовый выход флуоресценции. Цистеин при взаимодействии с этими группами образует семичленное гетероциклическое соединение, за счет чего происходит освобождение фенольного гидроксила [113] и возникает ВФ (схема 11 ).
Схема 11 . Определение цистеина за счет реакции элиминирования тушащей флуоресценцию функциональной группы красителя.
Такого рода превращения могут лежать в основе методик флуоресцентного определения цистеина [73–75, 113–119] или его селенсодержащего аналога [120].
Упоминание эффекта ВФ в биоорганическом анализе в настоящее время встречается в единичных работах [121–123]. Соответствующие методики представляют собой адаптацию аналогов, используемых в неорганическом или органическом анализе. Так, аскорбиновая кислота или фенолсодержащий красителя генерируются за счет разрушения эфиров фосфорной или карбоновой кислот под действием щелочной фосфатазы [124], эстеразы [121], β-галактозидазы [122]. Далее фактически определяют продукты реакции – аскорбиновую кислоту или нативный флуорофор (краситель). В работе [124] использовали весьма необычный вид элиминирования тушителя. Фосфорилированная аскорбиновая кислота не восстанавливает MnO2, входящий в состав наночастиц. Под действием щелочной фосфатазы образуется свободная аскорбиновая кислота, которая реагирует с диоксидом марганца с образованием ионов Mn2+, что сопровождается ВФ. Авторами в этом случае использовална антистоксова флуоресценция наночастиц (upconversion nanoparticles).
* * *
Термин “возникающая флуоресценция” (ВФ) (turn-on fluorescence) объединяет работы существенно различного направления и степени новизны. Сюда относят как новые (но по духу традиционные) ароматические хелаты для определения неорганических катионов, так и селективные реагенты на органические аналиты, действие которых основано на межмолекулярных взаимодействиях, природа которых не всегда понятна. Появление или существенное повышение интенсивности собственной флуоресценции органического соединения при взаимодействии с аналитом может быть обусловлено либо разрушением исходных структур, либо синтезом новых. К первому случаю можно отнести элиминирование функциональных групп, обладающих тушащим эффектом, ко второму – формирование новых структурных фрагментов (обычно новых циклов), повышающих интенсивность излучения. Оба процесса допускают ковалентную и координационную реализацию. Нередко они протекают одновременно. Отдельный интересный раздел − ВФ при образовании межмолекулярных комплексов без изменения системы ковалентных и координационных связей. Такие системы, пока немногочисленные, применяют для определения некоторых анионов или нейтральных органических молекул по ВФ ароматических реагентов.
Практически неисследованной в настоящее время остается область, в которой аналит является катализатором целевой реакции. Пока что в литературе имеются лишь единичные работы по этой тематике, причем в них описываются биоорганические катализаторы – ферменты. Поиск традиционных катализаторов реакций с ВФ, их практическое использование могут лежать в основе нового направления определения сверхмалых содержаний вещества.
Работа выполнена по теме госзадания ГЕОХИ РАН.
Список литературы
Константинова-Шлезингер М.А. Люминесцентный анализ. М.: Изд-во АН СССР, 1951. 66 с.
Гладков А.А. Люминесцентный анализ в медицине. Кишинев: КГУ, 1958. 389 с.
Божевольнов Е.А. Люминесцентный анализ неорганических веществ. М.: Химия, 1966. 416 с.
Головина А.П., Левшин Л.В. Химический люминесцентный анализ неорганических веществ. М.: Химия, 1978. 248 с.
Красников В.В., Тимошкин Е.И., Титкова А.В. Спектральный люминесцентный анализ пищевых продуктов. М.: Агропромиздат, 1987. 288 с.
Люминесцентный анализ в медико-биологических исследованиях / Под ред. Соминского В.Н. Рига: РМИ, 1990. 145 с.
Gooijer C., Kozin I., Velthorst N.H. Shpol’skii spectrometry, a distinct method in environmental analysis // Mikrochim. Acta. 1997. V. 127. P. 149. https://doi.org/10.1007/BF01242719
Fletcher K.A., Fakayode S.O., Lowry M., Tucker S.A., Neal S.L., Kimaru I.W., McCarroll M.E., Patonay G., Oldham P.B., Rusin O., Strongin R.M., Warner I.M. Molecular fluorescence, phosphorescene, and chemiluminescence spectrometry // Anal. Chem. 2006. V. 78. № 12. P. 4047. https://doi.org/10.1021/ac060683m
Гришаева Т.И. Методы люминесцентного анализа. СПб: АНО НПО “Профессионал”, 2003. 226 с.
Siraj N., El-Zahab B., Hamdan S., Karam T.E., Haber L.H., Li M., Fakayode S.O., Das S., Valle B., Strongin R.M., Patonay G., Sintim H.O., Baker G.A., Powe A., Lowry M., Karolin J.O., Geddes C.D., Warner I.M. Fluorescence, phosphorescence, and chemiluminescence // Anal. Chem. 2016. V. 88. № 1. P. 170. https://doi.org/10.1021/acs.analchem.5b04109
Rodríguez J.J.S., Halko R., Rodríguez J.R.B., Aaron J.J. Environmental analysis based on luminescence in organized supramolecular systems // Anal. Bioanal. Chem. 2006. V. 385. № 3. P. 525. https://doi.org/10.1007/s00216-006-0342-4
Штыков С.Н., Горячева И.Ю. Аналитическая люминесцентная спектроскопия в микрогетерогенных супра- и надмолекулярных самоассоциирующих организованных средах // Оптика и спектроскопия. 1997. Т. 83. № 4. С. 698 (Shtykov S.N., Goryacheva I.Yu. Luminescent analytical spectroscopy in microheterogeneous supra- and supermolecular self-assembled organized media // Opt. Spectrosс. 1997. V. 83. No 4. P. 645)
Абрамова А.М., Горячева О.А., Дрозд Д.Д., Новикова А.С., Пономарева Т.С., Строкин П.Д., Горячева И.Ю. Люминесцентные полупроводниковые квантовые точки в химическом анализе // Журн. аналит. химии. 2021. Т. 76. №. 3 С. 19. (Abra-mova A.M., Goryacheva O.A., Drozd D.D., Novikova A.S., Ponomareva T.S., Strokin P.D., Goryacheva I.Yu. Luminescence semiconductor quantum dots in chemical analysis // J. Anal. Chem. 2021. V. 76. № 3. P. 273. https://doi.org/10.1134/S106193482103002310.1134/S1061934821030023)https://doi.org/10.31857/S0044450221030026
Smirnova T.D., Shtykov S.N., Zhelobitskaya E.A. Energy transfer in liquid and solid nanoobjects: application in luminescent analysis // Phys. Sci. Rev. 2018. V. 4. № 3. Article 20189981. https://doi.org/10.1515/psr-2018-9981
Ruedas-Rama M.J., Walters J.D., Orte A., Hall E.A.H. Fluorescent nanoparticles for intracellular sensing: A review // Anal. Chim. Acta. 2012. V. 751. P. 1. https://doi.org/10.1016/j.aca.2012.09.025
Nsibande S.A., Montaseri H., Forbes P.B.C. Advances in the application of nanomaterial-based sensors for detection of polycyclic aromatic hydrocarbons in aquatic systems // Trends Anal. Chem. 2019. V. 115. P. 52. https://doi.org/10.1016/j.trac.2019.03.029
Zhang Q., Liu P., Li S., Zhang X., Chen M. Progress in the analytical research methods of polycyclic aromatic hydrocarbons (PAHs) // J. Liq. Chromatogr. Relat. Technol. 2020. V. 43. № 13-14. P. 425. https://doi.org/10.1080/10826076.2020.1746668
Bigdeli A., Ghasemi F., Abbasi-Moayed S., Shahrajabian M., Fahimi-Kashani N., Jafarinejad S., Nejad M.A.F., Hormozi-Nezhad M.R. Ratiometric fluorescent nanoprobes for visual detection: Design principles and recent advances – A review // Anal. Chim. Acta. 2019. V. 1079. P. 30. https://doi.org/10.1016/j.aca.2019.06.035
Nawaz H., Zhang X., Chen S., You T., Xu F. Recent studies on cellulose-based fluorescent smart materials and their applications: A comprehensive review // Carbohydr. Polym. 2021. V. 267. Article 118135. https://doi.org/10.1016/j.carbpol.2021.118135
Tu D., Zheng W., Huang P., Chen X. Europium-activated luminescent nanoprobes: From fundamentals to bioapplications // Coord. Chem. Rev. 2019. V. 378. P. 104. https://doi.org/10.1016/j.ccr.2017.10.027
Rasheed T., Nabeel F. Luminescent metal-organic frameworks as potential sensory materials for various environmental toxic agents // Coord. Chem. Rev. 2019. V. 401. Article 213065. https://doi.org/10.1016/j.ccr.2019.213065
Paderni D., Giorgi L., Fusi V., Formica M., Ambrosi G., Micheloni M. Chemical sensors for rare earth metal ions // Coord. Chem. Rev. 2021. V. 429. Article 213639. https://doi.org/10.1016/j.ccr.2020.213639
Brzechwa-Chodzyńska A., Drożdż W., Harrowfield J., Stefankiewicz A.R. Fluorescent sensors: A bright future for cages // Coord. Chem. Rev. 2021. V. 434. Article 213820. https://doi.org/10.1016/j.ccr.2021.213820
Lakshmi P.R., Nanjan P., Kannan S., Shanmugaraju S. Recent advances in luminescent metal–organic frameworks (LMOFs) based fluorescent sensors for antibiotics // Coord. Chem. Rev. 2021. V. 435. Article 213793. https://doi.org/10.1016/j.ccr.2021.213793
Guo L., Yang L., Li M., Kuang L., Song Y., Wang L. Covalent organic frameworks for fluorescent sensing: Recent developments and future challenges // Coord. Chem. Rev. 2021. V. 440. Article 213957. https://doi.org/10.1016/j.ccr.2021.213957
Hao Z., Zhu R., Chen P.R. Genetically encoded fluorescent sensors for measuring transition and heavy metals in biological systems // Curr. Opin. Chem. Biol. 2018. V. 43. P. 87. https://doi.org/10.1016/j.cbpa.2017.12.002
Zhang H., Ju Q., Pang S., Wei N., Zhang Y. Recent progress of fluorescent probes for the detection of alkaline phosphatase (ALP): A review // Dyes Pigm. 2021. V. 194. Article 109569. https://doi.org/10.1016/j.dyepig.2021.109569
Yang Y., Tu D., Zhang Y., Zhang P., Chen X. Recent advances in design of lanthanide-containing NIR-II luminescent nanoprobes // iScience. 2021. V. 24. Article 102062. https://doi.org/10.1016/j.isci.2021.102062
Mehta V.N., Desai M.L., Basu H., Singhal R.K., Kailasa S.K. Recent developments on fluorescent hybrid nanomaterials for metal ions sensing and bioimaging applications: A review // J. Mol. Liq. 2021. V. 333. Article 15950. https://doi.org/10.1016/j.molliq.2021.115950
Mizukami S. Targetable fluorescent sensors for advanced cell function analysis // J. Photochem. Photobiol. C. 2017. V. 30. P. 24. https://doi.org/10.1016/j.jphotochemrev.2017.01.003
Patel S., Jamunkar R., Sinha D., Monisha, Patle T.K., Kant T., Dewangan K., Shrivas K. Recent development in nanomaterials fabricated paper-based colorimetric and fluorescent sensors: A review // Trends Env. Anal. Chem. 2021. V. 31. Article e00136. https://doi.org/10.1016/j.teac.2021.e00136
Guo C., Sedgwick A.C., Hirao T., Sessler J.L. Supramolecular fluorescent sensors: An historical overview and update // Coord. Chem. Rev. 2021. V. 427. Article 213560. https://doi.org/10.1016/j.ccr.2020.213560
Hyman L.M., Franz K.J. Probing oxidative stress: Small molecule fluorescent sensors of metal ions, reactive oxygen species, and thiols // Coord. Chem. Rev. 2012. V. 256. № 19–20. P. 2333. https://doi.org/10.1016/j.ccr.2012.03.009
Kwon N., Kim D., Swamy K.M.K., Yoon J. Metal-coordinated fluorescent and luminescent probes for reactive oxygen species (ROS) and reactive nitrogen species (RNS) // Coord. Chem. Rev. 2021. V. 427. Article 213581. https://doi.org/10.1016/j.ccr.2020.213581
Qiao M., Ding L., Lv F. Surfactant assemblies encapsulating fluorescent probes as selective and discriminative sensors for metal ions // Coord. Chem. Rev. 2021. V. 432. Article 213696. https://doi.org/10.1016/j.ccr.2020.213696
Sharma S., Ghosh K.S. Overview on recently reported fluorometric sensors for the detection of copper ion based on internal charge transfer (ICT), paramagnetic effect and aggregation induced emission (AIE) mechanisms // J. Mol. Struct. 2021. V. 1237. Article 30324. https://doi.org/10.1016/j.molstruc.2021.130324
Fang Y., Dehaen W. Small-molecule-based fluorescent probes for f-block metal ions: A new frontier in chemosensors // Coord. Chem. Rev. 2021. V. 427. Article 213524. https://doi.org/10.1016/j.ccr.2020.213524
Singh H., Bamrah A., Bhardwaj S.K., Deep A., Khatri M., Kim K.-H., Bhardwaj N. Nanomaterial-based fluorescent sensors for the detection of lead ions // J. Hazard. Mater. 2021. V. 407. Article 124379. https://doi.org/10.1016/j.jhazmat.2020.124379
Rasheed T., Bilal M., Nabeel F., Iqbal H.M.N., Li C., Zhou Y. Fluorescent sensor based models for the detection of environmentally-related toxic heavy metals // Sci. Total Environ. 2018. V. 615. P. 476. https://doi.org/10.1016/j.scitotenv.2017.09.126
Geraghty C., Wynne C., Elmes R.B.P. 1,8-Naphthalimide based fluorescent sensors for enzymes // Coord. Chem. Rev. 2021. V. 437. Article 213713. https://doi.org/10.1016/j.ccr.2020.213713
Tong X., Shi S., Tong C., Iftikhar A., Long R., Zhu Y. Quantum/carbon dots-based fluorescent assays for enzyme activity // Trends Anal. Chem. 2020. V. 131. Article 116008. https://doi.org/10.1016/j.trac.2020.116008
Hou J.-T., Zhang M., Liu Y., Ma X., Duan R., Cao X., Yuan F., Liao Y.-X., Wang S., Ren W.X. Fluorescent detectors for hydroxyl radical and their applications in bioimaging: A review // Coord. Chem. Rev. 2020. V. 421. Article 213457. https://doi.org/10.1016/j.ccr.2020.213457
Zhang Z., Fan J., Du J., Peng X. Two-channel responsive luminescent chemosensors for dioxygen species: Molecular oxygen, singlet oxygen and superoxide anion // Coord. Chem. Rev. 2021. V. 427. Article 213575. https://doi.org/10.1016/j.ccr.2020.213575
Zhang X.-Y., Yang Y.-S., Wang W., Jiao Q.-C., Zhu H.-L. Fluorescent sensors for the detection of hydrazine in environmental and biological systems: Recent advances and future prospects // Coord. Chem. Rev. 2020. V. 417. Article 213367. https://doi.org/10.1016/j.ccr.2020.213367
Wan H., Xu Q., Gu, P. Li H., Chen D., Li N., He J., Lu J. AIE-based fluorescent sensors for low concentration toxic ion detection in water // J. Hazard. Mater. 2021. V. 403. Article 123656. https://doi.org/10.1016/j.jhazmat.2020.123656
Rasheed T., Li C., Bilal M., Yu C., Iqbal H.M.N. Potentially toxic elements and environmentally-related pollutants recognition using colorimetric and ratiometric fluorescent probes // Sci. Total Environ. 2018. V. 640–641. P. 174. https://doi.org/10.1016/j.scitotenv.2018.05.232
Verbitskiy E.V., Rusinov G.L., Chupakhin O.N., Charushin V.N. Design of fluorescent sensors based on azaheterocyclic push-pull systems towards nitroaromatic explosives and related compounds: A review // Dyes Pigm. 2020. V. 180. Article 108414. https://doi.org/10.1016/j.dyepig.2020.108414
Chen Q., Sun Y., Liu S., Zhang J., Zhang C., Jiang H., Han X., He L., Wang S., Zhang K. Colorimetric and fluorescent sensors for detection of nerve agents and organophosphorus pesticides // Sens. Actuators. B. 2021. V. 344. Article 130278. https://doi.org/10.1016/j.snb.2021.130278
Zhao X., Dai X., Zhao S., Cui X., Gong T., Song Z., Meng H., Zhang X., Yu B. Aptamer-based fluorescent sensors for the detection of cancer biomarkers // Spectrochim. Acta A. 2021. V. 247. Article 119038. https://doi.org/10.1016/j.saa.2020.119038
Kumari R., Sunil D., Ningthoujam R.S. Naphthalimides in fluorescent imaging of tumor hypoxia – An up-to-date review // Bioorg. Chem. 2019. V. 88. Article 102979. https://doi.org/10.1016/j.bioorg.2019.102979
Wang H., Jing M., Li Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators // Curr. Opin. Neurobiol. 2018. V. 50. P. 171. https://doi.org/10.1016/j.conb.2018.03.010
Barooah N., Mohanty J., Bhasikuttan A.C. Fluorescent probes for the stabilization and detection of G-quadruplexes and their prospective applications // J. Ind. Chem. Soc. 2021. V. 98. Article 100078. https://doi.org/10.1016/j.jics.2021.100078
Mochida A., Ogata F., Nagaya T., Choyke P.L., Kobayashi H. Activatable fluorescent probes in fluorescence-guided surgery: Practical considerations // Bioorg. Med. Chem. 2018. V. 26. № 4. P. 925. https://doi.org/10.1016/j.bmc.2017.12.002
Koveal D., Díaz-García C.M., Yellen G. Fluorescent biosensors for neuronal metabolism and the challenges of quantitation // Curr. Opin. Neurobiol. 2020. V. 63. P. 111. https://doi.org/10.1016/j.conb.2020.02.011
O’Banion C.P., Yasuda R. Fluorescent sensors for neuronal signaling // Curr. Opin. Neurobiol. 2020. V. 63. P. 31. https://doi.org/10.1016/j.conb.2020.02.007
Wang H., Su H., Wang N., Wang J., Zhang J., Wang J.-H., Zhao W. Recent development of reactional small-molecule fluorescent probes based on resorufin // Dyes Pigm. 2021. V. 191. Article 109351. https://doi.org/10.1016/j.dyepig.2021.109351
Li Z., Wang C., Zhang M., Li S., Mao Z., Liu Z. Activatable luminescent probes for imaging brain diseases // Nano Today. 2021. V. 39. Article 101239. https://doi.org/10.1016/j.nantod.2021.101239
Luo X., Han Y., Chen X., Tang W., Yue T., Li Z. Carbon dots derived fluorescent nanosensors as versatile tools for food quality and safety assessment: A review // Trends Food Sci. Technol. 2020. V. 95. P. 149. https://doi.org/10.1016/j.tifs.2019.11.017
Ушаков Е.Н., Алфимов М.В., Громов С.П. Принципы дизайна оптических молекулярных сенсоров и фотоуправляемых рецепторов на основе краун-эфиров // Успехи химии. 2008. Т. 77. № 1. С. 39. doi: (Ushakov E.N., Alfimov M.V., Gromov S.P. Design principles for optical molecular sensors and photocontrolled receptors based on crown ethers // Russ. Chem. Rev. 2008. V. 77. № 1. P. 39. https://doi.org/10.1070/RC2008v077n01ABEH003757)
Wang X., Shen C., Zhou C., Bu Y., Yan X. Methods, principles and applications of optical detection of metal ions // Chem. Eng. J. 2021. V. 417. Article 129125. https://doi.org/10.1016/j.cej.2021.129125
Li P., Li S.F.Y. Recent advances in fluorescence probes based on carbon dots for sensing and speciation of heavy metals // Nanophotonics. 2021. V. 10. № 2. P. 877. https://doi.org/10.1515/nanoph-2020-0507
Sharma S., Ghosh K.S. Recent advances (2017–20) in the detection of copper ion by using fluorescence sensors working through transfer of photo-induced electron (PET), excited-state intramolecular proton (ES-IPT) and Förster resonance energy (FRET) // Spectrochim. Acta A. 2021. V. 254. Article 119610. https://doi.org/10.1016/j.saa.2021.119610
Han S., Zhao Y., Zhang Z., Xu G. Recent Advances in electrochemiluminescence and chemiluminescence of metal nanoclusters // Molecules. 2020. V. 25. № 21. Article 5208. https://doi.org/10.3390/molecules25215208
Rajasekar M. Recent Trends in Rhodamine derivatives as fluorescent probes for biomaterial applications // J. Mol. Struct. 2021. V. 1235. Article 130232. https://doi.org/10.1016/j.molstruc.2021.130232
Nagarajan R., Varadaraju C., Lee K.H. Recent advancements in the role of N-Heterocyclic receptors on heavy metal ion sensing Dyes Pigm. 2021. V. 191. Article 109331. https://doi.org/10.1016/j.dyepig.2021.109331
Zhang H.-C., Guo Y.-M. Advances of Carbon quantum dots for fluorescence turn-on detection of reductive small biomolecules // Chinese J. Anal. Chem. 2021. V. 49. № 1. P. 14. https://doi.org/10.1016/S1872-2040(20)60070-6
Gupta A. Aggregation-induced emission: A tool for sensitive detection of amines // ChemistrySelect. 2019. V. 4. № 44. P. 12848. https://doi.org/10.1002/slct.201903248
Karmakar A., Samanta P., Dutta S., Ghosh S.K. Fluorescent “turn-on” sensing based on metal–organic frameworks (MOFs) // Chem. Asian J. 2019. V. 14. № 24. P. 4506. https://doi.org/10.1002/asia.201901168
Chen C., Tian R., Zeng Y., Chu C., Liu G. Activatable fluorescence probes for “turn-on” and ratiometric biosensing and bioimaging: From NIR-I to NIR-II // Bioconjug. Chem. 2020. V. 31. № 2. P. 276. https://doi.org/10.1021/acs.bioconjchem.9b00734
Tarnowska M., Krawczyk T. Click chemistry as a tool in biosensing systems for sensitive copper detection // Biosens. Bioelectr. 2020. V. 169. Article 112614. https://doi.org/10.1016/j.bios.2020.112614
Feng Y., Su Y., Liu R., Lv Y. Engineering activatable nanoprobes based on time-resolved luminescence for chemo/biosensing // Trends. Anal. Chem. 2021. V. 140. Article 116283. https://doi.org/10.1016/j.trac.2021.116283
Xu H., Gu B., Li Y., Huang Z., Su W., Duan X., Yin P., Li H., Yao S. A highly selective, colorimetric and ratiometric fluorescent probe for NH2NH2 and its bioimaging // Talanta. 2018. V. 180. P. 199. https://doi.org/10.1016/j.talanta.2017.12.039
Karakuş E., Sayar M., Dartar S., Kaya B.U., Emrullahoğlu M. Fluorescein propiolate: a propiolate-decorated fluorescent probe with remarkable selectivity towards cysteine // Chem. Commun. 2019. V. 55. № 34. P. 4937. https://doi.org/10.1039/c9cc01774g
Wang B.-J., Liu R.-J., Fang J., Wang Y.-W., Peng Y. A water-soluble dual-site fluorescent probe for the rapid detection of cysteine with high sensitivity and specificity // Chem. Commun. 2019. V. 55. № 78. P. 11762. https://doi.org/10.1039/c9cc06468k
Kim Y., Choi M., Mulay S.V., Jang M., Kim J.Y., Lee W.-H., Jon S., Churchill D.G. Aqueous red-emissive probe for the selective fluorescent detection of cysteine by deprotection/cyclization cascade resulting in large stokes’ shift // Chem. Eur. J. 2018. V. 24. № 21. P. 5623. https://doi.org/10.1002/chem.201706073
Shi W.-J., Feng L.-X., Wang X., Huang Y., Wei Y.-F., Huang Y.-Y., Ma H.-J., Wang W., Xiang M., Gao L. A near-infrared-emission aza-BODIPY-based fluorescent probe for fast, selective, and “turn-on” detection of HClO/ClO– // Talanta. 2021. V. 233. Article 122581. https://doi.org/10.1016/j.talanta.2021.122581
Bhattacharyya A., Makhal S.C., Guchhait N. Fate of protected HBT based chemodosimeters after undergoing deprotection: Restoration of ESIPT or generation of emissive phenoxide? // Chem. Phys. 2019. V. 520. P. 61–69. https://doi.org/10.1016/j.chemphys.2019.01.008
Болотин С.Н. Органические люминофоры с аномально большим сдвигом Стокса / Люминесцентный анализ. Проблемы аналитической химии. Т. 19 / Под ред. Романовской Г.И. М.: Наука, 2015. С. 84.
Kyrychenko A., Karpushina G.V., Svechkarev D., Kolodezny D., Bogatyrenko S.I., Kryshtal A.P., Doroshenko A.O. Fluorescence probing of thiol-functionalized gold nanoparticles: Is alkylthiol coating of a nanoparticle as hydrophobic as expected? // J. Phys. Chem. C. 2012. V. 116. № 39. P. 21059. https://doi.org/10.1021/jp3060813
Singh H., Bhargava G., Kumar S., Singh P. Microstructural (self-assembly) and optical based discrimination of Hg2+, CN− and Hg(CN)2 ion-pair; Hg2+ promoted-ESIPT assisted guanylation of thiourea // Sens. Actuators. B: 2018. V. 272. P. 43. https://doi.org/10.1016/j.snb.2018.05.104
Pan W., Zheng C., Liao G., Liu G., Pu S. A H2O-induced fluorescence turn-on diarylethene derivative and its fluorescent sensing Al3+ // Microchem. J. 2021. V. 163. Article 105887. https://doi.org/10.1016/j.microc.2020.105887
Malini J., Sayed M. 1′-hydroxy-2′-acetonaphthone: A simple fluorescence turn-on signaling probe with high selectivity and sensitivity for Al3+ in pure water // J. Photochem. Photobiol. A. 2021. V. 418. Article 113431. https://doi.org/10.1016/j.jphotochem.2021.113431
Mudi N., Hazra P., Shyamal M., Maity S., Giri P.K., Samanta S.S., Mandal D., Misra A. Designed synthesis of fluorescence ‘Turn-on’ dual sensor for selective detection of Al3+ and Zn2+ in water // J. Fluoresc. 2021. V. 31. № 2. P. 315. https://doi.org/10.1007/s10895-020-02664-2
Badekar P.S., Thakur G.C.N., Varma M.E., Ghatpande N.S., Kulkarni P.P., Kumbhar A.A. Rhodamine-based fluorescence “turn-on” chemosensor: detection of Fe3+ion in aqueous medium and MCF-7 live cells // ChemistrySelect. 2021. V. 6. № 9. P. 2373. https://doi.org/10.1002/slct.202004640
Cui S., Qiu S., Lu R., Pu S. A multi-functional fluorescent sensor for Zn2+ and ${\text{HSO}}_{4}^{ - }$ based on a newdiarylethene derivative // Tetrahedron Lett. 2018. V. 59. № 36. P. 3365. https://doi.org/10.1016/j.tetlet.2018.07.05710.1016/j.tetlet.2018.07.057
Liu X., Liu H., Tang X., Liu G., Pu S. A highly selective colorimetric and fluorescent probe for Cu2+ based diarylethene with a diaminomaleonitrile unit // Tetrahedron. 2021. V. 78. Article 131788. https://doi.org/10.1016/j.tet.2020.131788
Li M., Ruan S., Yang H., Zhang Y., Yang Y., Song J., Xu X., Wang Z., Wang S. Nopinone-based AIE-active dual-functional fluorescent chemosensor for Hg2+ and Cu2+ and its environmental and biological applications // Dalton Trans. 2020. V. 49. № 43. P. 15299. https://doi.org/10.1039/d0dt02888f
Hontz D., Hensley J., Hiryak K., Lee J., Luchetta J., Torsiello M., Venditto M., Lucent D., Terzaghi W., Mencer D., Bommareddy A., VanWert A.L. A copper(II) macrocycle complex for sensing biologically relevant organic anions in a competitive fluorescence assay: Oxalate sensor or urate sensor? // ACS Omega. 2020. V. 5. № 31. P. 19469. https://doi.org/10.1021/acsomega.0c01655
Ravichandiran P., Kaliannagounder V.K., Bella A.P., Boguszewska-Czubara A., Masłyk M., Kim C.S., Park C.H., Johnson P.M., Park B.-H., Han M.-K., Kim A.R., Yoo D.J. Simple Colorimetric and fluorescence chemosensing probe for selective detection of Sn2+ ions in an aqueous solution: Evaluation of the novel sensing mechanism and its bioimaging applications // Anal. Chem. 2021. V. 93. № 2. P. 801. https://doi.org/10.1021/acs.analchem.0c03196
Ravichandiran P., Kaliannagounder V.K., Maroli N., Boguszewska-Czubara A., Masłyk M., Kim A.R., Park B.-H., Han M.-K., Kim C.S., Park C.H., Yoo D.J. A dual-channel colorimetric and ratiometric fluorescence chemosensor for detection of Hg2+ ion and its bioimaging applications // Spectrochim. Acta A. 2021. V. 257. Article 119776. https://doi.org/10.1016/j.saa.2021.119776
Cai Y., Ren B., Peng C., Zhang C., Wei X. Highly sensitive and selective fluorescence “turn-on” detection of Pb (II) based on Fe3O4@Au–FITC nanocomposite // Molecules. 2021. V. 26. № 11. Article 3180. https://doi.org/10.3390/molecules26113180
Jantra S., Palaga T., Rashatasakhon P., Sukwattanasinitt M., Wacharasindhu S. A “turn on” fluorometric and colorimetric probe based on vinylphenol-BODIPY for selective detection of Au(III) ion in solution and in living cells // Dyes Pigm. 2021. V. 191. Article 109341. https://doi.org/10.1016/j.dyepig.2021.109341
Shang X., Li X., Han J., Jia S., Zhang J., Xu X. Colorimetric and fluorescence turn-on sensor for biologically important anions based on carbazole derivative // Inorg. Chem. Commun. 2012. V. 16. P. 37. https://doi.org/10.1016/j.inoche.2011.11.025
Gong Y.-J., Lv M.-K., Zhang M.-L., Kong Z.-Z., Mao G.-J. A novel two-photon fluorescent probe with long-wavelength emission for monitoring HClO in living cells and tissues // Talanta. 2019. V. 192. P. 128. https://doi.org/10.1016/j.talanta.2018.08.089
Chen B., Fu H., Lv Y., Li X., Han Y. An oxidative cyclization reaction based fluorescent ‘‘Turn-On” probe for highly selective and rapid detection of hypochlorous acid // Tetrahedron Lett. 2018. V. 59. № 12. P. 1116. https://doi.org/10.1016/j.tetlet.2018.02.018
Zhang H., Yin X., Hong J., Deng Y., Feng G. A NIR fluorescence probe having significant fluorescence turn-on signal at 700 nm and large Stokes shift for rapid detection of HOCl in vivo // Talanta. 2021. V. 223. Article 121768. https://doi.org/10.1016/j.talanta.2020.121768
Sun Q., Liu H., Qiu Y., Chen J., Wu F.-S., Luo X.-G., Wang D.-W. A highly sensitive and selective fluorescence turn-on probe for the sensing of H2S in vitro and in vivo // Spectrochim. Acta A. 2021. V. 254. Article 119620. https://doi.org/10.1016/j.saa.2021.119620
Wu Q., Zheng J., Zhang W., Wang J., Liang W., Stadler F.J. A new quinoline-derived highly-sensitive fluorescent probe for the detection of hydrazine with excellent large-emission-shift ratiometric response // Talanta. 2019. V. 195. P. 857. https://doi.org/10.1016/j.talanta.2018.12.015
Hao Y., Zhang Y., Ruan K., Meng F., Li T., Guan J., Du L., Qu P., Xu M. A highly selective long-wavelength fluorescent probe for hydrazine and its application in living cell imaging // Spectrochim. Acta A. 2017. V. 184. P. 355. https://doi.org/10.1016/j.saa.2017.04.041
Zhong K., He Y., Deng L., Yan X., Li X., Tang Y., Hou S., Tang L. A near-infrared fluorescent probe for H2S based on tandem reaction to construct iminocoumarin-benzothiazole and its application in food, water, living cells // Anal. Chim. Acta. 2020. V. 1127. P. 49. https://doi.org/10.1016/j.aca.2020.06.050
Zhang H., Xie Y., Wang P., Chen G., Liu R., Lam Y.-W., Hu Y., Zhu Q., Sun H. An iminocoumarin benzothiazole-based fluorescent probe for imaging hydrogen sulfide in living cells // Talanta. 2015. V. 135. P. 149. https://doi.org/10.1016/j.talanta.2014.12.044
Xu W., Li X., Han M., Zhou T., Yang Y., Li W. A new“turn-on” fluorescence probe based on hydrazine-triggered tandem reaction // Spectrochim. Acta A. 2020. V. 228. Article 117754. https://doi.org/10.1016/j.saa.2019.117754
Cui J., Cao L., Wang G., Ji W., Nie H., Yang C., Zhang X. A fast-responding, highly sensitive detection system consisting of a fluorescent probe and palladium ions for N2H4 in environmental water and living cells // Anal. Methods. 2019. V. 11. № 39. P. 5023. https://doi.org/10.1039/c9ay01555h
Wei T.-B., Zhao Q., Li Z.-H., Dai X.-Y., Niu Y.-B., Yao H., Zhang Y.-M., Qu W.-J., Lin Q. Supramolecular organogel with aggregation-induced emission for ultrasensitive detection and effective removal of Cu2+ and Hg2+ from aqueous solution // Dyes Pigm. 2021. V. 192. Article 109436. https://doi.org/10.1016/j.dyepig.2021.109436
Yang Y., Chen P., Liu Y., Cai Z., Wang X., Me Y., Ding X., Lin L., Jiang H., Zhang Z., Ju Y. A colorimetric indicator-displacement assay based on stable Cu2+ selective carbon dots for fluorescence turn-on detection of pyrophosphate anions in urine // Spectrochim. Acta A. 2021. V. 251. Article 119479. https://doi.org/10.1016/j.saa.2021.119479
Yang R., Dou Y., Zhang Y., Qu L., Sun Y., Li Z. A facile and highly efficient fluorescent turn-on switch strategy based on diketone isomerization and its application in peroxynitrite fluorescent imaging // Sens. Actuators B. 2021. V. 337. Article 129805. https://doi.org/10.1016/j.snb.2021.129805
Chen L., Qi W., Du C., Wang Y., Liu C., Huang X., Chang X. A novel copper ion sensing fluorescent probe for fast detection of pyrophosphate and alkaline phosphatase // New J. Chem. 2021. V. 45. № 7. P. 3727. https://doi.org/10.1039/d1nj00075f
Rhaman M.M., Fronczek F.R., Powell D.R., Hossain M.A. Colourimetric and fluorescent detection of oxalate in water by a new macrocycle-based dinuclear nickel complex: A remarkable red shift of the fluorescence band // Dalton Trans. 2014. V. 43. № 12. P. 4618. https://doi.org/10.1039/c3dt53467g
Wang T., Pang Q., Tong Z., Xiang H., Xiao N. A hydrazone-based spectroscopic off-on probe for sensing of basic arginine and lysine // Spectrochim. Acta A. 2021. V. 258. Article 119824. https://doi.org/10.1016/j.saa.2021.119824
Basak M., Halder S., Das G. Folic acid induced disassembly of self-assembled fluorene-naphthalene based receptor and contemporaneous detection of folic acid in aqueous medium // J. Photochem. Photobiol. A. 2021. V. 414. Article 113292. https://doi.org/10.1016/j.jphotochem.2021.113292
Liu X., Dong L., Wang L., Xu H., Gao S., Zhong L., Zhang S., Jiang T. 2-Aminopurine modified DNA probe for rapid and sensitive detection of L-cysteine // Talanta. 2019. V. 202. P. 520. https://doi.org/10.1016/j.talanta.2019.05.007
No H.S., Kim T., Hong J.-I. Iridium(III) complex-based phosphorescent and electrochemiluminescent dual sensor for selective detection of glutathione // Sens. Actuators. B. 2021. V. 342. Article 129868. https://doi.org/10.1016/j.snb.2021.129868
Chen D., Long Z., Dang Y., Chen L. A novel fluorescent probe with red emission and a large Stokes shift for selective imaging of endogenous cysteine in living cells // Analyst. 2018. V. 143. № 23. P. 5779. https://doi.org/10.1039/c8an01657g
Ma Y., Zhao Y., Xia L., Huang J., Gu Y., Wang P. A novel one- and two-photon fluorescent probe induced by light for selective imaging of Cys in living cells and tissues // Anal. Chim. Acta. 2018. V. 1035. P. 161. https://doi.org/10.1016/j.aca.2018.06.036
Chen D., Long Z., Dang Y., Chen L. A new fluorescent probe for specific detection of cysteine with facile preparation and living cell imaging // Dyes Pigm. 2019. V. 166. P. 266. https://doi.org/10.1016/j.dyepig.2019.03.051
Zhang S., Wu D., Wu J., Xia Q., Jia X., Song X., Zeng L., Yuan Y. A water-soluble near-infrared fluorescent probe for sensitive and selective detection of cysteine // Talanta. 2019. V. 204. P. 747. https://doi.org/10.1016/j.talanta.2019.06.074
Hou J., Cai P., Wang C., Shen Y. A novel fluorescent probe with a large stokes shift for cysteine based on dicyanoisophorone // Tetrahedron Lett. 2018. V. 59. № 26. P. 2581. https://doi.org/10.1016/j.tetlet.2018.05.057
Xiao Y., Guo K., Wei J., Gao X., Yi D., Li Y., Yu X., Zhang C., Wang Q. Selective detection of Cys and GSH by using one fluorescent probe at two excitation wavelengths // Tetrahedron Lett. 2020. V. 61. № 44. Article 152462. https://doi.org/10.1016/j.tetlet.2020.152462
Sun W., Tang X., Li J., He M., Zhang R., Han X., Zhao Y., Ni Z. A novel 4-hydroxypyrene-based ‘‘off–on” fluorescent probe with large Stokes shift for detecting cysteine and its application in living cells // Tetrahedron Lett. 2020. V. 61. № 6. Article 151467. https://doi.org/10.1016/j.tetlet.2019.151467
Wang Z., Yang S., Liu X., Yang T., Han T., He X., Jiang Y., Hao Y. A near-infrared turn-on fluorescent probe for the rapid detection of selenocysteine and its application of imaging in living cells and mice // Microchem. J. 2021. V. 170. Article 10668. https://doi.org/10.1016/j.microc.2021.106681
Gwynne L., Williams G.T., Yan K.-C., Gardiner J.E., Hilton K.L.F., Patenall B.L., Hiscock J.R., Maillard J.-Y., He X.-P., James T.D., Sedgwick A.C., Jenkins A.T.A. The evaluation of ester functionalised TCF-based fluorescent probes for the detection of bacterial species // Isr. J. Chem. 2021. V. 61. № 3–4. P. 234. https://doi.org/10.1002/ijch.202000105
Niu Y., Wang H., Wang Y., Feng L. A “turn-on” fluorescent probe for ultra-sensitive detection of β-galactosidase // Microchem. J. 2021. V. 166. Article 106205. https://doi.org/10.1016/j.microc.2021.106205
Pinto I.A., Toloza C.A.T., Almeida J.M.S., da Silva A.R., Larrude D.G., Aucélio R.Q. Quantification of neomycin in rubella vaccine by off/on metal ion mediated photoluminescence from functionalized graphene quantum dots // Spectrochim. Acta A. 2019. V. 220. Article 117139. https://doi.org/10.1016/j.saa.2019.117139
Liang M.-Y., Zhao B., Xiong Y., Chen W.-X., Huo J.-Z., Zhang F., Wang L., Li Y. A “turn-on” sensor based on MnO2 coated UCNPs for detection of alkaline phosphatase and ascorbic acid // Dalton Trans. 2019. V. 48. № 43. P. 16199. https://doi.org/10.1039/c9dt02971k
Sui B., Liu X., Wang M., Belfield K.D. A Highly selective fluorescence turn-on sensor for extracellular calcium ion detection // Chem. Eur. J. 2016. V. 22. № 30. P. 10351. https://doi.org/10.1002/chem.201602162
Xu W., Mu L., Yuan H., Zhang T., Shi W. Silicon nanowires for ‘turn-on’ fluorescence detection of Zn(II) // Appl. Surf. Sci. 2010. V. 256. № 24. P. 7565. https://doi.org/10.1016/j.apsusc.2010.06.003
Ma Z., Zhang D., Guo J., Li M., Wang T., Yin H., Wang H., Liu J. An anthraquinone-based “turn-on” fluorescence probe for Hg2+ detection and its application in cell imaging // Inorg. Chem. Commun. 2021. V. 130. Article 108753. https://doi.org/10.1016/j.inoche.2021.108753
Gupta R.C., Dwivedi S.K., Ali R., Misra A. An efficient molecular scaffold exhibiting fluorescence “turn-on” response for cyanide and HCN // Chemistry Select. 2018. V. 3. № 7. P. 2025. https://doi.org/10.1002/slct.201702901
Ramírez-García G., Cervantes E.D., Mounzer O., De la Rosa E., Luke T.L., De la Cruz F.N. A turn-on luminescence method for phosphate determination based on fast green-functionalized ZrO2:Yb,Er@ZrO2 Core@Shell upconversion nanoparticles // Anal. Chem. 2019. V. 91. № 22. P. 14657. https://doi.org/10.1021/acs.analchem.9b03817
Wang Y.-B., Luo H.-Z., Wang C.-Y., Guo Z.-Q., Zhu W.-H. A turn-on fluorescent probe based on π-extended coumarin for imaging endogenous hydrogen peroxide in RAW 264.7 cells // J. Photochem. Photobiol. A. 2021. V. 414. Article 113270. https://doi.org/10.1016/j.jphotochem.2021.113270
Dong J., Zhao Z., Liu R., Zhang H., Wu Y., Ba X. Investigation of a halloysite-based fluorescence probe with a highly selective and sensitive “turn-on” response upon hydrogen peroxide // RSC Adv. 2017. V. 7. № 87. P. 55067. https://doi.org/10.1039/c7ra10210k
Xu C., Xu W., Yang Z., Li S., Wang Y., Hua J. A turn-on mitochondria-targeted near-infrared fluorescent probe with a large Stokes shift for detecting and imaging endogenous superoxide anion in cells // J. Photochem. Photobiol. A. 2021. V. 415. Article 113304. https://doi.org/10.1016/j.jphotochem.2021.113304
Erande Y., Chemate S., More A., Sekar N. PET governed fluorescence “turn on” BODIPY probe for selective detection of picric acid // RSC Adv. 2015. V. 5. № 109. P. 89482. https://doi.org/10.1039/c5ra17932g
Wang J.-Z., Li F., Xiao M.-M., Ma C.-R., Cheng G.-Q., Zhao B.-X. A new turn-on fluorescent probe for sensing 4-methylbenzenethiol in real water samples // Spectrochim. Acta A. 2021. V. 260. Article 119947. https://doi.org/10.1016/j.saa.2021.119947
Nsanzamahoro S., Zhang Y., Wang W.-F., Ding Y.-Z., Shi Y.-P., Yang J.-L. Fluorescence “turn-on” of silicon-containing nanoparticles for the determination of resorcinol // Microchim. Acta. 2021. V. 188. № 2. Article 46. https://doi.org/10.1007/s00604-021-04700-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии