Журнал аналитической химии, 2023, T. 78, № 1, стр. 55-63
Сравнение газохроматографических параметров удерживания алифатических ениновых спиртов с данными для их структурных аналогов
И. А. Савина a, Д. М. Гусев a, Т. В. Зимина a, А. А. Голованов a, И. Г. Зенкевич b, *
a Тольяттинский государственный университет,
Научно-аналитический центр физико-химических и экологических исследований
445020 Тольятти, Белорусская ул., 14, Россия
b Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп, 26, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 20.03.2022
После доработки 03.04.2022
Принята к публикации 03.04.2022
- EDN: KKPXUS
- DOI: 10.31857/S0044450222120155
Аннотация
Проанализированы закономерности газохроматографических индексов удерживания на стандартных неполярных полидиметилсилоксановых неподвижных фазах совокупности ранее недостаточно подробно охарактеризованных алифатических ениновых спиртов, содержащих связи С=С и С≡С в молекуле (14 вторичных и два третичных гомолога). Показано, что использование гомологических инкрементов индексов удерживания iRI = RI – 100x, где х = int(M/14), М – молекулярное массовое число, 14 – массовое число гомологической разности CH2, обеспечивает возможность сравнения данных для структурных аналогов (в том числе с алканолами, алкенолами и алкинолами). Обсуждаются особенности сопоставления значений iRI для соединений, относящихся к разным гомологическим группам у ≡ M(mod14), например CnH2n+2O (y = 4), CnH2nO (y = 2), CnH2n–2O (y = 0) и CnH2n–4O (y = = 12). Главная особенность состоит в том, что при переходе граничной величины y = 0 за счет увеличения формальной непредельности изменяется соотношение, связывающее значения параметра х и число атомов углерода в молекуле (условие n = x – 1 заменяется условием n = x). Следовательно, в последнем случае для обеспечения возможности сравнения гомологических инкрементов iRI с данными для структурных аналогов других рядов из них следует вычитать 100. С учетом этой поправки установлено, что значения iRI для вторичных ениновых спиртов (12 ± 16) и ранее охарактеризованных втор-алкинолов (23 ± 21) практически совпадают, а для третичных ениновых спиртов – согласуются с данными для всех рассмотренных групп структурных аналогов (алканолов, алкенолов и алкинолов).
Хромато-масс-спектрометрию в настоящее время относят к самым эффективным методам идентификации и количественного определения следов аналитов в сложных смесях. В значительной мере возможности метода определяются наличием и доступностью информационного обеспечения (базы данных), содержащего как масс-спектры, так и хроматографические параметры удерживания. Однако объем таких массивов справочных данных несопоставимо меньше количества известных органических соединений, а число объектов, охарактеризованных газохроматографическими индексами удерживания, заметно уступает количеству масс-спектров. Так, последняя версия (2020 г.) базы Национального института стандартов и технологии (США) [1] содержит масс-спектры более 300 тыс. соединений, тогда как индексы удерживания на стандартных фазах известны всего для приблизительно 140 тыс. С другой стороны, подобные базы данных служат источниками информации не только о представленных в них соединениях, но и об отсутствующих или недостаточно подробно охарактеризованных объектах (как об отдельных соединениях, так и о классах веществ). Такое несоответствие можно считать объективной предпосылкой необходимости хроматографической характеристики ранее не рассмотренных классов соединений. Если ограничиться лишь несколькими примерами, то к ним относится характеристика α-алкинолов [2], монозамещенных гидразонов этилового эфира глиоксалевой кислоты [3], ди- и триалкилфосфитов [4], диэтилацеталей алифатических карбонильных соединений [5], алкилдихлорфосфатов, диалкилхлорфосфатов и их тиоаналогов [6], алкилзамещенных 1,3-диоксоланов, 1,3-диоксанов [7], соответствующих им арильных производных [8] и др. При этом важно отметить следующие моменты:
– В число недостаточно подробно охарактеризованных попадают даже сравнительно несложные органические соединения;
– Простейший (описательный) уровень рассмотрения хроматографических данных, еще встречавшийся в работах последней трети ХХ века (см., например, [9]), в настоящее время используют редко. В первую очередь интерес представляет выявление закономерностей, применимых не только к выбранной группе аналитов, но и к соединениям иной химической природы, прежде всего, к структурным аналогам, а иногда даже более общие аналитические проблемы. Так, например, данные для α-алкинолов позволили уточнить хроматографические индексы удерживания продуктов их дегидратации – соединений плохо охарактеризованного класса алифатических енинов [2]. Если проследить степень изученности алифатических спиртов в зависимости от числа кратных связей в молекуле, то для алканолов (ФН = 0)11 она закономерно максимальна. Алкенолы (ФН = 1), диеновые [1] и ацетиленовые [2] (ФН = 2) спирты охарактеризованы менее подробно, а для более ненасыщенных аналогов известны лишь единичные данные. Так, если рассматривать алифатические ениновые спирты (одна двойная и одна тройная связи в молекуле) с общей молекулярной формулой CnH2n−4O (ФН = = 3), то база NIST [1] в диапазоне молекулярных масс от 82 до 194 (5 ≤ n ≤ 11) содержит стандартные масс-спектры ионизации электронами 16 гомологов этого ряда. Однако индексы удерживания на стандартных неполярных полидиметилсилоксановых неподвижных фазах (RI) определены для всего двух из них: 6-метил-6-гептен-4-ин-6-ола (RI 972) [10] и известного природного соединения – дегидролиналоола (RI 1091 [11] и 1116 [12]), среднее значение RI по результатам анализов различных образцов 1124 ± 9. Масс-спектрометрические данные для известных представителей этого ряда [1] подтверждают заметную интенсивность сигналов молекулярных ионов, обусловленную высокой формальной непредельностью алифатических ениновых спиртов. Это гарантирует надежное определение их молекулярных масс в ходе хромато-масс-спектрометрического анализа.
Задача настоящей работы – характеристика алифатических ениновых спиртов газохроматографическими индексами удерживания на стандартной неполярной полидиметилсилоксановой фазе с целью сравнения с данными для их структурных аналогов и установления особенностей такого сравнения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Краткая характеристика способов синтеза и свойств ениновых спиртов. Соединения (I) и (II) получены путем взаимодействия ацетиленида лития с акролеином и соответственно с кротоновым альдегидом в жидком аммиаке [13, 14]. Спирты (III)–(XI) и (XIII)–(XVI) получали аналогичным способом взаимодействием замещенных ацетиленидов лития с α,β-непредельными карбонильными соединениями в тетрагидрофуране по описанной ранее [15] общей методике; спирт (XII) получали, исходя из этинилмагнийбромида и коричного альдегида [16]. Спирты (XVII) и (XVIII) в виде смесей цис- и транс-изомеров (с преобладанием транс-изомеров) получали кислотно-катализируемой перегруппировкой спиртов (II) и (IV) по методике [17].
Охарактеризованные алифатические ениновые спирты (иначе – винилэтинилкарбинолы) представляют собой бесцветные или слабо окрашенные вязкие жидкости, за исключением спирта (XI), который выделен в виде игольчатых кристаллов с Тпл 64–66°С (из петролейного эфира); спирты (I)–(VI), согласно данным газохроматографического (детектор по теплопроводности) и элементного анализа, содержали до 2–3% воды. Препаративные выходы, значения некоторых физико-химических свойств, а также аналитические и спектральные характеристики спиртов (IV)–(XXIII) приведены в табл. 1 и 2.
Таблица 1.
Препаративные выходы, температуры кипения и данные элементного анализа для впервые синтезированных алифатических ениновых спиртов
| № | Выход, %* | Ткип, °С (мм рт. ст.) |
Найдено, % | Молекулярная формула | Вычислено, % | ||||
|---|---|---|---|---|---|---|---|---|---|
| H | C | Si | H | C | Si | ||||
| IV | 76 | 78–80 (8) | 76.63 | 9.43 | C7H10O | 76.33 | 9.15 | ||
| V | 42 | 75–76 (9) | 78.25 | 10.47 | C9H14O | 78.21 | 10.21 | ||
| VI | 32 | 80–81 (15) | 77.30 | 10.99 | C8H12O | 77.38 | 9.74 | ||
| VII | 79 | 75–77 (10) | 62.03 | 9.40 | 17.98 | C8H14OSi | 62.28 | 9.15 | 18.20 |
| VIII | 60 | 98–99 (9) | 78.56 | 10.45 | C9H14O | 78.21 | 10.21 | ||
| IX | 48 | 97–98 (15) | 78.01 | 11.00 | C9H14O | 78.21 | 10.21 | ||
| X | 66 | 111–112 (9) | 78.87 | 10.86 | C10H16O | 78.90 | 10.59 | ||
| XIII | 47 | 136–137 (7) | 80.50 | 11.77 | C13H22O | 80.35 | 11.41 | ||
| XIV | 88 | –** | 65.15 | 7.54 | 12.39 | C12H16O2Si | 65.41 | 7.32 | 12.75 |
| XV | 82 | 176–177 (11) | 72.68 | 8.03 | 11.83 | C14H18OSi | 72.99 | 7.88 | 12.19 |
| XVI | 63 | –** | 74.88 | 8.97 | 9.98 | C17H24OSi | 74.94 | 8.88 | 10.31 |
| XVII | 81 | 68–74 (8) | 74.65 | 8.37 | C6H8O | 74.97 | 8.39 | ||
| XVIII | 84 | 78–85 (8) | 76.59 | 9.46 | C7H10O | 76.33 | 9.15 | ||
Таблица 2.
Спектральные характеристики впервые синтезированных алифатических ениновых спиртов
| № | Спектр ЯМР 1Н, δ, м.д. | Спектр ЯМР13С, δ, м.д. |
ИК спектр, ν, см–1 |
|---|---|---|---|
| IV | 1.65–1.76 м (3H), 1.86 дд (4H, JHH 2.2, 0.8 Гц), 4.73–4.81 м (1H), 5.60 дд (1H, JHH 15.2, 1.2 Гц), 5.86 дд (1H, JHH 15.2, 1.2 Гц) | 3.6, 17.5, 63.1, 79.0, 82.2, 128.3, 130.9 | 3350, 2237, 1674 |
| V | 0.97 т (3H, JHH 7.4 Гц), 1.52 с (4H), 1.44–1.62 м (2H), 2.20 т (2H, JHH 7.1 Гц), 5.08 дд (1H, JHH 10.2, 1.2 Гц), 5.48 дд (1H, JHH 17.0, 1.2 Гц), 5.96 дд (1H, JHH 17.0, 10.2 Гц) | 13.5, 20.7, 22.1, 30.4, 68.4, 82.5, 85.3, 113.1, 142.7 | 3348, 2240, 1677 |
| VI | 0.98 т (3H, JНН 7.4 Гц), 1.46–1.60 м (2H), 2.14–2.26 м (2H), 2.38 с (1H), 4.85 к (1H, JНН 1.7 Гц), 5.17 дд (1H, JНН 10.1, 1.5 Гц), 5.43 дд (1H, JНН 17.0, 1.5 Гц), 5.96 ддд (1H, 1H, JНН 17.1, 10.1, 5.4 Гц) | 13.4, 20.7, 22.0, 63.3, 79.2, 86.9, 115.8, 137.7 | 3350, 2245, 1643 |
| VII | 0.20 с (9H), 0.29 с (1H), 4.86–4.89 м (1H), 5.24 дд (1Н, JНН 10.0, 1.4 Гц), 5.49 дд (1Н, JНН 17.0, 1.4 Гц), 5.92–6.05 м (1H) | –0.48, 63.6, 91.2, 104.1, 136.7 | 3337, 2174, 1643 |
| VIII | 0.88 т (3H, JHH 7.3 Гц), 1.31–1.56 м (4H), 2.13–2.29 м (3H), 4.77–4.89 м (1H), 5.16 дт (1H, JHH 10.1, 1.4 Гц), 5.40 дт (1H, JHH 17.0, 1.4 Гц), 5.86 – 6.01 м (1H) | 13.5, 17.4, 18.6, 22.0, 30.3, 63.2, 79.1, 86.7, 128.1, 131.0 | 3348, 2245, 1643 |
| IX | 0.97 т (JНН 7.4 Гц, 3H), 1.46–1.59 м (2H), 1.67–1.74 м (3H), 2.13–2.23 м (2H), 2.29 с (1H), 4.79 д (1H, JНН 6.1 Гц), 5.53–5.65 м (1H), 5.78–5.92 м (1H) | 13.5, 17.4, 20.7, 22.0, 63.0, 79.9, 86.4, 128.0, 130.9 | 3348, 2234, 1674 |
| X | 0.82–0.98 м (3H), 1.32–1.62 м (5H), 1.65–1.77 м (3H), 2.14–2.30 м (2H), 4.76–4.83 м (1H), 5.60 дд (1H, JHH 15.2, 1.2 Гц), 5.86 дд (1H, JHH 15.2, 1.2 Гц) | 13.6, 17.4, 18.5, 22.0, 30.7, 63.0, 79.8, 86.7, 128.2, 131.0 | 3348, 2245, 1672 |
| XIII | 0.79–0.95 м (3H), 1.19–1.30 м (9H), 1.26–1.37 м (1H), 1.33–1.42 м (1H), 1.42–1.58 м (2H), 2.21 тд (2H, JHH 7.1, 2.0 Гц), 4.79–4.88 м (1H), 5.17 дт (1H, JHH 10.1, 1.4 Гц), 5.42 дт (1H, JHH 17.0, 1.4 Гц), 5.89–6.01 м (1H) | 14.1, 19.0, 22.7, 28.7, 28.9, 29.1, 29.2, 31.8, 63.4, 87.2, 96.0, 115.9, 137.8 | 3399, 2241, 1643 |
| XIV | 0.22 с (9H), 0.31 с (1H), 5.04 д (1Н, JНН5.8), 6.25 дд (1Н, JНН 15.6, 5.8 Гц), 6.33 д (1Н, JНН 3.4 Гц), 6.40 дд (1Н, JНН 3.4, 1.8 Гц), 6.60 д (1Н, JНН 15.6 Гц), 7.39 д (1Н, JНН 1.8 Гц) | –0.45, 63.0, 91.4, 104.0, 109.2, 113.0, 120.1, 125.8, 142.5, 151.8 | 3421, 2173, 1626 |
| XV | 0.24 с (9H), 0.35 с (1H), 5.08 д (1Н, JНН 6.0 Гц), 6.32 дд (1Н, JНН 15.8, 6.0 Гц), 6.82 д (1Н, JНН 15.8 Гц), 7.25–7.51 м (5H) | 0.14, 63.4, 91.4, 104.3, 126.8, 127.9, 126.8, 132.1, 136.1, 149.0 | 3391, 2245, 1645 |
| XVI | 0.54–0.81 м(6H), 0.89–1.13 м (10H), 5.06 дд (1H, JHH 5.8, 1.4 Гц), 6.30 дд (1H, JHH 15.8, 5.8 Гц), 6.67–6.87 м (1H), 7.19–7.61 м (5H) | 4.4, 7.4, 63.3, 88.7, 94.2, 126.9, 128.1, 128.6, 128.7, 129.2, 131.4 | 3375, 2169, 1670 |
| XVII | 1.23–1.28 м (Нцис-, транс-), 2.88 c (Нтранс-), 3.07 с (ОНцис-, транс-), 3.15 c (Нцис-), 4.32 квинтет (JНН 12.65, 6.42, 6.24 Гц, Нтранс-), 4.82 квинтет (JНН 13.76, 7.15, 6.60 Гц, Нцис-), 5.45 д (JНН 11.00 Гц, Нцис-), 5.62 д (JНН 16.05 Гц, Нтранс-), 5.99 дд (JНН 11.00, 8.25 Гц, Нцис-), 6.24 дд (JНН 16.05, 5.59 Гц, Нтранс-) | 22.4, 22.8,66.1,67.8, 77.9,79.3, 81.7,83.0, 107.9, 148.6 | 3368, 3294, 2102, 1632 |
| XVIII | 4.27–4.37 м (Hтранс-), 4.76–4.87 м (Hцис-), 5.46 дд (Hцис-, JHH 10.8, 1.1 Гц), 5.64 дд (Hтранс-, JHH 15.9, 1.4 Гц), 5.83 дд (Hцис-, JHH 8.0, 0.7 Гц), 6.06 дд (Hтранс-, JHH 15.8, 0.7 Гц) | 4.2, 4.3, 22.5, 22.9, 66.1, 68.1, 75.6, 77.7, 86.5, 91.6, 109.4, 109.6, 145.2, 145.4 | 3370, 2101, 1633 |
Спектры ЯМР 1Н и 13С растворов спиртов в CDCl3 записывали на спектрометре Bruker AVANCE III 400 (400.13 и 101.61 МГц соответственно). ИК-спектры записывали для образцов в тонком слое между пластинами KBr на приборе Shimadzu IR 100 с преобразованием Фурье. Элементный микроанализ проводили на стандартной аппаратуре в соответствии с методиками, приведенными в руководстве [18].
Условия газохроматографического анализа алифатических ениновых спиртов: газовый хроматограф Кристалл-люкс 4000М с пламенно-ионизационным детектором и капиллярной колонкой из плавленого кварца длиной 25 м, внутренним диаметром 0.20 мм и толщиной пленки полидиметилсилоксановой неподвижной фазы 0.33 мкм. Использовали режим программирования температуры от 60 до 220°С со скоростью 6 град/мин (общее время программирования температуры 26.7 мин) с заключительным изотермическим участком. Температура испарителя и детектора 220°С, газ-носитель гелий, объемный расход 10 мл/мин, дозируемые количества 0.1–0.2 мкл, деление потока при вводе проб 1 : 6.
Характеризуемые соединения дозировали в виде растворов в ацетоне (концентрация 1–3%) с добавками сопоставимых количеств 3–4 реперных н-алканов, так чтобы 1–2 из них имели меньшие по сравнению с целевым аналитом времена удерживания, а два остальных – большие. Кратность измерений 2–5 с последующим усреднением времен удерживания реперных н-алканов. Хроматограммы обрабатывали и хранили в ПО NetChrom.
Обработка результатов. Все ениновые спирты характеризовали линейно-логарифмическими индексами удерживания RI [19], вычисленными для всех значений их времен удерживания для характеристики воспроизводимости:
(1)
$\begin{gathered} {\text{R}}{{{\text{I}}}_{х}} = {\text{R}}{{{\text{I}}}_{n}} + \left( {{\text{R}}{{{\text{I}}}_{{n{\text{ + }}k}}}--{\text{ R}}{{{\text{I}}}_{n}}} \right) \times \\ \times \,\,{{\left[ {f\left( {{{t}_{{{\text{R,}}x}}}} \right)--f\left( {{{t}_{{{\text{R,}}n}}}} \right)} \right]} \mathord{\left/ {\vphantom {{\left[ {f\left( {{{t}_{{{\text{R,}}x}}}} \right)--f\left( {{{t}_{{{\text{R,}}n}}}} \right)} \right]} {\left[ {f\left( {{{t}_{{{\text{R}},n{\text{ + }}k}}}} \right)--f\left( {{{t}_{{{\text{R,}}n}}}} \right)} \right]}}} \right. \kern-0em} {\left[ {f\left( {{{t}_{{{\text{R}},n{\text{ + }}k}}}} \right)--f\left( {{{t}_{{{\text{R,}}n}}}} \right)} \right]}}, \\ \end{gathered} $Для вычислений индексов удерживания использовали программу QBasic. Заметим, что в выбранном режиме программирования абсолютные значения коэффициента q невелики, так что значения линейно-логарифмических индексов близки к линейным индексам, вычисление которых проще. Для усреднения результатов использовали ПО Microsoft Excel 2010 и Origin (версии 4.1 и 8.1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Гомологические инкременты газохроматографических индексов удерживания алифатических ениновых спиртов. В табл. 3 приведены индексы удерживания 16 алифатических ениновых спиртов, расположенных в порядке увеличения их молекулярных массовых чисел от 82 до 194 (5 ≤ nС ≤ 13), и (во второй части таблицы) шести спиртов, содержащих иные структурные фрагменты (фенильный, триалкилсилильные и 2-фурильный заместители). В таблицу дополнительно включены два соединения, для которых известны значения RI: 6-метил-6-гептен-5-ин-2-ол и 3,7-диметил-6-октен-1-ин-3-ол (дегидролиналоол). Бóльшая часть соединений, перечисленных в первой части табл. 3 (14 из 16), представляют собой вторичные спирты, содержащие фрагмент >CH−OH; исключениями являются только 3-метил-1-октен-4-ин-3-ол и дегидролиналоол с гидроксильными группами при третичных атомах углерода (или, иначе, имеющих дополнительные разветвления sp3-углеродного скелета молекул, далее обозначаемые символом Z). Принимая во внимание закономерности газохроматографического удерживания соединений других классов (прежде всего, первичных, вторичных и третичных алканолов), такие изомеры имеют меньшие индексы удерживания и должны быть отнесены в самостоятельные группы. Разветвления углеродного скелета молекул в стерически жестких фрагментах структуры (в том числе при двойных связях С=С) проявляются в существенно меньших вариациях индексов.
Таблица 3.
Индексы удерживания ениновых спиртов RC≡C−CR′(OH)CH=CHR′′ и RC≡C−CH=CH−CH(OH)CH3 на неполярной полидиметилсилоксановой неподвижной фазе и их гомологические инкременты
| Молекулярная формула (№ в табл. 1 и 2) | М | Соединение | RI | iRI |
|---|---|---|---|---|
| Алифатические ениновые спирты | ||||
| С5Н6О (I) | 82 | 1-Пентен-4-ин-3-ол | 680 ± 1 | 180 |
| С6Н8О (II) | 96 | (Е)-2-Гексен-5-ин-4-ол | 802 ± 2 | 202 |
| С6Н8О (III) | 96 | 1-Гексен-4-ин-3-ол | 836 ± 1 | 236 |
| С6Н8О (Z-XVII) | 96 | (Z)-3-Гексен-5-ин-2-ол* | 782 ± 2 | 182 |
| С6Н8О (E-XVII) | 96 | (E)-3-Гексен-5-ин-2-ол* | 823 ± 1 | 223 |
| С7Н10О (IV) | 110 | (Е)-2-Гептен-5-ин-4-ол | 956 ± 2 | 256 |
| С7Н10О (Z-XVIII) | 110 | (Z)-3-Гептен-5-ин-2-ол* | 933 ± 2 | 233 |
| С7Н10О (E-XVIII) | 110 | (E)-3-Гептен-5-ин-2-ол* | 988 ± 1 | 288 |
| С8Н12О (VI) | 124 | 1-Октен-4-ин-3-ол | 1004 ± 1 | 204 |
| С8Н12О (–) | 124 | 6-Метил-6-гептен-4-ин-3-ол* | 972** | 172 |
| С9Н14О (IX) | 138 | (Е)-2-Нонен-5-ин-4-ол | 1123 ± 1 | 223 |
| С9Н14О (VIII) | 138 | 1-Нонен-4-ин-3-ол | 1106 ± 1 | 206 |
| С9Н14О (V) | 138 | 3-Метил-1-октен-4-ин-3-ол (+1)*** | 1001 ± 1 | 101 |
| С10Н16О (X) | 152 | (Е)-2-Децен-5-ин-4-ол | 1228 ± 1 | 228 |
| С10Н16О (–) | 152 | 3,7-Диметил-6-октен-1-ин-3-ол (дегидролиналоол) (+1)*** | 1124 ± 9 | 124 |
| С13Н22О (XIII) | 194 | 1-Тридецен-4-ин-3-ол | 1488 ± 3 | 188 |
| Среднее значение для втор-алкенинолов, N = 14: | 216 ± 32 | |||
| Среднее значение для трет-алкенинолов (Z + 1), N = 2: | 112 ± 16 | |||
| Ениновые спирты, содержащие иные структурные фрагменты | ||||
| С11Н10О (XII) | 158 | 5-Фенил-1-пентен-4-ин-3-ол | 1380 ± 3 | 280 |
| С11Н10О (XI) | 158 | (Е)-1-Фенил-1-пентен-4-ин-3-ол | 1402 ± 2 | 302 |
| C8H14OSi (VIII) | 154 | 5-Триметилсилил-1-пентен-4-ин-3-ол | 1007 ±2 | –93 |
| С14Н18OSi (XI) | 218 | (Е)-1-Фенил-5-триметилсилил-1-пентен-4-ин-3-ол | 1712 ± 3 | 212 |
| С12Н16О2Si (XIV) | 220 | (Е)-1-(2-Фурил)-5-триметилсилил-1-пентен-4-ин-3-ол | 1553 ± 3 | 53 |
| C17H24OSi (XVI) | 272 | (Е)-5-Триэтилсилил-1-фенил-1-пентен-4-ин-3-ол | 2036 ± 4 | 136 |
Значения RI алифатических ениновых спиртов варьируют от 680 приблизительно до 1490, однако их непосредственное рассмотрение с целью сопоставления со структурами молекул нерационально. Для этого необходимы дополнительные преобразования индексов, например, к форме так называемых гомологических инкрементов, iRI. Гомологические инкременты аддитивных свойств (А) были введены для представления хроматографических данных при их совместной интерпретации с масс-спектрами в хромато-масс-спектрометрии [20]:
где х – целое частное от деления молекулярного массового числа M на 14, x = int(M/14) (14 – массовое число гомологической разности), ΔA(CH2) – инкремент свойства А для гомологической разности СН2.Подобное преобразование значений различных свойств в гомологические инкременты устраняет их зависимость от положения гомологов в гомологических рядах (от числа атомов углерода в молекуле), тогда как влияние природы функциональных групп и особенностей структуры сохраняется. Следовательно, значения iRI после соответствующей статистической обработки характеризуют уже не отдельные гомологи, а ряды в целом.
Если для газохроматографических индексов удерживания гомологов принять такое “естественное” условие, как ΔRI(CH2) ≈ 100, то выражение (2) может быть преобразовано к следующему простому соотношению:
Иногда, например, в обращенно-фазовой ВЭЖХ используют отличные от 100 оценки ΔRI(CH2) ≠ 100.
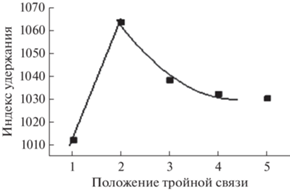
Значения iRI для всех охарактеризованных ениновых спиртов также приведены в табл. 3. Их вариации достаточно велики (от 172 до 288), что обусловлено влиянием сразу нескольких факторов. Во-первых, структурные фрагменты С−С≡СН или С−С≡С−С при тройных связях С≡С (иначе – при sp-гибридизованных атомах углерода) – жесткие (линейные), что проявляется в увеличении температур кипения и газохроматографических индексов удерживания содержащих такие фрагменты соединений (по сравнению с изомерами). Вариации RI для изомеров других рядов с разным положением связей С≡С достаточно велики (например, для изомерных н-децинов они превышают 50 ед. индекса), а сами зависимости оказываются достаточно сложными [21]. Для их иллюстрации на рис. 1 представлены вариации индексов удерживания н-децинов в зависимости от положения тройной связи С≡С (по данным [1]), для которых, как и для остальных н-алкинов максимальные значения RI наблюдаются для 2-изомеров.
Рис. 1.
Зависимость индексов удерживания изомерных н-децинов от положения тройной связи в молекуле (по данным [15]).
Для иллюстрации этой же структурной особенности весьма показательны различия не только индексов удерживания, но и соответственно гомологических инкрементов (Z) и (Е)-изомеров 3-гексен-5-ин-2-ола и 3-гептен-5-ин-2-ола. Значения RI изомеров первого спирта составляют 782 и 823, тогда как второго (всего на метиленовую группу больше) – 933 и 988 (увеличение индексов составляет 151 и 165 ед.). Причина этой аномалии в том, что в молекуле первого спирта жесткий фрагмент структуры содержит четыре атома углерода (HC≡C−CH=CH−), тогда как второго – пять (CH3−C≡C−CH=CH−). Отнесение (Z) и (E)-изомеров в смесях (соединения XVII и XVIII) проведено на основании спектров ПМР, причем их соотношения согласуются с газохроматографическими данными.
На “уровне” гомологических инкрементов индексов удерживания более простых структурных аналогов эту особенность можно представить следующим образом. Оценка значений iRI для терминальных алкинов составляет 109 ± 13 (при наличии дополнительного разветвления углеродного скелета она уменьшается до 64 ± 10), а для нетерминальных алкинов она равна 158 ± 18 (вычислено по данным [1]).
Во-вторых, к увеличению значений RI может приводить сопряжение связей С≡С и С=С; максимальное значение iRI = 288 принадлежит именно такому изомеру – (Е)-3-гептен-5-ин-2-олу. И, наконец, для алифатических ениновых спиртов характерны аномально большие различия индексов (E) и (Z)-изомеров. Для пары изомерных 3-гексен-5-ин-2-олов они составляют 41, а для 3-гептен-5-ин-2-олов – 55 ед. индекса. Для сравнения, различие RI(Z) и (E)-4-октенов составляет всего 4, а 3-октенов – 2 ед. индекса [1]. В результате совместного проявления всех перечисленных факторов стандартное отклонение среднего значения iRI алифатических енинолов оказывается довольно большим: 216 ± 32. Уменьшение неопределенности подобных оценок возможно только в результате более подробной структурной классификации рассматриваемых соединений, однако этому препятствует сравнительно небольшое число объектов (N = 14), что делает их дальнейшее разделение на подгруппы нерациональным.
Выше отмечено, что два ениновых спирта из перечисленных в табл. 1 гомологов (3-метил-1-октен-4-ин-3-ол и дегидролиналоол) содержат третичные гидроксильные группы. Подобный структурный фрагмент проявляется в существенном уменьшении значений iRI до 101 и 124. Их можно охарактеризовать средним значением (112 ± 16), однако из-за малого числа объектов эту оценку следует рассматривать исключительно как предварительную. Шесть соединений в заключительной части табл. 1 содержат дополнительное функциональные группы (фенильный, триалкилсилильные и 2-фурильный заместители). Из них специальных комментариев заслуживают только фенилзамещенные ениновые спирты, для которых можно выявить элементы аддитивности индексов удерживания относительно алифатических соединений этого класса. Данные базы [1] позволяют охарактеризовать инкремент замещения атома водорода при связях С≡С и С=С фенильным фрагментом С6Н5 (676 ± 35). Как отмечено выше, уменьшение стандартного отклонения этой средней величины возможно только в результате более детальной классификации структур молекул. Тогда, исходя из индекса удерживания 1-пентен-4-ин-3-ола (680 ± 1), можно оценить значения RI 5-фенил-1-пентен-4-ин-3-ола и 1-фенил-1-пентен-4-ин-3-ола: 680 + + (676 ± 35) ≈ 1356 ± 35 (экспериментальные величины 1380 и 1402).
Сравнение гомологических инкрементов газохроматографических индексов удерживания структурных аналогов. Важной особенностью гомологических инкрементов индексов удерживания, которую необходимо учитывать при сравнении данных для структурных аналогов, является “скачок” в 100 ед. индекса при переходе номеров гомологических групп таких аналогов (у) через значение у = 0. Номера гомологических групп у были введены одновременно с параметрами х как вычеты массовых чисел ионов (здесь рассматриваем только молекулярные массовые числа) по модулю 14 [20]:
Все многообразие органических соединений по значениям у можно классифицировать на 14 гомологических групп, 0 ≤ у ≤ 13 [14]. Допустим, мы сравниваем соединения различной формальной непредельности, например, с молекулярными формулами последовательности CnH2n+kX → → CnH2n+k–2X → CnH2n+k–4X → …. Если номера гомологических групп молекулярных массовых чисел “пересекают” значение у = 0, то величина х скачкообразно уменьшается на единицу. Учитывая важность этой особенности параметров х, ее целесообразно рассмотреть подробнее, например, для последовательности молекулярных формул CnH2n+2O → CnH2nO → CnH2n–2O → CnH2n–4O →…, что иллюстрируют данные табл. 4.
Таблица 4.
Иллюстрация изменения соотношения между гомологическими инкрементами индексов удерживания и числом атомов углерода в молекуле в последовательности соединений различной формальной непредельности при переходе через граничное значение у = 0
| Молекулярная формула |
CnH2n+ 2O | CnH2nO | CnH2n–2O | CnH2n– 4O | CnH2n – 6O |
|---|---|---|---|---|---|
| y ≡ M(mod14) | 4 | 2 | 0 | 12 | 10 |
| Формальная непредельность | 0 | 1 | 2 | 3 | 4 |
| n = f(x) | n = x – 1 | n = x | |||
| Соотношение iRI = f(n), приведенное к единой шкале | iRI = RI – 100(n + 1) | iRI = RI – 100n | |||
Все соединения, относящиеся к первым трем молекулярным формулам этой последовательности (CnH2n+2O, CnH2nO и CnH2n–2O) и, следовательно, принадлежащие к гомологическим группам 4, 2 и 0 соответственно, характеризуются одинаковым соотношением, связывающим значения параметра х (определяются непосредственно из значений М) и число атомов углерода в молекуле, а именно n = x – 1. В справочных таблицах руководства [20] подобные соотношения приведены для различных молекулярных формул. Однако при переходе к соединениям с молекулярной формулой CnH2n–4O и, следовательно, при увеличении ФН до 3, это соотношение трансформируется в n = x. Это означает, что в первых трех случаях связь гомологических инкрементов индексов удерживания с числом атомов углерода в молекуле имеет вид iRI = RI – 100(n + 1), тогда как в последнем оно иное: iRI = RI – 100n. Следовательно, для обеспечения возможности сравнения соединений с различными молекулярными формулами между собой последнюю из величин iRI необходимо скорректировать на (−100) ед. индекса. При уменьшении формальной непредельности, т.е. в последовательности молекулярных формул в направлении увеличения значений у при “пересечении” границы у = 13 → у = 0, для обеспечения возможности такого сравнения к значениям iRI нужно прибавить 100. Необходимость применения этого правила возникает при сравнении гомологических инкрементов индексов удерживания характеризуемых алифатических ениновых спиртов с данными для их структурных аналогов, результаты которого представлены в табл. 5.
Таблица 5.
Сравнение алифатических ениновых спиртов и некоторых их структурных аналогов по значениям гомологических инкрементов индексов удерживания
| Группа гомологов, ссылка |
nC = f(x) | Z | Диапазон nC | Число соединений | iRI ± si(RI) |
|---|---|---|---|---|---|
| втор-Алканолы [1] | x – 1 | 0 | С3–С7 | 9 | 85 ± 4 |
| 1 | С4–С7 | 7 | 53 ± 19 | ||
| трет-Алканолы [1] | 0 | С4–С8 | 11 | 24 ± 13 | |
| втор-Алкенолы [1] | x – 1 | 0 | С4–С7 | 11 | 63 ± 15 |
| трет-Алкенолы [1] | 0 | С5–С6 | 2 | 24 ± 32 | |
| втор-Алкинолы [2] | x – 1 | 0, 1 | С4–С10 | 11 | 111 ± 25 |
| трет-Алкинолы [2] | 1, >1 | С5–С10 | 10 | 23 ± 21 | |
| втор-Алкенинолы (данная работа) | x | 1, >1 | C3–C13 | 14 | 216 ± 32 |
| [116 ± 32]* | |||||
| трет-Алкенинолы (данная работа) | 0, 1 | C9–C10 | 2 | 112 ± 16 | |
| [12 ± 16]* |
В этой таблице обращают на себя внимание сразу несколько примеров хорошего совпадения значений iRI ± si(RI). Прежде всего, они закономерно близки для втор-алканолов (85 ± 4) и втор-алкенолов (63 ± 15). Вторую подобную пару образуют втор-алкинолы (111 ± 25) и впервые охарактеризованные в данной работе вторичные алкениновые спирты (116 ± 32). Заметим, что в последнем случае сравнение как раз и предполагает использование обсуждавшейся выше поправки (−100 ед. инд.). Увеличение значений iRI ± si(RI) при наличии связей С≡С в молекулах обусловлено отмеченной выше жесткостью фрагментов С−С≡С−С или С−С≡СН. И, наконец, присутствие третичных гидроксильных групп проявляется в практическом совпадении гомологических инкрементов индексов удерживания всех алифатических спиртов с различными значениями ФН, перечисленных в табл. 3: трет-алканолов (24 ± 13), трет-алкенолов (24 ± 32), трет-алкинолов (23 ± 21) и трет-алкенинолов (12 ± 16). Последняя величина, как и для вторичных спиртов этой же группы, получена с учетом поправки (−100 ед. индекса) для сравнения со спиртами другой непредельности.
Подобное совпадение аналитических характеристик различных соединений, во-первых, представляет интерес как важная закономерность, которой подчиняются газохроматографические параметры удерживания структурных аналогов с одинаковыми функциональными группами, но различающихся формальной непредельностью. Во-вторых, это условие фактически представляет собой важный критерий проверки правильности результатов для впервые характеризуемых классов соединений, не требующий сложных вычислений, а основанный на сопоставлении данных для структурных аналогов.
Авторы благодарят К.В. Гордона (Тольяттинский государственный университет) за выполнение элементных анализов.
Список литературы
The NIST Mass Spectral Library (NIST/EPA/NIH EI MS Library, 2017 Release). Software/Data Version; NIST Standard Reference Database, Number 69, August 2017. National Institute of Standards and Technology, Gaithersburg, MD 20899: http://webbook.nist.gov (дата обращения: март 2022 г.).
Арцыбашева Ю.П., Зенкевич И.Г. Хроматографическая характеристика α-алкинолов // Журн. общей химии. 2014. Т. 84. № 3. С. 391. https://doi.org/10.1134/S1070363214030074
Ротару К.И., Зенкевич И.Г., Костиков Р.Р. Хроматомасс-спектрометрическая характеристика монозамещенных гидразонов этилового эфира глиоксалевой кислоты // Масс-спектрометрия. 2015. Т. 12. № 4. С. 73. (Rotaru K.I., Zenkevich I.G., Kostikov R.R. GC/MS Characterization of monosubstituted hydrazones of glyoxylic acid ethyl esters // J. Anal. Chem. 2016. V. 71. № 14. P. 1377.)https://doi.org/10.1134/S1061934816140136
Zenkevich I.G., Nosova V.E. Comparative gas chromatographic/mass spectrometric characterization of di- and trialkyl phosphites // Rapid Commun. Mass Spectrom. 2019. V. 33. № 16. P. 1324. https://doi.org/10.1002/rcm.8473
Зенкевич И.Г., Лукина В.М. Хроматомасс-спектрометрическая характеристика диэтилкеталей алифатических карбонильных соединений // Аналитика и контроль. 2019. Т. 23. № 3. С. 410. https://doi.org/10.15826/analitika.2019.23.3.009
Зенкевич И.Г., Носова В.Е. Газохроматографические индексы удерживания в хроматомасс-спектрометрической идентификации алкилдихлорфосфатов, диалкилхлорфосфатов и их тиоаналогов // Масс-спектрометрия. 2019. Т. 16. № 1. С. 58. (Zenkevich I.G., Nosova V.E. Gas chromatographic retention indices in GC/MS identification of alkyldichlorophosphates, dialkylchlorophosphates, and their thio analogues // J. Anal. Chem. 2019. V. 74. № 14. P. 1421. https://doi.org/10.1134/S106193481914012010.1134/S1061934819140120)https://doi.org/10.25703/MS.2019.16.18
Елисеенков Е.В., Зенкевич И.Г. Хроматомасс-спектрометрическая характеристика замещенных 1,3-диоксоланов и 1,3-диоксанов // Масс-спектрометрия. 2020. Т. 176. № 1. С. 48. (Eliseenkov E.V., Zenkevich I.G. Characterization of substituted 1,3-dioxolanes and 1,3-dioxanes by gas chromatography – mass spectrometry // J. Anal. Chem. 2020. V. 75. № 14. P. 1790. https://doi.org/10.1134/S106193482014008710.1134/S1061934820140087)https://doi.org/10.25703/NS.2020.17.15
Зенкевич И.Г., Елисеенков Е.В. Принципы контроля правильности газохроматографических индексов удерживания ранее не охарактеризованных аналитов (на примере 2-арил-1,3-диоксоланов и -1,3-диоксанов) // Журн. аналит. химии. 2020. Т. 75. № 12. С. 1129. (Zenkevich I.G., Eliseenkov E.V. Principles of controlling the correctness of gas-chromatographic retention indices of previously uncharacterized analytes (based on an example of 2-aryl-1,3-dioxolanes and 2-aryl-1,3-dioxanes) // J. Anal. Chem. 2020. V. 75. № 12. P. 1608. https://doi.org/10.1134/S106193482012010.1134/S1061934820120https://doi.org/10.31857/S0044450220120154
Macak J., Nabivach V., Buryan P, Sindler J. Dependence of retention indices of alkylbenzenes on their molecular structures // J. Chromatogr. A. 1982. V. 234. P. 285. https://doi.org/10.1016/S0021-967(00)81867-1
Shivashankar S., Roy T.K., Moorthy P.N.R. Headspace solid phase microextraction and GC/MS analysis of the volatile components in seed and cake of Azadirachata indica A. juss // Chem. Bull “Politechnika”, Timisoara, Romania. 2012. V. 57 (71). № 1. P. 1.
Nivinslien R., Gudalevic A., Mockute D., Meskaskiene V., Grigalinnaite B. Influence of urban environment on chemical composition of Tilia cordata essential oil // Chemija. 2007. V. 18. № 1. P. 44.
Moldao-Martin M., Beirao-da-Costa S., Neves C., Cavaleiros C., Salqueiro L., Beirao-da-Costa M.L. // Olive oil flavored by the essential oil of Mentha piperita and Thymus mastichina L. // Food Qual. Pref. 2004. V. 15. P. 447.
Brandsma L. Synthesis of Acetylenes, Allenes and Cumulenes: Methods and Techniques. Amsterdam: Elsevier, 2004. 469 p.
Jones E.R.H., McCombie J.T. Studies in the polyene. Part VI. The preparation of ethinylcarbinols from α,β-unsaturated aldehydes // J. Chem. Soc. 1942. P. 733.
Golovanov A.A., Odin I.S., Gusev D.M., Vologzhanina A.V., Sosnin I.M., Grabovskiy S.A. Reactivity of cross-conjugated enynones in cyclocondensations with hydrazines: Synthesis of pyrazoles and pyrazolines // J. Org. Chem. 2021. V. 86. № 10. P. 7229. https://doi.org/10.1021/acs.joc.1c00569
Skattebøl L., Jones E.R.H., Whiting M.C. 1-Phenyl-1-penten-4-yn-3-ol // Org. Synth. 1959. V. 39. № 10. P. 56.
Landgreb J.A., Rynbrandt R.H. Synthesis of o-, m-, and p-ethynylbenzyl chloride and closely related structures. The electronic nature of the acetylene group // J. Org. Chem. 1966. V. 31. № 8. P. 2585.
Климова В.А. Основные микрометоды анализа органических соединений. М.: Химия, 1975. С. 51.
Kovats’retention index system / Encyclopedia of Chromatography / Ed. J. Cazes. J. 3rd Ed. Boca Raton: CRC Press (Taylor & Francis Group), 2010. P. 1304.
Зенкевич И.Г., Иоффе Б.В. Интерпретация масс-спектров органических соединений. Л.: Химия, 1986. 176 с.
Kuningas K., Rang S., Kailas T. Relationships between the structure and retention of n-alkenes and n-alkynes on silicone phases // J. Chromatogr. 1990. V. 520. P. 137. https://doi.org/10.1016/0021-9673(90)85094-C
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


