Журнал аналитической химии, 2023, T. 78, № 2, стр. 166-175
Об устойчивости незамещенных гидразонов ароматических карбонильных соединений к гидролизу в условиях обращенно-фазовой ВЭЖХ
А. Деруиш a, Г. В. Каракашев b, А. И. Уколов b, И. Г. Зенкевич a, *
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
b Научно-исследовательский институт гигиены, профпатологии и экологии человека
Федерального медико-биологического агентства России
188663 Ленинградская обл., г.п. Кузьмоловский, ст. Капитолово 93, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 30.06.2022
После доработки 14.07.2022
Принята к публикации 14.07.2022
- EDN: CEGSOJ
- DOI: 10.31857/S0044450223020032
Аннотация
Соединения ряда незамещенных гидразонов RR′C=NNH2 отличаются нестабильностью в ходе газохроматографического разделения. Проверка их устойчивости к гидролизу в условиях обращенно-фазовой ВЭЖХ показала, что гидразоны ароматических кетонов стабильны. В отличие от них, гидразоны альдегидов оказались стабильными в системах метанол–вода при их нейтральной реакции (при отсутствии кислых модификаторов). В системах же ацетонитрил–вода, содержащих 0.1% муравьиной кислоты, стабильны только гидразоны ароматических кетонов, тогда как производные альдегидов полностью гидролизуются. Эту особенность необходимо принимать во внимание при определении других соединений этого класса. Для выявления гидролиза аналитов сопоставлены индексы удерживания исходных карбонильных соединений и гидразонов при разных соотношениях объемов органических модификаторов и водных фаз и различных значениях рН элюента, относительные оптические плотности характеризуемых компонентов A(254/220) = А(254)/А(220), а также данные хромато-масс-спектрометрического анализа.
Нестабильность химических соединений осложняет многие экспериментальные операции с ними. Для подобных объектов надежные значения аналитических параметров часто отсутствуют, что затрудняет их идентификацию. С другой стороны, именно отсутствие справочной информации является одним из признаков нестабильности аналитов. Помимо нестабильности исходных образцов (взаимодействие компонентов анализируемых проб между собой), возможности хроматографического анализа дополнительно ограничены нестабильностью аналитов в процессе их хроматографического разделения [1]. В газовой хроматографии основной причиной является термическое разложение аналитов, а в высокоэффективной жидкостной хроматографии (ВЭЖХ) – их гидролиз. Поскольку этими факторами обусловлена значительная часть ошибок и парадоксов интерпретации результатов [2], подобные примеры, несомненно, заслуживают специального рассмотрения.
Нестабильность присуща даже относительно несложным соединениям, например незамещенным гидразонам алифатических и ароматических альдегидов и кетонов (RR'C=N–NH2). Такие гидразоны синтетически легко доступны и образуются при взаимодействии карбонильных соединений с гидразином (или гидразин-гидратом). При избытке карбонильных соединений становится значимым параллельное образование азинов (схема 1 ):
Схема 1 . Взаимодействие карбонильных соединений с гидразином.
Соединения этого класса хорошо известны и являются, например, промежуточными продуктами при восстановлении карбонильных соединений гидразин-гидратом до изоструктурных углеводородов (реакция Кижнера–Вольфа) [3–5]. Однако в базе NIST [6], как ни удивительно, содержатся сведения лишь об одном из простейших представителей этого класса – гидразоне ацетона. Известно всего одно значение его газохроматографического индекса удерживания на стандартных неполярных полидиметилсилоксановых неподвижных фазах, определенное с большой погрешностью (700 ± 24). Если же обратить внимание на доступные справочные значения нормальной температуры кипения этого гидразона (по разным данным они составляют 124−125, 114−116, 122−126, 128−131, 110.5°С и т.п.), то их значительный разброс свидетельствует о термической нестабильности этого соединения. Даже в процессе хранения при комнатной температуре незамещенные гидразоны постепенно превращаются в более стабильные азины. Поэтому неудивительно, что проверка возможностей газохроматографического разделения как алифатических, так и ароматических соединений этого класса подтвердила их разложение в хроматографической колонке [7]. Примечательно, что этот процесс, в отличие от большинства других примеров термической деструкции аналитов, представляет собой бимолекулярную реакцию второго порядка, а образующийся при этом гидразин способен вступать во вторичные взаимодействия с другими компонентами анализируемых образцов (схема 2 ):
Схема 2 . Схема разложения незамещенных гидразонов с образованием азинов.
Результатом протекания подобных процессов оказывается искажение формы хроматографических пиков и аномальные контуры хроматограмм. Если компонент А превращается в компонент Б (или наоборот), то между их пиками может регистрироваться размытая зона Z (“шлейф”, “плато” и т.п.), как это условно изображено на рис. 1. Аналогичный вид имеют хроматограммы соединений, способных к таутомерным превращениям в ходе хроматографического разделения [8].
Рис. 1.
Схематическое изображение хроматограммы аналитов, нестабильных в условиях хроматографического разделения. Регистрация размытой зоны Z (“шлейф”, “плато” и т.п.) между пиками свидетельствует о том, что компонент А превращается в компонент Б (или наоборот) в хроматографической колонке.
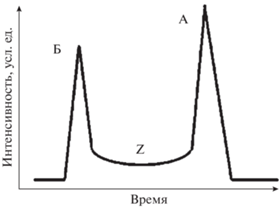
Подобные профили хроматограмм нестабильных в условиях разделения аналитов сходны как в газовой хроматографии, так и в обращенно-фазовой ВЭЖХ. Как правило, продукты разложения А → Б имеют меньшие параметры удер-живания, tR(Б) < tR(А). Однако для бимолекулярной реакции Б → А (схема 2 ) более сложные продукты бимолекулярных реакций могут иметь большие параметры удерживания. Регистрация масс-спектров в различных точках диффузных зон Z (рис. 1) [1] показывает, что они могут быть образованы либо только продуктами разложения Б, либо обоими компонентами А и Б в переменных соотношениях. Оценка температурных диапазонов термической стабильности аналитов в ходе хроматографического разделения на основании их температур кипения при атмосферном давлении без разложения [9] показывает, что даже для простейших незамещенных гидразонов это условие не выполняется.
Таким образом, принципиальная невозможность газохроматографического разделения незамещенных гидразонов (I) заставляет проверить применимость для этих целей обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ), что и является задачей настоящей работы. Необходимым условием УФ-детектирования аналитов в этом варианте разделения является наличие хромофора в молекуле, поэтому рассмотрение ограничено только гидразонами ароматических карбонильных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты, растворители. В работе использовали гидразин-гидрат (99%, Ленреактив) и следующие карбонильные соединения: п-метилбензальдегид х. ч. (Реахим, Москва), ацетофенон, пропиофенон, бутирофенон (Sigma-Aldrich Rus LLC, Россия), п-метилацетофенон х. ч. (Реахим, Москва). Реакцию карбонильных соединений (100 мкл или ∼100 мг) с гидразин-гидратом (1 мл) для гомогенизации реакционных смесей проводили в смеси с 1 мл изопропилового спирта х. ч. (Криохром, Санкт-Петербург). Для предотвращения образования азинов (схема 1 ) мольный избыток гидразин-гидрата составлял приблизительно 25–30. Далее анализировали реакционные смеси, которые предварительно смешивали с элюентом в соотношении 1 : 100. В случае альдегидов, легко окисляющихся в присутствии кислорода атмосферного воздуха, реакционные смеси обычно содержали некоторые количества соответствующих карбоновых кислот, имеющих меньшие параметры удерживания. Для приготовления элюентов для ВЭЖХ использовали метанол х. ч. (Криохром, Санкт-Петербург) и деионизованную воду (удельное сопротивление 18.2 МОм ⋅ см) с добавкой 0.1% муравьиной кислоты (98% “для анализа”, PanReac, Испания).
Условия хроматографического анализа. Времена удерживания выбранных соединений в различных изократических режимах определяли на жидкостном хроматографе Shimadzu LC-20 Prominence с диодно-матричным детектором и колонкой Phenomenex C18 длиной 250 мм, внутренним диаметром 4.6 мм и размером частиц сорбента 5 мкм. Образцы анализировали в нескольких режимах изократического элюирования. Расход элюента 1.0 мл/мин, температура колонки 30°C. Пробы дозировали с использованием автосамплера SIL-20A/AC, объем проб 20 мкл, число параллельных дозирований каждой из них – два. Для определения индексов удерживания во все образцы добавляли смесь трех реперных н-алкилфенилкетонов C6H5COCnH2n+1 c n = 1−3. Для всех аналитов вычисляли относительные оптические плотности при 254 и 220 нм, A(254/220) = = А(254)/А(220).
Условия хромато-масс-спектрометрического анализа. Анализ проводили на жидкостном хроматографе UltiMate 3000 (Thermo, США) с масс-спектрометрическим детектором QExactive (Thermo, США) с орбитальной ловушкой и колонкой ZorbaxSB-C18 длиной 50 мм, внутренним диаметром 4.6 мм и размером частиц сорбента 1.8 мкм. Использовали градиентное элюирование смесью 0.1%-ного водного раствора муравьиной кислоты (фаза А) и ацетонитрила (фаза Б): 20% Б (0–0.5 мин), 15 – 90% Б (0.5–8 мин) 90% Б (8–10 мин) и 20% Б (10.1–14 мин); для элюента такого состава рН ≈ ≈ 2.7. Расход элюента 0.4 мкл/мин, объем проб 1 мкл. Условия электрораспылительной ионизации с регистрацией положительно заряженных ионов: температура проводящего капилляра 380°С, температура распыляющего капилляра 300°С, расход газа-осушителя 45 усл. ед., расход вспомогательного газа 20 усл. ед., напряжение на капилляре 3.5 кВ.
Обработка результатов. В условиях изократического элюирования гидразоны характеризовали логарифмическими индексами удерживания [10]:
(1)
$\begin{gathered} {\text{R}}{{{\text{I}}}_{х}}~ = ~\,\,{\text{R}}{{{\text{I}}}_{n}} + \left( {{\text{R}}{{{\text{I}}}_{{n + k}}}--{\text{R}}{{{\text{I}}}_{n}}} \right) \times \\ \times \,\,{{\left[ {{\text{lg}}\left( {{{t}_{{{\text{R}},x}}}} \right) - {\text{lg}}\left( {{{t}_{{{\text{R}},n}}}} \right)} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{lg}}\left( {{{t}_{{{\text{R}},x}}}} \right) - {\text{lg}}\left( {{{t}_{{{\text{R}},n}}}} \right)} \right]} {\left[ {{\text{lg}}\left( {{{t}_{{{\text{R}},n + k}}}} \right)--{\text{lg}}\left( {{{t}_{{{\text{R}},n}}}} \right)} \right]}}} \right. \kern-0em} {\left[ {{\text{lg}}\left( {{{t}_{{{\text{R}},n + k}}}} \right)--{\text{lg}}\left( {{{t}_{{{\text{R}},n}}}} \right)} \right]}}, \\ \end{gathered} $Необходимые для вычисления логарифмических индексов удерживания времена удерживания несорбируемых компонентов (t0) оценивали по временам удерживания трех реперных н-алкилфенилкетонов по формуле Петерсона и Хирша [11]:
(2)
${{t}_{0}} \approx {{\left( {{{t}_{{{\text{R}},1}}}{{t}_{{{\text{R}},3}}}--t_{{{\text{R}},2}}^{2}} \right)} \mathord{\left/ {\vphantom {{\left( {{{t}_{{{\text{R}},1}}}{{t}_{{{\text{R}},3}}}--t_{{{\text{R}},2}}^{2}} \right)} {\left( {{{t}_{{{\text{R}},1}}} + {{t}_{{{\text{R}},3}}}--2{{t}_{{{\text{R}},2}}}} \right)}}} \right. \kern-0em} {\left( {{{t}_{{{\text{R}},1}}} + {{t}_{{{\text{R}},3}}}--2{{t}_{{{\text{R}},2}}}} \right)}}.$Для статистической обработки параметров удерживания использовали ПО Excel (Microsoft Office, 2010), а для построения графиков – ПО Origin (версия 4.1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Различные полифункциональные соединения, относящиеся к классу гидразонов, находят широкое применение, например, как лекарственные препараты [12–17]. Некоторые из замещенных гидразонов, значительно более устойчивых к гидролизу, чем незамещенные, рекомендованы как производные карбонильных соединений для их разделения и определения в ОФ ВЭЖХ [18, 19]. Чаще всего для этого используют 2,4-динитрофенилгидразоны [18–24]. Что же касается незамещенных гидразонов, то их характерным свойством является легкость гидролиза; по имеющимся оценкам [25] она в 102–103 раз выше, чем изоструктурных оксимов RR'C=NOH. Именно нестабильность незамещенных гидразонов при хранении в нашем случае определила природу анализируемых образцов: это непосредственно реакционные смеси соответствующих карбонильных соединений, содержащие большой избыток гидразин-гидрата.
Задача настоящей работы не предполагала характеристику большого количества аналитов, а заключалась, прежде всего, в выяснении стабильности простейших незамещенных гидразонов ароматических карбонильных соединений в условиях ОФ ВЭЖХ. Это позволило ограничить рассмотрение их сравнительно небольшим числом.
Гидразоны ароматических кетонов. В табл. 1 приведены аналитические данные для продуктов взаимодействия четырех ароматических кетонов с гидразин-гидратом I–IV, прежде всего, индексы удерживания продуктов, определенные в изократических режимах при содержании метанола в элюенте от 50 до 85 об. %. Кроме этого указаны диапазоны значений m/z, соответствующие молекулярным массам исходных соединений и ожидаемых гидразонов, что необходимо для их селективного масс-спектрометрического детектирования, а также отношения оптических плотностей A(254/220) = А(254)/А(220). Для сравнения приведены соответствующие относительные оптические плотности исходных карбонильных соединений и их индексы удерживания. Использование таких спектральных параметров повышает надежность и однозначность идентификации аналитов в ОФ ВЭЖХ. В ряде случае становится возможным их отнесение к соответствующим гомологическим рядам [26, 27].
Таблица 1.
Аналитические данные (индексы удерживания, значения m/z и относительные оптические плотности A(254/220)) для гидразонов некоторых алкиларилкетонов
| Характеристики аналита | с(CH3OH), об. % | Диапазон (m/z) ионов [M + H]+ |
Среднее значение A(254/220) | Значение A(254/220) исходного кетона | Индекс удержи-вания исходного кетона | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 55 | 60 | 65 | 70 | 75 | 80 | 85 | |||||
| Гидразон ацетофенона (I) | |||||||||||
| RI | 738 | 737 | 738 | 734 | 737 | 736 | 734 | 135.0896–135.0937 | 2.7 | 800 | |
| A(254/220) | 1.23 | 1.23 | 1.22 | 1.20 | 1.13 | 1.12 | 1.04 | 1.17 ± 0.07 | |||
| ΔRI = RIгидразон – RIкетон | –62 | –63 | –62 | –66 | –63 | –64 | –66 | ||||
| Гидразон п-метилацетофенона (II) | |||||||||||
| RI | 784 | 799 | 803 | 830 | 816 | – | – | 149.1051–149.1096 | – | 884* | |
| A(254/220) | 1.18 | 1.22 | 1.18 | 1.16 | 1.21 | 1.19 | 1.12 | 1.18 ± 0.03 | |||
| ΔRI = RIгидразон – RIкетон | –100 | –85 | –81 | –54 | –68 | – | – | ||||
| Гидразон пропиофенона (III) | |||||||||||
| RI | 795 | 808 | 819 | 830 | 820 | 840 | – | 149.1051–149.1095 | 2.3 | 900 | |
| A(254/220) | 1.33 | 1.16 | 1.13 | 1.03 | 1.10 | 1.07 | 1.09 | 1.13 ± 0.10 | |||
| ΔRI = RIгидразон – RIкетон | –105 | –92 | –81 | –70 | –80 | –60 | – | ||||
| Гидразон бутирофенона (IV) | |||||||||||
| RI | 875 | 885 | 894 | 901 | 890 | 905 | 939 | 163.1222–163.1238 | 2.7 | 1000 | |
| A(254/220) | 1.30 | 1.13 | 1.12 | 1.08 | 1.10 | 1.07 | 1.01 | 1.12 ± 0.09 | |||
| ΔRI = RIгидразон – RIкетон | –125 | –115 | –106 | –99 | –110 | –95 | –61 | ||||
| Среднее значение A(254/220): | 1.15 ± 0.03 | 2.6 ± 0.2 | |||||||||
| Среднее значение ΔRI = RIгидразон – RIкетон | –81 ± 21 | ||||||||||
Представленная в табл. 1 информация позволила установить следующее:
– Массовые числа ионов [M + H]+ главных компонентов реакционных смесей во всех случаях соответствуют массовым числам таких ионов для ожидаемых гидразонов ароматических кетонов I–IV;
– Регистрация масс-хроматограмм реакционных смесей по массовым числам ионов [M + H]+ исходных карбонильных соединений показала их отсутствие. Кроме того, хроматограммы по полному ионному току в диапазоне m/z 50–750 и результаты ВЭЖХ-анализа демонстрируют отсутствие в таких реакционных смесях детектируемых количеств азинов;
– Индексы удерживания регистрируемых компонентов всегда меньше индексов удерживания исходных кетонов и зависят от концентрации метанола в составе элюента. Среднее значение разности индексов удерживания гидразонов и исходных кетонов составляет −81 ± 21. Поскольку индексы удерживания в ОФ ВЭЖХ зависят от концентрации органического компонента элюента [28], дополнительно оценили коэффициенты dRI/dc, равные −0.11 ± 0.05 (I), 1.9 ± 0.6 (II), 1.6 ± 0.3 (III) и 1.6 ± 0.4 (IV);
– Относительные оптические плотности A(254/220) главных компонентов реакционных смесей составляют 1.15 ± 0.03 и статистически значимо отличаются от значений A(254/220) исходных алкиларилкетонов (2.6 ± 0.2).
– Различия в индексах удерживания и относительных оптических плотностях исходных кетонов и ожидаемых гидразонов подтверждают полноту взаимодействия кетонов с гидразин-гидратом. Кроме того, отсутствие хроматографических аномалий продуктов взаимодействия показывает, что такие гидразоны стабильны к гидролизу в условиях их разделения методом ОФ ВЭЖХ даже при слабокислой реакции водно-ацетонитрильного элюента (0.1% муравьиной кислоты).
Еще одним доводом в пользу образования гидразонов алкиларилкетонов является наличие на масс-хроматограммах реакционных смесей по массам ионов [M + H]+ гидразонов несимметричных карбонильных соединений (всех алкиларилкетонов) двух пиков с одинаковыми молекулярными массами, соответствующими син- (минорный компонент с меньшим временем удерживания) и анти-изомерам гидразонов. Подобное разделение син- и анти-изомеров ранее отмечено для 2,4-динитрофенилгидразонов несимметричных карбонильных соединений [29].
Поведение гидразонов замещенных бензальдегидов в условиях ВЭЖХ. Аналитические данные для продуктов взаимодействия трех ароматических альдегидов V–VII приведены в табл. 2. Интерпретировать хроматограммы таких реакционных смесей в условиях ОФ ВЭЖХ сложнее. Прежде всего, необходимо отметить известный факт [30], что альдегиды в реакциях с гидразинами более реакционноспособны по сравнению с кетонами, что означает возможность образования не только незамещенных гидразонов, но и соответствующих азинов (схема 1 ). Для более детальной характеристики общих особенностей поведения гидразонов альдегидов в условиях ОФ ВЭЖХ один пример целесообразно рассмотреть подробнее, а именно: результаты анализа реакционной смеси п-метилбензальдегида (V) с гидразин-гидратом, фрагмент хроматограммы которой по суммарному ионному току в диапазоне m/z 50–300 приведен на рис. 3а.
Рис. 2.
Фрагменты масс-хроматограмм гидразонов ацетофенона (а) и пропиофенона (б) по массовым числам ионов [M + H]+. Минорные пики с меньшими временами удерживания соответствуют син-изомерам, основные – анти-изомерам.
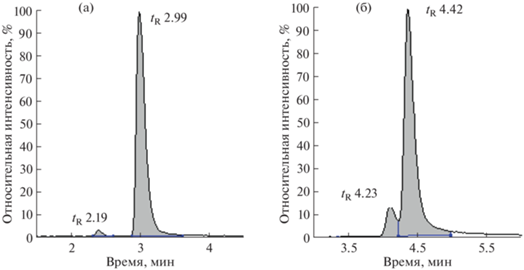
Таблица 2.
Аналитические данные (индексы удерживания и относительные оптические плотности A(254/220)) компонентов реакционных смесей некоторых замещенных бензальдегидов с гидразин-гидратом в сравнении с данными для исходных альдегидов
| Аналит и его характеристики | с(CH3OH), об. % | Среднее значение A(254/220) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | |||
| п-Метилбензальдегид* (А)** | RI | 870 | – | 874 | – | 879 | – | 884 | – | |
| A(254/220) | 2.36 | – | 2.01 | – | 2.02 | – | 1.97 | – | 2.09 ± 0.18 | |
| Гидразон п-метилбензальдегида (V) (Б) | RI | – | 719 | 720 | 720 | 721 | 724 | 724 | 722 | |
| A(254/220) | – | 1.22 | 1.17 | 1.16 | 1.21 | 1.19 | 1.32 | – | 1.21 ± 0.06 | |
| ΔRI = RIгидразон – RIальдегтд | –154 | –158 | –160 | |||||||
| о-Метилбензальдегид (А) | RI | 860 | – | 860 | – | 860 | – | 861 | – | |
| A(254/220) | 2.51 | – | 2.00 | – | 1.71 | – | 1.52 | – | 1.9 ± 0.4 | |
| Гидразон о-метилбензальдегида (VI) (Б) | RI | – | 728 | 724 | 721 | 717 | 716 | 712 | 710 | |
| A(254/220) | – | 0.63 | 0.63 | 0.59 | 0.62 | 0.60 | 0.53 | 0.63 | 0.63 ± 0.04 | |
| ΔRI = RIгидразон – RIальдегид | –136 | –143 | –149 | |||||||
| Среднее значение A(254/220) для альдегидов: | 2.0 ± 0.1 | |||||||||
| Среднее значение A(254/220) для гидразонов: | 0.9 ± 0.4 | |||||||||
| о-Гидроксибензальдегид (А) | RI | 795 | – | 804 | – | 811 | – | 819 | – | |
| A(254/220) | – | – | – | – | – | – | – | – | – | |
| Гидразон о-гидроксибензальдегида (VII) (Б) | RI | – | 722 | 719 | 715 | 713 | 711 | 708 | 702 | 0.44 ± 0.03; |
| A(254/220) | – | 0.48 | 0.47 | 0.45 | 0.46 | 0.41 | 0.40 | 0.40 | 0.51*** | |
| Среднее значение ΔRI = RIгидразон – RIальдегид | –150 ± 9 | |||||||||
Рис. 3.
Масс-хроматограммы реакционной смеси п-метилбензальдегида с избытком гидразин-гидрата (а) по суммарному ионному току в диапазоне m/z 50–300; (б) по массовому числу ионов [M + H]+ исходного альдегида (в диапазоне m/z 121.0630–121.0666); (в) по массовому числу ионов [M + H]+ незамещенного гидразона (m/z в диапазоне 135.0896–135.0037).

В области времени удерживания исходного карбонильного соединения нет заметных хроматографических пиков; единственным сигналом оказывается пик со временем удерживания 12.39 мин, соответствующий азину п-метилбензальдегида. С целью селективного выявления возможных следов исходного карбонильного соединения записали масс-хроматограмму по значению m/z в диапазоне 121.0630–121.0666 (рис. 3б). Регистрируемый на ней сигнал со временем удерживания 4.52 мин можно приписать п-метилбензальдегиду; тогда второй сигнал с tR 1.95 мин закономерно принадлежит примеси продукта окисления такого альдегида кислородом воздуха – п-метилбензойной кислоте. С аналогичной целью, а именно для выявления возможных следов незамещенного гидразона, записали масс-хроматограмму по значению m/z в диапазоне 135.0896–135.0037 (рис. 3в). Однако вместо отчетливо детерминированных хроматографических пиков на ней проявляется широкий размытый сигнал. Правая граница такого “шлейфа” (приблизительно 12.4 мин) соответствует времени удерживания азина п-метилбензальдегида, тогда как левая (4.57 мин) практически совпадает со временем удерживания исходного альдегида. Форма такого сигнала аналогична специфическому хроматографическому профилю, изображенному на рис. 1, характеризующему нестабильность аналитов в хроматографической колонке в процессе разделения. В данном случае это указывает на гидролиз азина п-метилбензальдегида в процессе анализа (схема 3 ):
Схема 3 . Гидролиз азина п-метилбензальдегида с образованием гидразона.
Размытый сигнал, иллюстрируемый рис. 3в, преимущественно принадлежит ионам [C8H10N2 + H]+, соответствующим по составу незамещенному гидразону п-метилбензальдегида. Однако этот компонент не присутствует в реакционной смеси, а образуется в результате гидролиза азина. В соответствии со схемой 3 этот процесс должен протекать в две стадии. Можно отметить, что на основании имеющейся у авторов настоящей работы информации это всего лишь второй известный пример протекания двухстадийных процессов в хроматографической колонке и первый пример двухстадийного гидролиза аналитов в условиях ОФ ВЭЖХ. Ранее к процессам такого типа было отнесено термическое разложение незамещенных гидразонов карбонильных соединений в ходе газохроматографического анализа [1, 7]
Если сравнить результаты хроматографического анализа одних и тех же смесей ароматических альдегидов с гидразин-гидратом на хроматографе Shimadzu LC-20 Prominence и их хромато-масс-спектрометрического анализа на хроматографе UltiMate 3000, то они оказываются существенно отличающимися. Во-первых, индексы удерживания регистрируемых компонентов не совпадают друг с другом; в первом случае они меньше на 150 ± 9 ед. индекса. Такие различия превышают возможные вариации индексов удерживания в результате замены в составе элюента метанола на ацетонитрил. Иными словами, прослеживается та же закономерность, что и в случае гидразонов ароматических кетонов и самих карбонильных соединений, для которых такая разность равна −81 ± 21 (табл. 1). Незамещенные гидразоны, содержащие в молекуле два активных атома водорода, элюируются раньше, чем их прекурсоры. Во-вторых, не совпадают значения относительных оптических плотностей, А(254/220), равные 0.9 ± 0.4 и 2.0 ± 0.1. И здесь можно отметить аналогию с величинами А(254/220) для гидразонов кетонов и самих кетонов (1.15 ± 0.03 и 2.6 ± 0.2, табл. 1). Сочетание этих двух независимых аналитических параметров (индексы удерживания + спектральные отношения) позволяет однозначно утверждать, что в условиях хроматографического разделения мы обнаруживаем исключительно гидразоны, тогда как в условиях хромато-масс-спектрометрического анализа гидразоны альдегидов полностью гидролизуются. Причиной этого является слабокислая реакция элюента, содержащего 0.1% муравьиной кислоты, с рН ≈ 2.7.
* * *
Таким образом, в отличие от незамещенных гидразонов кетонов, которые стабильны даже в элюентах с рН < 7, незамещенные гидразоны альдегидов полностью гидролизуются при слабокислой реакции элюентов типа ацетонитрил–вода, обусловленной добавками в водную фазу 0.1% муравьиной кислоты. Эту их особенность необходимо принимать во внимание при определении других соединений этого класса. Для выявления гидролиза аналитов сопоставлены индексы удерживания исходных карбонильных соединений и гидразонов при разных соотношениях объемов органических модификаторов и водных фаз и различных значениях рН элюентов, относительные оптические плотности характеризуемых компонентов при длинах волн детектирования 254 и 220 нм, A(254/220) = А(254)/А(220), а также данные хромато-масс-спектрометрического анализа.
Экспериментальные данные настоящей работы получены в Ресурсном центре “Методы анализа состава вещества” Научного парка Санкт-Петербургского государственного университета. Авторы благодарят сотрудников Центра за содействие.
Список литературы
Zenkevich I.G. Features and new examples of gas chromatographic separation of thermally unstable analytes. Ch. 3 / Recent Advances in Gas Chromatography. London: IntechOpen Ltd., 2020. P. 1. https://doi.org/10.5772/intechopen.94229
Middleditch B.S. Analytical Artifacts: GC, MS, HPLC, TLC, and PC. Amsterdam: J. Chromatogr. Library, 1989. V. 44. 1033 p.
Herr C.H., Whitmore F.C., Schiessler R.W. The Wolff–Kishner reaction at atmospheric pressure // J. Am. Chem. Soc. 1945. V. 67. № 12. P. 2061. https://doi.org/10.1021/ja01228a002
Soffer M.D., Soffer M.B., Sherk K.W. A low pressure method for Wolff–Kishner reduction // J. Am. Chem. Soc. 1945. V. 67. № 9. P. 1435. https://doi.org/10.1021/ja1225a004
Kuethe J.T., Childers K.G., Peng Z., Journet M., Humphrey G.R., Vickery T., Bachert D., Lam T.T. A practical kilogram-scale implementation of the Wolff–Kishner reduction // Org. Process Res. Development. 2009. V. 13. № 3. P. 576. https://doi.org/10.1021/op9000274
The NIST Mass Spectral Library (NIST/EPA/NIH EI MS Library, 2017 Release). Software/Data Version; NIST Standard Reference Database, Number 69, August 2017. National Institute of Standards and Technology, Gaithersburg, MD 20899: http://webbook.nist.gov (дата обращения: апрель 2022 г.).
Зенкевич И.Г., Подольский Н.Е. Выявление соединений, нестабильных в условиях газохроматографического разделения. Незамещенные гидразоны карбонильных соединений // Аналитика и контроль. 2017. Т. 21. № 2. С. 125. https://doi.org/10.15825/analitika.2017.21.2.002
Зенкевич И.Г., Лукина В.М. Особенности газохроматографического разделения таутомеров этилацетоацетата // Журн. физ. химии. 2020. Т. 94. № 6. С. 910. https://doi.org/10.1134/S0036024420060357
Kornilova T.A., Ukolov A.I., Kostikov R.R., Zenkevich I.G. A simple criterion for gas chromatography/mass spectrometric analysis of thermally unstable compounds, and reassessment of the by-products of alkyl diazoacetate synthesis // Rapid Commun. Mass Spectrom. 2013. V. 27. № 3. P. 461. https://doi.org/10.1002/rcm.6457
Kovats’ retention index system / Encyclopedia of Chromatography / Ed. Cazes J. 3rd Ed. Boca Raton: CRC Press (Taylor & Francis Group), 2010. P. 1304.
Peterson M.L., Hirsch J. A calculation for locating the carrier gas front of a gas-liquid chromatogram // J. Lipid Res. 1959. V. 1. P. 132.
Kovarikova P., Vavrova K., Tomalova K., Schongut M., Hruskova K., Haskova P., Klimes J. HPLC-DAD and MS/MS analysis of novel drug candidates from the group of aromatic hydrazones revealing the presence of geometric isomers // J. Pharm. Biomed. Anal. 2008. V. 48. № 2. P. 295. https://doi.org/10.1016/j.jpba.2007.12.017
Isenberg S.L., Carter M.D., Crow B.S., Graham L.A., Johnson D.J., Beninato N., Steele K., Thomas J.D., Johnson R.C. Quantification of hydrazine in human urine by HPLC-MS-MS // J. Anal. Toxicol. 2016. V. 40. № 4. P. 248. https://doi.org/10.1093/jat/bkw015
Song L., Gao D., Li S., Wang Y., Liu H., Jiang Y. Simultaneous quantitation of hydrazine and acetylhydrazine in human plasma by high performance liquid chromatography – tandem mass spectrometry after derivatization with p-tolualdehyde // J. Chromatogr. B. 2017. V. 1063. P. 189. https://doi.org/10.1016/j.jchromb.2017.08.-36
Brewer C.T., Yang L., Edwards A., Lu Y., Low J., Wu J., Lee R.E., Chen T. The isoniazid metabolites hydrazine and pyridoxal isonicotinoyl hydrazone modulate heme biosynthesis // Toxicol. Sci. 2019. V. 168. № 1. P. 209. https://doi.org/10.1093/toxsci/kfy294
Wahbeh J., Milkowski S. The use of hydrazones for biomedical applications // SLAS Technol. 2019. V. 24. № 2. P. 161. https://doi.org/10.1117/2472630318822713
Mateeva A., Peikova L., Kondeva-Burdina M., Georgieva M. Development of new HPLC method for identification of metabolic degradation of N-pyrrolylhydrazide hydrazones with determined MAO-B activity in cellular cultures // Pharmacia. 2021. V. 69. № 1. P. 15. https://doi.org/10.3897/pharmacia.69.e78417
Derivatization of analytes in chromatography: General aspects / Encyclopedia of Chromatography / Ed. Cazes J. 3rd Ed. New York: Taylor & Francis, 2010. V. 1. P. 562.
Carbonyls: Derivatization for GC analysis / Encyclopedia of Chromatography / Ed. Cazes J. 3rd Ed. New York: Taylor & Francis, 2010. V. 1. P. 310.
Grosjean E., Green P.G., Grosjean D. Liquid chromatography analysis of carbonyl (2,4-dinitrophenyl)hydrazones with detection by diode array ultraviolet spectroscopy and by atmospheric pressure negative chemical ionization mass spectrometry // Anal. Chem. 1999. V. 71. № 9. P. 1851. https://doi.org/10.1021/ac981022v
Rapid separation and identification of carbonyl compounds by HPLC / Agilent Application Note / Wilmington: Agilent Technologies, Inc., 2008. 4 p.
Ochs S.M., Fasciotti M., Netto A.D.P. Analysis of 31 hydrazones of carbonyl compounds by RRLC-UV and RRLC-MS(/MS): A comparison of methods // J. Spectrosc. 2015. Article ID 890836. https://doi.org/10.1155/2015/890836
Damanik M., Murkovic M. Formation of potentially toxic carbonyl compounds during oxidation of triolein in the presence of alimentary antioxidants // Monatsh Chem. 2017. V. 148. № 12. P. 2031. https://doi.org/10.1007/s00706-017-2036-3
Frey J., Schneider F., Schink B., Hunn T. Synthesis of short-chain hydroxyaldehydes and their 2,4-dinitrophenylhydrazones derivatives, and separation of their isomers by high-performance liquid chromatography // J. Chromatogr. A. 2018. V. 1531. P. 143. https://doi.org/10.1016/chroma.2017.11.046
Kalia J., Reines R.T. Hydrolytic stability of hydrazones and oximes // Angew. Chem. Int. Ed. 2008. V. 47. № 39. P. 7523. https://doi.org/10.002/anie.200802651
Зенкевич И.Г., Косман В.М. Относительное поглощение при разных длинах волн - дополнительный УФ-спектральный параметр для идентификации органических соединений в обращенно-фазовой ВЭЖХ // Журн. аналит. химии. 1996. Т. 51. № 8. С. 870.
Зенкевич И.Г., Косман В.М. Новые возможности идентификации органических соединений по УФ-спектрам с использованием относительных оптических плотностей // Журн. прикл. химии. 1997. Т. 70. № 11. С. 1861
Зенкевич И.Г., Деруиш А. Аналитические аспекты зависимости индексов удерживания органических соединений в обращенно-фазовой ВЭЖХ от содержания метанола в составе элюента // Аналитика и контроль. 2022. Т. 26. № 1. С. 41. https://doi.org/10.15826/analitika.2022.26.1.004
Practical Gas Chromatography / Eds. Engewald W., Dettmer-Wilde K. Berlin: Springer-Verlag, 2014. 902 p.
Иоффе Б.В., Кузнецов М.А., Потехин А.А. Химия органических производных гидразина. Л.: Химия, 1979, 224 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии





