Биоорганическая химия, 2019, T. 45, № 1, стр. 96-102
Полиметиленовые производные нуклеиновых оснований с ω-функциональными группами. Х. Новый подход к получению α-амино-ω-нуклеокарбоновых кислот
В. В. Комиссаров *, А. М. Крицын *
* ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта РАН, Россия, 119901, Москва, ул. Вавилова, 32
Поступила в редакцию 28.02.2018
После доработки 20.03.2018
Принята к публикации 05.04.2018
Аннотация
Предлагается новый подход к синтезу α-амино-ω-нуклеокарбоновых кислот – аналогов виллардиина – активатора рецептора α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (АМПА), отвечающего за передачу быстрого возбуждающего сигнала в синапсах нервной системы позвоночных. На основании существенных различий в реакционной способности атомов галогенов в α,ω-дигалогенкарбоновых кислотах синтезированы эфиры α-фталоилимидо-ω-хлоркарбоновых кислот. Алкилированием этими эфирами урацила, тимина и аденина получены ключевые соединения – эфиры α-фталоилимидо-ω-нуклеокарбоновых кислот. Последовательное снятие фталильной защитной группы и кислотный гидролиз приводят к новым полиметиленовым производным нуклеиновых оснований, представляющим собой α-амино-ω-нуклеокарбоновые кислоты. Изучены их физико-химические свойства.
ВВЕДЕНИЕ
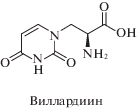
В 1959 г. Гмелин из семян растения Acacia willardiana выделил новую растительную аминокислоту виллардиин [2]. По своей структуре виллардиин является (2S)-2-амино-3-(урацилил-1)пропановой кислотой – одним из представителей нуклеоаминокислот.
Было установлено, что виллардиин активирует рецепторы α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (АМПА). Последние являются ионотропными рецепторами глутамата, передающими быстрые возбуждающие сигналы в синапсах нервной системы позвоночных. Они обнаружены практически во всех структурах головного мозга человека. Проведены многочисленные работы по синтезу различных аналогов, гомологов и производных виллардиина. В связи с этим следует упомянуть обстоятельный обзор отечественных авторов, посвященный нуклеоаминокислотам и нуклеопептидам [3].
Для синтеза ферментоустойчивых аналогов нейропептидов, таких как киоторфин, энкефалины, дерморфин и дальторфин, проявляющих опиоидную активность, применен подход, основанный на замене определенных аминокислотных остатков природного биорегулятора остатками непротеиногенных аминокислот. В качестве таких аминокислот использованы β-нуклео-α-аланины [4]. Они же вводились в модифицированные ανβ3-интегринингибирующие RGD-циклопептиды в качестве аналогов аргинина (см. статью [5]). В подобных нуклеопептидах в рамках одной молекулы сочетаются свойства пептидного остова белков и свойства, характерные для гетероциклических оснований нуклеиновых кислот. Сочетание таких структурных особенностей нуклеопептидов создает благоприятные условия для возникновения между нуклеопептидными цепями межнуклеотидных контактов кооперативного характера.
Нуклеоаминокислоты, в которых остаток нуклеинового основания отделен от фрагмента C-алкилированного глицина более чем одним метиленовым звеном или α-амино-ω-нуклеокарбоновыe кислоты, можно рассматривать, как полиметиленовые производные нуклеиновых оснований с функциональным группами на конце гидрофобной углеводородной цепи.
Подобные производные необычных аминокислот нашли заметное применение в медицинской химии [6]. Кроме того, такие соединения могут представлять интерес при построении пептидонуклеиновых кислот.
Основным подходом к синтезу полиметиленовых производных нуклеиновых оснований с ω‑функциональными группами является алкилирование нуклеиновых оснований, что приводит к смеси продуктов реакции. В случае пиримидиновых оснований, помимо 1-производных, образуются продукты 1,3-бисалкилирования, а в случае пуриновых – одновременно с 9-алкилированием происходит замещение по 7- или по 3-положениям в зависимости от структуры пуринового основания [7, 9]. При этом выходы 1-пиримидиновых и 9-пуриновых производных ω-нуклеокарбоновых кислот умеренные.
Нами ранее в качестве потенциальных ингибиторов ОТ ВИЧ, а также ДНК-топоизомеразы I человека были изучены полиметиленовые ω‑карбокси-, карбалкокси- и гидроксипроизводные пуриновых [10] и пиримидиновых [11] оснований. Варьирование длины углеводородной цепи от 5 до 9 атомов углерода позволило выяснить ее влияние на биологические свойства синтезированных соединений. Также был проведен поиск ингибиторов интегразы ВИЧ в ряду 5-(4-галогенфенил)-5-оксопентильных производных нуклеиновых оснований [12].
Для синтеза полиметиленовых производных нуклеиновых оснований с ω-функциональными группами удобно использовать α-бром-ω-хлоркарбоновые кислоты, которые в силу существенных различий в реакционной способности их галогенов [13], представляют уникальную возможность для селективной замены галогенов на различные функциональные группы. Мы показали, что в метил-α-бром-ω-хлоралканоатах на тиоцианатную группу с выходом более 90% в первую очередь замещается атом брома, находящийся в α-положении к карбоксильной группе [1].
В настоящей работе мы предлагаем подход к получению α-амино-ω-нуклеокарбоновых кислот, основанный на алкилировании нуклеиновых оснований эфирами α-фталоилимидо-ω-хлоркарбоновых кислот с последующим удалением защитных групп и демонстрируем его эффективность на примере синтеза ряда нуклеоаминокислот, в которых остаток урацила, тимина и аденина отделен от фрагмента C-алкилированного глицина 3, 4 и 7 метиленовыми звеньями.
Предложенный подход позволяет расширить линейку соединений для получения нуклеопептидов. Синтезированные α-амино-ω-нуклеокарбоновые кислоты также представляют интерес для дальнейшего изучения их взаимодействия с ферментами нуклеинового обмена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для получения целевых производных применена стратегия, приведенная на схеме. На первом этапе взаимодействием метиловых эфиров α‑бром-ω-хлоркарбоновых кислот (бутановой, пентановой, гексановой, гептановой и нонановой) с фталимидом в присутствии основания в среде неполярных растворителей (DMF или ацетонитрил) при комнатной температуре получены эфиры α-фталоилимидо-ω-хлоркарбоновых кислот. В качестве основания применяли DBU (метод А). Во втором варианте эфиры α-бром-ω-хлоркарбоновых кислот вводили в реакцию с фталимидом калия в эквимолярном соотношении в ацетонитриле при кипячении (метод Б). Выделение и очистку полученных соединений проводили при помощи колоночной хроматографии на силикагеле. Выходы α-фталоилимидных производных составляли более 90% (см. табл. 1). Реакция имеет общий характер – получены не описанные ранее метиловые эфиры α-фталоилимидо-ω-хлоркарбоновых кислот (Iа)–(Iд). Синтезированные соединения идентифицировали при помощи ТСХ, масс-спектрометриии и ЯМР-спектроскопии.
Таблица 1.
Метиловые эфиры α-фталоилимидо-ω-хлоркарбоновых кислот*
 |
||||||
| Соединение | n | Метод | Выход, % | Брутто | М | Rf (А) |
| (Iа) | 0 | А | 74.1 | C13H12ClNO4 | 281.7 | 0.71 |
| (Iб) | 1 | А | 70.6 | C14H14ClNO4 | 295.7 | 0.55 |
| Б | 71.3 | |||||
| (Iв) | 2 | А | 93.2 | C15H16ClNO4 | 309.7 | 0.63 |
| Б | 90.7 | |||||
| (Iг) | 3 | А | 85.9 | C16H18ClNO4 | 323.8 | 0.59 |
| (Iд) | 5 | А | 95.4 | C18H22ClNO4 | 351.8 | 0.42 |
| Б | 90.7 | |||||
На втором этапе полученными эфирами α‑фталоилимидо-ω-хлоркарбоновых кислот алкилировали нуклеиновые основания в диметилформамиде с применением в качестве основания DBU в течение 20 ч при температуре 80–100°С. Для алкилирования из пиримидиновых оснований выбраны урацил и тимин, а из пуриновых – аденин. Алкилирующими реагентами служили метиловые эфиры α-фталоилимидо-ω-хлор-пентановой (Iб), -гексановой (Iв) и -нонановой (Iд) кислот. Были получены и хроматографически на колонках с силикагелем очищены эфиры α-фталоилимидо-ω-нуклеокарбоновых кислот (IIа)–(IIи). Отметим, что взаимодействие реагента (Iа) с нуклеиновыми основаниями в описанных условиях приводило к сложной смеси продуктов реакции, не содержащей продуктов алкилирования нуклеиновых оснований.
Для снятия фталоилимидной защиты и гидролиза сложноэфирной группы использовали методику, предложенную Шиханом и Больхофером [14]. Раствор или суспензию метиловых эфиров α-фталоилимидо-ω-нуклеокарбоновых кислот (IIа)–(IIи) в метаноле кипятили 1–2 ч с эквивалентом гидразин гидрата, остаток после удаления в вакууме растворителя гидролизовали 1 ч при 100°С смесью конц. HCl–вода (1 : 1) и упаривали. Гидрохлориды аминокислот (IIIа)–(IIIи) из остатка извлекали водой и очищали на катионите Dowex-50 (H+-форма). α-Амино-ω-нуклеокарбоновые кислоты (IIIа)–(IIIи) представляют собой кристаллические тугоплавкие вещества, трудно растворимые в воде, на хроматограммах окрашиваются нингидрином. При рН 5 соединения хорошо растворимы в воде, что дает возможность их использования в биологических исследованиях в условиях приближенных к физиологическим.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали аденин, урацил, тимин (Sigma, США); 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), (Fluka, Швейцария); фталимид, D2O, CDCl3, DMSO-d6 (Acros Organics, Бельгия). Растворители очищали и абсолютировали по стандартным методикам. ТСХ проводили на пластинках Kieselgel 60 F254 (Merck, Германия), используя системы: хлористый метилен–этанол, 19 : 1 (А), хлористый метилен–этанол, 18 : 2 (Б). ТСХ аминокислот проводили в системе iPrOH–вода–аммиак, (7 : 1 : 2) (В). Вещества обнаруживали по УФ-поглощению при 254 нм и реакцией с нингидрином. Колоночную хроматографию проводили на силикагеле.
Silica gel 60 (0.040–0.063 мм (Merck, Германия)). Масс-спектры получали на приборе MS-30 (Kratos, Япония); метод ионизации – электронный удар. Спектры ЯМР регистрировали (δ, м.д.; КССВ, Гц) на спектрометре Bruker AMXIII-400 (Германия) с рабочей частотой 400 МГц для 1H-спектров и 100 МГц для 13C-спектров при 300 К в CDCl3, DMSO-d6, D2O и D2O с добавлением 5% CF3COOH22.
Метиловые эфиры α-фталоилимидо-ω-хлоркарбоновых кислот (Iа)–(Iд). (Метод А). К суспензии 10 ммоль фталимида и 10 ммоль метил-α-бром-ω-хлоралканоата в 20 мл DMF (или ацетонитрила) при перемешивании при комнатной температуре в течение 10 мин прибавляли по каплям 11 ммоль DBU. Реакционную массу после растворения выдерживали 12 ч при комнатной температуре, контролируя ход реакции ТСХ. Затем упаривали, остаток растворяли в 50 мл хлористого метилена, промывали 3 × 15 мл водой, сушили безводным сульфатом натрия и упаривали. Остаток хроматографировали на колонке с 200 г силикагеля, элюируя градиентом этилового спирта в хлористом метилене (0 → 15). Фракции, содержащие метил-α-фталоилимидо-ω-хлоралканаоат, объединяли и упаривали.
Метод Б. К раствору 20 ммоль метил-α-бром-ω-хлоралканоата в 30 мл ацетонитрила при перемешивании при комнатной температуре в течение 1 ч прибавляли небольшими порциями 20 ммоль фталимида калия. Реакционную массу перемешивали 5–7 ч при кипении, затем упаривали. Остаток обрабатывали 75 мл хлористого метилена, промывали 2 × 30 мл водой, органический слой сушили безводным сульфатом натрия и упаривали. Получали хроматографически чистые α-фталоилимидо-ω-хлоралконаоаты (Iа) – (Iд).
Метил-2-фталоилимидо-4-хлорбутаноат (Iа). 1H-ЯМР (CDCl3): 2.70 (2 H, м, H2, Alk); 3.67 (2 H, м, H3, Alk); 3.73 (3 H, с, COOCH3); 5.15 (1 H, дд, H1, Alk, J 9.3; 5.6); (7.74; 7.86) (2H × 2, м × 2, PhtN). 13C-ЯМР (CDCl3): 31.74 (C2, Alk); 41.22 (C3, Alk); 49.41 (COOCH3); 52.89 (C1, Alk); (123.64; 131.76; 134.31; 167.46) (PhtN); 169.18 (COOCH3).
Метил-2-фталоилимидо-5-хлорпентаноат (Iб). 1H-ЯМР (CDCl3): 1.77 (2 H, м, H3, Alk); 2.35 (2 H, м, H2, Alk); 3.51 (2 H, т, J 6.5, H4, Alk); 3.70 (3 H, с, COOCH3); 4.82 (1 H, дд, J 10.3; 5.1, H1, Alk); (7.72; 7.83) (2H × 2, м × 2, PhtN). 13C-ЯМР (CDCl3): 26.37 (C3, Alk); 29.33 (C2, Alk); 43.84 (C4, Alk); 51.37 (COOCH3); 52.79 (C1, Alk); (123.61; 131.73; 134.32; 167.55) (PhtN); 169.35 (COOCH3).
Метил-2-фталоилимидо-6-хлоргексаноат (Iв). 1H-ЯМР (DMSO-d6): 1.37 (2 H, м, H3, Alk); 1.72 (2 H, м, H4, Alk); 2.10 (2 H, м, H2, Alk); 3.57 (2 H, т, J 6.5, H5, Alk); 3.65 (3 H, с, COOCH3); 4.90 (1 H, дд, J 9.5; 5.6, H1, Alk); (7.90; 7.93) (2H × 2, м × 2, PhtN). 13C-ЯМР (DMSO-d6): 22.84 (С3, Alk); 27.36 (С4, Alk); 31.25 (С2, Alk); 44.90 (С5, Alk); 51.12 (COOCH3); 52.45 (С1, Alk); (123.44; 130.92; 134.88; 167.14) (PhtN); 169.33 (COOCH3).
Метил-2-фталоилимидо-7-хлоргептаноат (Iг). 1H-ЯМР (CDCl3): 1.22–1.54 (4 H, м, H3 и H5, Alk); 1.72 (2 H, м, H4, Alk); 2.23 (2 H, м, H2, Alk2); 3.46 (2 H, т, J 6.6, H6, Alk); 3.71 (3 H, с, COOCH3); 4.82 (1 H, дд, J 10.0; 5.6, H1, Alk); (7.73; 7.85) (2H × 2, м × 2, PhtN). 13C-ЯМР (CDCl3): 25.67 (C3, Alk); 26.24 (C4, Alk); 28.62 (C5, Alk); 32.30 (C2, Alk); 44.79 (C6, Alk); 52.07 (COOCH3); 52.74 (C1, Alk); (123.61; 131.87; 134.27; 167.71) (PhtN); 169.80 (COOCH3).
Метил-2-фталоилимидо-9-хлорнонаноат (Iд). 1H-ЯМР (CDCl3): 1.22–1.40 (8 H, м, H3, H4, H5, H6 Alk); 1.72 (2 H, м, H7, Alk); 2.22 (2 H, м, H2, Alk); 3.47 (2 H, т, J 6.7, H8, Alk); 3.71 (3 H, с, COOCH3); 4.82 (1 H, дд, J 10.4; 5.3, H1, Alk); (7.73; 7.85) (2H × 2, м × 2, PhtN). 13C-ЯМР (CDCl3): 26.23 (C3, Alk); 26.76 (C5, Alk); 28.61 (C4, Alk); 28.68 (C6, Alk); 28.75 (C7, Alk); 32.56 (C2, Alk); 45.06 (C8, Alk); 52.20 (COOCH3); 52.72 (C1, Alk); (123.60; 131.91; 134.24; 167.75) (PhtN); 169.96 (COOCH3).
Алкилирование нуклеиновых оснований метиловыми эфирами α-фталоилимидо-ω-хлоркарбоновых кислот. К суспензии 5 ммоль нуклеинового основания и 7 ммоль метил-фталоилимидохлоралканоата (Iа)–(Iд) в 10 мл DMF при перемешивании при комнатной температуре за 15 мин прибавляли по каплям 6 ммоль DBU. Реакционную массу перемешивали 10–12 ч при 90–100°С. Ход реакции контролировали ТСХ. Реакционную массу упаривали в вакууме, остаток хроматографировали на 75 г силикагеля, элюируя градиентом этанола в хлористом метилене (0 → 15%). Фракции, содержащие метил-α-фталоилимидо-ω-нуклеоалканоаты (IIа)–(IIи) объединяли и упаривали.
Метил-2-фталоилимидо-5-(урацилил-1)пентаноат (IIа). Выход 49.8%, масло, Rf 0.56 (Б). Масс-спектр: m/z 372.3 [MH]+, рассчитано 371.3 (C18H17N3O6). 1H-ЯМР (DMSO-d6): 1.57 (2 H, м, H3, Alk); 2.05 (2 H, м, H2, Alk); 3.62 (3 H, с, COOCH3); 3.65 (2 H, т, J 7.2, H4, Alk),; 4.92 (1 H, дд, J 10.1; 5.1,H1, Alk); 5.50 (1 H, д, J 7.8, H5, Base); 7.59 (1 H, д, J 7.8, H6, Base); 7.90 (4 H, м, PhtN); 11.14 (1 H, c, H3, Base). 13C-ЯМР (DMSO-d6): 25.08 (2 C, C2 и С3, Alk); 46.60 (С4, Alk); 50.93 (COOCH3); 52.51 (С1, Alk); 100.83 (C5, Base); (123.45; 130.98; 134.87; 167.18) (PhtN); 145.45 (C6, Base); 150.89 (C2, Base), 163.58 (C4, Base); 169.24 (COOCH3).
Метил-2-фталоилимидо-5-(тиминил-1)пентаноат (IIб). Выход 52%, масло, Rf 0.51(Б) Масс-спектр: m/z 386.4 [MH]+, рассчитано 385.4 (C19H19N3O6). 1H-ЯМР (DMSO-d6): 1.58 (2 H, м, H3, Alk); 1.72 (3 H, с, 5-CH3, Base); 2.09 (2 H, м, H2, Alk); 3.62 (3 H, с, COOCH3); 3.65 (2 H, т, J 7.2, H4, Alk); 4.84 (1 H, дд, J 9.5; 5.6, H1, Alk); 7.23 (1 H, c, H6, Base); 7.81 (4 H, м, Ph); 10.99 (1 H, c, H3, Base). 13C-ЯМР (DMSO-d6): 11.67 (5-CH3, Base); 24.99, 25.13 (2 C, C2 и С3, Alk); 46.34 (C4, Alk); 50.76 (COOCH3); 52.17 (C1, Alk); 108.98 (C5, Base); (123.08; 130.97; 134.22; 166.85) (PhtN); 140.37 (C6, Base); 150.74 (C2, Base), 164.11 (C4, Base); 168.82 (COOCH3).
Метил-2-фталоилимидо-5-(аденинил-9)пентаноат (IIв). Выход 52.4%, масло, Rf 0.67(А) Масс-спектр: m/z 395.4 [MH]+, рассчитано 394.4 (C19H18N6O4). М = 394.4 1H-ЯМР (DMSO-d6): 1.57 (2 H, м, H3, Alk); 2.07 (2 H, м, H2, Alk); 3.63 (3 H, с, COOCH3); 4.03 (2 H, т, J 7.0, H4, Alk);4.83 (1 H, дд, J 9.6; 5.6, H1, Alk); 7.13 (2 H, c, 6-NH2,, Base); 7.90 (4 H, м, PhtN); 8.03 (1 H, c, H8, Base); 8.05 (1 H, c, H2, Base). 13C-ЯМР (DMSO-d6): 25.07, 25.09 (2 C, C2 и С3, Alk); 43.00 (C4, Alk); 50.92 (COOCH3); 52.54 (C1, Alk); 118.67 (C5, Base); (123.41; 130.95; 134.87; 167.20) (PhtN); 140.71 (C8, Base); 149.50 (C4, Base); 152.21 (C2, Base), 155.83 (C6, Base); 169.45 (COOCH3).
Метил-2-фталоилимидо-6-(урацилил-1)гексаноат (IIг). Выход 52%, масло, Rf 0.77 (А) Масс-спектр: m/z 386.4 [MH]+, рассчитано 385.4 (C19H19N3O6). 1H-ЯМР (CDCl3): 1.25–2.30 (6 H, м, H2 – H4, Alk); 3.63 (2 H, т, J 7.2, H5, Alk); 3.69 (3 H, с, COOCH3); 4.80 (1 H, дд, J 10.0; 5.6, H1, Alk); 5.59 (1 H, д, J 7.8, H5, Base); 7.08 (1 H, д, J 7.8, H6, Base); 7.78 (4 H, м, PhtN); 9.25 (1 H, c, H3, Base). 13C-ЯМР (CDCl3): 22.92 (С3, Alk); 28.10 (С4, Alk); 28.15 (С2, Alk); 48.25 (С6, Alk); 51.52 (COOCH3); 52.72 (С1, Alk); 102.02 (C5, Base); (123.55; 131.58; 134.31; 167.64) (PhtN); 144.27 (C6, Base); 150.68 (C2, Base), 162.51 (C4, Base); 169.44 (COOCH3).
Метил-2-фталоилимидо-6-(тиминил-1)гексаноат (IIд). Выход 58.1%, масло, Rf 0.79 (А). Масс-спектр: m/z 400.4 [MH]+, рассчитано 399.4 (C20H21N3O6). 1H-ЯМР (CDCl3): 1.25–2.30 (6 H, м, H2 – H4, Alk); 1.84 (3 H, с, 5-CH3, Base) 3.67 (2 H, т, J 7.2, H5, Alk); 3.70 (3 H, с, COOCH3); 4.80 (1 H, дд, J 9.2; 6.3, H1, Alk); 6.92 (1 H, c, H6, Base); 7.70 (4 H, м, PhtN); 8.88 (1 H, c, H3, Base). 13C-ЯМР (CDCl3): 12.2 (5-CH3, Base); 22.98 (С3, Alk); 28.21 (2С, С2 и С4, Alk); 47.92 (С5, Alk); 51.60 (COOCH3); 52.74 (С1, Alk); 110.53 (C5, Base); (123.57; 131.62; 134.31; 167.59) (PhtN); 140.27 (C6, Base); 150.70 (C2, Base), 162.53 (C4, Base); 169.50 (COOCH3).
Метил-2-фталоилимидо-6-(аденинил-9)гексаноат (IIе). Выход 57.8%, масло, Rf 0.21 (А). Масс-спектр: m/z 409.24 [MH]+, рассчитано 408.4 (C20H20N6O4). 1H-ЯМР (DMSO-d6): 1.23 (2 H, м, H3, Alk); 1.78 (2 H, м, H4, Alk); 2.10 (2 H, м, H2, Alk); 3.62 (3 H, с, COOCH3); 4.07 (2 H, т, J 7.0, H5, Alk);4.85 (1 H, дд, J 9.6; 5.6, H1, Alk); 7.09 (2 H, c, 6-NH2, Base); 7.88 (4 H, м, PhtN); 8.02 (1 H, c, H8, Base); 8.08 (1 H, c, H2, Base). 13C-ЯМР (DMSO-d6): 22.65 (С3, Alk); 27.61 (С4, Alk); 28.78 (С2, Alk); 42.50 (С5, Alk); 51.17 (COOCH3); 52.51 (С1, Alk); 118.65 (C5, Base); (123.47; 130.90; 134.91; 167.17) (PhtN); 140.68 (C8, Base); 149.46 (C4, Base); 152.22 (C2, Base), 155.84 (C6, Base); 169.42 (COOCH3).
Метил-2-фталоилимидо-9-(урацилил-1)нонаноат (IIж). Выход 66%, масло, Rf 0.79 (А). Масс-спектр: m/z 428.5 [MH]+, рассчитано 427.5 (C22H25N3O6). 1H-ЯМР (CDCl3): 1.17–2.30 (12 H, м, H2 – H7, Alk); 3.64 (2 H, т, J 7.2, H8, Alk); 3.69 (3 H, с, COOCH3); 4.80 (1 H, дд, J 10.0; 5.6, H1, Alk); 5.63 (1 H, д, J 7.8, H5, Base); 7.11 (1 H, д, J 7.8, H6, Base); 7.80 (4 H, м, PhtN); 9.12 (1 H, c, H3, Base). 13C-ЯМР (CDCl3): 25.99 (С3,); 26.10 (С4, Alk); 28.52 (2 C, С6 и С7, Alk); 28.67 (С5, Alk); 28.80 (С2, Alk); 48.65 (С8, Alk); 51.95 (COOCH3); 52.60 (С1, Alk); 101.94 (C5, Base); (123.47; 131.70; 134.61; 167.67) (PhtN); 144.32 (C6, Base); 150.68 (C2, Base), 162.48 (C4, Base); 169.79 (COOCH3).
Метил-2-фталоилимидо-9-(тиминил-1)нонаноат (IIз). Выход 61%, масло, Rf 0.48 (А). Масс-спектр: m/z 442.5 [MH]+, рассчитано 441.5 (C23H27N3O6). 1H-ЯМР (CDCl3): 1.17–2.30 (12 H, м, H2 – H7, Alk); 1.89 (3 H, с, 5-CH3, Base); 3.61 (2 H, т, J 7.2, H8, Alk); 3.71 (3 H, с, COOCH3); 4.82 (1 H, дд, J 10.1; 5.6, H1, Alk); 6.94 (1 H, c, H6, Base); 7.80 (4 H, м, PhtN); 8.35 (1 H, c, H3, Base).13C-ЯМР (CDCl3): 11.8 (5-CH3, Base); 26.09 (С3, Alk); 26.20 (С4, Alk); 28.60 (С6 и C7, Alk); 28.77 (С5, Alk); 28.93 (С2, Alk); 48.40 (С8, Alk); 52.05 (COOCH3); 52.65 (С1, Alk); 110.47 (C5, Base); (123.53; 131.81; 134.19; 167.67) (PhtN); 140.31 (C6, Base); 150.60 (C2, Base), 162.50 (C4, Base); 169.85 (COOCH3).
Метил-2-фталоилимидо-9-(аденинил-9)нонаноат (IIи). Выход 54%, масло, Rf 0.41(А). Масс-спектр: m/z 451.5 [MH]+, рассчитано 450.5 (C23H26N6O4).М 450.5. 1H-ЯМР (CDCl3): 1.15–2.20 (12 H, м, H2 – H7, Alk); 3.66 (3 H, с, COOCH3); 4.10 (2 H, т, J 7.2, H8, Alk); 4.83 (1 H, дд, J 10.2; 5.2, H1, Alk); 6.40 (2 H, c, 6-NH2, Base); 7.75 (4 H, м, PhtN); 7.75 (1 H, c, H8, Base); 8.24 (1 H, c, H2, Base)). 13C-ЯМР (CDCl3): 25.98 (C3, Alk); 26.32 (C4, Alk); 28.46 (2 C, C6 и С7, Alk); 28.55 (C5, Alk); 29.79 (C2, Alk); 43.78 (C8, Alk); 51.93 (COOCH3); 52.54 (C1, Alk); 119.20 (C5); (123.41; 131.66; 134.09; 167.55) (PhtN); 140.26 (C8, Base); 149.80 (C4, Base); 152.40 (C2, Base), 155.49 (C6, Base); 169.74 (COOCH3).
Снятие фталоилимидной защитной группы и гидролиз сложноэфирной группы. К раствору (или суспензии) 10 ммоль метилового эфира α-фталоилимидо-ω–нуклеокарбоновой кислоты (IIa)–(IIи) в 25 мл метанола прибавляли 10 ммоль 85% водного гидразингидрата и кипятили 1–3 ч с обратным холодильником. После охлаждения реакционную массу упаривали, прибавляли 15 мл воды и 15 мл конц. HCl и кипятили 1–2 ч с обратным холодильником. Упаривали в вакууме, переупаривали 3 раза с 15 мл воды, остаток обрабатывали 50 мл этилового спирта, осадок отфильтровывали, фильтрат упаривали. Остаток растворяли в 75 мл воды, наносили на колонку с Dowex-50 (H+-форма) и аминокислоту элюировали 5% водным аммиаком. Ср. [14].
2-Амино-5-(урацилил-1)пентановая кислота (IIIа). Выход 84.6%, Rf 0.44 (В), т. пл. 205–207°С. Масс-спектр: m/z 228.2 [MH]+, рассчитано 227.2 (C9H13N3O4). 1H-ЯМР (D2O): 1.51–1.90 (4 H, м, H2 и H3, Alk); 3.67 (1 H, м, H1, Alk); 3.73 (2 H, т, J 7.2, H4, Alk); 5.73 (1 H, д, J 7.8, H5, Base); 7.80 (1 H, д, J 7.8, H6, Base). 13C-ЯМР (D2O): 26.74 (C3, Alk); 30.08 (C2, Alk); 50.99 (С4, Alk); 57.05 (C1, Alk); 104.35 (C5, Base), 149.91 (C6, Base); 155.09 (C2, Base); 169.58 (C4, Base); 177.03 (COOH).
2-Амино-5-(тиминил-1)пентановая кислота (IIIб). Выход 85.4%, Rf 0.56 (В), т. пл. 214–216°С. Масс-спектр: m/z 242.3 [MH]+, рассчитано 241.3 (C10H15N3O4). 1H-ЯМР (D2O, 5% CF3COOH): 1.40–2.10 (4 H, м, H2 и H3, Alk); 1.80 (3 H, с, 5-CH3, Base); 3.58 (1 H, м, H1, Alk); 3.91 (2 H, т, J 7.2, H4, Alk); 7.41 (с, 1 H, H6, Base). 13C-ЯМР (D2O, 5% CF3COOH): 14.00 (5-CH3, Base); 26.69 (C3, Alk); 29.63 (C2, Alk); 50.52 (C4, Alk); 55.93 (C1, Alk); 113.64 (C5, Base); 145.67 (C6, Base); 155.04 (C2, Base); 169.62 (C4, Base); 175.40 (COOH).
2-Амино-5-(аденинил-9)пентановая кислота (IIIв). Выход 88%, Rf 0.52 (В), т. пл. 238–239°С. Масс-спектр: m/z 251.3 [MH]+, рассчитано 250.3 (C10H14N6O2). М = 250.3. 1H-ЯМР (D2O, 5% CF3COOH): 1.80–2.10 (4 H, м, H2 и H3, Alk); 3.58 (1 H, м, H1, Alk); 4.34 (2 H, т, J 7.2, H4, Alk); 8.30 (с, 1 H, H8, Base); 8.37(1 H, с, H2, Base). 13C-ЯМР (D2O, 5% CF3COOH): 24.99 (C3, Alk); 26.76 (C2, Alk); 43.74 (C4, Alk); 52.35 (C1, Alk); 118.27 (C5, Base); 144.30 (C8, Base); 144.83 (C2, Base); 148.59 (C4, Base); 149.80 (C6, Base); 171.61 (COOH).
2-Амино-6-(урацилил-1)гексановая кислота (IIIг). Выход 64.22%, Rf 0.44 (В), т. пл. 219–221°С. Масс-спектр: m/z 242.3 [M]+, рассчитано 241.3 (C10H15N3O4). 1H-ЯМР (D2O): 1.44 (2 H, м, H3, Alk); 1.70–1.95 (4 H, м, H2 и H4, Alk); 3.73 (1 H, м, H1, Alk); 3.80 (2 H, т, J 7.2, H5, Alk); 5.82 (1 H, д, J 7.8, H5, Base); 7.64 (1 H, д, J 7.8, H6, Base). 13C‑ЯМР (D2O): 21.39 (C3, Alk); 27.75 (C2, Alk); 30.02 (C4, Alk); 48.49 (C5, Alk); 54.65 (C1, Alk); 101.50 (C5, Base); 147.33 (C6, Base); 152.40 (C2, Base); 166.89 (C4, Base); 174.65 (COOH).
2-Амино-6-(тиминил-1)гексановая кислота (IIIд). Выход 61.46%, Rf 0.56 (В), т. пл. 206–207°С. Масс-спектр: m/z 256.3 [MH]+, рассчитано 255.3 (C11H17N3O4). 1H-ЯМР (D2O): 1.44 (2 H, м, H3, Alk); 1.70–1.95 (4 H, м, H2 и H4, Alk); 1.87 (3 H, с, 5-CH3, Base); 3.72 (1 H, м, H1, Alk); 3.76 (2 H, т, J 7.2, H5, Alk); 7.48 (1 H, с, H6, Base). 13C-ЯМР (D2O): 14.01 (5-CH3, Base); 19.56 (C3, Alk); 24.16 (C2, Alk); 30.57 (C4, Alk); 50.88 (C5, Alk); 57.42 (C1, Alk); 113.44 (C5, Base); 145.84 (C6, Base); 155.13 (C2, Base); 169.75 (C4, Base); 177.64 (COOH).
2-Амино-6-(аденинил-9)гексановая кислота (IIIе). Выход 57.93%, Rf 0.59 (В), т. пл. 226–227°С. Масс-спектр: m/z 265.3 [MH]+, рассчитано 264.3 (C11H16N6O2). 1H-ЯМР (D2O): 1.40 (2 H, м, H3, Alk); 1.85 (4 H, м, H2 и H4, Alk); 3.66 (1 H, м, H1, Alk); 4.08 (2 H, т, J 7.2, H5, Alk); 7.97 (с, 1 H, H8, Base); 7.99 (1 H, с, H2, Base). 13C-ЯМР (D2O): 24.38 (C3, Alk); 31.50 (C2, Alk); 32.86 (C4, Alk); 46.22 (C5, Alk); 57.40 (C1, Alk); 120.66 (C5, Base); 144.68 (C8, Base); 150.98 (C4, Base); 154.59 (C2, Base); 157.70 (C6, Base); 177.69 (COOH).
2-Амино-9-(урацилил-1)нонановая кислота (IIIж). Выход 51.4% Rf 0.58 (В), т. пл. 213–215°С. Масс -спектр: m/z 284.3 [MH]+, рассчитано 283.3 (C13H21N3O4). 1H-ЯМР (D2O, 5% CF3COOH): 1.00–1.80 (12 H, м, H2 – H7, Alk); 3.54 (1 H, м, H1, Alk); 3.69 (2 H, т, J 7.2, H8, Alk); 5.73 (1 H, д, J 7.9, H5, Base); 7.45 (1 H, д, J 7.9, H6, Base). 13C-ЯМР (D2O, 5% CF3COOH): 26.98 (C3, Alk); 28.28 (C2, Alk); 30.75 (C6, Alk); 30.84 (C7, Alk); 30.89 (C4, Alk); 32.61 (C5, Alk); 51.86 (C8, Alk); 55.88 (C1, Alk); 104.22 (C5, Base); 149.93 (C6, Base); 154.92 (C2, Base); 169.64 (C4, Base); 174.85 (COOH).
2-Амино-9-(тиминил-1)нонановая кислота (IIIз) Выход 51.4% Rf 0.58 (В), т. пл. 204–206°С. Масс-спектр: m/z 298.3 [MH]+, рассчитано 297.3 (C14H23N3O4). 1H-ЯМР (D2O, 5% CF3COOH): 1.00-1.80 (12 H, м, H2 – H7, Alk); 1.62 (3 H, с, 5-CH3, Base); 3.34 (1 H, м, H1, Alk); 3.82 (2 H, т, J 7.2, H8, Alk); 7.22 (1 H, с, H6, Base). 13C-ЯМР (D2O, 5% CF3COOH): 11.90 (5-CH3, Base); 24.61 (C3, Alk); 25.50 (C2, Alk); 26.02 (C6, Alk); 28.05 (C7, Alk); 28.65 (C4, Alk); 30.31 (C5, Alk); 49.28 (C8, Alk); 53.54 (C1, Alk); 111.27 (C5, Base); 143.91 (C6, Base); 152.96 (C2, Base); 167.56 (C4, Base); 172.75 (COOH).
2-Амино-9-(аденинил-9)нонановая кислота (IIIи). Выход 51.4%, Rf 0.62(В), т. пл. 226–227°С Масс-спектр: m/z 307.4 [MH]+, рассчитано 306.4 (C14H22N6O2).М = 306.37. 1H-ЯМР (D2O, 5% CF3COOH): 0.50–1.30 (12 H, м, H2 – H7, Alk); 3.29 (1 H, м, H1, Alk); 3.59 (2 H, т, J 7.2, H8, Alk’); 7.72 (с, 1 H, H8, Base); 7.77 (1 H, с, H2, Base). 13C-ЯМР (D2O, 5% CF3COOH): 23.50 (C3, Alk); 24.91 (C2, Alk); 27.10 (C6, Alk); 27.38 (C7, Alk); 28.38 (C4, Alk); 29.13 (C5, Alk); 44.48 (C8, Alk); 52.39 (C1, Alk); 115.87 (C5, Base); 143.80 (C8, Base); 144.07 (C2, Base); 147.81 (C4, Base); 148.89 (C6, Base); 171.39 (COOH).
Список литературы
Комиссаров В.В., Крицын А.М. // Биоорган. химия. 2017. Т. 43. С. 650–654. [Komissarov V.V., Kritzyn A.M. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 669–672.]
Gmelin R. // Z. Physiol. Chem. 1959. V. 316. P. 164–169.
Швачкин Ю.П., Мишин Г.П., Коршунова Г.А. // Успехи химии. 1982. Т. LI. вып. 2. С. 314–331.
Коршунова Г.А. Нуклеоаминокислоты и нуклеоаминопептиды: дизайн ферментоустойчивых аналогов нейропептидов. Диссертация на соискание ученой степени доктора химических наук в форме научного доклада. 1993.
Lorenz K.B., Diederichsen U. // Lett. Peptide Science. 2003. V. 10. P. 111–117.
Blaskovich M.A.T. // J. Med.Chem. 2016. V. 59. P. 10807–10836.
Крицын А.М., Комиссаров В.В. // Биоорган. химия. 2004. Т. 30. С. 487–492. [ Kritzyn A.M., Komissarov V.V. // Russ. J. Bioorg. Chem. 2004. V. 30. P. 436–440.]
Комиссаров В.В., Панова Н.Г., Крицын А.М. // Биоорган. химия. 2008. Т. 34. С. 75–82. [Komissarov V.V., Panova N.G., Kritzyn A.M. // Russ. J. Bioorg. Chem. 2008. V. 34. P. 67–73.]
Комиссаров В.В., Крицын А.М. // Биоорган. химия. 2010. Т. 36. С. 514–525. [Komissarov V.V., Kritzyn A.M. // Russ. J. Bioorg. Chem. 2010. V. 36. P. 477–487.]
Макинский А.А., Крицын А.М., Ульянова Е.А., Захарова О.Д., Бугреев Д.В., НевинскийГ.А. // Биоорган. химия. 2001. Т. 27 С. 191–962. [Makinsky A.A., Kritzyn A.M., Ul’yanova E.A., Zakharova O.D., Bugreev D.V., Nevinsky G.A. // Russ. J. Bioorg. Chem. 2001. V. 27. P. 167–172.]
Макинский А.А., Крицын А.М., Ульянова Е.А., Захарова О.Д., Невинский Г.А. // Биоорган. химия. 2000. Т. 26. С. 732–742. [Makinsky A.A., Kritzyn A.M., Uljanova E.A., Zakharova O.D., Nevinsky G.A. // Russ. J. Bioorg. Chem. 2000. V. 26. № 10. P. 662–668.]
Комиссаров В.В., Княжанская Е.С., Атрохова А.В., Готтих М.Б., Крицын А.М. // Биоорган. химия. 2014. Т. 40. С. 578–587. [Komissarov V.V., Knyazhanskaya E.S., Atrokhova A.V., Gottikh M.B., Kritzyn A.M. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 532–540.]
Cheronis N.D., Spitzmuller K.H. // J. Org. Chem. 1941. V. 6. P. 349–375.
Sheehan J.C., Bolhofer W.A. // J. Amer. Chem. Soc. 1950. V. 72. P. 2786–2788.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия