Биоорганическая химия, 2019, T. 45, № 1, стр. 103-111
Поведение липофильных конъюгатов доксорубицина в липидном бислое липосом
А. С. Алексеева *, А. О. Чугунов *, **, П. Е. Волынский *, Н. Р. Онищенко *, Ю. Г. Молотковский *, Р. Г. Ефремов *, ***, **, И. А. Болдырев *, ****, Е. Л. Водовозова *
* ФГБУН Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН, Россия, 117997, Москва, ГСП-7, ул. Миклухо-Маклая, 16/10
** НИУ Высшая школа экономики, Москва, 101000, Россия
*** Московский физико-технический институт (ГУ), Долгопрудный, 141700, Россия
**** Национальный Исследовательский Технологический Университет МИСиС, Россия, 119049, Москва, Ленинский просп., 4
Поступила в редакцию 27.04.2018
После доработки 21.05.2018
Принята к публикации 04.06.2018
Аннотация
Получение липосомальных препаратов путем включения водорастворимых лекарств в липидный бислой в виде липофильных пролекарств представляет значительный интерес. Ранее мы синтезировали диолеоилглицеридный и олеоильный конъюгаты доксорубицина, предназначенные для встраивания в жидкофазный бислой липосом. В данной работе исследовано влияние структуры липидных производных доксорубицина на их поведение в бислоях из пальмитоилолеоилфосфатидилхолина и димиристоилфосфатидилхолина с помощью флуоресцентных методов и молекулярного моделирования. Показано, что конъюгаты обладают ограниченной подвижностью в липидном бислое, что во многом обусловлено образованием водородных связей между агликоном доксорубицина и фосфатными группами липидов. Молекулы липофильных конъюгатов также склонны к кластеризации в мембране липосом за счет взаимодействий между остатками доксорубицина. При этом олеоильные остатки вытягиваются параллельно ацильным цепям липидов. Олеоильный конъюгат сильнее взаимодействует с бислоем по сравнению с диглицеридным за счет образования большего количества водородных связей. Обнаруженные свойства производных доксорубицина могут способствовать их включению в липидный бислой в достаточных с точки зрения терапевтического эффекта количествах, а также внутриклеточному высвобождению антибиотика за счет ферментолиза.
ВВЕДЕНИЕ
Применение липосом в качестве систем доставки лекарств является на сегодня признанным подходом к повышению эффективности лечения и улучшению качества жизни онкологических больных [1]. На мировом рынке наномедицинских препаратов, предназначенных для системного введения, средства на основе липосом занимают лидирующую позицию. Известный пример успешного липосомального препарата для противоопухолевой терапии ― Doxil®/Caelyx® (также с 2013 г. доступен дженерик Lipodox®), который представляет собой пегилированные (то есть покрытые полиэтиленгликольными цепями для экранирования от захвата клетками ретикуло-эндотелиальной системы) липосомы диаметром около 100 нм с инкапсулированным антибиотиком доксорубицином [2]. Липидный бислой липосом названных препаратов построен из насыщенных фосфолипидов и холестерина, образующих жесткую “конденсированную” мембрану, устойчивую к преждевременному разрушению в кровотоке. В технологии производства этих препаратов используется метод эффективного инкапсулирования водорастворимых субстанций во внутренний объем липосом ― remote loading, то есть дистанционная, или, так называемая, активная загрузка, когда лекарство диффундирует через липидный бислой против градиентов концентраций некоторых солей [3]. Внутри липосомы лекарство накапливается в виде осадка, образуя, как правило, кристаллическую фазу, за счет чего повышается емкость наноразмерного носителя (мольное отношение лекарство/липиды достигает 0.2–0.25). При пассивном инкапсулировании раствора лекарства в липосомы получить терапевтически значимую концентрацию действующего вещества проблематично, поскольку внутренний водный объем наноразмерных носителей слишком мал. С другой стороны, метод активной загрузки осуществим только для амфифильных слабых кислот или оснований, в том числе для антибиотиков антрациклинового ряда, типа доксорубицина.
Липосомы Doxil®, при всех отмеченных выше достоинствах, имеют ряд недостатков, среди которых затрудненная интернализация клетками опухолей самого разного типа, а также слишком медленное внутриклеточное высвобождение доксорубицина [4, 5]. В связи с этим, продолжаются поиски других вариантов модификации доксорубицина (DOX), в том числе путем превращения в липидные производные с целью улучшения поглощения клетками [6–9]. DOX представляется удобным объектом для изучения механизмов действия его производных на (суб)клеточном уровне и in vivo с помощью флуоресцентных методов, так как он обладает собственной флуоресценцией в красной области спектра (λвозб/λисп 495/595 нм).
Молекула DOX состоит из тетрациклического антрахиноидного агликона доксорубицинона, соединенного гликозидной связью с аминосахаром даунозамином (рис. 1). Модификации по остатку даунозамина или по гидроксилу гидроксиацетильного остатка агликона не должны отражаться на оптических свойствах тетрациклического флуорофора в интересующей области спектра. Интересно, что скваленоильные эфиры DOX по гидроксилу гидроксиацетильного остатка способны самопроизвольно образовывать наночастицы оригинальной формы “loop-train”, которые на мышиных моделях показали усиление торможения роста опухолей на фоне уменьшения общей токсичности по сравнению с DOX [8]. Жирнокислотные ациламиды DOX также обладают цитотоксической активностью, хотя и пониженной по сравнению со сложноэфирными производными [6, 7, 9]. Это объясняется меньшей способностью к расщеплению внутриклеточными ферментами амидной связи, чем эфирной, в силу более высокой специфичности амидаз по сравнению с эстеразами [10].
Альтернативным способом нагрузки липосом водорастворимыми субстанциями является включение их в липидный бислой в виде липидных производных — липофильных пролекарств (см. обзоры [11–13]). Такая конструкция липосомальных препаратов способствует улучшению их фармакологических свойств: позволяет получить наноразмерные липосомы с приемлемой емкостью загрузки (причем при использовании упрощенной технологии производства), уменьшает вероятность потерь активной субстанции в ходе циркуляции в кровотоке и на стадии взаимодействия с клеткой-мишенью, способна облегчить внутриклеточную разгрузку за счет возможности прямого трансмембранного переноса амфифильного вещества. После интернализации клеткой липофильное пролекарство расщепляется эндогенными ферментами с высвобождением активного начала. Нами разработаны липосомы с жидкофазным липидным бислоем на основе природных фосфолипидов и диолеоилглицеридных сложноэфирных конъюгатов широко применяемых в клинике химиотерапевтических средств – алкилирующего агента мелфалана и метотрексата, антиметаболита фолиевой кислоты [14]. Противоопухолевая эффективность липосомальных препаратов подтверждена в экспериментах in vivo на моделях опухолей мышей [15, 16].
Ранее мы синтезировали диолеоилглицеридный конъюгат доксорубицина DOX-DG (рис. 1), предназначенный для включения в жидкофазный бислой липосом (неопубл. данные). Показано, что DOX-DG в составе 100-нм липосом эффективно поглощается клетками путем эндоцитоза (что важно для преодоления множественной лекарственной устойчивости, обусловленной функцией белков семейства АТР-связывающих кассет) [17]. Затем, с целью упрощения синтеза липофильного пролекарства, а также имея в виду его более быстрый, чем для DOX-DG, ферментолиз в клетке (в результате гидролиза DOX-Ole эстеразами образуется гидроксиацетиламид доксорубицина, последующий гидролиз которого амидазами с высвобождением DOX облегчен), был синтезирован олеоильный конъюгат DOX-Ole (рис. 1). Однако оказалось, что это производное плохо включается в липосомы.
Рис. 1.
Структуры доксорубицина (DOX), липидных конъюгатов DOX-Ole и DOX-DG, фосфолипидов (POPC, DMPC) и схематическое изображение липосомы.
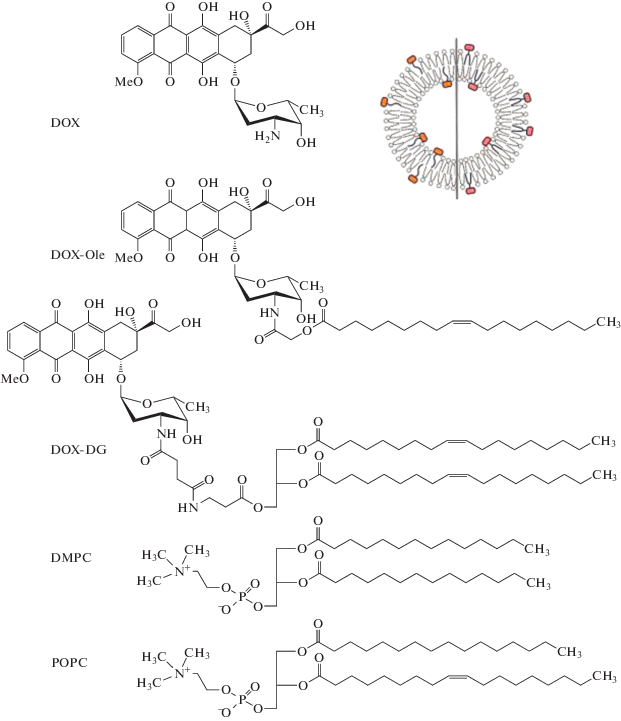
Цель настоящей работы — сравнение поведения липидных конъюгатов доксорубицина различной структуры в липидном бислое с помощью флуоресцентных методов и молекулярного моделирования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Флуоресцентные измерения
Анизотропия флуоресценции (поляризация флуоресценции, r) характеризует угол вращения молекулы в течение жизни возбужденного состояния и является мерой подвижности молекул. Одна из характеристик флуорофора – его внутренняя анизотропия r0, то есть максимально возможное значение анизотропии флуоресценции полностью неподвижной молекулы (ее измеряют в твердом растворе, например, в замороженном до –70°С пропиленгликоле). Для доксорубицина величина r0 равна 0.33 [18]. Степень поляризации флуоресценции уменьшается, когда флуорофоры получают возможность свободно вращаться. В водном растворе молекула DOX весьма подвижна – значение анизотропии r падает до 0.08 (табл. 1). При добавлении липосом в раствор доксорубицина анизотропия DOX возрастает до 0.14, что свидетельствует о связывании молекулы поверхностью липосом. Еще более высокие значения анизотропии флуоресценции наблюдаются для липидных производных DOX в липосомах – вплоть до значения 0.29 для конъюгата DОХ-Ole в липидном бислое из POPC. В этом случае подвижность остатка доксорубицина приближается к анизотропии полностью неподвижной молекулы – r0 (табл. 1).
Изменение значений анизотропии флуоресценции r при нагревании позволяет судить об изменении подвижности агликона DOX в липидном бислое: чем выше подвижность, тем ниже анизотропия. В свою очередь, подвижность молекулы в бислое определяется контактами с окружающими молекулами, фазовым состоянием бислоя (жидкокристаллическая либо гелевая фаза), а также возможным взаимодействием с другими молекулами флуорофора (образование димеров). Для измерений были выбраны фосфолипиды, образующие бислои с существенно различающимися температурами фазовых переходов Tm: POPC (Tm –2°C) и DMPC (Tm +24°C) [19]. Анизотропия интактного DOX в PBS линейно убывает от 0.08 до 0.05 при нагревании от 16 до 40°C. В присутствии липосом (из DMPC) значения r доксорубицина увеличиваются до 0.14 (16°С) и 0.10 (40°С).
Анизотропия DOX-DG и DOX-Ole в липидных бислоях может достигать высоких значений, что свидетельствует в пользу прочного удерживании пролекарств в мембране (рис. 2а). Для большинства мембранных зондов значения анизотропии гораздо ниже, например, для фосфатидилхолина, несущего BODIPY-группу при -Сω ацильного остатка в sn-2-положении, в бислое из DMPC r = 0.2 при 17°C [20]. Высокие значения rDOX можно объяснить образованием водородных связей между остатком DOX конъюгатов и полярными группами липидов.
Рис. 2.
Температурные зависимости анизотропии флуоресценции (а): 1.5% DOX-Ole (1, 2) и 1.5% DOX-DG (3, 4) в бислоях из POPC (1, 3) или DMPC (2, 4) и (б) зависимость анизотропии флуоресценции DOX-Ole от его содержания в бислое липосом из POPC (%): 0.375 (1), 1.5 (2), 0.75 (3), 3.0 (4). Приведены средние значения ±SЕ измерений.

В липосомах POPC анизотропия обоих производных монотонно уменьшается при нагревании, процесс осуществляется в жидкокристаллической фазе. Однако в случае липосом DMPC кривые имеют максимум при ~24°C. Мы предполагаем, что уменьшение значений r при понижении температуры ниже Tm может быть вызвано димеризацией остатков DOX в составе липофильных конъюгатов в бислое. Известно, что доксорубицин склонен к самоассоциации в водных растворах, и недавно показано, что внутренняя анизотропия его димеров равна –0.1 [18]. То есть увеличение доли димеров в системе снижает суммарную анизотропию флуоресценции DOX. Тогда увеличение анизотропии при нагревании ниже температуры фазового перехода в бислое из DMPC соответствует разрушению димеров DOX-Ole или DOX-DG. Образованием димеров объясняется также значительное падение анизотропии флуоресценции, наблюдаемое на примере DOX-Ole при увеличении его концентрации в бислое до 3% (рис. 2б).
Показано [21], что в растворе DOX образует два типа димеров – с параллельной и антипараллельной ориентацией в плоскости ароматических колец. Ранее [17] мы получали 100-нм липосомы, нагруженные DOX-DG, с помощью метода экструзии, в результате которого удается сформировать преимущественно моноламеллярные везикулы [22]. Применение такой методики в случае DOX-Ole не дало результата, как уже упоминалось во “Введении”. В данной работе для получения липосом мы использовали ультразвуковую дезинтеграцию, поэтому присутствие значительного пула мультиламеллярных везикул весьма вероятно. Следовательно, вполне возможно образование как антипараллельных, так и параллельных (более устойчивых) димеров DOX за счет димеризации молекул коньюгатов, находящихся в соседних бислоях. Такие димеры, по-видимому, могут возникать уже на начальной стадии получения липосом – при образовании гигантских мультиламеллярных везикул во время гидратации липидной пленки.
Молекулярная динамика
Чтобы изучить поведение производных доксорубицина в липидном бислое, мы провели расчеты молекулярной динамики (МД) модельных систем, в которых основой бислоя является POPC, при этом в каждый монослой помещали по шесть молекул DOX-DG или DOX-Ole. Целью данных расчетов была оценка поведения этих молекул в липидном бислое, для чего достаточно системы выбранного размера и длительности траектории 50 нс. За это время расчета все основные параметры (толщина бислоя, площадь на одну молекулу липида и параметры порядка ацильных цепей POPC) приходили к равновесным значениям (см. эксперимент. часть). Сходная схема расчета ранее использовалась при моделировании различных однокомпонентных бислоев [23], а также при тестировании силовых полей для МД-расчетов липидных систем [24]. Для набора более качественной статистики все расчеты были повторены трижды.
Расчеты показали, что гидрофобные хвосты DOX-DG/DOX-Ole лежат в области неполярных ацильных цепей POPC, а агликон доксорубицина (головка) “плавает” на границе раздела фаз бислой–вода (рис. 3). При этом головка DOX-DG в среднем расположена “выше” (дальше от центра бислоя), чем головка DOX-Ole (см. профили плотности на рис. 4а). В соответствии с этой картиной, остатки DOX-DG имеют бóльшую доступность растворителю (воде) и формируют больше водородных связей с молекулами воды (за исключением остатка углевода) (рис. 4б). Эти результаты подтверждают, что молекулы DOX-Ole сильнее взаимодействуют с бислоем и ограничены в подвижности (по сравнению с диглицеридным конъюгатом), в силу чего анизотропия флуоресценции для них выше.
Рис. 3.
Фрагменты молекулярной динамики DOX-Ole (а) и DOX-DG (б) в бислое POPC. Фосфатные группы представлены сферами, углеродные связи – линиями. На обоих рисунках слева отражено преимущественное расположение остатка DOX в составе молекул пролекарств, а справа — кластеры фрагментов DOX.
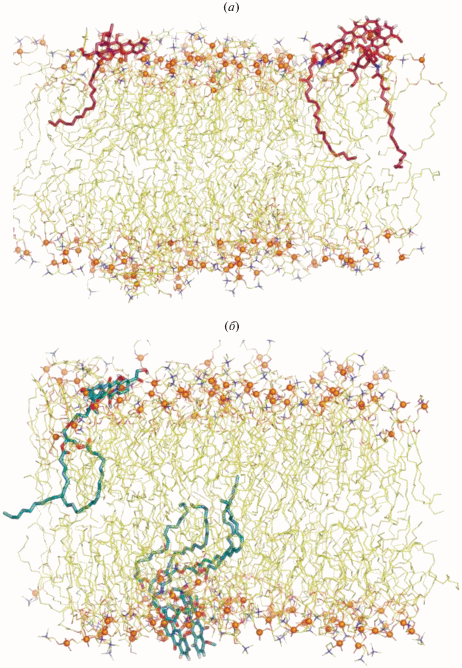
Рис. 4.
Анализ данных молекулярной динамики. (а) Профили плотности молекул DOX-Ole/DOX-DG и фосфатных групп POPC (POPC_P) вдоль нормали (Z) бислоя. (б) Количество водородных связей с молекулами воды, образуемых различными частями молекул DOX-Ole и DOX-DG. (в) Среднее по времени количество водородных связей, образованных различными частями пролекарств и липидов. Части молекул, участвующие в образовании H-связей: D – агликон DOX; С – углеводный остаток; PP – фосфатные группы POPC; PG – остаток глицерина POPC; О – другие группы. (г) Ориентация остатка DOX в составе молекул пролекарств относительно бислоя.
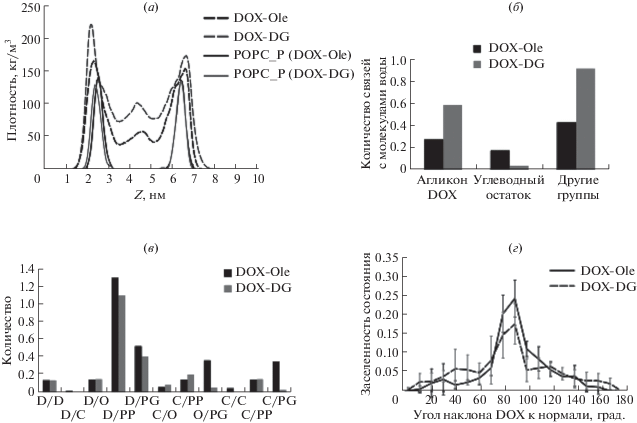
Анализ водородных связей, возникающих между производными доксорубицина и фосфолипидами, показал, что наибольшее их число образует агликон DOX (рис. 4в). При этом агликон чаще всего образует водородные связи с фосфатными группами POPC и реже – с глицериновыми. Интересно, что DOX-Ole образует заметно больше водородных связей по сравнению с DOX-DG (рис. 4в). Очевидно, именно эта особенность DOX-Ole приводит к большей анизотропии флуоресценции (таблица и рис. 2).
Большое число водородных связей агликона DOX с фосфатными группами липидов приводит к тому, что остаток доксорубицина в липофильных производных оказывается расположен параллельно поверхности бислоя. Причем в случае DOX-Ole (больше водородных связей) вероятность найти агликон в этом положении выше. Данное наблюдение подтверждается распределением углов наклона остатка доксорубицина по отношению к нормали к мембране: в случае DOX-Ole это более узкий пик вблизи 90° (агликон лежит в плоскости мембраны), чем в случае DOX-DG (рис. 4г), что подчеркивает более сильное взаимодействие с бислоем головки DOX-Ole и, следовательно, более высокую анизотропию флуоресценции, что и было измерено в эксперименте.
ЗАКЛЮЧЕНИЕ
Результаты настоящей работы показывают, что подвижность производных доксорубицина в бислое липосом ограничена не только латеральной диффузией липидов, но и образованием водородных связей между агликоном DOX и фосфатными группами липидов. Кроме того, молекулы липофильных конъюгатов DOX склонны к кластеризации в мембране липосом. При этом олеоильные остатки вытягиваются вдоль нормали к поверхности мембраны, приблизительно параллельно углеводородным цепям липидов, поскольку в такой конфигурации минимально возмущение упаковки ацильных цепей. Обнаруженные различия в свойствах диолеоилглицеридного и олеоильного производных доксорубицина могут влиять как на возможность их включения в липидный бислой в достаточных (с точки зрения терапевтического эффекта) количествах, так и на внутриклеточное высвобождение антибиотика за счет ферментолиза.
Ранее мы сравнили in vitro внутриклеточный транспорт доксорубицина и “жидкофазных” липосом, несущих DOX-DG [17]. Оказалось, что конъюгат задерживается в органеллах опухолевых клеток, что замедляет его проникновение в ядро (основную мишень DOX) по сравнению с самим доксорубицином. Наиболее вероятной причиной этого является встраивание липосом в мембраны органелл. Нам пока не известно, насколько сильно, с учетом ограничения подвижности конъюгатов в липидном бислое, замедляется их ферментолиз и высвобождение молекулы DOX. В отличие от изучаемых нами липосом, которые эффективно поглощаются опухолевыми клетками, липосомы Doxil® интернализуются с трудом [4, 5]. Недавно профессор Баренхольц (Barenholz), один из главных разработчиков DOXIL’a, предложил следующий механизм действия препарата, основанный на явлении повышенного глутаминолиза и вследствие этого накоплении аммиака в опухолях [5]: DOX из внутреннего объема липосом, экстравазировавших в опухоль, но не интернализованных клетками, диффундирует наружу против градиента концентрации аммиака (процесс, обратный активной загрузке липосом), а затем уже поступает в клетки. Следовательно, сравнивать противоопухолевый эффект различных липосомальных форм доксорубицина имеет смысл только в экспериментах in vivo, где суммируется действие физиологических барьеров как на тканевом, так и на (суб)клеточном уровне.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Синтезы rас-1,2-диолеоил-3-[доксорубицин-N-сукцинил-N'-(3- аминопропионил)]глицерина (DOX-DG) и N-олеоилоксиацетилдоксорубицина (DOX-Ole) будут описаны в отдельной статье. Использовали доксорубицин (DOX) от Лэнс-Фарма (Россия), 1-пальмитоил-2-олеоил-sn-глицерофосфохолин (POPC) и 1,2-димиристоил-sn-глицерофосфохолин (DMPC) фирмы “Avanti Polar Lipids” (США). Растворители очищали стандартными методами; упаривания проводили в вакууме при температурах не выше 40°С. Готовили фосфатно-солевой буфер PBS, pH 7.05 (КН2PO4, 0.2 г/л; NaH2PO4 ⋅ 2H2O, 0.15 г/л; Na2HPO4, 1.0 г/л; KCl, 0.2 г/л; NaCl, 8.0 г/л).
Получение липосомальных дисперсий. Дисперсии состава POPC(DMPC) – DOX-Ole/DOX-DG, 97 : 0.38–3 (моль/моль), 5 мкМ по пролекарству, получали cледующим образом: смесь липидов в требуемых соотношениях упаривали в круглодонных пробирках из растворов в хлороформе на роторном испарителе; липидные пленки высушивали в течение 40 мин при 7 Па (лиофильная сушилка “ИНЕЙ-4”; ИБП РАН, Россия), затем гидратировали РBS, подвергая 10-кратной процедуре замораживания/оттаивания (жидкий азот/+40°С), и обрабатывали на ультразвуковой бане (35 кГц; Сапфир, Россия) при комнатной температуре (или при нагревании до 35°С в случае дисперсий DMPC) в течение 30 мин. Концентрацию дисперсий липосом по DOX определяли спектрофлуориметрически, разбавляя аликвоты в 10 раз метанолом или подкисленным этанолом. Дисперсии липосом хранили при 4°С не более 2 недель.
Таблица 1.
Анизотропия флуоресценции (r) доксорубицина и его производных в водном растворе (PBS) и в дисперсиях липосом (PBS) при 16°С, а также внутренняя анизотропия DOX
| Препарат | DOX | DОХ-DG | DOX-Ole | ||||
|---|---|---|---|---|---|---|---|
| Липосомы | ─* | ─ (PBS) | DMPC | DMPC | POPC | DMPC | POPC |
| r | 0.33(r0) | 0.08 | 0.14 | 0.24 | 0.25 | 0.24 | 0.29 |
* В твердом растворе [18].
Флуоресцентная спектроскопия. Спектры флуоресценции регистрировали на спектрофлуориметре Hitachi F4000 (Япония) в зеркальных кюветах (ООО “Фотон-Век”, г. Пущино) объемом 300 мкл при длине волны возбуждения флуоресценции 475 нм и ширине щели 10 нм в интервале длин волн 595–700 нм при ширине щели 10 нм; скорость 120 нм/мин.
Для флуоресцентных измерений готовили 5 мкМ раствор доксорубицина в PBS. Для определения анизотропии флуоресценции DOX в присутствии DMPC 50 мкл раствора DOX добавляли к 250 мкл 15 мМ дисперсии DMPC и обрабатывали на ультразвуковой бане в течение 30 мин при 35°С. Температурные зависимости анизотропии флуоресценции DOX-DG/DOX-Ole в составе липосомальных дисперсий регистрировали с помощью жидкостного термостата CTE-22A Coolnics Circulator (Yamato-Komatsu, Япония). Рассеяние учитывали, снимая спектры флуоресценции дисперсии DMPC в отсутствие DOX.
Анизотропию флуоресценции определяли согласно выражению:
Молекулярное моделирование. Молекулярная динамика (МД) DOX-DG/DOX-Ole в бислое POPC была проведена с помощью программы GROMACS в силовом поле Gromos 43a2x. Система: 58 молекул POPC, 6 молекул DOX-Ole или DOX-DG в каждом монослое, около 5300 молекул воды. Размер ячейки: 6 × 6 × 8.8 нм3. Длительность траекторий МД: 50 нс × 3 для каждой системы (всего 6 траекторий). Температура: 315 K (термостат V-rescale). Давление: 1 бар (баростат Берендсена). Учет электростатических взаимодействий: метод PME (Particle Mesh Ewald). Анализ МД осуществляли, вычисляя следующие характеристики: среднюю площадь на молекулу липида; характерную толщину бислоев и профили плотности атомов; водородные связи и сольватацию; параметры порядка ацильных цепей; наклон “головки” доксорубицина; гидрофобные параметры экспонированных групп. Анализ водородных связей осуществляли с помощью стандартной утилиты GROMACS g_hbond, позволяющей оценивать факт образования таких связей между парами донор/акцептор, а также измерять время жизни водородных связей. Для анализа мы группировали доноры и акцепторы следующим образом: агликон DOX (D), углеводный остаток (С), фосфатные группы POPC (РР), остаток глицерина POPC (PG), другие группы (О).
БЛАГОДАРНОСТИ
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-79-20440), а также программы Президиума РАН “Молекулярная и клеточная биология” (А.О.Ч., Р.Г.Е.). Анализ данных МД был выполнен при поддержке Российского фонда фундаментальных исследований (проект № 16-04-00578). Авторы благодарны суперкомпьютерному центру “Политехнический” при СПбГУ за предоставленные вычислительные ресурсы.
Список литературы
Allen T.M., Cullis P.R. // Adv. Drug Deliv. Rev. 2013. V. 65. P. 36–48.
Barenholz Y. // J. Control. Release. 2012. V. 160. P. 117–134.
Zucker D., Marcus D., Barenholz Y., Goldblum A. // J. Control. Release. 2009. V. 139. P. 73–80.
Jung S.H., Seong H., Cho S.H., Jeong K.S., Shin B.C. // Int. J. Pharmaceutics. 2009. V. 382. P. 254–261.
Silverman L., Barenholz Y. // Nanomedicine. 2015. V. 11. P. 1841–1850.
Chhikara B.S., Mandal D., Nicole St.J., Parang K. // Eur. J. Med. Chem. 2011. V. 46. P. 2037–2042.
Chhikara B.S., Mandal D., Parang K.J. // J. Med. Chem. 2012. V. 55. P. 1500–1510.
Maksimenko A., Dosio F., Mougin J., Ferrero A., Wack S., Reddy L.H., Weyn A.A., Lepeltier E., Bourgaux C., Stella B., Cattel L., Couvreur P. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. E217–226.
Song Y.F., Liu D.Z., Cheng Y., Liu M., Ye W.L., Zhang B.L., Liu X.Y., Zhou S.Y. // Sci. Rep. 2015. V. 5. P. 16125. doi 10.1038/srep16125
Liederer B.M., Borchardt R.T. // J. Pharm. Sci. 2006. V. 95. P. 1177–1195.
Mura S., Bui D.T., Couvreur P., Nicolas J. // J. Control. Release. 2015. V. 208. P. 25–41.
Irby D., Du C.G., Li F. // Mol. Pharmaceutics. 2017. V. 14. P. 1325–1338.
Kapoor B., Gupta R., Singh S.K., Gulati M., Singh S. // Adv. Coll. Interface Sci. 2018. V. 253. P. 35–65.
Водовозова Е.Л., Кузнецова Н.Р., Кадыков В.А., Хуцян С.С., Гаенко Г.П., Молотковский Ю.Г. // Рос. нанотехнол. 2008. Т. 3. № 3–4. С. 162–172. [Vodovozova E.L., Kuznetsova N.R., Kadykov V.A., Khutsyan S.S., Gaenko G.P., Molotkovskii J.G. // Nanotechnologies in Russia. 2008. V. 3(3–4). Р. 228–239.]
Kuznetsova N.R., Stepanova E.V., Peretolchina N.M., Khochenkov D.A., Boldyrev I.A., Bovin N.V., Vodovozova E.L. // J. Drug Target. 2014. V. 22. P. 242–250.
Alekseeva A.S., Moiseeva E.V., Onishchenko N.R., Boldyrev I.A., Singin A.S., Budko A.P., Shprakh Z.S., Molotkovsky J.G., Vodovozova E.L. // Int. J. Nanomedicine. 2017. V. 15. P. 3735–3749.
Кузнецова Н.Р., Свирщевская Е.В., Скрипник И.В., Зарудная Е.Н., Бенке А.Н., Гаенко Г.П., Молотковский Ю.Г., Водовозова Е.Л. // Биол. мембраны. 2012. Т. 29. № 5. С. 329–339. [Kuznetsova N.R., Svirshchevskaya E.V., Skripnik I.V., Zarudnaya E.N., Benke A.N., Gaenko G.P., Molotkovskii Yu.G., Vodovozova E.L. // Biochemistry (Moscow) Suppl. Series A: Membrane and Cell Biol. 2013. V. 7(1). P. 12–20.]
Changenet-Barret P., Gustavsson T., Markovitsi D., Manet I., Monti S. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 2937–2944.
Silvius J.R. // Lipid–Protein Interactions. New York: John Wiley & Sons, Inc., 1982.
Омельков А.В., Павлова Ю.Б., Болдырев И.А., Молотковский Ю.Г. // Биоорган. химия. 2007. Т. 33. № 5. С. 544–549. [Omel’kov A.V., Pavlova Iu.B., Boldyrev I.A., Molotkovskii Iu.G. // Bioorg. Khim. 2007. V. 33(5). P. 544–549.]
Agrawal P., Barthwal S.K., Barthwal R. // Eur. J. Med. Chem. 2009. V. 44. P. 1437–1451.
Hope M.J., Bally M.B., Webb G., Cullis P.R. // Biochim. Biophys. Acta. 1985. V. 812(1). P. 55–65.
Polyansky A.A., Volynsky P.E., Nolde D.E., Arseniev A.S., Efremov R.G. // J. Phys. Chem. B. 2005. V. 109(31). P. 15052–15059.
Jämbeck J.P.M., Lyubartsev A.P. // J. Phys. Chem. B. 2012. V. 116(10). P. 3164–3179.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


