Биоорганическая химия, 2019, T. 45, № 1, стр. 58-68
Получение и характеризация нейтрализующего моноклонального антитела против вируса бешенства
Е. Н. Ильина *, О. Н. Солопова **, ***, Д. С. Балабашин ****, М. В. Ларина ****, Т. К. Алиев *****, Т. В. Гребенникова ******, М. А. Лосич ******, О. Н. Зайкова ******, П. Г. Свешников **, Д. А. Долгих *, ****, М. П. Кирпичников *, *****
* Московский государственный университет им. М.В. Ломоносова, биологический факультет, Россия, 119991, Москва, Ленинские горы, д. 1, стр. 12
** Всероссийский научный центр молекулярной диагностики и лечения, Москва, 117149 Россия
*** ФГБУ “Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина” Минздрава России, Москва, 115478 Россия
**** Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997 Россия
***** Московский государственный университет им. М.В. Ломоносова, химический факультет, Москва, 119991 Россия
****** ФГБУ “Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи” МЗ РФ, Москва, 123098 Россия
Поступила в редакцию 28.05.2018
После доработки 08.06.2018
Принята к публикации 19.06.2018
Аннотация
Бешенство – это зоонотическое заболевание, для которого в настоящее время не разработано эффективных методов лечения после наступления клинических симптомов. Поликлональные сыворотки, как человеческие, так и лошадиные, наравне с вакцинами являются значимыми агентами в рамках профилактики заболевания. Однако из-за неблагоприятных побочных реакций на введение иммуноглобулинов животного происхождения, высокой стоимости и ограниченной доступности более безопасной человеческой сыворотки, поликлональные иммуноглобулины необходимо заменить на стабильный и эффективный препарат, которым являются антирабические нейтрализующие рекомбинантные моноклональные антитела (мАТ). В результате экспрессии в клетках CHO нами получено гуманизированное мАТ 1С5, которое связывается с антигенным сайтом (АС) III гликопротеина вируса бешенства (RABVG) и демонстрирует высокую вируснейтрализующую активность в флуоресцентном вируснейтрализующем тесте (FAVN).
ВВЕДЕНИЕ
Ежегодно от бешенства по всему миру погибает более 60 000 человек [1, 2]. Причиной развития данного заболевания является вирус, принадлежащий к роду Lyssavirus семейства Rhabdoviridae. Геном вируса представлен одноцепочечной РНК отрицательной полярности. Вирус поражает преимущественно центральную нервную систему, в результате чего развивается фатальный энцефалит. Существующий подход по предотвращению заболевания заключается в использованиии мер предэкспозиционной и постэкспозиционной профилактики. Предэкспозиционная профилактика состоит в вакцинации и особенно важна для лиц, планирующих посетить или проживающих в районах с высоким уровнем заболеваемости бешенством. Постэкспозиционная профилактика (ПЭП) включает в себя введение поликлональных вируснейтрализующих иммуноглобулинов (RIG) и вакцинацию. Использование поликлональных иммуноглобулинов человека (HRIG) и лошадиных иммуноглобулинов (ERIG), сопровождается определенными проблемами, которые можно было бы устранить путем создания гуманизированных или полностью человеческих мАТ, обладающих нейтрализующими свойствами по отношению к вирусу бешенства.
Первостепенная задача всех профилактических средств – не дать вирусу попасть в клетки для дальнейшего размножения, т.е. блокирование вирусных частиц до проникновения внутрь клетки. В вирусном заражении ключевую роль играет белок G (гликопротеин), который взаимодействует с рецепторами ( nAchR, NCAM и NGFR), обеспечивающими проникновение вируса внутрь клетки путем клатрин-опосредованного эндоцитоза [3]. Гликопротеин является основным поверхностным антигеном вируса, стимулирующим развитие иммунного ответа. Таким образом, для предотвращения развития вирусного заражения антитело должно связываться именно с белком G и проявлять вируснейтрализующую активность.
Таблица 1.
Результаты исследования антирабической активности образцов антител методом FAVN с использованием культурального фиксированного штамма вируса бешенства CVS-11
| Образец | Значения антирабической активности, МЕ/мг |
|---|---|
| Полноразмерное мышиное мАТ 1С5 | 579.3 |
| Гуманизированный Fab-фрагмент 1С5 | 95.3 |
| Гуманизированный F(ab')2-фрагмент 1С5 | 76.5 |
| Гуманизированное мАТ 1С5 | 631.8 |
| CR4098 | 463.3 |
| CR57 | 212.3 |
В структуре гликопротеина вируса бешенства (RABVG), состоящего из 505 аминокислотных остатков, в настоящее время выделяют 8 антигенных сайтов (АС) [4]. АС различаются уровнем изменчивости аминокислотных остатков, и, естественно, наиболее предпочтительны для терапевтического использования те антитела, на специфическое связывание которых наиболее вариабельные остатки оказывают минимальное влияние [4]. На данный момент известно три нейтрализующих мАТ, которые уже достигли третьей стадии клинических испытаний. Это препарат компании Crucell CL184 [5–7], представляющий собой комбинацию двух человеческих мАТ, CR57 [8] и CR4098 [9] и человеческое мАТ RABV1(17C7) [10, 11].
Интерес к данному направлению исследований и актуальность получения новых терапевтических антител для экстренной профилактики бешенства не ослабевает. Это обусловлено необходимостью поиска более эффективных антител, специфичных к широкому набору подтипов вируса, циркулирующих в природе.
На предыдущем этапе работы нами был создан гуманизированный аналог мышиного моноклонального антитела 1С5 в виде Fab-фрагмента к RABVG [12]. Рекомбинантные антитела довольно часто используют в виде фрагментов, однако такие конструкции не могут осуществлять элиминацию вируса посредством механизма антителозависимой клеточной цитотоксичности, кроме того фрагменты антител менее стабильны, и за счет меньшей молекулярной массы выводятся из организма быстрее, чем полноразмерные антитела. С учетом того, что известные перспективные антитела CR57, CR4098 и RABV1 – это полноразмерные молекулы IgG, логическим продолжением нашей работы стало получение полноразмерного гуманизированного мАТ 1С5 в качестве нового кандидата для экстренной постэкспозиционной профилактики бешенства у людей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее была проведена гуманизация мышиного мАТ 1С5 методом пересадки гипервариабельных участков мышиного мАТ на каркасные области человеческого антитела [12, 13]. Гуманизированное антитело 1C5 было получено в виде Fab и F(ab')2 фрагментов в результате экспрессии в дрожжевых клетках Pichia pastoris GS115.
Хотя фрагменты антител могут рассматриваться как альтернатива полноразмерным человеческим мАТ ввиду более простого производственного процесса и меньшей себестоимости, их применение ограничивается меньшим периодом полувыведения, а также отсутствием Fc-области, что исключает возможность активации механизма антителозависимой клеточной цитотоксичности. При этом есть данные об отсутствии или значительном снижении нейтрализующей активности у моновалентных форм фрагментов антител. [14–16].
Для получения полноразмерного гуманизированного антитела 1С5 была использована транзиентная экспрессия в клетках CHO. Клеточная линия СНО наиболее часто используемая система для лабораторного и промышленного производства рекомбинантных белков; в частности, на ее основе возможно получение терапевтических функционально-активных полноразмерных мАТ. Основными ее преимуществами являются высокая производительность, осуществление желаемого гликозилиривания и правильный фолдинг белков, а также простота выделения препарата.
Клетки CHO трансфицировали двумя плазмидами, сконструированными на основе вектора pcDNA3.4, несущими отдельно легкую (LC) и тяжелую (HC) цепи гуманизированного мАТ 1С5. Такой подход позволяет регулировать соотношение легкой и тяжелой цепей антитела для оптимизации экспрессии. В случае продукции тяжелой цепи в отсутствие легкой, первая накапливается в эндоплазматическом ретикулуме. При этом такие молекулы тяжелой цепи антитела имеют неправильную пространственную организацию, из-за чего подвергаются деградации в протеасомах. Легкие цепи способствуют сворачиванию и секреции тяжелых цепей, а также замедляют деградацию белков с неправильной структурой. Избыток легких цепей в клетках-продуцентах может минимизировать накопление тяжелых цепей и увеличивать скорость сборки и фолдинга молекул антитела [17].
В нашей работе мы при трансфекции клеток также использовали избыток плазмиды, кодирующей LC, по отношению к плазмиде, кодирующей HC. Для создания полноразмерного мАТ 1С5 был выбран изотип тяжелой цепи IgG1. Стоит отметить, что подавляющее число терапевтических препаратов антител приходится на долю IgG, а именно изотипа IgG1 [18, 19]. Данный класс иммуноглобулинов в норме преобладает в сыворотке крови человека по сравнению с остальными классами (IgA, IgM, IgE и IgD), при этом наибольшее содержание в крови характерно для антител IgG1-изотипа, которые составляют 60% от всех молекул класса IgG [20]. Антитела, относящиеся к изотипу IgG1, обеспечивают антителозависимую клеточную цитотоксичность и активацию системы комплемента – механизмы, необходимые для вирусной нейтрализации. Также антитела IgG1-изотипа характеризуются длительным временем полужизни в кровотоке, что делает их более пригодными для терапевтического применения, чем, например, антитела IgG3-изотипа [21].
К 5'-концу последовательности каждой из цепей, LC и HC, была присоединена нуклеотидная последовательность лидерного пептида, необходимая для секреторной экспрессии антитела, и последовательность Козак, вводимая для инициации трансляции. Цепи были клонированы под контроль промотора CMV (рис. 1а). Данная система экспрессии характеризуется секрецией целевого белка в среду культивирования, правильным фолдингом белковой молекулы, гликозилированием молекулы белка и позволяет получать за короткие промежутки времени полноразмерные антитела в функционально-активном виде в количествах, достаточных для иммунохимического анализа, определения аффинности и изучения их нейтрализующей активности [22].
Рис. 1.
Выделение и очистка гуманизированного мАТ 1С5. (а) – схема экспрессионной кассеты для получения полноразмерных мАТ в клетках CHO с использованием транзиентной экспрессии, (б) – электрофорез гуманизированного мАТ 1С5 в 10% SDS-ПААГ в невосстанавливающих (1) и восстанавливающих (2) условиях. М – маркеры молекулярных масс, (в) – аналитическая гель-фильтрационная хроматография (колонка Superdex 200-10/300-GL) мАТ 1С5, выделенного на протеин-А-сефарозе; время выхода пика – 30.417 мин; время выхода маркерных белков, мин: ферритин (44 кДа) – 26.08, альдолаза (150 кДа) – 31.17, кональбумин (75 кДа) – 34.7.
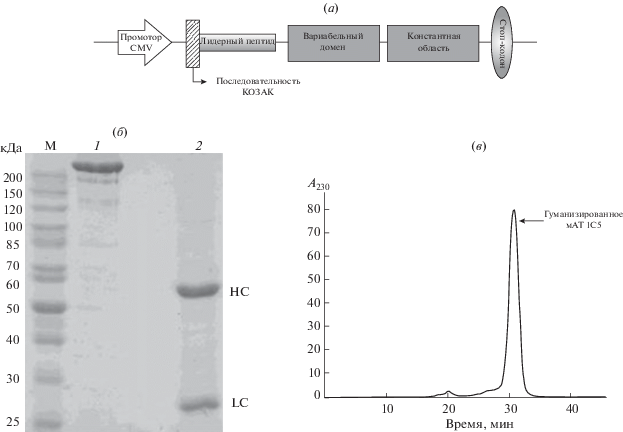
Белок выделяли с помощью аффинной хроматографии на протеин-А-сефарозе. Обе цепи антитела, HC и LC, были выявлены в растворимом белковом препарате, выделенном из супернатанта в результате экспрессии в клетках CHO, как основные полосы, мигрирующие в ПААГ в соответствии с ожидаемыми молекулярными массами 52 и 28 кДа, соответственно (рис. 1б, в). Продуктивность используемой нами транзиентной системы экспрессии составила от 120 до 150 мг/л. Чистота полученного образца рекомбинантного мАТ 1C5 составила не менее 98%.
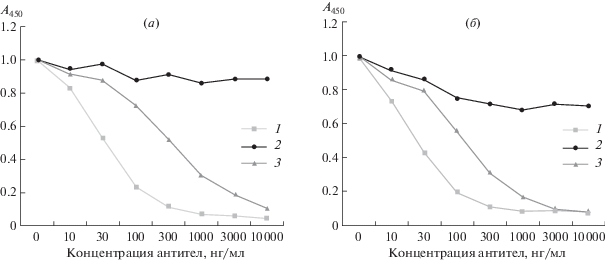
Результатами непрямого иммуноферментного анализа с использованием нативного RABVG (штамм “Внуково-32”) в качестве антигена была подтверждена функциональная активность мАТ 1С5 в тесте in vitro (рис. 2).
Рис. 2.
Связывание с RABVG гуманизированного мАТ 1С5 (1), мАТ CR4098 (2), мАТ CR57 (3). Взаимодействие гуманизированного мАТ 1С5, мАТ CR4098 и мАТ CR57 с нативным RABVG было установлено с помощью непрямого ИФА и выражено как значение оптической плотности, зарегистрированное при длине волны 450 нм. RABVG сорбировали на планшет в концентрации 10 мкг/мл.

Для исследования вируснейтрализующей активности гуманизированного мАТ 1С5 а также его рекомбинантных Fab- и F(ab')2-фрагментов и родительского мышиного полноразмерного мАТ 1С5, использовали тест FAVN с применением культурального фиксированного штамма вируса бешенства CVS-11. Дополнительно в тестирование были включены в качестве положительных контролей два известных мАТ к RABVG, CR57 и CR4098, с подтвержденной нейтрализующей активностью в тестах не только in vitro, но и in vivo [23]. Вируснейтрализующую активность всех исследуемых антител определяли в сравнении с международным стандартом ВОЗ антирабического иммуноглобулина с известной активностью и рассчитывали в МЕ/мг. Результаты теста FAVN (таблица) показали, что гуманизированное мАТ 1С5 является высоконейтрализующим антителом, как и антитела сравнения CR57 и CR4098.
Наряду с этим необходимо отметить, что антирабическая активность полноразмерного гуманизированного мАТ 1С5 значительно превосходит активность его фрагментов. Данный факт можно объяснить стабильностью молекулы гуманизированного полноразмерного мАТ 1С5 по сравнению с F(ab')2-фрагментом, а также наличием двух участков связывания антигена, в то время как Fab-фрагмент обладает только одним участком связывания RABVG.
Другой важной характеристикой препаратов на основе мАТ является сила связывания антитела с антигеном. Константу диссоциации комплекса антиген-антитело полученного полноразмерного мАТ 1С5 определяли методом конкурентного ИФА по Фриге и др. [24]. Нативный RABVG, выделенный из вирусных частиц штамма “Внуково-32”, сорбировали в лунки планшета в концентрации 1 мкг/мл. Полученная кривая связывания в координатах Клотца [25] приведена на рис. 3.
Рис. 3.
Кривая Клотца связывания RABVG для гуманизированного мАТ 1С5 (1), где Ао и А – оптическое поглощение (λ450) раствора антитела в отсутствие антигена и раствора свободных антител в смеси антиген – антитело, а – молярная концентрация антигена.

Значение константы диссоциации комплекса гуманизированного мАТ 1С5 и RABVG было определено как 6.6 × 10–9 М. Для расчетов использовали молекулярную массу RABVG, который представлен в виде тримера, – 201 кДа [26]. Также вычисляли среднее стандартное отклонение для четырех точек титрования, которое составило 1.3 × 10–9 М.
Как следует из представленных данных, полученное полноразмерное гуманизированное мАТ 1С5 обладает высоким сродством к RABVG.
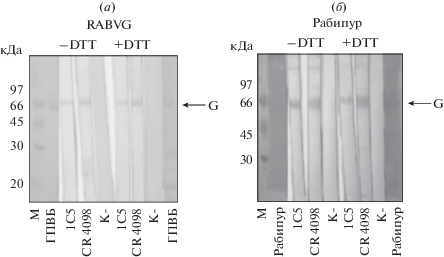
Специфичность взаимодействия гуманизированного мАТ 1С5 с RABVG была также подтверждена с помощью иммуноблоттинга с нативным RABVG (штамм “Внуково-32”) и вакцинным препаратом “Рабипур”, содержащим инактивированный вирус бешенства (штамм Flury-LEP). Иммобилизованный после электрофоретического разделения в восстанавливающих и невосстанавливающих условиях на нитроцеллюлозной мембране нативный RABVG или вакцинный препарат инкубировали в растворе с мАТ 1С5 или контрольным мАТ CR4098. Результаты иммуноблоттинга демонстрируют, что оба антитела связываются с одной и той же белковой полосой, мигрирующей в ПААГ на уровне 66 кДа, что соответствует мономерной форме RABVG (рис. 4).
Рис. 4.
Вестерн-блот-анализ связывания гуманизированного мАТ 1С5 (на рис. а и б) и мАТ CR4098 (на рис. а и б) с высокоочищенным RABVG (а) и с вакциной Рабипур (штамм Flury-LEP) (б). Образцы были нанесены в невосстанавливающих условиях (–DTT) без кипячения пробы и в восстанавливающих условиях (+DTT) с кипячением пробы. М – маркеры молекулярных масс, К- – отрицательный контроль.
Чтобы определить, с каким АС взаимодействует мАТ 1С5, был проведен ряд экспериментов с использованием метода ИФА по изучению конкуренции при связывании с RABVG экспериментального гуманизированного мАТ 1С5 и двух референтных антител CR57 и CR4098 (рис. 5). Ранее в работе [23] было показано, что контрольные мАТ CR57 и CR4098 распознают АС I и АС III RABVG соответственно. Анализируя результаты ИФА, мы предполагали, что если участки связывания двух антител перекрываются, то это будет выражаться в значительной конкуренции за связывание между исследуемым мАТ 1С5 и референтным антителом.
Рис. 5.
Конкурентный ИФА гуманизированного мАТ 1С5 (1), мАТ CR57 (2), мАТ CR4098 (3) с конъюгатами пероксидазы хрена с гуманизированным мАТ 1С5 – мАТ 1С5–ПХ (а) и мАТ CR4098–ПХ (б), где B и Во – оптическое поглощение (λ 450 нм) в присутствии конкурирующего антитела и без добавления конкурирующего антитела.
Результаты конкурентного ИФА (рис. 5) показывают, что мАТ 1С5 конкурирует с мАТ CR4098. Полученные данные позволяют сделать вывод о взаимодействии мАТ 1C5 с АС III (рис. 6). АС III является консервативным и считается второй по значимости антигенной детерминантой вируса бешенства, с которой взаимодействуют нейтрализующие антитела [27–29]. Данный АС включает аминокислотные остатки 330–338, наиболее вариабельными из которых являются 332, 333, 336, 338 [4, 30].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие реактивы и клетки: питательная среда DMEM, питательная среда RPMI 1640, питательная среда OptiCHO (Invitrogen, США), раствор пенициллин-стрептамицин-фунгизон (Anti-anti) (Invitrogen, США), флаконы и планшеты для культивирования эукариотических клеток (Greiner Bio One, США), планшеты для ИФА (Corning Costar, США), планшеты для ИФА Nunc Maxisorp (Thermo Scientific, США), однокомпонентный субстрат тетраметилбензидин (TMB) (НПО “Биотест Системы”, Россия), Tween20, эндонуклеазы рестрикции (Thermo Scientific, США), ДНК-полимераза Tersus (Евроген, Россия), вектор pALTA (Евроген, Россия), T4-ДНК-лигаза (Thermo Scientific, США), (DMSO (Sigma), бактоагар, дрожжевой экстракт, триптон (BD, Франция), штаммы E. coli XL1_Blue (a, b 3 recA1 endA1 gyrA96 thi_1 hsdR17 supE44 relA1 lac [F' proABlacIqZΔM15 Tn10 (Tetr)]) (Stratagene, США). Остальные химические реактивы были получены из коммерческих источников и использованы без предварительной очистки.
Конструирование экспрессионного вектора для получения мАТ 1C5 в клетках СНО. Вариабельные домены тяжелой (variable heavy, VH) и легкой цепи (variable light, VL) гуманизированного мАТ 1С5 были амплифицированы с использованием полученных ранее плазмидных векторов [13] для экспрессии гуманизированного Fab-фрагмента антитела 1С5 в Pichia pastoris, и праймеров, на концы которых были введены последовательности, перекрывающиеся с началом константного домена легкой κ-цепи человека и константного домена CH1 тяжелой цепи IgG1 человека, соответственно, с одной стороны, и с 3'-концом лидерного пептида с другой. Далее посредством объединения лидерного пептида, вариабельного домена и константных доменов легкой, либо тяжелой цепей иммуноглобулина человека были получены кодирующие последовательности тяжелой (heavy chain, HC) и легкой (light chain, LC) цепей гуманизированного мАТ 1С5. Для этого была проведена ПЦР с перекрывающимися областями (SOE-ПЦР) с использованием внешних праймеров, содержащих сайты узнавания рестриктаз NheI и XhoI (отмечены подчеркиванием) (соответственно, для легкой цепи: (5') tcaatgctagcctcaaaatgaagttg и (5') gtctcgagctaacactctcccctgttg; для тяжелой цепи: (5') atctagctagctaaaagatgagagtgct и (5') cttctcgagtcatttacccggagacag). Также на 5'-конец каждой цепи антитела была добавлена последовательность Козак (для LC: ctcaaa, для HC: taaaag). Гуманизированное полноразмерное мАТ 1С5 нарабатывали, используя транзиентную экспрессию в клетках CHO, для чего была выбрана биплазмидная система на основе вектора pcDNA 3.4. Экспрессионные кассеты LC и HC были клонированы по сайтам NheI/XhoI в вектор pcDNA3.4 под контроль промотора CMV (рис. 1а).
Транзиентная экспрессия мАТ 1С5 в клетках CHO. Для секреторной экспрессии рекомбинантного гуманизированного антитела 1С5 в культуральную среду, были использованы клетки CHO. За 24 ч до трансфекции клетки были пересеяны в концентрации 4 × 106 клеток/мл в колбу Эрленмейера, содержащую 30 мл культуральной среды. Трансфекцию клеток проводили с использованием липофектамина (Invitrogen, США) согласно рекомендациям производителя и комбинации очищенных векторных конструкций, содержащих отдельно гены LC и HC целевого антитела. Культивирование продолжали в течение 14 сут при температуре 37°С в атмосфере, содержащей 8% CO2, при постоянном перемешивании на орбитальном шейкере со скоростью 130 об./мин до снижения количества живых клеток в культуре до уровня 0.3 × 106 клеток/мл.
После завершения культивирования клетки осаждали центрифугированием при скорости вращения 1200 об./мин в течение 10 мин, затем супернатант, содержащий мАТ 1С5, центрифугировали в течение 15 мин при скорости вращения 4000 об./мин и стерилизовали раствор мАТ фильтрованием через мембрану с размером пор равным 0.22 мкм. До выделения супернатант хранили при температуре 4°С.
Выделение и очистка мАТ 1С5. SDS-ПААГ. Очистку гуманизированного мАТ 1С5 проводили методом аффинной хроматографии на протеин-А-сефарозе Mab Select (GE Healthcare, США) в соответствии с рекомендациями производителя. Целевой белок с колонки элюировали 0.1 М глициновым буфером (рН 3.0), полученные фракции нейтрализовали путем добавления 1 М Tris-HCl (pH 8.0) в соотношении 1/10 часть от объема глицинового буфера.
Наличие и чистоту целевого белка в полученных фракциях анализировали с помощью электрофореза в восстанавливающих и невосстанавливающих условиях в 10% ПААГ по методу Лэммли [31]. В каждую лунку вносили по 3 мкг исследуемого образца. В качестве стандартов молекулярных масс использовали смесь белков (Thermo Fisher Scientific, США) 10–200 кДа. Для разделения белка в восстанавливающих условиях образец анализировали в присутствии 2-меркаптоэтанола. Чистоту препарата определяли с помощью аналитической гель-фильтрационной хроматографии на колонке Superdex 200-10/300-GL (GE Healthcare, США) в 100 мМ Tris-HC- буфере (pH 8.0), содержащем 150 мМ NaCl, а также денситометрическим методом, для чего гель после электрофореза сканировали в камере ChemiDoc™ XRS+ System (BIO-RAD, США) и обрабатывали изображение при помощи программного обеспечения Quantity One® 1-D Analysis Software # 170-9600 (BIO-RAD, США). Антитело, элюированное с колонки, диализовали против фосфатно-солевого буфера (PBS) pH 7.4 и стерилизовали фильтрацией через мембрану с размером пор 0.22 мкм. Концентрацию целевого белка определяли спектрофотометрически на приборе NanoPhotometer P300 (IMPLEN, Германия).
Гликопротеин вируса бешенства (RABVG). Для иммуноферментного анализа и иммуноблотинга в качестве антигена использовали нативный высокоочищенный RABVG, штамм “Внуково-32”, предоставленный А.В. Киктенко, ФГУП “Предприятие по производству бактерийных и вирусных препаратов Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН”, который является основой при производстве отечественной антирабической вакцины КОКАВ.
Получение кодирующих последовательностей контрольных мАТ CR57 и CR4098, их экспрессия и выделение. Последовательности вариабельных областей контрольных антител взяты из патента US007959922B2. Получение вариабельных доменов тяжелой и легкой цепей контрольных антител CR57 и CR4098, проявляющих нейтрализующую активность против вируса бешенства, осуществляли методом химико-ферментативного синтеза. Последовательности VL и VH контрольных мАТ были синтезированы из перекрывающихся олигонуклеотидов с помощью ПЦР. Олигонуклеотиды имели длину от 40 до 50 оснований, при этом они попарно перекрывались между собой (10–12 оснований) и имели приблизительно одинаковую температуру отжига (~50°С). Вариабельные домены были объединены с лидерным пептидом и константными областями, соответствующими изотипам, описанным в патентах на мАТ CR57 и мАТ CR4098. Также на 5'-конец каждой цепи антитела была добавлена последовательность Козак, важная для инициации трансляции, после чего легкая и тяжелая цепи контрольных антител были клонированы отдельно в экспрессионый вектор pcDNA 3.4. мАТ CR57 и CR4098 были наработаны в клетках CHO и очищены с помощью аффинной хроматографии на протеин-А-сефарозе, как описано выше для мАТ 1C5.
Определение Kd. Равновесную константу диссоциации комплекса мАТ 1С5 с RABVG определяли согласно методу Фриге и др. [24] с использованием уравнения Клотца Ао/(Ао – А) = 1 + 1/аKd [25], где Ао – оптическое поглощение (λ450) раствора антитела в отсутствие антигена, А – оптическое поглощение (λ450) раствора свободных антител в смеси антиген антитело, а – молярная концентрация антигена, М.
На первом этапе в результате проведения непрямого ИФА была получена калибровочная кривая, позволяющая установить диапазон концентраций мАТ 1С5, при которых зависимость оптического поглощения (А450) от разведения мАТ 1С5 имеет близкий к линейному вид, что позволяет использовать упрощенный метод для расчета Kd. Далее для постановки конкурентного ИФА в рамках определения Kd была выбрана концентрация мАТ 1С5 (10 нг/мл) и разведения RABVG (8; 4; 2; 1; 0.5 и 0.025 мкг/мл), соответствующие линейному участку калибровочной кривой.
На иммунологический планшет, блокированный 0.25% раствором желатина, наносили RABVG в серийных двукратных разведениях, в концентрации от 16 до 0.5 мкг/мл (каждое разведение наносили на планшет в трех повторах), а также оставляли лунки без RABVG, в которые наносили только PBS, по которым определяли значение Ао. В каждую лунку затем добавляли мАТ 1С5 до конечной концентрации 10 нг/мл. Инкубировали 2 ч при комнатной температуре до установления равновесия, после чего смеси антиген-антитело переносили на другой планшет, на который заранее был сорбирован RABVG в концентрации 10 мкг/мл, и проводили непрямой ИФА для определения концентрации свободных антител. Эксперимент осуществляли с использованием нативного RABVG и пероксидазного коньюгата, специфичного к κ-цепи иммуноглобулина человека (ВНЦМДЛ, Россия).
Иммуноблотинг. Способность мАТ 1С5 взаимодействовать с RABVG и вирусными частицами вакцинных штаммов вируса бешенства исследовали методом иммуноблотинга. На первом этапе проводили электрофоретическое разделение RABVG и вирусных частиц (вакцина Рабипур, Индия) с помощью электрофореза в 12% ПААГ (SDS-ПААГ) в невосстанавливающих условиях без кипячения и в восстанавливающих условиях, с добавлением дитиотреитола с кипячением. Затем осуществляли электрофоретический перенос (электроблоттинг) разделенных белков из геля на твердую подложку, в качестве которой использовали нитроцеллюлозную мембрану с размером пор 0.45 мкм (ADVANTEC, Япония). Свободные места на мембране блокировали 5% раствором бычьего сывороточного альбумина (BSA) в PBS в течение ночи при температуре 4°C, и три раза промывали PBS-Т (10 мМ K2HPO4, pH 7.5, 0.145 M NaCl, 0.05% Tween20). Далее нитроцеллюлозную мембрану помещали в раствор исследуемого мАТ 1С5 с концентрацией 10 мкг/мл, отрицательный контроль (полученное в нашей лаборатории мАТ против интерлейкина-17А) и инкубировали 1 ч при температуре 37°C. После этого мембрану промывали три раза PBS, добавляли пероксидазный конъюгат антивидовых поликлональных антител против IgG человека и инкубировали в течение 1 ч при температуре 37°C. Далее мембрану промывали пять раз раствором PBS-T, содержащим 0.2% Tween20, добавляли субстрат (3,3-диаминобензидин, 4-хлор-1-нафтол и перекись водорода), и инкубировали 10–15 мин, после чего останавливали реакцию, промывая мембрану водой.
ИФА. Непрямой ИФА использовали для определения способности гуманизированного мАТ 1С5 взаимодействовать с RABVG в сравнении с контрольными антителами CR57 и CR4098. Планшет покрывали раствором RABVG (10 мкг/мл) в PBS, блокировали 5% раствором BSA в PBS, после чего добавляли исследуемые мАТ. Планшет инкубировали с мАТ в течение 1 ч при комнатной температуре, после чего промывали раствором PBS-Т, содержащим 0.05% Tween20, пять раз. Затем на планшет наносили раствор антивидовых поликлональных антител против человеческого иммуноглобулина, конъюгированных с пероксидазой хрена (ВНЦМДЛ, Россия). Планшет промывали раствором PBS-Т, содержащим 0.05% Tween20, семь раз, после чего в каждую лунку добавляли проявляющий субстрат тетраметилбензидин (ТМБ). После развития окраски реакцию останавливали 10% раствором серной кислоты. Оптическое поглощение измеряли на спектрофотометре Microplate Reader 680 (BioRad, США) при длине волны 450 нм.
Определение участка связывания RABVG гуманизированным мАТ 1С5 с помощью конкурентного ИФА. мАТ CR57, CR4098 и 1С5 конъюгировали с пероксидазой хрена периодатным методом [32]. RABVG сорбировали в концентрации 10 мкг/мл в PBS в течение ночи при температуре 4°С, затем планшет промывали PBS-Т. Антитела титровали в планшете, начиная с концентрации 10 мкг/мл, используя трехкратные разведения. К ним добавляли пероксидазные конъюгаты антител (мАТ – ПХ) с постоянной концентрацией. Конъюгаты антител предварительно титровали в прямом ИФА, по результатам которого выбирали оптимальные разведения. Смесь антител с конъюгированными антителами переносили на планшет с RABVG, и инкубировали 1 ч при температуре 37°C. После этого планшет промывали раствором 0.05% PBS-Т пять раз и добавляли раствор субстрата ТМБ. Реакцию останавливали 10% раствором серной кислоты. Оптическое поглощение измеряли на спектрофотометре Multiscan (Thermo Scientific, США) при длине волны 450 нм. Кривые конкуренции строили по зависимости В/Во от концентрации неконъюгированных антител для каждого конъюгата, где B – оптическое поглощение в присутствии конкурирующего антитела, Во – оптическое поглощение при использовании конъюгата без добавления конкурирующего антитела.
Определение антирабической вируснейтрализующей активности мАТ. Изучение специфической вируснейтрализующей активности рекомбинантного полноразмерного гуманизированного мАТ 1С5, а также рекомбинантного Fab- и F(ab')2-фрагментов гуманизированного антитела 1С5 и исходного мышиного полноразмерного мАТ 1С5 проводили в лаборатории молекулярной диагностики ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи”, аккредитованной ANSES (Nancy, France) Laboratory for Rabies and Wildlife OIE, по бешенству и лиссавирусам. Определение антирабической активности осуществляли с помощью флуоресцентного вируснейтрализующего теста (fluorescent antibody virus neutralization, FAVN) согласно [33].
Тест FAVN проводили с использованием Стандарта ВОЗ (WHO) антирабического иммуноглобулина, International Laboratory For Biological Standards, Copenhagen, Denmark: Second International Standard for Rabies Immunoglobulin (30 IU/ml of Rabies Antibodies in the amp.) и Стандарта European Pharmacopoeia Reference Standard Human rabies immunoglobulin BPR, Strasburg. Batch: 1.1, Id: 004X14, 91 IU/ml. Тестируемые антитела и вирус бешенств штамм CVS-11 инкубировали в течение 1 ч при температуре 37°С в атмосфере, содержащей 5% CO2, после чего эта смесь была использована для заражения клеток ВНК-21 С13 (АТСС CCL-10) в количестве 2 × 104 клеток в каждой лунке. Плашки инкубировали в течение 48 ч при 37°С (5% CO2), после чего удаляли среду, лунки промывали PBS и фиксировали клетки с помощью 80% ацетона. Окрашивание проводили путем добавления меченного флуоресцеинизотиоцианатом (FITC) моноклонального антирабического антитела (Fujirebio Diagnostics, США). После 30 мин инкубации при температуре 37°С в атмосфере, содержащей 5% CO2, лунки были дважды промыты PBS. Результат анализа учитывали с помощью флуоресцентной микроскопии, расчеты были выполнены по формуле Спирмена-Кербера:
${\text{lg (к о н е ч н о е р а з в е д е н и е )}} = - \left( {{{x}_{0}} - \frac{d}{2} + d\sum {\frac{{{{r}_{i}}}}{{{{n}_{i}}}}} } \right),$
х0 = –(lg наименьшего разведения антитела, при котором во всех лунках наблюдается сигнал при окрашивании меченным FITC антирабическим антителом (положительные лунки)),
d = lg этапа разведения,
ni = количество воспроизведений,
ri = количество положительных лунок.
Сравнение полученных значений титров испытуемых сывороток с титром положительной стандартной сыворотки позволяет выразить титры испытуемых сывороток в международных единицах (МЕ/мл), которые в дальнейшем были пересчитаны с учетом концентраций исследуемых образцов и представлены в МЕ/мг для корректного сравнения активности образцов.
ЗАКЛЮЧЕНИЕ
При выполнении данной работы, мы руководствовались информацией, публикуемой ВОЗ, о необходимости замены антирабического иммуноглобулина RIG на доступный и эффективный альтернативный препарат для экстренной профилактики бешенства на основе моноклональных нейтрализующих антител минимально иммуногенных для человека [34]. Нами было получено мАТ 1C5 (631.8 МЕ/мг), которое связывается с одним из значимых эпитопов гликопротеина вируса бешенства, АС III, и нейтрализует его в тесте in vitro. Гуманизированная природа данного антитела позволяет использовать его в рамках постэкспозиционной профилактики бешенства у людей. мАТ 1С5 является перспективным кандидатом для создания препарата, заменяющего поликлональный сывороточный иммуноглобулин.
БЛАГОДАРНОСТИ
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках федеральной целевой программы “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы” (уникальный идентификатор проекта RFMEFI60716X0154).
Список литературы
Fooks A.R., Banyard A.C., Horton D.L., Johnson N., McElhinney L.M., Jackson A.C. // Lancet. 2014. V. 11. P. 1389–1399.
Fisher C.R., Streicker D.G., Schnell M.J. // Nature Reviews Microbiology. 2018. V. 16. P. 241–255.
Lafon M. // J. Neurovirol. 2005. V. 11. P. 82–87.
Kuzmina N.A., Kuzmin I.V., Ellison J.A., Rupprecht Ch.E. // J. Antivir. Antiretrovir. 2013. V. 5. P. 37–43.
Crucell Holland BV. A Randomized Phase II Trial to Compare the Safety and Neutralizing Activity of CL184 in Combination with Rabies Vaccine vs. HRIG or Placebo in Combination with Rabies Vaccine in Healthy Adult Subjects. Available from: https://clinicaltrials.gov/ show/NCT00656097, registered on: September 2011.
Crucell Holland B.V. Randomized Phase II Trial on Safety and Neutralizing Activity of CL184 and Rabies Vaccine Versus Human Rabies Immune Globulin (HRIG) and Rabies Vaccine in Children and Adolescents. Available from: https://clinicaltrials.gov/ show/NCT00708084, registered on: March 2012.
Crucell Holland B.V. Rabies Virus Neutralizing Activity and Safety of CL184, a Monoclonal Antibody Cocktail, in Simulated Rabies Post–Exposure Prophylaxis in Healthy Adults. Available from: https://clinicaltrials.gov/ct2/show/study/NCT01228383, registered on: April 2013.
Dietzschold B., Gore M., Casali P., Ueki Y., Rupprecht C.E., Notkins A.L., Koprowski H. // J. Virol. 1990. V. 64. P. 3087–3090.
Kramer R.A., Marissen W.E., Goudsmit J., Visser T.J., Clijsters–Van der Horst M., Bakker A.Q., de Jong M., Jongeneelen M., Thijsse S., Backus H.H., Rice A.B., Weldon W.C., Rupprecht C.E., Dietzschold B., Bakker A.B., de Kruif J. // Eur. J. Immunol. 2005. V. 35. P. 2131–2145.
Sloan S.E., Hanlon C., Weldon W., Niezgoda M., Blanton J., Self J., Rowley K.J., Mandell R.B., Babcock G.J., Thomas W.D., Rupprecht C.E., Ambrosino D.M. // Vaccine. 2007. V. 25. P. 2800–2810.
Serum Institute of India Ltd. A Phase II/III, Randomized, Multi–Centric, Comparator–Controlled Study of the Safety and Neutralizing Activity of a Human Monoclonal Antibody to Rabies (SII RMAb) Administered in Conjunction with Rabies Vaccine for Post–Exposure Prophylaxis in Patients following Potential Rabies Exposure, CTRI/2012/05/002709. Available from: http://www.ctri.nic.in/Clinicaltrials/pmaindet2.php? trialid=4191, registered on: November 2012.
Беневоленский С.В., Зацепин С.С., Клячко Е.В., Морозкина Е.В., Позднякова Л.П., Свешников П.Г., Солопова О.Н., Шемчукова О.Б., Ягудин О.Б. Гуманизированные антигенсвязывающие фрагменты (Fab) против вируса бешенства, изолированный фрагмент ДНК, кодирующий Fab против вируса бешенства, клетка дрожжей, трансформированная фрагментом днк, и способ получения Fab против вируса бешенства с использованием дрожжей. RU2440412 (C2). 2012.
Свешников П.Г., Ягудин Т.А., Морозкина Е.В., Клячко Е.В., Зацепин С.С., Беневоленский С.В., Шемчукова О.Б., Позднякова Л.П., Солопова О.Н. // Вестник Московского университета. 2010. V. 51. С. 185–190.
Drew P.D., Moss M.T., Pasieka T.J., Grose C., Harris W.J., Porter A.J. // J. Gen. Virol. 2001. V. 82. P. 1959–1963.
Hultberg A., Temperton N.J., Rosseels V., Koenders M., Gonzalez-Pajuelo M., Schepens B., Itati Ibanez L., Vanlandschoot P., Schillemans J., Saunders M., Weiss R.A., Saelens X., Melero Jose A., Verrips C.Th., Gucht S.V., de Haard H.J. // PLoS One. 2011. V. 6. e17665.
Тиллиб С.В., Иванова Т.И., Васильев Л.А., Метлин А.Е., Логунов Д.Ю., Тутыхина И.Л., Алексеева С.В., Народицкий Б.С., Гинцбург А.Л. Тримеризованное однодоменное антитело, специфически связывающееся с гликопротеином g вируса бешенства, нейтрализующее вирус бешенства. RU2533802 (C1). 2014.
Schlatter S., Stansfield S.H., Dinnis D.M., Racher A.J., Birch J.R., James D.C. // Biotechnol. Prog. 2005. V. 21. P. 122–133.
Salfeld J.G. // Nature Biotechnology. 2007. V. 25. P. 1369–1372.
Schroeder H.W., Cavacini Jr., Cavacini L. // J Allergy Clin Immunol. 2010. V. 125. P. 41–52.
Jefferis R. // Expert Opin. Biol. Ther. 2007. V. 7. P. 1401–1413.
Alyanakian M.A., Bernatowska E., Scherrmann J. M., Aucouturier P., Poplavsky J.L. // Vox Sang. 2003. V. 84. P. 188–192.
Birch J.R., Racher A.J. // Advanced drug delivery reviews. 2006. V. 5–6. P. 671–685.
de Kruif J., Bakker A.B., Marissen W.E., Kramer R.A., Throsby M., Rupprecht C.E., Goudsmit J. // Annu. Rev. Med. 2007. V. 58. P. 359–368.
Gaudin Y., Ruigrok R.W., Tuffereau C., Knossow M., Flamand A. // Virology. 1992. V. 187. P. 627–632.
Lafon M., Wiktor T.J., Macfarlan R.I. // J. Gen. Virol. 1983. V. 64. P. 843–851.
Muller T., Dietzschold B., Ertl H., Fooks A.R., Freuling C., Fehlner–Gardiner C., Kliemt J., Meslin F.X., Franka R., Rupprecht C.E., Tordo N., Wanderler A.I., Kieny M.P. // PLoS Negl. Trop. Dis. 2009. 3, e542.
Benmansour A., Leblois H., Coulon P., Tuffereau C., Gaudin Y., Flamand A., Lafay F. // J. Virol. 1991. V. 65. P. 4198–4203.
De Benedictis P., Minola A., Rota Nodari E., Aiello R., Zecchin B., Salomoni A., Foglierini M., Agatic G., Vanzetta F., Lavenir R., Lepelletier A., Bentley E., Weiss R., Cattoli G., Capua I., Sallusto F., Wright E., Lanzavecchia A., Bourhy H., Corti D. // EMBO Molecular Medicine. 2016. V. 8. P. 407–421.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Friguet B., Chaffotte A.F., Djavadi-Ohaniance L., Goldberg M.E. // J. Immunol. Meth. 1985. V. 77. P. 305–319.
Klotz I. M. // The Proteins. 1953. V. 1. P. 727–806.
Tijssen P., Kurstak E. // Analytical Biochemistry. 1984. V. 136. P. 451–457.
International Office of Epizootics. Biological Standards Commission, International Office of Epizootics. International Committee. Manual of diagnostic tests and vaccines for terrestrial animals: mammals, birds and bees // Office international des épizooties, 2008. V. 2.
WHO consultation on a rabies monoclonal antibody cocktail for rabies post exposure treatment. Geneva // WHO. 2002.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



