Биоорганическая химия, 2019, T. 45, № 1, стр. 40-51
Регуляция агрегации самоассоциирующихся пептидов нитропроизводными азолоазина, в том числе N-концевого фрагмента β-амилоидного пептида Альцгеймера
О. А. Миргородская *, Ю. П. Козьмин **, А. В. Протасов *, И. Ю. Торопыгин ***, В. А. Олейников **, ****
* ФГБУ НИИ гриппа, Санкт-Петербург, Россия
** Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Россия, 117997, Москва ГСП-7, ул. Миклухо-Маклая, 16/10
*** Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича РАМН, Москва, Россия
**** Национальный исследовательский ядерный университет МИФИ (Московский инженерно-физический институт), Москва, Россия
Поступила в редакцию 27.04.2018
После доработки 25.05.2018
Принята к публикации 08.06.2018
Аннотация
Показана перспективность применения нитросоединений класса азолоазинов в качестве регуляторов агрегации природных пептидов, склонных к самоассоциации, на примере фрагмента β-амилоидного пептида Альцгеймера (βАР) и цитолитического пептида пчелиного яда мелиттина (Melittin). В зависимости от типа применяемого производного азолоазина происходит либо ассоциация пептида с образованием нерастворимой формы, либо ассоциация подавляется, вплоть до растворения ранее образовавшегося ассоциата. Определены участки и стехиометрия связывания азолоазинов с исследуемыми пептидами в образующихся ассоциатах. Обнаруженные эффекты объясняются уникальной способностью нитропроизводных азолоазинов диссоциировать в водных растворах с образованием стабильного ароматического аниона, имеющего электростатическое сродство к основным аминокислотным остаткам молекул пептидов. Этим же свойством нитроазолоазинов была обусловлена проверка их способности проявлять регуляторные функции в процессах агрегации. Полученные данные указывают на перспективность использования нитропроизводных азолоазинов в качестве индукторов или ингибиторов агрегации β-амилоидного пептида Альцгеймера, а возможно и других пептидов, образующих амилоидные отложения.
ВВЕДЕНИЕ
Самоассоциация пептидов, в ряде случаев сопровождающаяся их агрегацией, является достаточно распространенным явлением в биологических средах. Известно, что ряд антимикробных пептидов, таких как протегрин и мелиттин, в результате самоассоциации образуют каналы в мембранах микроорганизмов, приводя к их гибели [1–4].
Известен ряд химических веществ, способных искусственно индуцировать ассоциацию биологических полимеров. Явления как самоассоциации, так и индуцированной ассоциации (например, за счет наночастиц [5–7]), лежат в основе возникновения целого ряда патологических процессов в организме человека. Среди них актуальна болезнь Альцгеймера, сопровождающаяся ассоциацией пептидов βAP(1–40)–βAP(1–42), наблюдаемых в организме человека в виде бляшек [8]. В этой связи представляется важным выявление веществ, которые могли бы быть ингибиторами этих процессов.
Причем существует еще альтернативная гипотеза, что отложения этих ассоциатов на стенках сосудов являются не причиной болезни, а защитной реакцией организма по предотвращению нежелательного взаимодействия βAP с тау-белком, агрегация которого приводит к деменции [9]. В этой связи индукторы, стимулирующие запуск процессов ассоциации, также могут представлять определенный медицинский интерес.
Как показали данные наших экспериментов, в качестве индукторов и ингибиторов подобных процессов могут выступать азолоазины – синтетические аналоги пуриновых оснований [10]. Одно из таких соединений, а именно натриевая соль 2-метилтио-6-нитро-1,2,4-триазоло-[5,1-c]-1,2,4-триазин-7-она, в настоящее время выпускается под торговым названием Триазоверин (TZV) в качестве противовирусного препарата [11–13].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения влияния азолоазинов на процесс агрегации пептидов были выбраны пептиды двух типов (табл. 2). Это аналог N-концевого фрагмента β-амилоидного пептида Альцгеймера βAP*(1–21), с преобладанием кислых функциональных групп, и склонный к ассоциации пептид мелиттин с преобладанием основных функциональных групп. Пептиды с разной функциональной активностью были выбраны для того, чтобы понять общность воздействия азолоазинов на объекты белковой природы, не связывая это воздействие с функциональными свойствами конкретных пептидов.
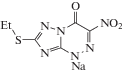
Таблица 1.
Структура использованных азолоазинов и их краткие названия, использованные в тексте данной статьи
| TZ (триазид) | TZV (триазоверин) | 2H315N3-TZV-стандарт | TZV-A | TZV-B |
|---|---|---|---|---|
 |
 |
 |
 |
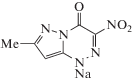 |
В табл. 1 представлены структурные формулы азолоазинов, а в табл. 2 – аминокислотные последовательности использованных в экспериментах пептидов. Заметим, что пептид βAP*(1−21) является фрагментом β-амилоидного пептида Альцгеймера (βAP), образующего скопления в виде амилоидных бляшек в организме больных болезнью Альцгеймера, а мелиттин − положительно заряженный токсичный пептид из яда пчел. Ассоциаты последнего способны встраиваться в мембраны бактериальных клеток, формируя в их мембранах поры, способные приводить к гибели клеток.
В водных растворах оба пептида хорошо растворимы, однако после внесения в их растворы триазоверина (TZV) все они теряют свою растворимость (табл. 3: № 1, № 5).
Таблица 3.
Изменение агрегатного состояния пептидов мелиттина и βAP*(1–21) в их 0.5 мМ водных растворах в присутствии добавок
| № | 0.5 мМ Мелиттин |
0.5 мМ βAP*(1–21) |
12.5 мМ TZV |
25 мМ NH4HCO3 |
62.5 мМ NaCl |
0.25% TFA |
Осадок |
|---|---|---|---|---|---|---|---|
| 1 | + | – | + | – | – | – | + |
| 2 | + | – | + | + | – | – | + |
| 3 | + | – | + | + | + | – | + |
| 4 | + | – | + | – | – | + | + |
| 5 | – | + | + | – | – | – | + |
| 6 | – | + | + | + | – | – | – |
| 7 | – | + | + | + | + | – | – |
| 8 | – | + | + | – | – | + | + |
Влияние состава среды на агрегацию пептидов βAP*(1–21) и мелиттина в присутствии TZV, как индуктора агрегации. Азолоазины в виде своих натриевых солей нацело диссоцируют в воде с образованием нейтральных растворов. Причина тому – рассредоточение отрицательного заряда аниона по всей объемной ароматической системе, благодаря чему равновесие в водном растворе сильно сдвинуто в сторону диссоциированной формы.
В случае мелиттина эксперимент проводили в бикарбонатном буфере (NH4HCO3) с pH 7.8 (близко к физиологическим условиям), поскольку мелиттин – основный пептид, и буфер его агрегации не мешает. Тогда как в экспериментах с βAP*(1–21) бикарбонатный буфер не использовался, поскольку βAP*(1–21) – кислый пептид и в этом буфере осадков с TZV не образует. Из-за отсутствия буфера пришлось контролировать pH среды: водный раствор βAP*(1–21) при концентрации 1 мМ имел pH = 6.5 и оставался таким же в надосадочной жидкости и после добавления TZV. Тем не менее, в отсутствии TZV оба использованных пептида растворимы в широком диапазоне pH, а поэтому эффект седиментации не может быть приписан изменению pH среды из-за смешения растворов.
Результаты экспериментов по влиянию различных добавок на агрегацию пептидов βAP*(1–21) и мелиттина в водной среде представлены в табл. 3: № 2–4, № 6–8.
Из полученных данных следует, что в случае пептида βAP*(1–21) присутствие 25 мМ NH4HCO3 препятствует агрегации, обычно вызываемой TZV (табл. 3: № 6), тогда как в случае мелиттина ни одна из использованных добавок инициированной агрегации не препятствует.
Причина столь разного поведения объясняется различием в содержании остатков основных и кислых аминокислот. Так, в составе молекулы мелиттин полностью отсутствуют кислые остатки, но присутствует множество основных, способных к взаимодействию с анионом TZV, несущим противоположный заряд. Тогда как в составе молекулы пептида βAP*(1–21), кроме основных кислот, присутствуют три кислых аминокислотных остатка, которые в ионизированной форме имеют, как и TZV, отрицательный заряд.
Этому объяснению не противоречит и тот факт, что агрегация пептида βAP*(1–21) сохраняется даже в присутствии трифторуксусной кислоты (TFA) (табл. 3: № 3, № 8), которая подавляет ионизацию остатков карбоксилсодержащих аминокислот.
Использование MALDI-MS для количественного определения содержания пептидов и TZV в смесях. Количественное определение пептидов βAP*(1–21) и мелиттин в осадках ассоциатов и надосадочной жидкости над осадками проводили с использованием масс-спектрометрического метода MALDI-MS в режиме положительных ионов, с учетом особенностей масс-спектрометрической детекции пептидов в присутствии азолоазинов.
Количественное определение пептида βAP*(1–21). Для определения пептида βAP*(1–21) был получен стандарт пептида βAP*(1–21) с включенными в него атомами стабильного изотопа 18О. Получение стандарта осуществляли путем изотопного обмена в сильно кислой среде, как это описано в работах [14–16]. Изотопное распределение исходного соединения и полученного из него стандарта (в виде их смеси) представлено на рис. 1. Из спектра видно, что кислороды всех 5 карбоксильных групп (Glu + Asp + концевая COOH) проявили способность замещаться на изотоп 18О. И, как следствие, позволило получить идеальный внутренний стандарт для количественного анализа из-за полного отсутствия перекрывания между паттернами анализируемого вещества и стандарта.
Расчет исходной концентрации пептида проводили по данным MALDI-MS анализа. Концентрации рассчитывали из сопоставления суммарных площадей изотопных распределений ионов пептида и его смеси со стандартом с известной концентрацией, согласно методике, описанной в работах [14–16].
Количественное определение пептида мелиттина. Определение мелиттина проводили по спектрам MALDI-MS продуктов его триптического гидролиза, применяя в качестве внутреннего стандарта тех же продукты гидролиза, меченных путем изотопного обмена, изотопом по C-концевым карбоксильным группам, аналогично описанному выше подходу для βAP*(1–21).
Необходимость использования трипсинолиза обусловлена тем, что мелиттин не содержит остатков дикарбоновых аминокислот, а его C‑концевая карбоксильная группа амидирована. и, следовательно, в этом случае отсутствует возможность введения изотопной 18O-метки в исходную молекулу путем обмена. Тогда как у продуктов трипсинолиза появляются свободные карбоксильные группы, в которую метку ввести уже можно.
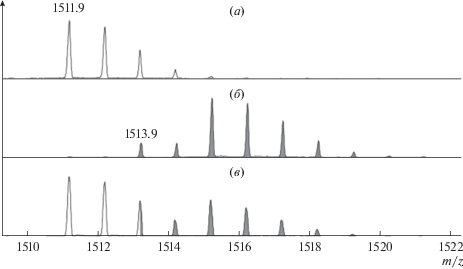
Из двух продуктов предельного гидролиза выбран “маркерный” фрагмент мелиттина Mel(6–16) с m/z = 1511.9 с последовательностью VLTTGLPALISWIK и наибольшей интенсивностью в спектре (рис. 2а). Из гидролизата, путем изотопного обмена в C-концевых карбоксильных группах, был получен меченный стандарт (рис. 2б), который добавляли к триптическому гидролизату анализируемой пробы. А из соотношения интенсивностей меченных и немеченых ионов “маркерного” фрагмента (рис. 2в) рассчитывали концентрацию анализируемого пептида в пробе.
Рис. 2.
Фрагмент MALDI-MS спектра триптического пептида Mel(6–16) в гидролизате (а), продукта его изотопного обмена, используемого в качестве стандарта [18O]Mel(6–16) (б), и смеси этого пептида со стандартом (в).
Количественное определение TZV и его аналогов. Концентрацию TZV определяли с использованием MALDI-MS в режиме отрицательных ионов, применяя в качестве стандарта его изотопно-замещенный аналог TZV-A, синтезированный с изотопами 2H и 15N из изотопно-замещенных реактивов (табл. 1). На рис. 3 в качестве примера представлены данные масс-спектрометрического анализа по определению его концентрации в осадке (табл. 4: № 3) Концентрацию TZV-A определяли из относительной интенсивности его иона по сравнению с ионом TZV.
Рис. 3.
Фрагмент масс-спектра с изотопными распределениями для TZV и его стандарта TZV-A (затемненные сигналы в спектре) при анализе осадка (табл. 4: № 3).

Таблица 4.
Результаты визуальной оценки изменения агрегатного состояния 0.5 мМ раствора βAP* (1–21) в присутствии азолоазинов и результаты количественного определения всех компонентов смесей в осадках и надосадочных жидкостях
| № | TZ | TZV | TZV-B | TZV-A | Пиридин | Осадок | ||
|---|---|---|---|---|---|---|---|---|
| визуально | βAP* (1–21) | TZV | ||||||
| мМ | мМ | |||||||
| 1 | 5 | – | – | – | – | – | – | – |
| 2 | – | 5 | – | – | – | + | 0.24 | 0.5 |
| 3 | – | 7.5 | – | – | – | + | 0.43 | 0.81 |
| 4 | – | 10 | – | – | – | + | 0.48 | 1.02 |
| 5 | – | – | 5 | – | – | – | – | – |
| 6 | – | – | – | 5 | – | + | 0.24 | 0.47 |
| 7 | 4.5 | 5 | – | – | – | + | 0.26 | 0.5 |
| 8 | – | 5 | 4.5 | – | – | – | – | – |
| 9 | – | 10 | 4.5 | – | – | – | – | – |
| 10 | – | 25 | 4.5 | – | – | ± | – | – |
| 11 | – | 25 | 2.5 | – | – | + | – | – |
| 12 | – | 25 | 0.5 | – | – | + | – | – |
| 13 | – | 5 | – | 4.5 | – | + | 0.5 | 0.48 TZV 0.42 TZV-A |
| 14 | – | 5 | – | – | 4.5 | – | – | – |
| 15 | – | 10 | – | – | 4.5 | – | – | – |
| 16 | – | 20 | – | – | 4.5 | – | – | – |
| 17 | – | 25 | – | – | 4.5 | ± | – | – |
| 18 | – | 25 | – | – | 2.5 | + | – | – |
Для прочих азолоазинов концентрации определяли из соотношения интенсивностей их ионов с интенсивностью ионов TZV-A по предварительно построенным калибровочным кривым. Так для TZV и TZV-A было показано экспериментально, что соотношение интенсивностей этих соединений пропорционально соотношению их концентраций, как это показано в качестве примера на рис. 3.
Изменение агрегатного состояния βAP*(1–21) и мелиттина в зависимости от количества добавленного TZV и его аналога. Разработка метода количественного анализа компонентов, участвующих в изменении агрегатного состояния пептидов в присутствии азолоазинов, позволила в последующих экспериментах дополнить визуальные наблюдения количественными данными по их содержанию в осадках и в надосадочной жидкости. Полученные результаты представлены в табл. 4 для βAP*(1–21), а в табл. 5 для мелиттина. В случае пептида βAP*(1–21) эксперименты проводили в водных растворах, а в случае мелиттина в растворе бикарбонатного буфера (25 мМ NH4HCO3). Условия выбраны с учетом результатов, ранее представленных в табл. 3.
Таблица 5.
Результаты визуальной оценки изменения агрегатного состояния 0.25 мМ раствора мелиттина в присутствии азолоазинов и их смесей, а также результаты количественного определения компонентов смесей и расчет соотношения пептидов и азолоазинов в осадках и надосадочных жидкостях
| № | TZ | TZV | TZV-B | TZV-A | Пиридин | Осадок | ||
|---|---|---|---|---|---|---|---|---|
| визуально | мелиттин | TZV | ||||||
| мМ | мМ | |||||||
| 1 | 5 | – | – | – | – | – | – | – |
| 2 | – | 5 | – | – | – | + | 0.25 | 1.76 |
| 3 | – | 10 | – | – | – | + | 0.25 | 1.87 |
| 4 | – | 5 | – | – | – | + | – | 2.1 |
| 5 | – | – | 5 | – | – | – | – | – |
| 6 | – | – | – | 5 | – | + | – | – |
| 7 | 4.5 | 5 | – | – | – | + | – | – |
| 8 | – | 5 | 4.5 | – | – | + | – | – |
| 9 | – | 5 | – | 4.5 | – | + | – | – |
| 10 | – | 5 | – | – | 4.5 | + | – | – |
| 11 | – | 5 | – | – | 10 | + | – | – |
| 12 | – | 5 | – | – | 50 | + | – | – |
| 13 | – | 5 | – | – | 500 | + | – | – |
Прежде всего, была оценена способность аналогов TZV вызывать агрегацию обоих пептидов в сопоставимых условиях. Из полученных данных следует, что, помимо TZV, агрегацию пептида βAP*(1–21) способен вызывать еще и TZV-A (табл. 4: № 6, 13). Тогда как TZV-B, напротив, подавляет агрегацию, вызываемую TZV, будучи добавленным в концентрации 20–25% от концентрации последнего (табл. 4: № 8–12). Кроме того, образующийся осадок при агрегации пептида βAP*(1–21) с TZV, нерастворимый в воде без буфера (25 мМ NH4HCO3), хорошо растворяется в водном растворе с TZV-B.
В отношении мелиттина наблюдается схожая картина – агрегацию по-прежнему вызывают TZV и TZV-A (табл. 5: № 2, 4, 6), тогда как TZV-B и TZ агрегацию не вызывают (табл. 5: № 1, 5). Однако в этом случае TZV-B при сопоставимых концентрациях агрегацию не подавляет (табл. 5: № 8).
Выявленная способность TZV-B ингибировать агрегацию может быть объяснена тем, что это соединение обладает большей ароматичностью из-за замены в пятичленном кольце атома N на С. И если ароматичность оказывается решающей в ингибировании агрегации, тогда аналогичным действием в качестве конкурента за связывание с TZV должен обладать, например, пиридин.
Проверка этой гипотезы была выполнена экспериментально путем добавления пиридина в опытах с пептидом βAP*(1–21) (табл. 4: № 14–18) и с мелиттином (табл. 5: № 10–13). Из полученных результатов следует, что пиридин оказывает ингибирующее действие только на агрегацию пептида βAP*(1–21), но не влияет на агрегацию мелиттина. Причем, ингибирующее действие TZV-B и пиридина начинает проявляться при достижении мольного отношения к TZV, близкого к единице (табл. 5: № 10–13). Т.е. одна молекула ингибитора нейтрализует действие одной молекулы индуктора.
Определение соотношение пептидов βAP*(1–21) и мелиттина с азолоазинами в осадках. Для количественного определения соотношений компонентов в осадках для каждого из пептидов выбирались соотношения, близкие к достаточным для агрегации пептидов, без большого избытка TZV.
Состав осадков, образующихся в процессе агрегации, практически не зависит от избытка реагентов и составляет 2 молекулы TZV на одну молекулу βAP*(1–21) и (табл. 4: № 2–4). Так же ведет себя и TZV-A (табл. 4: № 6). При одновременном добавлении смеси TZV и TZV-A в осадке присутствуют оба азолоазина с небольшим преимуществом TZV (табл. 4: № 13).
В случае мелиттина образуется осадок, в котором на одну молекулу мелиттина приходится около 6 молекул TZV (табл. 5: № 2–3).
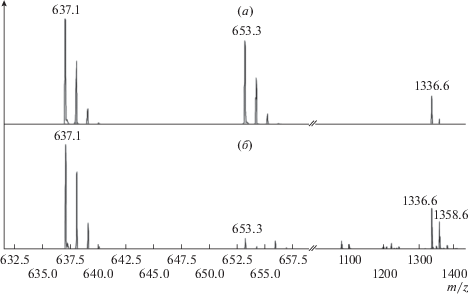
Определение участков связывания пептида βAP*(1–21) с TZV. Наличие основных кислот в последовательности пептида позволило использовать трипсин для получения его более коротких фрагментов. В полученном гидролизате (30 мин гидролиза) зарегистрировано три основных пептида: βAP*(1–5) − DAEFR с m/z = 637.17; βAP*(6–16) HDSGYEVHHQK с m/z = 1336.6 и его ион с Nа с m/z = 1358.6, а также пептид βAP*(17–21) KLVFF с m/z = 653.27 (рис. 4а).
При добавлении раствора TZV к продуктам трипсинолиза βAP*(1–21) исчезает практически только пептид KLVFF c m/z = 653.27 (рис. 4а). Этот эффект хорошо виден на рис. 4б в сравнении с фрагментами βAP*(1–5) с m/z = 637.17, и βAP*(6–16) с m/z = 1336.6, которые остаются в растворе.
Из полученных данных следует, что в пептиде βAP*(1–21) центром связывания с TZV является участок KLVFF. В этом фрагменте хорошо сочетается наличие положительного заряда у Lys (K) и двух ароматических аминокислот – Phe-Phe (FF) для связывания c TZV, имеющим отрицательный заряд и ароматическую часть для стекинга с FF.
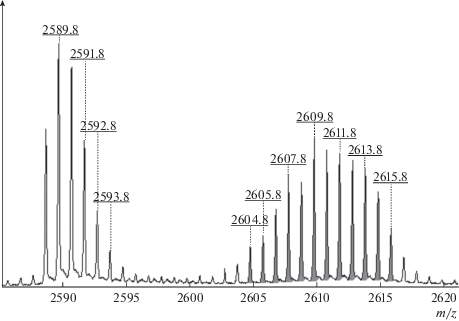
Определение участков связывания TZV c мелиттином. Для выявления участков связывания, определяющих агрегацию мелиттина, была использована особенность его масс-спектрометрической детекции в присутствии TZV. Она заключалась в том, что при нанесении на мишень смеси пептидов с TZV, агрегированные пептиды в масс-спектрах себя не проявляют. В качестве примера на рис. 5 представлен спектр природного мелиттина, содержащего гомологичные примеси. Видно, что в присутствии TZV мелиттин не регистрируется в связи с его агрегацией, однако в спектре по-прежнему присутствуют примеси, представляющие собой укороченные гомологи мелиттина, неспособные к агрегации.
Из представленных данных следует, что в спектре коммерческого препарата, мелиттин регистрируется в виде интенсивного молекулярного иона с присутствием некоторого количества примесных ионов, представляющих собой укороченные пептидные цепочки, по-видимому, представляющие собой промежуточные продукты его биосинтеза. В присутствии TZV ион мелиттина из спектра исчезает, тогда как примесные ионы остаются, и доминантным становится один из примесных ионов с m/z = 2585. Аминокислотный состав последнего определить не удалось. Одновременно существенно возростает относительная интенсивность остальных примесных ионов, многие из которых представляют собой гомологи мелиттина, укороченные с C-конца (табл. 6), очевидно не участвующие в образовании недетектируемых ассоциатов.
Таблица 6.
Значения m/z (молекулярная масса протонированного иона MH+) и пептидные фрагменты мелиттина, зарегистрированные при добавлении TZV к мелиттину на мишени (см. рис. 5)
| № | MH+ | Пептид | Фрагмент |
|---|---|---|---|
| 1 | 714.4 | Mel(22–26) | RKRQQ |
| 2 | 842.5 | Mel(21–26) | KRKRQQ |
| 3 | 955.6 | Mel(20–26) | IKRKRQQ |
| 4 | 1141.7 | Mel(19–26) | WIKRKRQQ |
| 5 | 1228.7 | Mel(18–26) | SWIKRKRQQ |
| 6 | 1454.9 | Mel(16–26) | LISWIKRKRQQ |
| 7 | 1525.9 | Mel(15–26) | ALISWIKRKRQQ |
| 8 | 1792.1 | Mel(12–26) | GLPALISWIKRKRQQ |
| 9 | 1995.2 | Mel(10–26) | TTGLPALISWIKRKRQQ |
| 10 | 2207.3 | Mel(8–26) | VLTTGLPALISWIKRKRQQ |
| 11 | 2335.5 | Mel(7–26) | KVLTTGLPALISWIKRKRQQ |
| 12 | 2845.8 | Mel(1–26) | GIGAVLKVLTTGLPALISWIKRKRQQ |
Для определения в мелиттине аминокислотных последовательностей, участвующих в связывании или ассоциации при взаимодействии с TZV, использовали триптические фрагменты мелиттина. С этой целью был получен триптический гидролизат мелиттина, MALDI-спектр которого представлен на рис. 6б. Затем к полученному гидролизату был добавлен TZV. Как следует из сравнения спектров на рис. 6б и рис.6в, при добавлении TZV в спектре исчез фрагмент GIGAVLKVLTTGLPALISWIKR (ион с m/z = = 2306.4), тогда как его составные фрагменты – GIGAVLK (в виде пары ионов M + H+ с m/z = = 657.4 и M + Na+ с m/z = 679.4) и VLTTGLPALISWIKR (в виде пары ионов M + H+ с m/z = 1668.0 и M + Na+ с m/z = 1690.0) остались в растворе. Кроме того, в растворе остался пептид VLTTGLPALISWIK (в виде пары ионов M + H+ с m/z = 1511.9 и M + Na+ с m/z = 1533.9).
Рис. 6.
Результаты масс-спектрометрического анализа мелиттина (а) и продуктов его триптического гидролиза до (б) и после (в) добавления TZV.
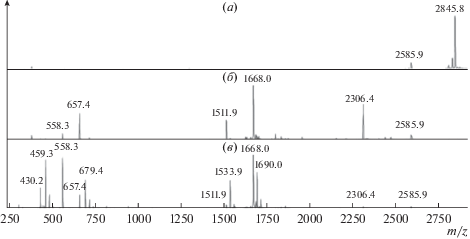
В области низких значений m/z, в растворе, в присутствии TZV, виден весь спектр пептидов, содержащих N-концевые пептиды: RKRQQ (m/z = = 714.4), KRQQ (m/z = 558.3 и m/z = 430.2), оставшиеся в растворе. Из этого следует, что они не осаждаются в присутствии TZV.
Полученный результат свидетельствует о том, что участком связывания мелиттина с TZV, является протяженный участок Mel(1–22), тогда как более короткие фрагменты Mel (1–7), Mel (8–22) и Mel (23–26) с TZV не связываются.
На примере двух типов функционально значимых пептидов – пептида из C-концевой последовательности пептида Альцгеймера и “катионного” пептида мелиттина, выявлено, что азолоазины (TZV и некоторые его аналоги) индуцируют самоассоциацию и агрегацию пептидов.
Мелиттин и βAP*(1–21) отчетливо проявляют особенности взаимодействия с TZV и его аналогами. Можно полагать, что эти особенности обусловлены существенными различиями их аминокислотного состава.
Показано, что в образующихся нерастворимых ассоциатах существенно отличаются молярные соотношения пептида и TZV. На 1 молекулу βAP*(1–21) приходится 2 молекулы TZV, тогда как 1 молекулу мелиттина их приходится 6. Если учесть, что ароматическая система аниона TZV имеет отрицательный заряд на одном из атомов N (формула в табл. 1), то можно предположить, что ее взаимодействие с пептидами, в первую очередь, будет определять электростатическим взаимодействием с основными аминокислотами. Можно ожидать, что электростатическое взаимодействие зависит от микроокружения вблизи предполагаемых сайтов связывания. В табл. 7 наглядно представлен баланс основных и кислых аминокислотных остатков в этих пептидах в сравнении с числом молекул TZV, приходящих на одну молекулу пептида в осадке.
Таблица 7.
Сравнение аминокислотного состава вблизи возможных центров связывания пептидов с TZV и их соотношения в осадке
| Пептид | Состав осадка: отношение TZV/пептид | Число основных групп: Lys + Arg + концевая NH2 | Число кислых групп: Glu + Asp + концевая COOH |
|---|---|---|---|
| βAP*(1–21) | 2 : 1 | Всего: 2 + 1 + 1 = 4 из них активных: 2 + 0 + 0 = 2 | 2 + 2 + 1 = 5 |
| Мелиттин | 6 : 1–7 : 1 | 3 + 2 + 1 = 6 | 0 + 0 + 0 = 0 |
В пептиде βAP*(1–21), с учетом N-концевой аминогруппы и двух основных аминокислот (2Lys + + Arg + NH2), имеют место 4 потенциальных центра связывания, два из которых дезактивированы: N-концевая аминогруппа Asp1 дезактивирована близостью боковой карбоксильной группы того же остатка, а основная группа Arg5 дезактивирована своим ближайшим микроокружением (3 кислые группы по соседству: у остатков Glu1 + Asp3 + Glu7). В итоге у пептида βAP*(1–21) остаются лишь 2 возможных центра связывания – Lys15 и Lys16, а у его аналога βAP – только один Lys15 (табл. 2).
Таким образом для агрегации мелиттина в присутствии TZV необходима полная последовательность, содержащая 5 основных аминокислот и N-концевую аминогруппу. При этом в образовании ассоциатов участвуют уже 6–7 молекул TZV. Тогда как для агрегации βAP*(1–21) достаточно наличие короткой последовательности KLVFF.
Кроме того, существенным различием является разный эффект воздействия пиридина на ассоциацию этих пептидов в присутствии TZV: пиридин не препятствует ассоциации βAP*(1–21), но не мешает ассоциации мелиттина.
Аналогично воздействию пиридина, по разному проявляется и влияние TZV-B на ассоциацию пептидов в присутствии TZV. Добавление TZV-B в существенно меньших концентрации, чем TZV, препятствует агрегации βAP*(1–21), но не оказывает влияния на агрегацию мелиттина. Кроме того, замечено, что TZV-B не только препятствует образованию нерастворимых ассоциатов βAP*(1–21) с TZV, но и способен их растворять. Из экспериментов следует, что TZV-B конкурирует с TZV за центры связывания βAP*(1–21), участвующие в образовании ассоциатов.
Оценивая результаты влияние всех использованных азолоазинов на агрегацию обоих пептидов (см. табл. 4, 5) можно отметить, что способность вызывать агрегацию βAP*(1–21) присуща TZV и TZV-A примерно в равной мере, судя их соотношению в составе осадка. Тогда как TZ не влияет на агрегацию и не препятствует ассоциации βAP*(1–21) в присутствии TZV. Однако в случае мелиттина TZ может способствовать ассоциации. Важно заметить, что азолоазины в разной степени способны к комплексообразованию с обоими типами пептидов, но их действие определяется исключительно свойствами самих пептидов.
Таким образом, в результате выполненных исследований:
(1) Определен участок и стехиометрия связывания TZV с βAP*(1–21). Показано, что TZV связывается с βAP*(1–21) на гидрофобном участке βAP*(17–21) – KLVFF. Связывание индуцирует процесс агрегации пептида и образование осадка с содержанием TZV и βAP*(1–21) в соотношении 2 : 1.
(2) Определен участок и стехиометрия связывания TZV с мелиттином. Показано, что агрегацию мелиттина индуцирует связывание с молекулами TZV на участке N-концевого фрагмента полипетидной цепи мелиттина (1–22) – GIGAVLKVLTTGLPALISWIKR. Стехиометрия связывания TZV с мелиттином в интервале 6 : 1–7 : 1.
(3) Показано, что близкое производное TZV – TZV-A, индуцирует агрегацию аналогичным TZV образом.
(4) Обнаружено, что производное TZV-B, с большей, по сравнению с TZV ароматичностью, не только не ингибирует агрегацию βAP*(1–21) под воздействием TZV, но и способствует растворению уже образовавшего осадка из агрегированных молекул βAP*(1–21). Показано, что решающим для этого свойства является ароматичность соединения, что продемонстрировано на примере ингибирования агрегации пиридином. Принципиально важным представляется факт, что указанные соединения способны к растворению осадка, содержащего амилоидный пептид βAP*(1–21), но не меллитин. Это указывает на направленность воздействия этих соединений на участок βAP*(17–21) – KLVFF, опосредующий образование нерастворимых фибрилл, вызывающих болезнь Альцгеймера.
В целом, настоящая работа является важным этапом на пути понимания процессов формирования нерастворимых агрегатов из полипептидов и поиска соединений, способных ингибировать процессы агрегации и даже растворять такие агрегаты. Кроме того, отметим, что исследования взаимодействия азолоазинов с пептидами стимулируют работы по созданию новых модифицированных форм азолоазинов в качестве перспективных регуляторов агрегации пептидов, участвующих в формировании амилоидоза, в том числе и болезни Альцгеймера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пептид βAP*(1–21) был синтезирован компанией “Verta Ltd”. Мелиттин (≥85% HPLC) от компании “Sigma”, трипсин от компании “Promega”.
Азолоазины были синтезированы и любезно предоставлены профессором В.П. Русиновым из Уральского федерального университета имени первого Президента России Б.Н. Ельцина. H218O (97% 18O) использовалась от Sigma.
Масс-спектрометрические измерения и расчеты. Масс-спектры получены с помощью масс-спектрометра Ultraflex II MALDI-ToF/ToF (Bruker Daltonics, Германия), оборудованного Nd:YAG лазером (neodymium-doped yttrium aluminum garnet; Nd:Y3Al5O12).
Пептиды детектировали в виде положительных ионов с использованием в качестве матрицы α-циано-4-гидроксикоричной кислоты. Точность измерения моноизотопных масс была не хуже 25 миллионный долей (ppm).
Азолоазины детектировали в виде отрицательных ионов с использованием в качестве матрицы α-циано-4-гидроксикоричная кислоты.
Количественное определение пептида βAP*(1–21) в осадках проводили с использованием 18O-меченного стандарта βAP*(1–21), после растворения осадка в 25 мМ NH4HCO3 (pH = 7.8). Осадок отделяли в 25 мМ NH4HCO3 (pH = 7.8). К аликвоте анализируемого раствора добавляли раствор стандарта. Количество пептида в осадке рассчитывали из сопоставления суммарных площадей изотопного распределения в масс-спектре анализируемого пептида и его стандарта с учетом известной концентрации стандарта, согласно методике, описанной в работах [14–16].
Получение стандарта пептида βAP*(1–21). 20 мкл пептида с концентрацией 10–4 М высушивали в вакуумной центрифуге, растворяли в смеси 18 мкл H218O + 2 мкл 100% TFA и инкубировали в течение 90 минут при 70°С. Реакционную смесь высушивали в вакуумной центрифуге, а затем растворяли в воде. Смесь использовали для добавления к анализируемым образцам в качестве стандарта.
Триптический гидролиз βAP*(1–21). К 50 мкл пептида с концентрацией 10–5 М в 50 мМ NH4HCO3 (pH 7.8) добавляли 5 мкл раствора трипсина с концентрацией 0.05 мг/мл. Смесь инкубировали в течение 30 мин при 37°С. Реакцию останавливали добавлением 10 мкл 2% TFA. Полученную реакционную смесь высушивали в вакуумной центрифуге.
Триптический гидролиз мелиттина. К 20 мкл раствора мелиттина с концентрацией 10–5 М в 100 мМ NH4HCO3 (pH 7.8) добавляли 5 мкл трипсина с концентрацией 0.05 мг/мл. Смесь инкубировали в течение 24 ч при 37°С. Гидролиз контролировали масс-спектрометрически до образования пептида в качестве основного продукта гидролиза пептида VLTTGLPALISWIK.
Получение стандарта из триптического гидролизата мелиттина. Гидролизат высушивали в вакуумной центрифуге, образец перерастворяли в смеси 18 мкл H218O + 2 мкл 100% TFA и инкубировали в течение 90 мин при 70°С. Продукты изотопного обмена гидролизата высушивали, растворяли в воде и использовали в качестве стандарта.
Количественное определение мелиттина в осадках. Осадки, содержащие мелиттин (табл. 4) отделяли центрифугированием и растворяли в 20 мкл 50% ацетонитрила. К полученным растворам добавляли 20 мкл раствора трипсина (0.02 мг/мл в 50 мМ NH4HCO3) и выдерживали 24 часа при комнатной температуре. Полученные гидролизаты смешивали со стандартом. И из соотношения изотопных распределений, относящихся к анализируемому пептиду и его стандарту с известной концентрацией, рассчитывали количество мелиттина в осадке.
Количественное определение TZV проводили с использованием в качестве стандарта его аналога с изотопами 2H и 15N, включенных в процессе его синтеза. Для TZV-A концентрацию оценивали из его относительной интенсивности по сравнению с TZV. Определение проводили в осадках с мелиттином после их растворения в 50% ацетонитриле в 25 мМ NH4HCO3, и в осадках с пептидом βAP*(1–21), растворенных в 100 мМ NH4HCO3.
ЗАКЛЮЧЕНИЕ
В настоящей работе исследования были проведены фрагментом βAP, включающим амфифатический заряженный N-конец βAP и центральную гидрофобную область βAP*(17–21) – LVFFA, без гидрофобного C-конца. Как показали предыдущие исследования, именно эта центральная гидрофобная область играет ключевую роль в агрегации βAP [17–20], именно с этого участка начинается процесс образования фибрилл [9]. Яркой особенностью этой области является наличие двух остатков фенилаланина (Phe19 и Phe20). Известно, что ароматические аминокислоты встречаются во многих белках, которые самоорганизуются и объединяются, вызывая болезни человека [21]. Причем в начале образования фибрилл основную роль играет Phe19, тогда как присутствие Phe20 несколько замедляет агрегацию [23, 24].
Полученные нами данные по взаимодействию TZV и его аналогов с βAP*(1–21) также подтверждают имеющиеся данные [23, 24] о роли участка Phe19 – Phe20 в процессах как индукции агрегации, так и ее ингибирования. В целях предотвращения этой агрегации ранее уже предлагались соединения, главным образом пептидной природы, нацеленные на блокирование этого участка [25]. Выгодным свойством TZV и его аналогов в качестве возможных регуляторов агрегации является их высокая стабильность в биологических средах по сравнению с пептидами.
Для TZV показана его низкая токсичность, а потому не следует ожидать высокой токсичности и от его аналогов. Тем более что по своей природе все они являются близкими родственниками природных пуринов и ксантинов. А потому потенциально могут быть положены в основу разработок по созданию фармацевтических средств для ингибирования фибриллогенеза во всех его аспектах.
БЛАГОДАРНОСТИ
Работа выполнена при поддержке Министерства образования и науки Российской Федерации, Соглашение № 14.604.21.0180, уникальный идентификационный номер проекта RFMEFI60417X0180 (методики количественной масс-спектрометрии в определении характеристик ассоциатов), при поддержке грантов РФФИ 17-00-00394 и 18-04-00893 (определение сайтов связывания). Авторы благодарят профессора В.П. Русинова из Уральского федерального университета имени первого Президента России Б.Н. Ельцина за предоставленные образцы азолоазинов.
Список литературы
Bello J., Bello H. R., Granado, E. // Biochemistry. 1982. V. 21. P. 461–465.
Quay S.C., Condie C.C. // Biochemistry. 1983. V. 22. P. 695–700.
Shai Y. // Biopolymers. 2002. V. 66. P. 236–248.
Bechinger B. // J. Membr. Biol. 1997. V. 156. P. 197–211.
Wu W.H., Sun X., Yu Y.P., Hu J., Zhao L., Liu Q., Zhao Y.F., Li Y.M. // Biochem. Biophys. Res. Commun. 2008. V. 373(2). P. 315–318.
Stsiapura V., Sukhanova A., Baranov A., Artemyev M., Kulakovich O., Oleinikov V., Pluotl M., Cohenl J.H.M., Nabiev I. // Nanotechnology. 2006. V. 17(2). P. 581–587.
Melnikau D., Savateeva D, Lesnyak V., Gaponik N., Fernandez Y.N., Vasilevskiy M.I., Costa M.F., Mochalov K.E., Oleinikov V., Rakovich Y.P. // Nanoscale. 2013. V. 5(19). P. 9317–9323.
Murphy M.P., LeVine H. 3rd. // J. Alzheimers Dis. 2010. V. 19(1). P. 311.
Perez M., Cuadros R., Benítez M.J., Jimenez J.S. // J. Alzheimers Dis. 2004. V. 6(5). P. 461–467.
Русинов В.Л., Петров А.Ю., Постовский И.Я. // Химия гетероциклических соединений. 1980. С. 1283–1285.
Шестакова Т.С., Халымбаджа И.А., Деев С.Л., Ельцов О.С., Русинов В.Л., Шенкарев З.О., Арсеньев А.С., Чупахин О.Н. // Известия АН, Серия химическая. 2011. С. 714–717.
Чупахин О.Н., Русинов В.Л., Уломский Е.Н., Чарушин В.Н, Петров А.Ю., Киселев О.И. // Патент РФ 2330036. 2008.
Чупахин О.Н., Русинов В.Л., Уломский Е.Н., Чарушин В.Н., Петров А.Ю., Киселев О.И. // Патент РФ № 2294936. 2007.
Козьмин Ю.П., Манойлов А.В., Серебрякова М.В., Миргородская О.А. // Биоорганическая химия. 2011. Т. 37(6). С. 793–806.
Kozmin Yu.P., Manoilov A.V., Serebryakova M.V., Mirgorodskaya O.A., // RJBC 2011. V. 37(6) P. 719–731.
Toropygin I.Y., Kugaevskaya E.V., Mirgorodskaya O.A., Elisseeva Y.E., Kozmin Y.P., Popov I.A., Nikolaev E.N., Makarov A.A, Kozin S.A. // Rapid Commun. Mass Spectrom. 2008. V. 22. P. 231–239.
Esler W.P., Stimson E.R., Ghilardi J.R., Lu Y.A., Felix A M., Vinters H.V., Mantyh P.W., Lee J.P., Maggio J.E. // Biochemistry. 1996. V. 35. P. 13914–13921.
Tjernberg L.O., Callaway D.J., Tjernberg A., Hahne S., Lilliehook C., Terenius L., Thyberg J., Nordstedt C. // J. Biol. Chem. 1999. V. 274. P. 12619–12625.
Hilbich C., Kisterswoike B., Reed J., Masters C.L., Beyreuther K. // J. Mol. Biol. 1992. V. 228. P. 460–473.
De Groot N.S., Aviles F.X., Vendrell J., Ventura S. // FEBS J. 2006. V. 273. P. 658–668.
Gazit E. // FASEB J. 2002. V. 16. P. 77–83.
Cukalevski R., Boland B., Frohm B., Thulin E., Walsh D., Linse S. // ACS Chem. Neurosci. 2012. V. 3(12). 1008–1016.
Armstrong A.H., Chen J., McKoy A.F., Hecht M.H. // Biochemistry. 2011. V. 50. P. 4058–4067.
Creighton T.E. // Proteins: Structures and Molecular Properties. 2nd ed., Freeman W.H., New York. P. 4 and P. 256.
Funke S.A, Willbold D. // Current Pharmaceutical Design. 2012. V. 18. P. 755–767.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия