Биоорганическая химия, 2019, T. 45, № 1, стр. 75-87
Исследование полного липидома мягкого коралла Sinularia siaesensis
Т. В. Сикорская *, А. Б. Имбс *
* Национальный научный центр морской биологии ДВО РАН, Россия, 690041, Владивосток, ул. Пальчевского, 17
Поступила в редакцию 30.03.2018
После доработки 17.04.2018
Принята к публикации 28.04.2018
Аннотация
Методами газовой и жидкостной хроматомасс-спектрометрии проведено исследование полного липидома тропического мягкого коралла Sinularia siaesensis (Cnidaria: Anthozoa: Octocorallia: Alcionacea), содержащего внутриклеточные симбиотические микроводоросли (зооксантеллы). Определена структура и содержание 144 молекулярных видов основных классов ацильных липидов этой альционарии, к которым относятся воски (WE), триглицериды (TG), моноалкилдиацилглицериды (MADAG), этаноламин-, холин-, серин- и инозитглицерофосфолипиды (PE, PC, PS и PI), церамидаминоэтилфосфонат (CAEP), сульфохиновозилдиацилглицерид (SQDG), моно- и дигалактозилдиацилглицериды (MGDG и DGDG). Главными компонентами липидома S. siaesensis были: воски 16:0/16:0, 16:0/18:0 и 18:0/16:0; TG 16:0/16:0/16:0 и 16:2/16:0/16:0; MADAG 18:0e/16:0/16:0, 16:0e/16:0/18:0 и 16:0e/16:0/16:0; PS 18:0e/24:5, лизо-PC 18:0e, PE 18:1e/20:4, PC 18:0e/20:4, CAEP 18:2b/16:0, SQDG 14:0/16:0 и PI 18:0/24:5. Доминирование насыщенных восков в запасных липидах является видоспецифическим признаком тропических альционарий. Воски синтезируются в организме-хозяине, а зооксантеллы могут увеличивать долю насыщенных восков за счет передачи насыщенных жирных кислот (FA). Остатки полиненасыщенных FA (PUFA) находятся в молекулах TG и MADAG преимущественно в положениях sn-1 и sn-2 соответственно. Обнаружение MADAG с остатками маркерных FA зооксантелл (18:0e/18:3/16:0, 18:0e/18:4/16:0 и 16:0e/18:3/16:0) подтверждает передачу PUFA от симбионтов к хозяину. Тетракозаполиеновые FA (TPA), хемотаксономические маркеры октокораллов, сосредоточены в молекулярных видах алкилацилглицерофосфосеринов (серинглицерофосфолипиды, PS) и алкилацилглицерофосфоинозитов (инозитглицерофосфолипиды, PI). Большинство молекулярных видов алкилацилглицерофосфоэтаноламинов (этаноламинглицерофосфолипидов, PE), PC и PS находятся в алкилацильной форме, в то время как для молекул PI характерна диацильная форма. Заметная доля MGDG, DGDG и SQDG указывает на важность зооксантелл в формировании липидного профиля симбиотических мягких кораллов. Определение профиля молекулярных видов липидов необходимо для развития липидомного подхода в изучении биохимии и экологии кораллов и других книдарий.
ВВЕДЕНИЕ
Кораллы (тип Cnidaria, класс Anthozoa) распространены от полярных до тропических областей Мирового океана и встречаются на глубинах до 6 км. Одной из самых важных морских тропических экосистем является экосистема коралловых рифов, которые служат домом для 25% всех тропических видов животных [1]. Подавляющее большинство видов кораллов – колониальные организмы. Колонии шестилучевых рифообразующих, или твердых, кораллов (подкласс Hexacorallia) имеют твердый известковый экзоскелет. Такого экзоскелета нет у колоний восьмилучевых мягких кораллов (подкласс Octocorallia), в которых известковые включения (спикулы) распределены по всему объему колонии. Alcionacea – наиболее многочисленный отряд восьмилучевых кораллов, в котором различают до 40 родов и 1200 видов.
Более 80% всех видов альционарий обитает на мелководье тропических морей Индо-Пацифики. В отличие от бореальных и глубоководных видов, практически все тропические альционарии, обитающие на глубинах до 40 метров, являются симбиотическими животными, ткани которых содержат внутриклеточные микроводоросли или зооксантеллы (динофлагелляты рода Symbiodinium) [2]. В процессе фотосинтеза зооксантеллы вырабатывают питательные вещества, обеспечивая до 90% энергии, необходимой организму-хозяину [3, 4]. Полная потеря зооксантелл колониями кораллов при температуре воды более 32°С называется “обесцвечиванием” (bleaching) кораллов и приводит к гибели организма-хозяина [5].
Альционарии богаты липидами, которые составляют до 23% от сухого веса мягких тканей кораллов [6]. Содержание общих липидов заметно меняется в зависимости от стадии полового цикла коралла, а также от сезона, глубины обитания, освещенности, температуры воды и других факторов окружающей среды [7]. В экстракте общих липидов альционарий присутствуют различные ацильные липиды, которые являются производными жирных кислот (FA), а также углеводороды и стерины [8–10]. Липиды выполняют важные функции в организме коралла [11]; нейтральные липиды служат для них основным “запасным депо” и источником энергии, а полярные липиды, в первую очередь фосфолипиды, выполняют структурную функцию и составляют основу клеточных мембран.
Нейтральные липиды альционарий, среди которых найдены воски (сложные эфиры FA и алифатических спиртов (AA)), триацилглицериды (TG), моноалкилдиацилглицериды (MADAG) и эфиры стеринов (SE), составляют более половины общих липидов этих животных [7, 8, 10]. В общих липидах тропических альционарий содержится от 13 до 50% полярных липидов [10], в которых обнаружены этаноламин-, холин-, серин- и инозитглицерофосфолипиды (PE, PC, PS и PI), церамидаминоэтилфосфонат (CAEP), дифосфатидилглицерин (DPG), фосфатидилглицерин (PG), фосфатидная кислота (PA), цереброзиды (CE), а также лизоформы PE, PS и PC [9, 12]. Основными классами полярных липидов являются PE и PC. Глицерофосфолипиды альционарий, кроме 1,2-диацилпроизводных, содержат заметную долю 1-О-алкил-2-ацил- и 1-О-алкенил-2-ацил-глицерофосфолипидов (плазмалогенов) [12–14].
Маркером тканей полипов (организма-хозяина) в альционариях можно считать MADAG. Этот класс липидов характерен для книдарий [15] и отсутствует в липидах зооксантелл [16]. В тканях полипов альционарий доля MADAG может достигать 35% от суммы липидов [16]. Предполагается, что присутствие MADAG и CAEP в мембранах клеток книдарий повышает их устойчивость к действию высокоактивных липолитических ферментов [15, 17, 18].
В липидах зооксантелл обнаружены несколько классов гликолипидов [19], а именно, сульфохиновозилдиацилглицерол (SQDG), моно- и дигалактозилдиацилглицериды (MGDG и DGDG), которые характерны для биомембран фотосинтетического аппарата растений. Галактолипиды, а также некоторые полиненасыщенные FA (PUFA), которые входят в состав ацильных групп этих липидов, рассматриваются, как главные маркеры зооксантелл [20–22]. Отсутствие галактолипидов в полярных липидах фракции тканей полипов из мягкого коралла Clavularia viridis послужило доказательством высокой чистоты этой фракции [23].
Измерение уровня общих липидов, содержания основных классов липидов и состава FA является одним из основных методических подходов в изучении эффективности репродуктивной стратегии кораллов, степени повреждения и скорости восстановления частично обесцвеченных рифов, пищевых и симбиотических отношений кораллов, а также транспорта органического углерода между симбионтами и организмом-хозяином [24–29]. За время скрининговых исследований липидов кораллов [30] накоплена огромная информация о их составе и составе FA [7, 10, 31]. Однако следует учесть, что общие липиды, равно как и отдельные классы липидов, представляют собой сложную смесь молекулярных видов липидов, насчитывающую несколько сотен компонентов. FA являются набором “обломков”, которые образуются при гидролизе молекулярных видов липидов. Мы полагаем, что для развития новых направлений в области биохимии и экологии кораллов необходимо иметь данные о составе молекулярных видов липидов этих организмов.
По аналогии с геномом, протеомом и метаболомом, общий спектр липидных молекул биологической системы определяется как липидóм, а картирование спектра липидов и определение их биологической роли называется липидомикой [32]. На фоне множества медико-фармакологических исследований липидома человека, получены первые результаты в области липидомики морских организмов, например, макроводорослей [33], кальмаров [34] и актиний [35]. Сведения о липидоме альционарий ограничены описанием состава молекулярных видов полярных липидов трех тропических и одного холодноводного видов [13, 14, 36].
В настоящей работе впервые проведен анализ полного липидома тропического симбиотического мягкого коралла Sinularia siaesensis с использованием комплекса методов, включая газовую хроматомасс-спектрометрию, HPLC и тандемную масс-спектрометрию высокого разрешения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Классический метод экстракции [37] позволил получить общие липиды с выходом 4.85% от массы сухой ткани альционарии S. siaesensis. Общие липиды содержали, %: воски 18.25, TG 5.83, MADAG 7.79, PE 2.14, PC 2.53, PS 1.50, PI 0.32, CAEP 0.71, MGDG 0.29, DGDG 0.18 и SQDG 0.82. Общий профиль липидов, в котором доминируют неполярные липиды (воски, TG и MADAG), а среди фосфолипидов преобладают PE и PC, характерен для тропических видов альционарий [10]. Кроме 10 основных классов ацильных липидов, в экстракте присутствовали другие липофильные вещества, в частности, углеводороды, стерины, свободные FA и пигменты. Ранее было показано, что в составе углеводородов тропической синулярии преобладает 2-изопропенил-4а,8-диметил-1,2,3,4,4а,5,6,7-октагидронафталин [9], а среди стеринов – 24-метиленхолестерол и кампестерол [6]. Свободные FA не следует применять для характеристики общих липидов, поскольку составы свободных FA [38] и FA ацильных липидов [10] мягких кораллов резко различаются. Общие липиды S. siaesensis имели высокое содержание лизофосфатидилхолина (1.35%), что согласуется с данными работы [12]. Неспецифический гидролиз липидов при экстракции не может быть причиной высокого уровня лизо-PC в тканях S. siaesensis, поскольку лизо-формы других классов фосфолипидов практически отсутствовали.
Ацильные липиды, прежде всего WE и TG, рассматриваются как энергетический резерв кораллов, поэтому количество общих липидов широко используется в качестве индикатора расхода и накопления энергии колониями коралла [24, 38]. Ацильные липиды составили менее половины от экстракта общих липидов S. siaesensis (41.89%), поэтому, по нашему мнению, содержание индивидуальных классов липидов должно давать более точную картину энергетического баланса альционарий, чем количество общих липидов (суммарного липидного экстракта).
Неполярный липидом
В неполярной части липидома альционарии S. siaesensis присутствовали воски, TG и MGDG; эфиров стеринов не обнаружили. Анализ фракции восков проводили газовой хроматомасс-спектрометрией. Сумму TG и MADAG разделяли сверхкритической флюидной хроматографией (SFC) и анализировали методом масс-спектрометрии низкого разрешения. Две последовательно соединенные хроматографические колонки позволили достичь разделения практически всех молекулярных видов TG и MADAG за 85 мин анализа.
При ионизации методом электронного удара в масс-спектрах восков (общая формула R'OCOR, где R' и R – алкильные группы AA и FA, соответственно) присутствовали пики молекулярных ионов M+. Интенсивность сигналов молекулярных ионов (относительно базового иона m/z 57, 100%) была значительно выше в спектрах насыщенных восков (10–13%), чем в спектрах ненасыщенных восков (1–2%) (рис. 1а). Характеристическими ионами для насыщенных восков были [RCOOH]+ (50–70%) и [R'–H]+ (7–14%), а для ненасыщенных восков – [RCO]+ (30–40%), [RCOOH]+ (6–10%) и [R'–Н]+ (3–10%). Масс-спектрометрические данные интерпретировали согласно работе [39]. Характеристические ионы позволили обнаружить присутствие изомеров, например, 16:1/16:0 и 16:0/16:1, 18:0/15:0 и 17:0/16:0, которые не разделялись в условиях хроматографического анализа.
Рис. 1.
Хроматомасс-спектрометрический анализ молекулярных видов неполярного липидома мягкого коралла S. siaesensis: (а) хроматограмма восков (ГЖХ, пламенно-ионизационный детектор) и масс-спектр (EI) цетилпальмитата (16:0/16:0); (б) хроматограмма TG и MADAG (сверхкритическая флюидная хроматография, светорассеивающий детектор), масс-спектры (APCI) триглицерида 16:2/16:0/16:0 и смеси изомерных MADAG 16:0е/16:0/18:0 и 18:0е/16:0/16:0.
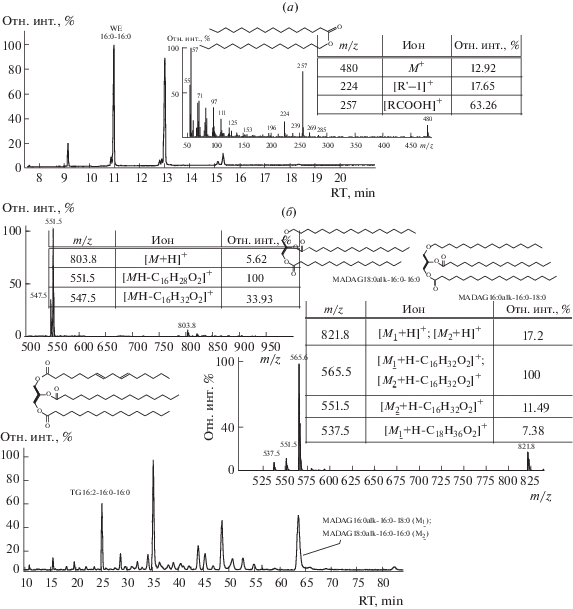
В режиме химической ионизации при атмосферном давлении (APCI) молекулы TG образуют молекулярные ионы в протонированной форме [M + H]+. В этих условиях наиболее вероятен отрыв ацильной группы в виде нейтральной молекулы RCOOH из положения sn-1 или sn-3 [40, 41], что приводит к появлению в масс-спектре наиболее интенсивных сигналов соответствующих фрагмент-ионов (рис. 1б). Спектр также содержит менее интенсивный сигнал иона [M–R'COOH]+, образующийся в результате отрыва остатка FA в положении sn-2. В масс-спектре молекулярного вида TG с тремя одинаковыми остатками FA присутствует сигнал только одного иона [M–RCOOH]+. Таким образом, метод позволяет определить брутто-формулу (количество атомов углерода и число двойных связей) всех трех ацильных групп в молекуле TG, а также заместитель в положении sn-2 остатка глицерина.
Масс-спектр каждого молекулярного вида MADAG также содержал сигнал иона [M + H]+. Согласно работам [34, 42], в масс-спектре MADAG с тремя различными алифатическими цепями наиболее интенсивный сигнал дает ион [M–R'COO]+, образованный при отрыве остатка FA в положении sn-2 (100%), отрыв остатка FA в положении sn-3 дает менее интенсивный сигнал иона [M–R''COO]+ (>50%), а наименьшую интенсивность имеет сигнал фрагмента[M–OR''']+ при отрыве остатка спирта (>10%) (рис. 1б). Использование этих закономерностей позволило установить брутто-формулы и положение всех заместителей в молекулах MADAG.
Впервые определен неполярный липидом мягкого коралла (табл. 1–3). Главными компонентами неполярного липидома альционарии S. siaesensis были (в процентах от общих липидов): цетилпальмитат (16:0/16:0), цетилстеарат (16:0/18:0) и стеарилпальмитат (18:0/16:0) (в сумме 14.07%, табл. 1); гексадекадиеноилдипальмитоилглицерин (16:2/16:0/16:0) и трипальмитин (16:0/16:0/16:0)(в сумме 3.51%, табл. 2); 1-О-октадецил-2,3-дипальмитоил-sn-глицерин (18:0e/16:0/16:0), 1-О-гексадецил-2-пальмитоил-3-стеароил-sn-глицерин (16:0e/16:0/18:0) и 1-О-гексадецил-2,3-дипальмитоил-sn-глицерин (16:0e/16:0/16:0) (в сумме 3.87%, табл. 3).
Таблица 1.
Состав восков мягкого коралла S. siaesensis
| Воски | С* | Сотн** | [M]+ |
|---|---|---|---|
| 16:0/14:0; 14:0/16:0*** | 1.019 | 5.58 | 452 |
| 16:1/16:0 | 0.068 | 0.37 | 478 |
| 16:1/16:0; 16:0/16:1 | 0.383 | 2.10 | 478 |
| 16:0/16:0 | 7.097 | 38.89 | 480 |
| 18:0/15:0; 17:0/16:0 | 0.036 | 0.20 | 494 |
| 16:0/18:1 | 0.311 | 1.70 | 506 |
| 18:0/16:1 | 0.275 | 1.51 | 506 |
| 16:0/18:0; 18:0/16:0 | 6.974 | 38.21 | 508 |
| 19:0/16:0; 17:0/18:0 | 0.128 | 0.70 | 522 |
| 18:0/18:1 | 0.274 | 1.50 | 534 |
| 18:0/18:0 | 0.888 | 4.88 | 534 |
| 16:0/22:0; 18:0/20:0; 20:0/18:0 | 0.111 | 0.61 | 564 |
| Другие | 0.686 | 3.76 | |
| Сумма | 18.251 | 100.00 |
Таблица 2.
Состав триацилглицеридов мягкого коралла S. siaesensis*
| Триацилгли- цериды | С | Сотн | [M + H]+ |
|---|---|---|---|
| 16:2/16:2/16:0** | 0.059 | 1.01 | 799.8 |
| 16:4/16:0/16:0 | 0.020 | 0.34 | 799.8 |
| 18:4/16:0/16:0 | 0.049 | 0.84 | 827.8 |
| 16:2/16:0/16:0 | 1.046 | 17.94 | 803.8 |
| 16:0/18:3/16:0 | 0.026 | 0.45 | 829.8 |
| 20:4/16:0/16:0 | 0.056 | 0.96 | 855.7 |
| 16:1/16:0/16:0; 22:6/16:0/16:0; 20:4/16:0/16:0 | 0.313 | 5.37 | 805.8; 879.78; 855.7 |
| 16:0e/16:3/16:0; 20:4/16:0/16:0 | 0.094 | 1.61 | 787.8; 855.7 |
| 18:2/16:0/16:0 | 0.129 | 2.21 | 831.8 |
| 16:0/16:0/16:0 | 2.464 | 42.26 | 807.8 |
| 18:1/16:0/16:0 | 0.313 | 5.37 | 833.8 |
| 16:0/16:0/18:0 | 0.502 | 8.61 | 835.8 |
| Другие | 0.760 | 13.03 | |
| Сумма | 5.831 | 100.00 |
Таблица 3.
Состав моноалкилдиацилглицеридов мягкого коралла S. siaesensis*
| MADAG | С | Сотн | [M + H]+ |
|---|---|---|---|
| 18:0e/16:0/16:0; 16:0e/16:0/18:0** | 0.047 | 0.55 | 821.8 |
| 18:0e/20:4/18:0 | 0.040 | 0.47 | 897.8 |
| 18:0e/16:2/16:0 | 0.058 | 0.68 | 813.8 |
| 16:0e/16:2/16:0 | 0.361 | 4.22 | 789.7 |
| 18:0e/18:0/16:0; 16:0e/18:3/16:0 | 0.140 | 1.64 | 849.8; 815.8 |
| 16:0e/16:1/16:0 | 0.192 | 2.25 | 791.8 |
| 16:0e/20:4/16:0 | 0.216 | 2.53 | 841.8 |
| 18:0e/18:4/16:0 | 0.086 | 1.01 | 841.8 |
| 16:0e/18:2/16:0 | 0.124 | 1.45 | 817.8 |
| 18:0e/16:2/16:0 | 0.645 | 7.54 | 817.8 |
| 18:0e/18:3/16:0 | 0.117 | 1.37 | 843.8 |
| 16:0e/16:0/16:0 | 1.653 | 19.33 | 793.8 |
| 18:0e/16:1/16:0 | 0.554 | 6.48 | 819.8 |
| 18:0e/20:4/16:0 | 0.403 | 4.71 | 869.8 |
| 18:0e/18:2/16:0 | 0.195 | 2.28 | 845.8 |
| 18:0e/18:2/16:0 | 0.026 | 0.30 | 845.7 |
| 18:0e/16:2/18:0 | 0.012 | 0.14 | 817.8 |
| 18:0e/22:5/16:0; 18:0/18:0/16:0 | 0.075 | 0.88 | 895.8; 863.8 |
| 18:0e/16:0/16:0; 16:0e/16:0/18:0 | 2.420 | 28.30 | 821.8; 821.8 |
| 18:0e/18:1/16:0 | 0.174 | 2.04 | 847.8 |
| 18:0e/20:4/18:0 | 0.058 | 0.68 | 897.8 |
| 18:0e/24:5/16:0 | 0.024 | 0.28 | 923.8 |
| 18:0e/18:2/18:0 | 0.016 | 0.19 | 873.8 |
| 18:0e/16:0/18:0 | 0.154 | 1.80 | 849.8 |
| Другие | 0.760 | 8.89 | |
| Сумма | 7.789 | 100.00 |
Ранее в мягком коралле Sinularia microclavate был обнаружен стеарилпальмитат [43], насыщенные WE 16:0/16:0 и 16:0/18:0 были указаны как главные компоненты восков в гидрокораллах рода Millepora [44] и твердых кораллах [15, 45, 46]. В исследованной нами альционарии доминировали насыщенные молекулярные виды, а ненасыщенные составили не более 6.8% от суммы восков; аналогичное распределение ранее было найдено в двух других видах симбиотических альционарий [47]. В отличие от восков альционарий, воски симбиотических твердых кораллов содержали до 47% ненасыщенных молекулярных видов [47]. Чен и др. [48, 49] исследовали динамику состава липидов во внутриклеточных липидных тельцах (lipid bodies) симбиотического твердого коралла Euphyllia glabrescens. Они обнаружили, что воски находятся в тканях организма-хозяина и отсутствуют в зооксантеллах, при этом ненасыщенные воски (пальмитилолеат) сосредоточены в липидных тельцах. Можно предположить, что в альционариях, также как в твердых кораллах, этот основной класс запасных липидов синтезируется в организме-хозяине [49, 50], а доминирование насыщенных молекулярных видов восков является видоспецифическим признаком тропических альционарий. Воски симбиотических видов кораллов не содержат маркерных PUFA зооксантелл, таких как 18:3n-6, 18:4n-3 и 18:5n-3 (табл. 1) [47, 49]. Мы полагаем, что зооксантеллы не синтезируют воски самостоятельно, но могут увеличивать долю насыщенных молекулярных видов восков за счет передачи организму-хозяину насыщенных FA и/или AA [50].
Поскольку ранее было показано, что большую часть ацильных групп TG и MADAG из тропической альционарии Sinularia sp. составляют остатки насыщенных FA 16:0 и 18:0 [9], подавляющее доминирование насыщенных молекулярных видов среди TG и MADAG из S. siaesensis не было неожиданностью (табл. 2, 3). Однако наибольший интерес вызвали ненасыщенные молекулярные виды этих липидных классов. Остатки PUFA находились в молекулах TG и MADAG преимущественно в положениях sn-1 и sn-2, соответственно. Это может быть результатом разницы в путях биосинтеза ацильных (TG) и этерных (MADAG) глицеролипидов. Из фосфатидной кислоты образуется 1,2-диацилглицерид, ацилирование которого по положению sn-3 дает молекулу ТГ [51]. MADAG образуется путем последовательного введения двух остатков FA в положения sn-2 и sn-3 молекулы 1-О-алкилглицерина [52].
Метод маркерных FA неоднократно использовался для характеристики липидов симбионтов, организма-хозяина и передачи FA между членами симбиотического сообщества коралла [53]. Такие PUFA, как 20:4, 22:5 и 22:6, характерны для тканей животных, и присутствие молекулярных видов TG и MADAG, содержащих остатки этих PUFA, закономерно для книдарий (табл. 3). Октокораллы синтезируют редкие тетракозаполиеновые кислоты (TPA, 24:5n-6 и 24:6n-3) [10, 54], поэтому MADAG 18:0e/24:5/16:0 (табл. 3) однозначно является маркером тканей организма-хозяина. Маркерными PUFA зооксантелл являются 16:4, 18:3 и 18:4 [11, 55], следовательно, TG с остатками этих PUFA (табл. 3) могут синтезировать симбионты кораллов. В то же время известно, что зооксантеллы не синтезируют этерные липиды, поэтому обнаружение в липидах мягкого коралла ряда молекулярных видов MADAG с остатками маркеров зооксантелл (18:0e/18:3/16:0, 18:0e/18:4/16:0 и 16:0e/18:3/16:0) (табл. 2) следует рассматривать, как хорошее подтверждение существования передачи PUFA от симбионтов к хозяину. Предполагается, что зооксантеллы мягких кораллов также участвуют в синтезе кислоты 16:2n-7 [55], остатки которой входят в состав нескольких основных молекулярных видов неполярного липидома мягкого коралла S. siaesensis (табл. 2, 3).
Полярный липидом
В полярной части липидома альционарии S. siaesensis присутствовали фосфонолипид CAEP, глицерофосфолипиды PE, PC, PS и PI, 1-О-алкилглицерофосфохолин (лизо-PC), а также гликолипиды MGDG, DGDG и SQDG. Липиды по классам разделяли HPLC на полярной фазе, время удерживания молекулярных видов PE, PC, CAEP, PS и PI находилось в интервале 3–5, 5–8, 7–11, 10–12 и 12–17 минут, соответственно. Структуру молекулярных видов определяли методом тандемной масс-спектрометрии (MS/MS) высокого разрешения в режиме ионизации распылением в электрическом поле (ESI). На рис. 2 и 3 для каждого класса липидов показаны масс-спектры и схемы фрагментации ионов на примере одного из молекулярных видов этого класса.
Рис. 2.
Масс-спектры и схемы фрагментации полярных липидов мягкого коралла S. siaesensis: (а) церамидаминоэтилфосфонат CAEP 18:2b/16:0; (б) алкилацилглицерофосфосерин PS 18:0e/24:5; (в) диацилглицерофосфоинозит PI 18:0/24:5. MS(E+) – масс-спектр в режиме регистрации положительных ионов, MS(E–) и MS/MS(E–) – масс-спектр и МS2 спектр в режиме регистрации отрицательных ионов.
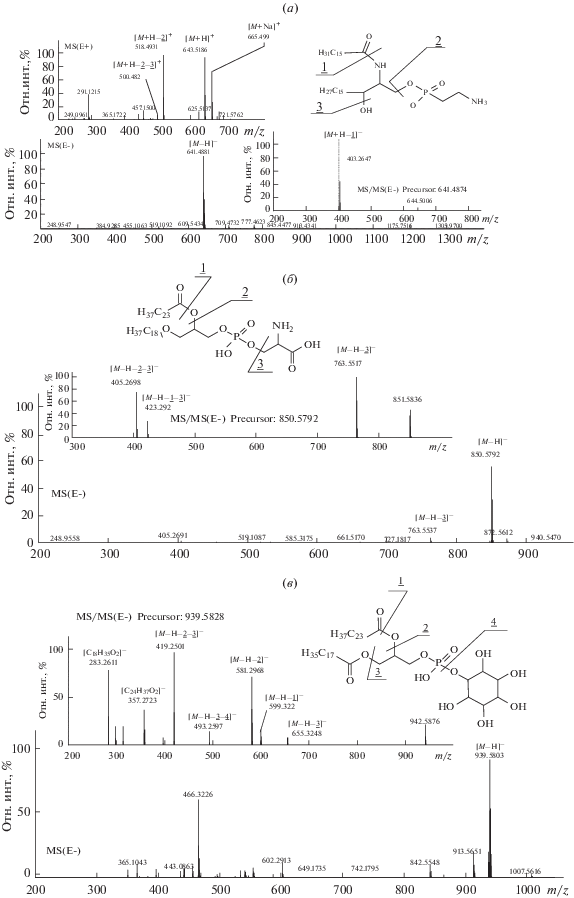
Рис. 3.
Масс-спектры и схемы фрагментации полярных липидов мягкого коралла S. siaesensis: (а) алкилацилглицерофосфоэтаноламин PE 18:0е/20:4; (б) алкилацилглицерофосфохолин PC 18:0alk/20:4. MS(E+) – масс-спектр в режиме регистрации положительных ионов, MS(E–) и MS/MS(E–) – масс-спектр и МS2-спектр в режиме регистрации отрицательных ионов.

На рис. 2а представлены масс-спектры CAEP 18:2b/16:0. В спектре положительных ионов наблюдали сигналы ионов [М + Na]+ (m/z 665.4990), [М + Н]+ (m/z 643.5186), [М + Н–2]+ (m/z 518.4931, отрыв полярной части) и [М + Н–2–3]+ (m/z 500.4820, отрыв полярной части и воды). В спектре отрицательных ионов присутствовал сигнал [М – Н]– (m/z 641.4881), который в MS/MS-спектре после отрыва кетена давал ион [М – Н–1]– с m/z 403.2647.
На рис. 2б представлены масс-спектры алкилацилглицерофосфосерина PS 18:0e/24:5. Депротонированный молекулярный ион [М – Н]– (m/z 850.6792) в MS/MS-спектре дает фрагменты, образованные при отрыве остатка серина [М – Н–3]– (m/z 763.5517), серина и кетена [М – Н–1–3]– (m/z 423.2920), а также серина и FA [М – Н–2–3]– (m/z 405.2698).
На рис. 2в представлены масс-спектры диацилглицерофосфоинозита PI 18:0/24:5. Ион [М – Н]– (m/z 939.5803) в MS/MS-спектре дает серию интенсивных сигналов, соответствующий фрагментам, образованных при потере различных комбинаций инозита, кетена и FA. Также наблюдаются сигналы ионов двух кислот [C18H35O2]– (m/z 283.2611) и [C24H37O2]– (m/z 357.2723).
На рис. 3а представлены масс-спектры алкилацилглицерофосфоэтаноламина PE 18:0е/20:4. Спектр MS/MS показывает, что ион [М – Н]– (m/z 750.5294) теряет кетен и FA, образуя фрагменты [М – Н–1]– и [М – Н–2]– соответственно. Этот спектр также содержит сигналы ионов [C20H31O2]– (m/z 303.2268) и [C18H35O2–CO2]– (m/z 259.2381). На рис. 3б представлены масс-спектры алкилацилглицерофосфохолина PC 18:0alk/20:4. Масс-спектр положительных ионов содержит сигналы с m/z 796.6230 ([М + Н]+) и m/z 818.5987 ([М + Na]+). В масс-спектре отрицательных ионов есть интенсивные сигналы аддукта [М + + НСОО]– (m/z 840.5968) и фрагмента [М – СН3]– (m/z 780.5760), который, в свою очередь, в MS/MS-спектре дает фрагмент [М–Н–1–2]– (m/z 494.3536), а также ионы [C20H31O2]– (m/z 303.2268) и [C18H35O2–CO2]– (m/z 259.2381).
Гликолипиды анализировали в тех же условиях, что и фосфорсодержащие классы, при этом времена удерживания MGDG, DGDG и SQDG находились в интервалах 2.5–3.5, 11–14 и 13–15.5 мин соответственно. Молекулярные виды всех классов гликолипидов образовывали ионы [М – Н]–, однако ионы MGDG не давали фрагментов в MS/MS-спектре, поэтому для MGDG определили только брутто-формулы молекулярных видов. MS/MS-спектры DGDG и SQDG содержали интенсивные сигналы фрагмент-ионов, образованных при потере остатков FA. При расшифровке масс-спектров гликолипидов использовали установленные ранее закономерности [22].
Главными компонентами полярного липидома альционарии S. siaesensis были (в процентах от общих липидов): PS 18:0e/24:5 (1.202%), лизо-PC 18:0e (1.055%), PE 18:1e/20:4 (0.909%), PC 18:0e/20:4 (0.510%), CAEP 18:2b/16:0 (0.433%), SQDG 14:0/16:0 (0.410%), PI 18:0/24:5 (0.196%) (табл. 4–6).
Таблица 4.
Состав этаноламин- и холинглицерофосфолипидов (PE и PC) мягкого коралла S. siaesensis*
| PE | С | Сотн | [M – H]– | PC | С | Сотн | [M + H]+ |
|---|---|---|---|---|---|---|---|
| 18:1e/17:1** | 0.039 | 1.82 | 714.5440 | 16:0e/16:2 | 0.184 | 7.27 | 716.5673 |
| 16:1e/20:4 | 0.054 | 2.53 | 722.5060 | 16:0e/18:4 | 0.201 | 7.95 | 740.5619 |
| 16:0e/20:4 | 0.030 | 1.42 | 724.5253 | 16:0e/16:3 | 0.148 | 5.84 | 742.5789 |
| 18:1e/18:2 | 0.044 | 2.07 | 726.5460 | 16:0e/18:2 | 0.164 | 6.47 | 744.6037 |
| 19:1e/17:1 | 0.096 | 4.49 | 728.5550 | 18:1e/16:0 | 0.075 | 2.95 | 746.6166 |
| 16:2/20:4*** | 0.090 | 4.21 | 734.5432 | 16:1e/20:6 | 0.042 | 1.66 | 762.5413 |
| 17:1e/20:4 | 0.012 | 0.58 | 736.5248 | 16:1e/20:5 | 0.049 | 1.94 | 764.5582 |
| 18:1e/20:4 | 0.909 | 42.54 | 750.5400 | 16:1e/20:4 | 0.043 | 1.69 | 766.5760 |
| 18:0e/20:4 | 0.105 | 4.89 | 752.5513 | 16:0e/20:4 | 0.397 | 15.68 | 768.5943 |
| 19:1e/20:4 | 0.098 | 4.61 | 764.5540 | 18:0e/18:3 | 0.102 | 4.04 | 770.6094 |
| 19:1/20:4 | 0.047 | 2.19 | 778.5256 | 18:0e/18:2 | 0.066 | 2.60 | 772.6352 |
| 20:3e/20:0-OH | 0.150 | 7.01 | 782.5904 | 18:0e/18:1 | 0.043 | 1.69 | 774.6458 |
| 20:1/20:4 | 0.051 | 2.40 | 792.5466 | 16:0e/22:6 | 0.065 | 2.58 | 792.5844 |
| 20:3e/21:0-OH | 0.093 | 4.37 | 796.6249 | 18:1e/20:4 | 0.062 | 2.45 | 794.6007 |
| 18:1e/20:0 | 0.018 | 0.83 | 802.5707 | 18:0e/20:4 | 0.510 | 20.17 | 796.6250 |
| 18:1e/24:5 | 0.066 | 3.10 | 804.5850 | 18:0e/20:3 | 0.042 | 1.65 | 798.6338 |
| 18:0e/24:5 | 0.061 | 2.86 | 806.6000 | 18:1e/22:6 | 0.073 | 2.89 | 818.5999 |
| 20:3e/22:0-OH | 0.173 | 8.11 | 810.6315 | 18:1e/22:5 | 0.062 | 2.44 | 820.6134 |
| Сумма | 2.138 | 100.0 | 16:0e/24:5 | 0.031 | 1.22 | 822.6340 | |
| 18:0e/24:5 | 0.016 | 0.64 | 850.6726 | ||||
| Другие | 0.157 | 6.21 | |||||
| Сумма | 2.531 | 100.0 |
Таблица 5.
Состав серин- и инозитглицерофосфолипидов (PS и PI), лизо-PC, а также церамидаминоэтилфосфонатов (CAEP) мягкого коралла S. siaesensis*
| PS | С | Сотн | [M – H]– | PI | С | Сотн | [M – H]– |
|---|---|---|---|---|---|---|---|
| 18:0e/22:5 | 0.012 | 0.80 | 822.5532 | 18:0e/22:4 | 0.003 | 1.10 | 899.5925 |
| 18:0e/24:6 | 0.182 | 12.17 | 848.5727 | 18:0/22:6 | 0.008 | 2.59 | 909.5472 |
| 18:0e/24:5 | 1.202 | 80.35 | 850.587 | 18:0/22:5 | 0.019 | 6.13 | 911.5601 |
| C50H82NO9P | 0.029 | 1.94 | 870.5535 | 18:0/22:4 | 0.039 | 12.17 | 913.5792 |
| C50H84NO9P | 0.072 | 4.81 | 872.5683 | 18:0/24:6 | 0.049 | 15.51 | 937.5754 |
| Сумма | 1.496 | 100.0 | 18:0/24:5 | 0.196 | 62.06 | 939.584 | |
| Другие | 0.014 | 4.42 | |||||
| Сумма | 0.316 | 100.0 | |||||
| CAEP | С | Сотн | [M – H]– | лизо-PC | С | Сотн | [M + H]+ |
| 18:2b/16:0 | 0.433 | 60.99 | 641.4952 | 18:0e | 1.055 | 78.10 | 494.3540 |
| 18:1b/16:0 | 0.124 | 17.47 | 643.5085 | 16:0e | 0.296 | 21.90 | 466.3230 |
| 18:0b/16:0 | 0.073 | 10.28 | 645.5263 | Сумма | 1.351 | 100.0 | |
| 18:2b/16:0-OH | 0.044 | 6.20 | 657.4889 | ||||
| C38H73N2O6P | 0.004 | 0.56 | 683.5016 | ||||
| C43H77N2O7P | 0.032 | 4.51 | 763.5543 | ||||
| Сумма | 0.710 | 100.0 |
* См. примечание к табл. 1 и 4.
Таблица 6.
Состав моногалактозил-, дигалактозил- и сульфохиновозилдиацилглицеролов (MGDG, DGDG и SQDG) мягкого коралла S. siaesensis*
| MGDG | С | Сотн | [M – H]– | SQDG | С | Сотн | [M – H]– |
|---|---|---|---|---|---|---|---|
| 32:2** | 0.010 | 3.51 | 725.513 | 14:0/14:0 | 0.015 | 1.83 | 737.4474 |
| 34:7 | 0.010 | 3.64 | 743.474 | 14:2/16:0 | 0.038 | 4.63 | 761.4457 |
| 36:9 | 0.024 | 8.50 | 767.474 | 14:1/16:0 | 0.125 | 15.24 | 763.461 |
| 36:8 | 0.044 | 15.59 | 769.4896 | 14:0/16:0 | 0.410 | 50.00 | 765.4772 |
| 36:7 | 0.057 | 20.00 | 771.5163 | 16:0/16:3 | 0.020 | 2.44 | 787.4592 |
| 38:10 | 0.009 | 3.09 | 793.4896 | 16:0/16:2 | 0.040 | 4.88 | 789.475 |
| 38:9 | 0.010 | 3.68 | 795.5053 | 16:0/16:0 | 0.142 | 17.32 | 793.508 |
| Другие | 0.120 | 8.07 | Другие | 0.030 | 3.66 | ||
| Сумма | 0.285 | 100.0 | Сумма | 0.82 | 100.0 | ||
| DGDG | С | Сотн | [M – H]– | ||||
| 34:7 | 0.021 | 11.73 | 905.5227 | ||||
| 36:9 | 0.029 | 16.20 | 929.5233 | ||||
| 18:4/18:4 | 0.076 | 42.46 | 931.5387 | ||||
| 18:4/20:5 | 0.053 | 29.61 | 957.5539 | ||||
| Сумма | 0.179 | 100.0 |
В исследованном виде альционарии остатки TPA, хемотаксономических маркеров всех октокораллов [10, 54], были сосредоточены в молекулярных видах PS и, частично, PI (табл. 5). Аналогичная диспропорция в распределении остатков TPA между классам фосфолипидов была отмечена в полярном липидоме других видов тропических и холодноводной альционарий [13, 14, 36], а также в медузе Rhopilemaes culentum [56]. Примечательно, что молекулярный вид PS 18:0e/24:5, содержащий остаток TPA, является одним из ключевых компонентов липидома альционарии S. siaesensis. Сравнение полярных липидомов S. siaesensis и других тропических альционарий подтверждает, что подавляющее большинство молекулярных видов PE, PC и PS этих животных находятся в алкилацильной форме, в то время как для молекулярных видов PI характерна диацильная форма (табл. 4–6). Поскольку MGDG, DGDG и SQDG являются главными классами липидов тилакоидных мембран растений, присутствие этих классов липидов закономерно для полного липидома мягкого коралла (табл. 6), содержащего зооксантеллы. SQDG 14:0/16:0 является одним из ключевых компонентов липидома S. siaesensis, что еще раз указывает на важность зооксантелл в формировании липидного профиля симбиотических мягких кораллов.
Наличие в липидоме исследованного мягкого коралла молекулярных видов с ацильными остатками TPA является следствием фундаментальных особенностей биосинтеза липидов в октокораллах, а доминирование насыщенных восков в запасных липидах, заметная доля MGDG, DGDG и SQDG, а также использование уникальных FA зооксантелл в синтезе липидов организма-хозяина, указывает на важность зооксантелл в формировании липидного профиля симбиотических мягких кораллов. Таким образом, полный липидом мягких кораллов зависит не только от особенностей биосинтеза липидов этих животных, но и отражает влияние симбиотических и ассоциированных организмов, источников пищи и условий среды обитания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экстракции липидов и ТСХ использовали гексан, бензол, хлороформ, метанол квалификации ч. д. а.; для ВЭЖХ – гексан, 2-пропанол, HCOOH, аммиак, триэтиламмин квалификации LC-MS grade (Sigma-Aldrich, США). ТСХ проводили на готовых пластинках Сорбфил ПТСХ-АФ-В, 10 см × 10 см (Россия). Стандарты триглицеридов, глико- и фосфолипидов получены от фирмы “Avanti Polar Lipids Inc.” (США). Тридецилпальмитат (х. ч.) получен от КНПО Диагностикум (Россия).
Объект исследования. Колонии мягкого коралла S. siaesensis van Ofwegen, 2008 собирали водолазным способом на глубинах 4–6 м в заливе Нячанг (NhaTrang) (Южно-Китайское море). Кораллы помещали в танк со свежей морской водой, транспортировали в лабораторию в течение 2 ч, тщательно очищали и немедленно использовали для экстракции липидов. Для анализа липидов использовали четыре разные колонии, в таблицах представлены средние значения от четырех измерений, отклонения не превышали 10% от средней величины.
Экстракция липидов. Липиды получали по модифицированному методу Фолча и др. [37]. Примерно 10 г влажной ткани измельчали на кусочки размером 1–3 мм и интенсивно гомогенизировали в 30 мл смеси хлороформ–метанол, 1 : 2, фильтровали, остаток дважды экстрагировали 30 мл смеси хлороформ–метанол, 2 : 1, оставляя для экстракции в течение 4 ч при 4°С. Экстракты объединяли, смешивали с 30 мл хлороформа и 35 мл воды и оставляли расслаиваться на ночь при 4°С. Затем нижний слой отделяли, упаривали, общие липиды растворяли в небольшом количестве хлороформа и хранили при –80°С.
Анализ восков. К аликвоте общих липидов добавляли внутренний стандарт (13:0/16:0, 480 мкг/мл), воски выделяли препаративной ТСХ в системе гексан–бензол, 70 : 30, растворяли в хлороформе и хранили при –18°С. Количественный анализ молекулярных видов восков осуществляли методом газо-жидкостной хроматографии на приборе Shimadzu GC-2010 (Япония) с пламенно-ионизационным детектором (температура 340°С) и капиллярной кварцевой колонкой Equity-5 (0.25 мм × × 30 м, толщина фазы 0.25 мкм, Supelco, США) в токе гелия (28.4 см/с), рабочее давление 1.2 атм., делитель пробы 1 : 30. Анализ проводили при температуре испарителя 320°С, в градиенте температуры колонки от 240 до 300°С со скоростью 20°С/мин и от 300 до 340°С со скоростью 4°С/мин. Структуру молекулярных видов восков определяли методом хроматомасс-спектрометрии на приборе Shimadzu GCMS QP5050A (Япония), используя капиллярную кварцевую колонку SPB-5ms (0.25 мм × 30 м, толщина фазы 0.25 мкм, Supelco, США) при температурных условиях, указанных выше. Температура интерфейса 240°С, ионизация электронным ударом (70 эВ). Масс-спектрометрические данные интерпретировали согласно работе [39].
Анализ TG и MADAG. Сумму TG и MADAG выделяли препаративной ТСХ, элюент–бензол, перерастворяли в хлороформе и хранили при ‒18°С. Количество TG и MADAG в общих липидах определяли денситометрией изображения аналитических ТСХ пластинок (Сорбфил Видеоденситометр, Россия) с построением калибровочной кривой по внешнему стандарту [14]. Молекулярные виды TG и MADAG разделяли сверхкритической флюидной хроматографией на приборе Shimadzu Nexera UC (Япония) на двух последовательно соединенных колонках Shim-pack XR-ODSII (2.0 × 150 мм) (Япония) при изократическом элюировании (0.6 мл/мин) сверхкритическим СО2 с добавкой 35% метанола, максимальное давление колонки 50 МПа и температура колонки 17°С. Для определения количества молекулярных видов ТГ и МАДАГ использовали детектор по светорассеиванию Shimadzu ELSD LT II (Япония) (температура испарительной трубки 40°С, давление газа распылителя (N2) 0.4 MPa). Для определения структуры этих веществ использовали жидкостной тройной квадрупольный масс-спектрометр Shimadzu LCMS-8060 (Япония), при этом к потоку элюента из хроматографической колонки с помощью насоса через постколоночный микросмеситель добавляли HCOOH (0.1% в MeOH) со скоростью 0.2 мл/мин. Анализ проводили в режиме химической ионизации при атмосферном давлении (APCI) и регистрации сигналов положительных ионов. Сканирование осуществляли в диапазоне m/z 300–1200. Температура интерфейса 350°С, температура линии десольватации 200°С. Скорости подачи испаряющего (N2), нагревающего (воздух) и осушающего газов (N2) (nebulizing, heating, and dry gases) составили 3, 10 и 10 л/мин соответственно. Интерпретацию масс-спектров проводили в соответствии со схемами фрагментации, опубликованными ранее [40, 41].
Анализ фосфорсодержащих липидов и гликолипидов. Общее количество фосфо- и фосфонолипидов и отдельных классов этих липидов определяли на спектрофотометре Shimadzu UV-1800 (Япония) по содержанию неорганического фосфора после сжигания с HClO4, как опубликовано ранее [57]. Количество гликолипидов определяли методом ТСХ в системе хлороформ–метанол–аммиак–бензол, 65 : 30 : 5 : 10 с последующей денситометрией [14] и калибровкой по внешнему стандарту гликолипидов.
Молекулярные виды фосфорсодержащих липидов и гликолипидов, входящие в состав общих липидов, разделяли на колонке Shim-Pack diol (4.6 × 50 мм, размер частиц 5 мкм) (Shimadzu, Япония) с использованием жидкостного хроматографа Shimadzu Nexera-e. В качестве элюента использовали систему А (2-пропанол–гексан–H2O–HCOOH–NH3–H2O–Et3N, 28 : 72 : 1.5 : 0.1 : : 0.05 : 0.02, по объему) и систему Б (2-пропанол–H2O–HCOOH–NH3–H2O–Et3N, 100 : 1.5 : 0.1 : : 0.05 : 0.02, по объему). Содержание системы Б программировали: от 0 до 20% (7 мин), от 20 до 100% (5 мин), 100% (5 мин), от 100 до 0% (0.1 мин) и 0% (10 мин). Скорость элюирования составила 0.2 мл/мин. Для детектирования липидов использовали жидкостной тандемный масс-спектрометр высокого разрешения Shimadzu LCMS-IT-TOF (ионная ловушка + времяпролетный масс-анализатор) (Япония). Анализ проводили в режиме ESI при одновременной регистрации сигналов положительных и отрицательных ионов. Сканирование осуществляли в диапазоне m/z 100–1200. Потенциал в источнике составлял –3.5 кВ при образовании отрицательных ионов и 4.5 кВ – при образовании положительных ионов. Температура ионного источника 250°С, давление газа-осушителя (N2) – 200 кПа, поток газа-распылителя (N2) – 1.5 л/мин. В соударительной ячейке масс-спектрометра использовали аргон (0.003 Па). Процентное содержание индивидуальных молекулярных видов для каждого класса гликолипидов и фосфорсодержащих липидов рассчитывали по площади пиков отрицательных ионов [M – H]ˉ, кроме холинглицерофосфолипидов, содержание которых определяли по площади пиков положительных ионов [M–СH3]+. Идентификацию молекулярных видов проводили, как описано ранее [14].
Список литературы
Spalding M.D., Grenfell A.M. // Coral Reefs. 1997. V. 16. P. 225–230.
Davy S.K., Allemand D., Weis V.M. // Microbiol. Mol. Biol. Rev. 2012. V. 76. P. 229–261.
Sorokin Y.I. Coral Reef Ecology. Ecological Studies. Berlin: Springer, 1995. V. 102.
Muscatine L., McCloskey L.R., Marian R.E. // Limnol. Oceanogr. 1981. V. 26. P. 601–611.
Hoegh-Guldberg O. // Mar. Freshw. Res. 1999. V. 50. P. 839–866.
Yamashiro H., Oku H., Higa H., Chinen I., Sakai K. // Comp. Biochem. Physiol. 1999. V. 122B. P. 397–407.
Имбс А.Б. // Биол. моря. 2013. Т. 39. С. 159–172.
Hamoutene D., Puestow T., Miller-Banoub J., Wareham V. // Coral Reefs. 2008. V. 27. P. 237–246.
Imbs A.B., Luu H.V., Long P.Q. // Chem. Nat. Comp. 2007. V. 43. P. 610–611.
Imbs A.B., Latyshev N.A., Dautova T.N., Latypov Y.Y. // Mar. Ecol. Progr. Ser. 2010. V. 409. P. 65–75.
Treignier C., Grover R., Ferrier-Pages C., Tolosa I. // Limnol. Oceanogr. 2008. V. 53. P. 2702–2710.
Латышев Н.А., Светашев В.И., Хунг Н.К., Нга Д.Т. // Биол. моря. 1986. № 3. С. 52–56.
Imbs A.B., Dang L.P.T., Rybin V.G., Nguyen N.T., Pham L.Q. // Biochem. Anal. Biochem. 2015. V. 4. P. 205.
Imbs A.B., Dang L.P.T., Rybin V.G., Svetashev V.I. // Lipids. 2015. V. 50. P. 575–589.
Joseph J.D. // Progr. Lipid Res. 1979. V. 18. P. 1–30.
Imbs A.B., Yakovleva I.M., Pham L.Q. // Fish. Sci. 2010. V. 76. P. 375–380.
Moschidis M.C. // Prog. Lipid Res. 1985. V. 23. P. 223–246.
Mukhamedova K.S., Glushenkova A.I. // Chem. Nat. Comp. 2000. V. 36. P. 329–341.
Awai K., Matsuoka R., Shioi Y. // Proceedings of the 12th Int. Coral Reef Symp. Cairns, Australia. 2012.
Bishop D.G., Kenrick J.R. // Lipids. 1980. V. 15. P. 799–804.
Tchernov D., Gorbunov M.Y., de Vargas C., Narayan Yadav S., Milligan A.J., Häggblom M., Falkowski P.G. // Proc. Nat. Acad. Sci. USA. 2004. V. 101. P. 13531–13535.
Имбс А.Б., Рыбин В.Г., Харламенко В.И., Данг Л.Т.Ф., Нгуен Н.Т., Фам К.М., Фам Л.К. // Биол. моря. 2015. Т. 41. С. 430–436.
Hashimoto N., Fujiwara S., Watanabe K., Iguchi K., Tsuzuki M. // Lipids. 2003. V. 38. P. 991–997.
Seemann J., Sawall Y., Auel H., Richter C. // Lipids. 2013. V. 48. P. 275–286.
Mueller C.E., Larsson A.I., Veuger B., Middelburg J.J. van Oevelen D. // Biogeosci. 2014. V. 11. P. 123–133.
Teece M.A., Estes B., Gelsleichter E., Lirman D. // Limnol. Oceanogr. 2011. V. 56. P. 1285–1296.
Papina M., Meziane T., van Woesik R. // Comp. Biochem. Physiol. 2003. V. 135B. P. 533–537.
Imbs A.B., Yakovleva I.M. // Coral Reefs. 2012. V. 31. P. 41–53.
Rodrigues L.J., Grottoli A.G., Pease T.K. // J. Exp. Mar. Biol. Ecol. 2008. V. 358. P. 136–143.
Meyers P.A. // Proceedings of Third Int. Coral Reef Symp. 1977. V. 1. P. 529–536.
Imbs A.B. // Polar Biol. 2016. V. 39. P. 1511–1514.
Spener F., Lagarde M., Geloen A., Record M. // Eur. J. Lipid Sci. Tech. 2003. V. 105. P. 481–482.
Vítová M., Goecke F., Sigler K., Řezanka T. // Algal Res. 2016. V. 13. P. 218–226.
Rybin V.G., Imbs A.B., Demidkova D.A., Ermolenko E.V. // Chem. Phys. Lipids. 2017. V. 202. P. 55–61.
Garrett T.A., Schmeitzel J.L., Klein J.A., Hwang J.J., Schwarz J.A. // PLoS One. 2013. V. 8. P. e57975.
Имбс А.Б. // Биол. моря. 2017. Т. 43. С. 210–214.
Folch J., Lees M., Sloane Stanley G.H. // J. Biol. Chem. 1957. V. 226. P. 497–509.
ViladrichN., Bramanti L., Tsounis G., Chocarro B., Martínez-Quitana A., Ambroso S., Madurell T., Rossi S. // Coral Reefs. 2016. V. 35. P. 1033–1045.
Urbanová K., Vrkoslav V., Valterová I., Háková M., Cvacka J. // J. Lipid Res. 2011. V. 53. P. 204–213.
Byrdwell W.C. // Lipids. 2005. V. 40. P. 383–417.
Holčapek M., Byrdwell W.C. Handbook of Advanced Chromatography/Mass Spectrometry Techniques. New York: Academic Press, 2017.
Hartvigsen K., Ravandi A., Bukhave K., Holmer G., Kuksis A. // J. Mass Spectrom. 2001. V. 36. P. 1116–1124.
Zhujin L., Jianxiong L., Houming W. // Chinese J. Org. Chem. 1990. V. 10. P. 277–281.
Al Lihaibi S.S., Al Sofyani A., Niaz G.R., Ahmad V.U., Noorwala M., Mohammad F.V. // Scientia Marina. 2002. V. 66. P. 95–101.
Chiereszko L.S., Karns T.K.B. // Biology and Geology of Coral Reefs, Vol. II / Ed. Jones O.A. New York: Acad. Press, 1973. P. 183–203.
Benson A.A., Muscatine L. // Limnol. Oceanogr. 1974. V. 19. P. 810–814.
Бош Т.В., Лонг Ф.К. // Биол. моря. 2017. Т. 43. С. 436–443.
Chen H.-K., Song S.-N., Wang L.-H., Mayfield A.B., Chen Y.-J., Chen W.-N.U., Chen C.-S. // PLoS One. 2015. V. 10. P. e0132519.
Chen H.-K., Wang L.-H., Chen W.-N.U., Mayfield A.B., Levy O., Lin C.-S., Chen C.-S. // Sci. Rep. 2017. V. 7. P. e3244.
Patton J.S., Abraham S., Benson A.A. // Mar. Biol. 1977. V. 44. P. 235–247.
Athenstaedt K., Daum G. // Eur. J. Biochem. 1999. V. 266. P. 1–16.
Magnusson C.D., Haraldsson G.G. // Chem. Phys. Lipids. 2011. V. 164. P. 315–340.
Imbs A.B., Yakovleva I.M., Dautova T.N., Bui L.H., Jones P. // Phytochem. 2014. V. 101. P. 76–82.
Vysotskii M.V., Svetashev V.I. // Biochim. Biophys. Acta. 1991. V. 1083. P. 161–165.
Имбс А.Б., Яковлева И.М., Латышев Н.А., Фам Л.К. // Биол. моря. 2010. Т. 36. С. 445–450.
Zhu S., Ye M., Xu J., Guo C., Zheng H., Hu J., Chen J., Wang Y., Xu S., Yan X. // J. Agric. Food Chem. 2015. V. 63. P. 8283−8291.
Vaskovsky V.E., Kostetsky E.Y., Vasendin I.M. // J. Chromatogr. 1974. V. 114. P. 129–141.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


