Биоорганическая химия, 2019, T. 45, № 2, стр. 173-183
Получение гибридом, продуцирующих моноклональные антитела к белку NS1 вируса Зика
С. С. Ветчинин , А. Г. Шевяков , Г. Н. Федюкина , Е. В. Баранова , С. Ф. Бикетов
ФБУН “Государственный научный центр прикладной микробиологии и биотехнологии” Роспотребнадзора
142279 Московская область, п., Оболенск, Россия
Поступила в редакцию 13.06.2018
После доработки 28.06.2018
Принята к публикации 20.06.2018
Аннотация
Получены гибридомы, продуцирующие моноклональные антитела (мкАТ) к рекомбинантному белку NS1 вируса Зика, синтезированному в клетках эмбриональных почек человека линии HEK293 (ZV293). Специфичность антител исследована с помощью иммуноферментного анализа (ИФА) с использованием аналогично синтезированных белков NS1 флавивирусов Денге 1–4 серогруппы, японского энцефалита, желтой лихорадки, клещевого энцефалита и лихорадки Западного Нила. Отобрано два типа гибридом, мкАТ которых взаимодействуют с термолабильными (мкАТ 2F6 и 3F3) и термостабильными эпитопами (мкАТ 1B9, 6D7 и 6F2) белка NS1 ZV. Показано, что мкАТ 3F3, специфичные к термолабильной детерминанте, можно использовать и как связывающие, и как выявляющие антитела при проведении “сэндвич”-ИФА. На основе мкАТ 3F3 разработан экспериментальный иммунохроматографический тест для выявления антигена NS1 ZV. Установлено также, что при проведении ИФА мкАТ 1B9, 6D7и 6F2 против термостабильных эпитопов белка NS1 специфически определяют белок NS1 ZV после его прогрева при температуре 98°С в течение 15 мин.
ВВЕДЕНИЕ
Лихорадки, передаваемые через укус комара – актуальная проблема для здравоохранения многих стран мира. Среди таких заболеваний наиболее известны малярия, лихорадка Денге, желтая лихорадка, японский энцефалит, лихорадки Зика, Чикунгунья и Западного Нила. Многие из них чаще протекают в легкой, субклинической форме, но нередки тяжелые осложнения (до 15%) и, при отсутствии своевременной медицинской помощи, летальные исходы. Из-за неспецифичности клинических симптомов здравоохранение нуждается в тестах, способных на ранних стадиях дифференцировать вирусные лихорадки различной этиологии.
Крупные вспышки лихорадки Зика в последние 3 года в ранее не эндемичных по вирусу Зика районах Бразилии и других стран Латинской Америки и параллельный рост случаев микроцефалии новорожденных стали причиной того, что в феврале 2016 года Всемирная организация здравоохранения объявила эпидемию лихорадки Зика глобальной угрозой здоровью человечества. Несмотря на то, что в ноябре того же года было объявлено об окончании вспышки лихорадки, из-за продолжающегося распространения комаров рода Aedes (главного переносчика вируса Зика), а также появления мутантных вариантов вируса сохраняется необходимость разработки и совершенствования средств профилактики и диагностики этого заболевания [1, 2].
Для постановки диагноза флавивирусной инфекции помимо клинических симптомов (сыпь, температура, артралгия, артрит, конъюнктивит) и наличия связи с эндемичными по вирусам, вызывающим эти заболевания, регионами необходимо выявление у пациентов специфических РНК, антител и/или секретируемых и не секретируемых антигенов.
К одному из наиболее специфичных и чувствительных методов обнаружения вирусной РНК относится метод ОТ-ПЦР. После появления симптомов заболевания РНК вируса Зика определяется в сыворотке крови в течение 7 дней, в слюне и моче – около 20 дней, семенной жидкости – более 20 дней [3, 4]. Однако, этот метод требует специального оборудования и зависит от сохранности вирусной РНК в клинических образцах.
В диагностике вируса Зика используют также реакцию нейтрализации (РН). Метод позволяет определять относительное количество вирус-специфических нейтрализующих антител, однако не выявляет классы антител и дает перекрестные реакции при повторной флавивирусной инфекции, особенно в районах, где циркулируют несколько видов флавивирусов. Кроме того, тест на РН достаточно продолжителен, и для тестирования большой панели образцов требуется специализированная лаборатория [5, 6].
Определение антител с помощью методов иммуноферментного анализа (ИФА) и иммунохроматографического (ИХ) теста, в отличие от РН, требует меньшего времени и технически существенно проще при анализе большого количества образцов. Однако все эти методы дают перекрестные реакции с антигенами других флавивирусов, особенно в эндемичных по этим вирусам регионах [7]. Для достижения большей специфичности серологических реакций необходим дизайн рекомбинантных антигенов с целью получения видоспецифических эпитопов [8].
Определение вирусных антигенов осуществляют также с применением видоспецифических мкАТ [9]. В качестве антигенов при получении мкАТ для диагностики флавивирусов обычно используют белок NS1 вируса, секретируемый из инфицированных клеток в виде гликозилированного гексамера и являющийся хорошим антигенным маркером острой фазы инфекции [10], а также структурный белок Е вируса [11]. Объединение тестов на наличие в крови пациентов антигена NS1 с тестами на наличие антител IgM и IgG к этому антигену повышает специфичность лабораторной диагностики, в частности, в случае дифференциальной диагностики лихорадки Денге, очень близкой по этиологии и патогенезу к лихорадке Зика. Отдельно тесты на NS1-антиген и антитела к этому антигену в крови пациента, в зависимости от метода (ИФА или ИХ-тесты), показывают специфичность 72–82% для антигенов и 75% для антител, а при объединении тестов на антитела и антигены – более 80% [12, 13]. Такое объединение особенно эффективно при обследовании туристов, вернувшихся из эндемичных по этим вирусам регионов [14].
Цель настоящей работы – получить на основе гибридомной технологии видоспецифические мкАТ к белку NS1 вируса Зика, пригодные для разработки диагностических тест-систем.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гибридомы, продуцирующие антитела против белка NS1 вируса Зика, получали слиянием клеток мышиной миеломы линии SP2/0 Ag 14 и спленоцитов из мышей, иммунизированных белком NS1ZV293 штамма Уганда, с титрами сывороток по данным ИФА не менее 1 : 32 000. Через неделю после слияния и культивирования клеток в селективной среде с HAT, проводили отбор образцов культуральной среды из лунок культуральных планшетов с делящимися гибридными клетками и анализировали на наличие мкАТ путем твердофазного ИФА с белком NS1 вируса Зика, синтезированного в клетках эмбриональных почек человека линии HEK293 (белок NS1ZV293). Всего обнаружено 30 образцов культуральной среды, положительно реагирующих на белок NS1ZV293. В процессе многократного клонирования гибридных клеток получены две стабильные гибридомы – продуценты мкАТ 3F3 и 2F6, показавших наибольшую специфичность к белку NS1ZV293.
Необходимые для анализа препаративные количества мкАТ 3F3 и 2F6 были получены из асцитной жидкости после внутрибрюшинного введения гибридомных клеток 3F3 и 2F6 мышам линии BALB/c. Антитела из асцита выделяли, используя аффинную хроматографию на колонке с белком А. Полученные мкАТ переводили в ФБР и использовали в работе.
С помощью ИФА показано, что полученные мкАТ 3F3 (IgG2b) специфично связываются только с гликозилированным белком NS1ZV293, выделенным из вирусного лизата клеток HEK293, зараженных штаммом Уганда (рис. 1). Отмечена слабая перекрестная реакция с белками NS1 вирусов японского энцефалита и желтой лихорадки (белки NS1JEV и NS1YFV, соответственно) (рис. 1). Также с помощью ИФА показано, что мкАТ 2F6 (IgG2b) специфически взаимодействуют как c гликозилированным белком NS1ZV293 штаммов Уганда и Суринам, так и с негликозилированным NS1ZV, синтезированным в E. сoli (белок NS1ZV E. сoli) (рис. 1).
Рис. 1.
Результаты исследования методом ИФА взаимодействия мкАТ 3F3 и 2F6 с флавивирусными антигенами: полученными в клетках НЕК293 белками NS1 вируса Денге серогрупп 1–4 (NS1DENV1–4 соответственно), вируса клещевого энцефалита (NS1TBEV), вируса японского энцефалита (NS1JEV), вируса желтой лихорадки (NS1YFV), вируса лихорадки Западного Нила (NS1WNV), вируса Зика штаммов Уганда и Суринам (NS1ZV293 Уганда и Суринам соответственно) и полученным в клетках E. coli белком NS1 вируса Зика (NS1ZVE. сoli). НМС – нормальная мышиная сыворотка (отрицательный контроль).

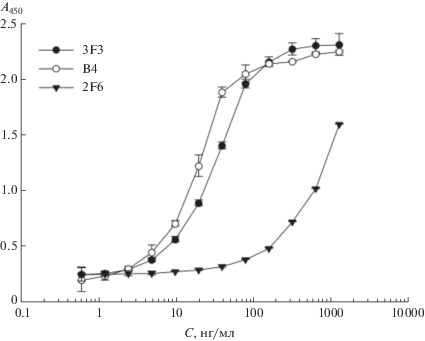
Полученные моноклональные антитела 2F6 и 3F3 были исследованы в качестве агентов для обнаружения рекомбинантного белка NS1ZV293 методом “сэндвич”-ИФА. NS1 вируса Зика – в буферном растворе методом “сэндвич”-ИФА. В качестве первых антител для сорбции на поверхность лунок винилового планшета для ИФА использовали мкАТ 2F6, 3F3 и коммерческие мышиные мкАТ В4, специфичные к белку NS1 вируса Зика, в качестве вторых антител – биотинилированные мкАТ 3F3. Наилучшую чувствительность при определении белка NS1 вируса Зика показали пары мкАТ 3F3-биотинилированные 3F3 и В4-биотинилированные 3F3 (рис. 2, кривые 1 и 2 соответственно). Предел чувствительности определения коммерческого рекомбинантного белка NS1 (Native Antigen, Великобритания) в ФБР методом “сэндвич”-ИФА с использованием в качестве первых антител мкАТ 3F3 и В4 составил 3–4 нг/мл.
Рис. 2.
Определение белка NS1 вируса Зика, синтезированного в клетках HEK293, методом “сэндвич”-ИФА с использованием в качестве первых антител мкАТ 3F3, мкАТ В4, мкАТ 2F6, в качестве вторых антител – биотинилированных мкАТ 3F3. С – концентрация белка NS1 в образце.
Для разработки ИХ-теста для определения белка NS1 вируса Зика (NS1ZV293) были использованы мкАТ 3F3, конъюгированные с коллоидным золотом (КЗ), которые продемонстрировали высокую специфичность к белку NS1ZV293 (рис. 3). Показано, что тест хорошо выявляет 50 и 100 нг белка NS1ZV293 (рис. 3, полоски 1 и 2 соответственно). Связывание конъюгатов со 100 нг аналогичных белков NS1 вирусов Денге серогруппы 3, лихорадки Западного Нила, клещевого энцефалита и желтой лихорадки не обнаружено (рис. 3, полоски 3–6 соответственно).
Рис. 3.
Иммунохроматографический тест на основе мкАТ 3F3, специфичных к белку NS1 вируса Зика. Показаны результаты определения белка NS1 вируса Зика в количестве 50 и 100 нг (полоски 1 и 2 соответственно), белков NS1 вирусов Денге серогруппы 3, лихорадки Западного Нила, клещевого энцефалита и желтой лихорадки (полоски 3–6, соответственно) в количестве 100 нг. К – контрольная зона с нанесенными на мембрану кроличьими антимышиными иммуноглобулинами, Т – тестовая зона с нанесенными на мембрану мкАТ 3F3.

В связи с тем, что для работы с патогенным материалом в полевых условиях может потребоваться термическая обработка образцов для уничтожения патогена, была проверена возможность использования мкАТ 3F3 для метода “сэндвич”-ИФА с образцами белка NS1ZV293, прогретыми при температуре 56°С в течение 60 мин и при температуре 98°С в течение 5 мин. Показано, что прогрев белка NS1ZV293 при температуре 56°С практически не влияет на его взаимодействие с антителами 3F3 (рис. 4, график 2), а прогрев белка при температуре 98°С приводит к полному отсутствию связывания с антителами 3F3 (рис. 4, график 3).
Рис. 4.
Влияние температурной обработки синтезированного в клетках HEK293 белка NS1 вируса Зика (NS1 ZV293) штамма Уганда на его взаимодействие с мкАТ 3F3. Результаты “сэндвич”-ИФА белка NS1 ZV293 штамма Уганда без температурной обработки (1), прогретого при температуре 56°С в течение 60 мин (2) и прогретого при температуре 98°С в течение 5 мин (3). В качестве вторых антител использованы биотинилированные мкАТ 3F3. С – концентрация белка NS1 в образце.

Для получения мкАТ, связывающихся с термостабильными антигенными детерминантами, мышей иммунизировали белком NS1ZV293, прогретым при температуре 98°С в течение 5 мин, и проводили гибридизацию спленоцитов иммунизированных мышей с миеломными клетками. В процессе селекции, отбора, клонирования и повторного клонирования положительных гибридов (всего 46) выделены 3 гибридомы, продуцирующие мкАТ 1В9 (IgG2a), 6D7 (IgG2a) и 6F2 (IgG1) с наибольшей специфичностью взаимодействия с прогретым белком NS1ZV293.
С помощью ИФА была исследована специфичность полученных мкАТ по отношению к белкам NS1 вируса Зика и контрольных флавивирусов (рис. 5). Показано, что мкАТ 1В9 не взаимодействуют с исходным гликозилированным белком NS1ZV293 штамма Уганда и гликозилированными белками NS1 контрольных флавивирусов, но хорошо выявляют структуру не гликозилированного белка NS1ZV E. сoli (рис. 5а). После прогрева белка NS1ZV293 штамма Уганда существенно увеличивается его связывание с мкАТ 1В9 (рис. 5б). Следует отметить одинаково слабое взаимодействие мкАТ 1В9 как с исходным, так и с прогретым при температуре 98°С белком NS1ZV293 штамма Суринам (рис. 5а, б).
Рис. 5.
Результаты твердофазного ИФА по определению специфичности мкАТ 1В9, 6D7 и 6F2 по отношению к флавивирусным антигенам: полученным в клетках НЕК293 исходным (а) и прогретым при температуре 98°С в течение 5 мин (б) белкам NS1 вируса Зика штаммов Уганда и Суринам (белки NS1ZV293 Уганда и Суринам соответственно), вируса Денге серогрупп 1–4 (NS1DENV1–4 соответственно), вируса клещевого энцефалита (NS1TBEV), вируса японского энцефалита (NS1JEV), вируса желтой лихорадки (NS1YFV), вируса лихорадки Западного Нила (NS1WNV), к полученному в клетках E. coli исходному (а) и прогретому (б) белку NS1 вируса Зика (NS1ZVE. сoli) и инактивированному нагреванием лизату клеток Vero, инфицированных вирусом Зика (ZVVero). НМС – нормальная мышиная сыворотка (отрицательный контроль).

Моноклональные антитела 6D7 одинаково хорошо связываются как с исходным, так и с прогретым белком NS1ZV293 штамма Уганда, а также с исходным белком NS1ZV293 штамма Суринам (рис. 5а), но при прогреве белка NS1ZV293 штамма Суринам его связывание с мкАТ 6D7 существенно уменьшается. Более слабое взаимодействие белка NS1ZV E. сoli с мкАТ 6D7 полностью утрачивается при его прогреве (рис. 5а, б).
Моноклональные антитела 6F2 имеют высокий уровень связывания как с исходными, так и с прогретыми белками NS1ZV E. сoli и NS1ZV293 штамма Уганда. В то же время мкАТ 6F2 практически полностью утрачивают способность к взаимодействию с прогретым белком NS1ZV293 штамма Суринам (рис. 5а, б).
Следует отметить, что для мкАТ 1В9 и 6D7 не наблюдается связывания ни с исходными, ни с прогретыми белками NS1 контрольных флавивирусов. В то же время, отмечена перекрестная реакция мкАТ 6F2 с исходными белками NS1 вирусов Денге серогрупп 1-3, клещевого энцефалита и лихорадки Западного Нила (рис. 5а), которая практически исчезает при их прогревании (рис. 5б). Напротив, при прогревании белка NS1 японского энцефалита появляется слабое перекрестное связывания его с мкАТ 6F2 (рис. 5б), отсутствующее у исходного белка (рис. 5а).
Для определения белка NS1ZV293 и белка NS1 из вирусного лизата клеток Vero штамма Уганда, прогретых при температуре 98°С в течение 5 мин, методом “сэндвич”-ИФА в качестве первых антител использовали мкАТ 1В9 (наилучшая специфичность связывания с белком), а в качестве вторых антител – биотинилированные мкАТ 6F2. Предел чувствительности определения белка NS1 вируса Зика методом “сэндвич”-ИФА составил 30–40 нг/мл как для индивидуального белка NS1ZV293, так и для белка в вирусном лизате из клеток Vero (рис. 6). “Сэндвич”-ИФА с прогретыми рекомбинантными белками NS1 вирусов Денге серотипов 2 и 4, лихорадки Западного Нила и японского энцефалита дал отрицательные результаты.
Рис. 6.
Результаты определения белка NS1 вируса Зика методом “сэндвич”-ИФА в препарате индивидуального белка NS1ZV293 штамма Уганда, прогретого при температуре 98°С в течение 5 мин (1), и в лизате инфицированных вирусом Зика клеток Vero, прогретом при температуре 98°С в течение 5 мин (2). В качестве первых антител использованы мкАТ 1В9, в качестве вторых антител – биотинилированные мкАТ 6F2. С – концентрация белка NS1 в образце.

Различия во взаимодействии мкАТ 3F3 (против термолабильного эпитопа), 6D7 и 6F2 (против термостабильных эпитопов) с белками NS1 ZV293 штаммов Уганда (Африканская разновидность) и Суринам (Американская разновидность) свидетельствуют об их эпитопном различии. Это может быть связано с большим числом остатков цистеина (до 12), участвующих в образовании внутримолекулярных S–S-мостиков, необходимых для правильного сворачивания белков NS1 флавивирусов [21], и участков гликозилирования, которые влияют на антигенные свойства белка [22–27]. Степень гомологии геномов этих штаммов является неполной и составляет 88% [28]. мкАТ 2F6 направлены, вероятно, против общей для штаммов Уганда и Суринам антигенной детерминанты. При денатурации белка NS1 ZV293 при температуре 98°С взаимодействие мкАТ гибридом 2F6 и 3F3 с белком утрачивается. Можно предположить, что эти мкАТ направлены против одних из основных конформационных детерминант белка NS1 вируса Зика. Полученные в нашем исследовании результаты в определенной степени согласуются с результатами эпитопного анализа белка NS1 вируса Денге серотипа 2 с помощью мкАТ до и после денатурации белка [10].
Особое место в полученной панели мкАТ к белку NS1 вируса Зика занимают мкАТ 1В9, которые взаимодействуют одинаково хорошо с исходным и прогретым белком NS1ZV E. сoli, а с белком NS1 ZV293 штамма Уганда только после тепловой денатурации. Это, вероятно, обусловлено тем, что при денатурации белок из гексамерной формы переходит в мономерную, структура которой сходна со структурой белка NS1 ZV E. сoli. При этом с исходным и денатурированным белком NS1 ZV293 штамма Суринам связывание отсутствует.
Таким образом, получены гибридомы, продуцирующие высокоспецифичные антитела к термолабильным и термостабильным детерминантам белка NS1 ZV293. Показано, что эти антитела можно использовать для специфического выявления белка NS1 ZV293 как методами сэндвич-ИФА и ИХ-тестов, так и при его эпитопном анализе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали рекомбинантные белки NS1 вируса Зика штаммов Уганда и Суринам, вирусов Денге 1–4 серогрупп, японского энцефалита, желтой лихорадки, клещевого энцефалита и лихорадки Западного Нила, синтезированные в клетках эмбриональных почек человека линии HEK293, моноклональные мышиные антитела HH6.B10.A4.B4 (мкАТ B4) к белку NS1 вируса Зика, инактивированный нагреванием лизат клеток Vero, зараженных вирусом Зика (Native Antigen, Великобритания), рекомбинантный белок NS1 вируса Зика, синтезированный в клетках E. сoli (ProSpec, Израиль).
Для проведения биохимических и культуральных работ, конструирования иммунохроматографических тестов использовали следующие реактивы и материалы: цитрат натрия дигидрат, карбонат калия, карбонат натрия, золотохлористоводородную кислоту, твин20, трис(гидроксиметил)аминометан (Трис), полный и неполный адъювант Фрейнда, антикроличьи иммуноглобулины, конъюгированные с пероксидазой хрена, пристан, диметилсульфоксид (DMSO), азид натрия, питательную среду RPMI-1640, 50× добавка для культуральной среды с гипоксантином, аминоптерином и тимидином (НАТ), 50× добавка для культуральной среды с гипоксантином и тимидином (НТ) (Sigma, США), фетальную сыворотку теленка (Hy Clone), ПЭГ-4000 (Merk, Германия), БСА (ICN, Biochemicals, Великобритания), бикарбонат натрия (Ameresco, США), сахарозу (ROTH, Германия), обезжиренное молоко (BioRad, США), гидроокись натрия, лимонную кислоту, сульфат аммония (Хеликон, Россия), сукцинимидил-6-(биотинамидо)гексонат (Thermoscientific, США), серную и соляную кислоты (ХимМед, Россия), нитроцеллюлозную мембрану 8 мкм (Schleicher&Schuell, Германия), колонку PD-10 с сефадексом G-25 (GE Healthcare, США), колонку с белок А сефарозой (GE Healthcare, США), 96-луночные планшеты и флаконы для культур клеток (Costar, США), планшеты для ИФА (Nunc, Дания).
Все соли были аналитической или химической чистоты. Растворы готовили на деионизованной воде, очищенной на установке MilliQ (Millipore, США).
Иммунизация мышей. Мышей линии BALB/с иммунизировали введением подкожно рекомбинантного белка NS1ZV293 штамма Уганда, растворенного в 100 мкл физиологического раствора и эмульгированного в соотношении 1 : 1, в количестве 80 мкг в полном адъюванте Фрейнда в 1-ый день эксперимента и 50 мкг в неполном адъюванте Фрейнда на 30-ый день эксперимента, и последующим введением внутривенно 10 мкг белка, растворенного в 50 мкл физиологического раствора, на 60-ый день эксперимента.
При получении гибридом, продуцирующих моноклональные антитела к термостабильным детерминантам, для иммунизации использовали белок NS1ZV293, прогретый при температуре 98°С в течение 15 мин.
Через три дня отбирали по 10 мкл крови из хвостовой вены иммунизированных мышей и определяли титры сывороток в ИФА с белком NS1ZV293.
Иммуноферментный анализ (ИФА). В лунки планшета для ИФА вносили по 100 мкл исходного или прогретого белка NS1 флавивирусов c концентрацией 1 мкг/мл в 0.01 М карбонатном буфере, рН 9.6 и инкубировали при температуре 4°С в течение ночи. Планшеты промывали 0.1 М фосфатно-солевым буферным раствором с 0.5% Твин 20 (ФБР–Т) три раза. Для блокирования неспецифических мест связывания в лунки добавляли по 150 мкл 1% БСА в ФБР–Т и инкубировали в течение 60 мин при температуре 37°C на шейкере. Лунки промывали три раза ФБР–Т, добавляли по 100 мкл различных разведений сывороток иммунизированных мышей в ФБР–Т и контрольную сыворотку мыши BALB/c в разведении 1/1000 и инкубировали в течение 60 мин при температуре 37°C. Лунки промывали пятикратно ФБР–Т, добавляли по 100 мкл антимышиных кроличьих иммуноглобулинов, конъюгированных с пероксидазой хрена, в рабочем разведении и инкубировали 40 мин при температуре 37°C. Пятикратно отмывали лунки планшета ФБР–Т и вносили в них по 100 мкл раствора субстрата (3,3',5,5'-тетраметилбензидин). Через 5 мин инкубации реакцию останавливали добавлением 50 мкл 4 N раствора H2SO4. Определение результатов производили на планшетном фотометре “Униплан” (Россия) при длине волны 450 нм.
Подготовка макрофагового питающего слоя. Мышей линии BALB/с умерщвляли ингаляцией СО2, вводили внутрибрюшинно по 3 мл охлажденной (4°C) жидкой питательной среды RPMI-1640 и в течение 3 мин проводили массаж брюшной полости. После этого мышь вскрывали и отбирали из брюшной полости жидкость, содержащую макрофаги. Полученную суспензию осаждали центрифугированием (1500 g, 10 мин) и разводили осадок до концентрации 4 × 105 клеток/мл в питательной среде RPMI-1640, содержащей 20% фетальной сыворотки теленка, 2 мМ L-глутамин, 80 мкг/мл гентамицина. Полученную суспензию макрофагов вносили по 50 мкл в каждую лунку 96-луночного планшета для тканевого культивирования. Планшеты культивировали при температуре 37°C в атмосфере с 5% СО2.
Выделение спленоцитов гипериммунных мышей. Мышь, иммунизированную белком NS1ZV293 штамма Уганда, с титром сыворотки по данным ИФА не менее 1 : 32 000, умерщвляли ингаляцией СО2, производили забор крови, вскрывали, извлекали селезенку и вымывали из нее спленоциты средой RPMI-1640 при помощи шприца. Спленоциты осаждали центрифугированием (1800 g × 10 мин) и ресуспендировали в среде RPMI-1640.
Гибридизация. Клетки мышиной миеломы линии SP2/0 Ag 14 культивировали на среде RPMI-1640 с 20% фетальной сывороткой теленка до общего количества клеток в матрасе не менее 107, трехкратно отмывали средой без сыворотки, осаждая центрифугированием при 1800 g в течение 10 мин, смешивали с суспензией спленоцитов и отмывали еще 3 раза при тех же условиях. Полученную смесь клеток переносили в плоскодонный бюкс и осаждали центрифугированием при 1800 g в течение 10 мин.
Слияние клеток проводили по методике, описанной в работе [15]. В качестве агента для слияния клеток использовали 50% водный раствор ПЭГ-4000 с рН 8.0. Полученную суспензию после гибридизации переносили на 96-луночные планшеты с питающим слоем макрофагов по 50 мкл на лунку. Далее планшеты культивировали в СО2-инкубаторе при температуре 37°C и в атмосфере с 5% СО2.
Селекция, отбор и клонирование гибридных клеток. На следующий день после гибридизации в каждую лунку планшета добавляли по 100 мкл селективной среды RPMI-1640, содержащей 20% фетальной сыворотки теленка, 2 мМ L-глютамин, 27.22 мкг/мл гипоксантина, 7.6 мкг/мл тимидина и 0.352 мкг/мл аминоптерина (двукратная НАТ-среда). В течение следующих двух недель культивирование гибридных клеток осуществляли на однократной НАТ-среде. Каждые 3–4 дня 1/2 объема питательной среды в каждой лунке заменяли на свежую. Начиная с 14-х суток культивирования, аналогичным образом НАТ-среду заменяли на среду НТ, а еще через 7 сут – на полную питательную среду RPMI-1640. Гибридные клетки клонировали методом лимитирующих разведений. Отбор гибридных клеток проводили на основе метода ИФА.
Наработка и очистка моноклональных антител. Для получения препаративных количеств мкАТ мышам линии BALB/с (самки 22–24-недельного возраста, массой 20–22 г) вводили внутрибрюшинно по 0.5 мл пристана и через 30 дней – 107 гибридных клеток. Через 5–7 дней отбирали у мышей асцитную жидкость и центрифугировали при 10 000 g в течение 30 мин. Надосадочную жидкость разводили 0.1 М ФБР, рН 8.6 в соотношении 1 : 4 и наносили на колонку с белок-А-сефарозой со скоростью 0.5 мл/мин. Промывали колонку ФБР со скоростью 1.4 мл/мин и элюировали мкАТ 0.1 М цитратным буфером, рН 3.0. Раствор мкАТ нейтрализовали 10 М NaOH, осаждали раствором сульфата аммония до 50% насыщения при температуре 4°C в течение ночи и центрифугировали при 10 000 g в течение 30 мин. Осадок растворяли в ФБР и удаляли сульфат аммония гель-фильтрацией на колонке PD-10 с сефадексом G-25 с использованием ФБР. Поглощение препарата белка определяли на спектрофотометре SmartSpecPlus (BioRad, США) при длине волны 280 нм, концентрацию белка расчитывали по формуле: С (мг/мл) = = n × 0.77А280, где n – разведение образца, А280 – поглощение при длине волны 280 нм.
Чистоту антител контролировали с использованием электрофореза в полиакриламидном геле по методу Лэмли в восстанавливающих условиях [16].
Изотипы мкАТ определяли с помощью набора стрип-полосок IsoQuick (Sigma, США), согласно инструкции.
Специфическую активность мкАТ по отношению к препаратам NS1 проверяли методом твердофазного ИФА.
“Сэндвич”-ИФА с использованием биотинилированных антител к белку NS1 вируса Зика. Биотинилирование мкАТ проводили согласно инструкции фирмы-производителя (Thermoscientific, США). Свободный биотин удаляли из реакционной смеси гель-фильтрацией на колонке PD-10 с Sephadex 25.
При проведении “сэндвич”-ИФА в лунки планшета для ИФА вносили по 1 мкг мкАТ к белку NS1ZV293 в 100 мкл 0.01 М карбонатного буфера, рН 9.6 и инкубировали при температуре 4°С в течение ночи. Планшеты промывали ФБР–Т три раза. Для блокирования неспецифических мест связывания в лунки добавляли по 150 мкл 1% раствора БСА в ФБР–Т и инкубировали в течение 60 мин при температуре 37°C на шейкере. Лунки промывали три раза ФБР–Т, добавляли по 100 мкл разведений белка NS1ZV в ФБР–Т (от 1200 до 0.6 нг/мл) и инкубировали в течение 60 мин при температуре 37°C, а затем 30 мин при комнатной температуре. Лунки промывали три раза ФБР–Т, добавляли по 100 мкл биотинилированных мкАТ в рабочем разведении и инкубировали в течение 60 мин при температуре 37°C. Лунки планшета три раза отмывали ФБР–Т, вносили в лунки по 100 мкл конъюгата стрептавидина с пероксидазой хрена и инкубировали в течение 30 мин при температуре 37°C. Пятикратно отмывали лунки планшета ФБР–Т и вносили в лунки по 100 мкл раствора субстрата (3,3',5,5'-тетраметилбензидин). Через 5 мин инкубации реакцию останавливали добавлением 50 мкл 2 М H2SO4. Определение результатов производили на планшетном фотометре “Униплан” (Россия) при длине волны 450 нм.
Разработка иммунохроматографической тест-системы. Конъюгаты мкАТ 3F3 с коллоидным золотом получали по методикам, описанным в работах [17–20]. Значение поглощения полученного золотоконъюгата мкАТ при длине волны 520 нм (А520) составило 4.0.
Для формирования контрольной зоны на нитроцеллюлозной мембране 8 мкм использовали кроличьи антитела против иммуноглобулинов мыши. Для формирования тестовой зоны использовали мкАТ 3F3 к белку NS1 ZV. Растворы антител в ФБР наносили диспенсером (“IsoFlow”, ImagineTechnology, США) на нитроцеллюлозную мембрану шириной 5 мм в концентрации 0.5 мг/мл со скоростью 4 мм/с и объемом 0.2 мкл/мм. В качестве стабилизирующих добавок использовали 10% глицерин, 1% БСА и 0.01% NaN3. Раствор золотоконъюгата мкАТ 3F3 с поглощением 2.0 ОЕ520 наносили на стекловолоконные фильтры со скоростью 8 мм/с в объеме 1.6 мкл/мм. Нитроцеллюлозную мембрану и стеловолоконный фильтр высушивали на воздухе при 25% влажности и температуре 30°С.
После высушивания на мембрану подклеивали фильтр с золотоконъюгатом, сорбирующую и поглощающую мембраны (MDI, Индия). Полученную заготовку нарезали с помощью резчика стрипов (IndexCutter, Индия) на полоски шириной 5 мм. Полоски герметично упаковывали и хранили до использования при температуре 4°С.
Для проведения теста в микропробирках готовили растворы рекомбинантных белков NS1 вирусов Зика 50 и 100 нг/мл, и по 100 нг/мл – для вирусов Денге третьей серогруппы, лихорадки западного Нила, клещевого энцефалита и японского энцефалита. В растворы помещали полоски ИХ-тестов и наблюдали результат через 15 мин инкубации при комнатной температуре. Положительным результатом считали появления двух отчетливых полос красного цвета в тестовой и контрольной зонах. Отрицательный – отсутствие полосы в тестовой зоне.
Список литературы
Malone R.W., Homan J., Callahan M.V., Glasspool-Malone J., Damodaran L., Schneider A.D.B., Zimler R., Talton J., Cobb R.R., Ruzic I., Smith-Gagen J., Janies D., Wilson J. // PLoS Negl. Trop. Dis. 2016. V. 10(3). P. e0004530. doi 10.1371/journal.pntd.0004530
World Health Organization. Zika Virus Disease, Interim case definition. World Health Organization. 2016. 12 February. Available from: http://www.who.int/ csr/disease/zika/case-definition/en/.
Bingham A.M., Cone M., Mock V., Heberlein-Larson L., Stanek D., Blackmore C. //MMWR Morb. Mortal Wkly Rep. 2016. V. 65(18). P. 475–478.
Gourinat A.C., O’Connor O., Calvez E., Goarant C., Dupont-Rouzeyrol M. // Emerg. Infect. Dis. 2015. V. 21(1) P. 84–86.
Corbett K.S., Katzelnick L., Tissera H., Amerasinghe A., de Silva A.D., de Silva A.M. // J. Infect. Dis. 2015. V. 211(4). P. 590–599.
Shan C., Xie X., Barrett A.D.T., Garcia-Blanc M.A., Tesh R.B., Vasconcelos P.F.D.C., Vasilakis N., Weaver S.C., Shi P.Y. // ACS Infect. Dis. 2016. V. 2. P. 170–172.
Lanciotti R.S., Kosoy O.L., Laven J.J., Velez J.O., Lambert A.J., Johnson A.J., Stanfield S.M., Duffy M.R. // Emerg. Infect. Dis. 2008. V. 14(8). P. 1232–1239.
Stettler K., Beltramello M., Espinosa D.A., Graham V., Cassotta A., Bianchi S., Vanzetta F., Minola A., Jaconi S., Mele F., Foglierini M., Pedotti M., Simonelli L.,Dowall S., Atkinson B., Percivalle E., Simmons C.P., Varani L., Blum J., Baldanti F., Cameroni E., Hewson R., Harris E., Lanzavecchia A., Sallusto F., Corti D. // Science. 2016. V. 353. P. 823–826.
Calvet G.A., Santos F.B., Sequeira P.C. // Curr. Opin. Infect. Dis. 2016. V. 29. P. 446–459.
Rocha L.B., Alves R.P.S., Caetano B.A., Pereira L.R., Mitsunari T., Amorim J.H., Polatto J.M., Botosso V.F., Gallina N.M.F., Palacios R., Precioso A.R., Granato C.F.H., Oliveira D.B.L., da Silveira V.B., Luz D., Ferreira L.C.S., Piazza R.M.F. // Antibodies. 2017. V. 6. P. 14. doi 10.3390/antib6040014
Okabayashi T., Sasaki T., Masrinoul P., Chantawat N., Yoksan S., Nitatpattana N., Chusri S., Vargas R.E.M., Grandadam M., Brey P.T., Soegijanto S., Mulyantno K.C., Churrotin S., Kotaki T., Faye O., Faye O., Sow A., Sall A.A., Puiprom O., Chaichana P., Kurosu T., Kato S., Kosaka M., Ramasoota P., Ikuta K. // J. Clin. Microbiol. 2015. V. 53(2). P. 382–388. doi 10.1128/JCM.02033–14
Hang V.T., Nguyet N.M., Trung D.T., Tricou V., Yoksan S., Dung N.M., Van Ngoc T., Hien T.T., Farrar J., Wills B., Simmons C.P. // PLoS Negl. Trop. Dis. 2009. V. 3(1). P. E360. doi 10.1371/journal.pntd.0000360
Blacksell S.D., Jarman R.G., Bailey M.S., Tanganuchitcharnchai A., Jenjaroen K., Gibbons R.V., Paris D.H., Premaratna R., de Silva H.J., Lalloo D.G., Day N.P. // Clin. Vaccine Immunol. 2011. V. 18(12). P. 2095–2101.
Huhtamo E., Hasu E., Uzcategui N.Y., Erra E., Nikkari S., Kantele A., Vapalahti O., Piiparinen H. // J. Clin. Virol. 2010. V. 47(1). P. 49–53. doi 10.1016/j.jcv.2009.11.001
Nowinski R.C., Lostrom M.E., Tam M.R., Stone M.R., Burnette W.N. // Virology. 1979. V. 93(1). P. 111–126.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Handly D.A. Methods for synthesis of colloidal gold // Colloidal Gold / Ed. Hayat M.A. London: Academic Press, 1989. V. 1. P. 14–32.
Hermanson G.T. Bioconjugate Techniques. 2nd ed. London: Elsevier Inc., 2008. P. 924–935.
Oliver C. // Methods Mol. Biol. 1994. V. 34. P. 321–328.
Федюкина Г.Н., Ветчинин С.С., Баранова Е.В., Рудницкий С.Ю., Соловьев П.В., Колосова Н.В., Бикетов С.Ф. // Биотехнология. 2015. Т. 1. С. 85–92.
Blitvich B.J., Scanlon D., Shiell B.J., Mackenzie J.S., Pham K., Hall R.A. // J. Gen. Virol. 2001. V. 82(9). P. 2251–2256.
Lisowska E. // Cellular and Molecular Life Sciences. 2002. V. 59(3). P. 445–455.
Dowling W., Thompson E., Badger C., Mellquist J.L., Garrison A.R., Smith J.M., Paragas J., Hogan R.J., Schmaljohn C. // J. Virol. 2007. V. 81(4). P. 1821–1837.
Gavrilov B.K., Rogers K., Fernandez-Sainz I.J., Holinka L.G., Borca M.V., Risatti G.R. // Virology. 2011. V. 420(2). P. 135–145.
Bu G., Zhang N., Chen F. // Food Res. Int. 2015. V. 76(3). P. 511–517.
Sun X., Jayaraman A., Maniprasad P., Raman R., Houser K.V., Pappas C., Zeng H., Sasisekharan R., Katz J.M., Tumpey T.M. // J. Virol. 2013. V. 87(15). P. 8756–8766.
Song H., Qi J, Haywood J., Shi Y., Gao G.F. // Nat. Struct. Mol. Biol. 2016. V. 23(5). P. 456–458.
Haddow A.D., Nasar F., Guzman H., Ponlawat A., Jarman R.G., Tesh R.B., Weaver S.C. // PLoS Negl. Trop. Dis. 2016. V. 10(10). P. E0005083. doi 10.1371/journal.pntd.0005083
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


