Биоорганическая химия, 2019, T. 45, № 5, стр. 510-517
Фрагменты пептида галанина и их синтетические аналоги c кардиопротективным действием
М. Е. Палькеева 1, *, М. В. Сидорова 1, А. С. Молокоедов 1, М. В. Овчинников 1, А. А. Азьмуко 1, Л. И. Серебрякова 1, О. М. Веселова 1, И. М. Студнева 1, О. И. Писаренко 1
1 ФГБУ “Национальный медицинский исследовательский центр кардиологии” Минздрава РФ
121552 Москва, 3-я Черепковская ул., 15а, Россия
* E-mail: peptide-cardio@yandex.ru
Поступила в редакцию 18.01.2019
После доработки 08.02.2019
Принята к публикации 04.03.2019
Аннотация
Автоматическим твердофазным методом с использованием Fmoc-методологии синтезированы новые пептидные аналоги галанина, соответствующие фрагментам N-концевой последовательности. При синтезе пептидов было обнаружено неполное отщепление Boc-защиты индольного кольца остатка триптофана в ходе постсинтетических процедур и предложен метод решения данной проблемы. Изучены физико-химические свойства ряда природных и синтетических N-концевых фрагментов галанина. Проведена сравнительная оценка кардиопротективного действия пептидных агонистов рецептора галанина GalR2 на модели региональной ишемии и реперфузии сердца у крыс in vivo. Установлено, что аналог, содержащий последовательность карнозина, H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-Gly-Pro-βAla-His-OH, наиболее эффективно защищает сердце от ишемического и реперфузионного стресса.
ВВЕДЕНИЕ
Распространенность заболеваний сердечно-сосудистой системы требует создания лекарственных средств, способных воздействовать на адаптационные механизмы в миокардиальных клетках в условиях изменившегося кислородного и энергетического обеспечения. Перспективным подходом для решения этой задачи является использование природных пептидов – лигандов рецепторов, сопряженных с G-белками, инициирующих механизмы запрограммированного клеточного выживания, которые запускаются каскадами реперфузионных киназ. К таким соединениям относится нейропептид галанин, состоящий из 29 а.о. (у человека 30 а.о.) [1–4]. Галанин регулирует ряд жизненно важных процессов – запоминания, потребления пищи, невропатической боли, выработки других гормонов, метаболизма, ионного гомеостаза и осмоса. В периферических органах и тканях, включая сердце, галанин действует не только через нейрональные механизмы, но и активируя рецепторы GalR 1–3 [3, 4].
Рецепторы GalR1–3 являются потенциальной мишенью для лечения различных заболеваний, но данных о влиянии галанина на сердечно-сосудистую систему немного [2]. Было показано, что введение экзогенного галанина в определенные отделы мозга способно оказывать гипотензивный эффект и вызывать тахикардию у крыс [5]. Галанин снижает резистентность к инсулину и улучшает поглощение глюкозы в диабетическом сердце, что представляет ценность для изучения сочетанных расстройств [6]. Запуск галанином сигнальных путей через рецептор GalR2 способен снижать гибель кардиомиоцитов [7]. В связи с этим представляет интерес изучение свойств агонистов рецептора GalR2, оказывающих влияние на повреждения сердца при ишемии и реперфузии.
За связывание с рецепторами отвечает N-концевой фрагмент галанина, первые 15 а.о. которого консервативны у большинства видов животных и человека [5, 8]. В работах [8–12] была изучена фармакологическая значимость различных аминокислотных остатков N-концевой последовательности при их взаимодействии с рецепторами. Оказалось, что фармакофорными остатками являются Gly1, Trp2 , Tyr9 и Gly12 [8]. Также было установлено, что делеция N-концевого остатка Gly1 приводит к значительному падению сродства к рецептору GalR1 и предпочтительному сродству к рецептору GalR2 [9]. Путем последовательного замещения всех аминокислотных остатков в коротком N-концевом фрагменте галанин-(2-11) на Ala было показано, что наличие остатков Trp2, Asn5, Gly8 и Tyr9 при отсутствии Gly1 является необходимым условием преимущественного взаимодействия пептида с рецептором GalR2 [12].
Наиболее изученным агонистом рецептора GalR2 является галанин-(2-11)-амид. Он обладает более высоким сродством к GalR2, чем к GalR1, и в меньшей степени связывается с рецептором GalR3 [12, 13]. Нами было показано, что этот пептид улучшает восстановление сократительной функции и метаболического состояния изолированного сердца крысы после тотальной ишемии [14]. Эти эффекты обусловлены снижением образования активных форм кислорода и ингибированием апоптоза [15].
Недостатками галанин-(2-11)-амида в качестве потенциального фармакологического объекта оказались плохая растворимость в воде и низкая протеолитическая стабильность, затрудняющие его изучение на моделях in vivo. Более длинный фрагмент – галанин-(2-15)-ОН обладал лучшей растворимостью в воде при сохранении кардиопротективного действия [16]. Настоящая работа является продолжением исследований в этой области. Ее основной целью было создание пептидных агонистов рецептора GalR2 и изучение их действия при региональной ишемии и реперфузии сердца у крыс in vivo.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Cинтез и свойства пептидных агонистов рецепторов галанина
Для синтеза и изучения кардиопротекторных свойств были выбраны пептиды, соответствующие N-концевой части полноразмерного галанина: известные агонисты рецепторов GalR2 – галанин-(2-11)-амид (H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-NH2 (I)) [9, 12, 13] и [Ala6]галанин-(2-11)-амид из последовательности желтого тунца H-Trp-Thr-Leu-Asn-Ala-Ala-Gly-Tyr-Leu-Leu-NH2 (II) [17], которые предполагалось использовать в качестве препаратов сравнения при проведении биологических тестов; а также галанин-(2-15)-амид (III) [18], галанин-(2-15)-ОН со свободной карбоксильной группой Leu (IV) и новые аналоги – [Nle11, Arg15]галанин-(2-15) (V) и [βAla14, His15]галанин-(2-15) (VI) [19]. Все выбранные пептиды содержат в последовательности фармакофорные аминокислотные остатки Trp2, Asn5, Gly8 и Tyr9 [12], необходимые для связывания с клеточными рецепторами GalR2. Галанин-(2-15) и его аналоги содержат остатки полярных аминокислот His или Arg, способствующие увеличению растворимости пептидов в воде. Наличие в С‑концевой части аналогов (V) и (VI) неприродной аминокислоты – норлейцина и β-аминокислоты – βAla, соответственно, потенциально увеличивает их протеолитическую устойчивость [20]. Аналог (VI) представляет собой химерную молекулу, в которой последовательность (2-11)-галанина, связывающаяся с GalR2, соединена с последовательностью природного дипептида карнозина через дипептид Gly-Pro, обладающий конформационной лабильностью. Карнозин хорошо растворим в водных средах, обладает широким спектром физиологической активности и известен как антиоксидант, способный защищать сердце при гипоксии [21, 22]. Подобный подход был использован для создания нейропротективных аналогов галанина [23].
Все пептиды были получены автоматическим твердофазным синтезом с использованием Fmoc-методологии (см. эксп. часть). Их аминокислотные последовательности, выходы и физико-химические характеристики приведены в табл. 1.
Таблица 1.
Характеристики фрагментов галанина и их аналогов
| Пептид | Последовательность | Мрасч. | Выход*, % | MALDI-TOF, m/z | Раство-римость в воде, мг/мл | ВЭЖХ** | |
|---|---|---|---|---|---|---|---|
| Rt, мин | чис- тота, % | ||||||
| (I) | H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-NH2 | 1136.3 | 61.0 | 1136.77 | ≈0.25 | 16.53 | 98.1 |
| (II) | H-Trp-Thr-Leu-Asn-Ala-Ala-Gly-Tyr-Leu-Leu-NH2 | 1120.3 | 41.4 | 1120.61, 1142.60 [M + Na]+, 1158.58 [M + K]+ | ≈0.20 | 17.70 | 96.7 |
| (III) | H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-Gly-Pro-His-Ala-NH2 | 1498.68 | 27.4 | 1499.72 | ≈4 | 14.85 | 96.2 |
| (IV) | H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-Gly-Pro-His-Ala-ОН | 1499.67 | 45.4 | 1498.64 | ≈10 | 15.34 | 97.1 |
| (V) | H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Nle-Gly-Pro-His-Arg-ОН | 1584.88 | 21.2 | 1584.66 [М + Н]+ | >20 | 14.25 | 95.8 |
| (VI) | H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-Gly-Pro-βAla-His-OH | 1499.67 | 46.3 | 1499.76, 1521.73 [М + Na]+ 1537.72 [M + K]+ | >20 | 14.66 | 98.2 |
Модификации выделены жирным шрифтом.
** Аналитическую ВЭЖХ проводили на колонке Kromasil 100-5 C18 (4.6 × 250 мм), размер частиц сорбента 5 мкм; в качестве элюентов использовали: буфер А – 0.1% TFA, буфер Б – 80% ацетонитрил в буфере А, элюция со скоростью 1 мл/мин градиентом концентрации буфера Б в буфере А от 20 до 80% за 30 мин, детекция при 220 нм.
Интересно, что сырой продукт ТФС пептида (I) по данным ВЭЖХ, оказался смесью в основном трех веществ – (Ia), (Iб) и (I), с содержанием 23, 11 и 43% соответственно (рис. 1а). Известно, что серинсодержащие пептиды легко подвергаются N→O-ацильной миграции в кислой среде при комнатной температуре, эта реакция обратима, обратная миграция достигается щелочной обработкой пептида [24]. Кроме того, известно, что иногда при деблокировании Trp(Boc)-защищенных пептидилполимеров трифторуксусной кислотой имеет место неполное отщепление Boc-защиты с индольной функции триптофана. Образующийся при отщеплении изобутилена интермедиат Trp(СООН) предотвращает алкилирование индольного ядра и разрушается при последующей лиофилизации его раствора в разбавленной уксусной кислоте [25]. Указанные процессы происходят не всегда и зависят от конкретной аминокислотной последовательности.
Рис. 1.
ВЭЖХ продукта деблокирования пептида (I): а – сырой продукт ТФС; б – продукт лиофилизации из 5% АсОН; в – продукт обработки лиофилизата (I) 5% раствором аммиака с 10% диоксана в течение 16 ч; г – пептид, очищенный с помощью препаративной ВЭЖХ. Условия аналитической ВЭЖХ: колонка Диасфер 110-С-18 (4.0 × 250 мм), размер частиц сорбента 5 мкм. Элюенты: буфер А – 0.05 М КН2РО4, pH 3.0, буфер Б – 70% ацетонитрил в буфере А, элюция со скоростью 1 мл/мин градиентом концентрации буфера Б в буфере А от 20 до 80% за 30 мин. Детекция при 220 нм.
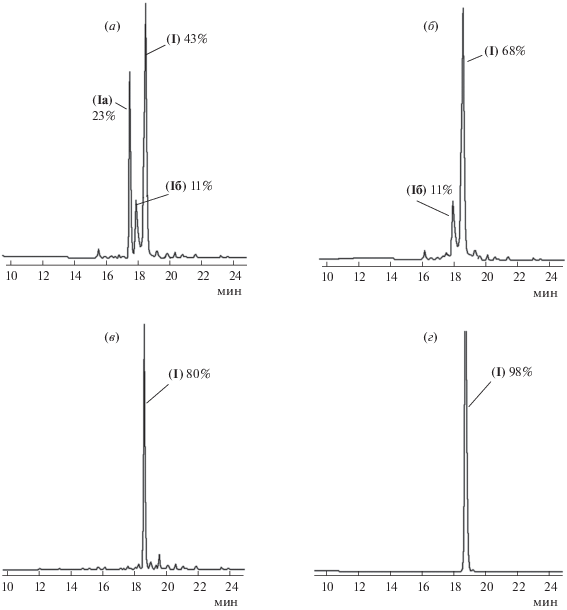
Для понимания того, какие превращения в нашем случае имели место при деблокировании, мы подвергли сырой пептид как кислой, так и щелочной обработке. После лиофилизации из 5% АсОН соотношение пиков на профиле ВЭЖХ изменилось: практически полностью исчез пик соединения (Ia) и соответственно доля целевого продукта (I) в реакционной смеси увеличилась до 68%, содержание продукта (Iб) при этом осталось неизменным (11%) (рис. 1б). Полагая минорную примесь (Iб) продуктом N→O-миграции, мы провели обработку пептида 5% раствором аммиака, с 10% диоксана – для полного растворения, в течение 16 ч, до исчезновения побочного изоацилпептида (Iб); при этом содержание целевого пептида (I) в смеси возросло до 80% (рис. 1в). После этого пептид (I) был очищен методом препаративной ВЭЖХ до 98% чистоты (рис. 1г). Таким образом, полученные результаты свидетельствуют о том, что пик (Iа) на рис. 1а соответствует Trp(СООН)-интермедиату пептида (I), а пик (Iб) – продукту N → O-ацильной миграции по остатку Ser.
При синтезе пептида (II) сырой продукт деблокирования пептидилполимера также был неоднороден и состоял из двух соединений в процентном соотношении 31 : 40. Учитывая отсутствие серина и связанной с ним N→O-ацильной миграции, сырой пептид подвергли только лиофилизации из 5% АсОН. Соотношение пиков в ВЭЖХ лиофилизата практически не изменилось, полное деблокирование Trp(СООН)-интермедиата было достигнуто только после нагрева сырого пептида в 5% водной АсОН с добавкой 5% диоксана при 45°С в течение 4–5 ч. Конечное содержание целевого вещества в сыром продукте составило 72% по данным ВЭЖХ.
При отщеплении пептидов (III)–(VI) от полимера и анализе сырых продуктов ТФС с помощью ВЭЖХ оказалось, что они также в основном состоят из двух веществ. В данном случае лиофилизации из 5–7% одного раствора АсОН оказалось достаточно для существенного обогащения исходных смесей целевым веществом. По-видимому, N→O-ацильной миграции не наблюдалось, возможно, благодаря присутствию основного остатка гистидина. Содержание пептидов в сырых продуктах ТФС до и после лиофилизации приведено в табл. 2.
Таблица 2.
Содержание целевых и побочных соединений в “сырых” продуктах ТФС N-концевых фрагментов галанина
| Пептид | Соотношение Trp(COОH)-интермедиат/целевой пептид в сыром продукте ТФС (%) до обработки 5% АсОН | Содержание целевого продукта после обработки 5% АсОН (%) |
|---|---|---|
| (I) | 23/43 | 80* |
| (II) | 31/40 | 72 |
| (III) | 42/31 | 77 |
| (IV) | 25/54 | 80 |
| (V) | 31/39 | 71 |
| (VI) | 27/54 | 83 |
Мы изучили растворимость пептидов (I)–(VI) в воде. Как и ожидалось, полученные нами новые аналоги галанина-(2–15) – пептиды (V) и (VI) оказались значительно лучше растворимы в воде (примерно в 100 раз) по сравнению с пептидами (I) и (II) (табл. 1). Кроме того, растворимость пептидов коррелировала с их временами удерживания при ВЭЖХ, что согласуется с литературными данными [26]. Далее были изучены кардиопротективные свойства полученных соединений.
Влияние пептидов (I)–(VI) на степень повреждения сердца при ишемии и последующей реперфузии11
Действие пептидов (I)–(VI) было изучено на модели региональной ишемии миокарда и реперфузии у наркотизированных крыс in vivo. В качестве критериев защиты использовали: 1) степень повреждения сердца при инфаркте миокарда (ИМ) в конце реперфузии; его оценивали процентным отношением площади ИМ к площади зоны риска (ЗР) левого желудочка сердца (ИМ/ЗР, %) и 2) активность маркеров некроза – МВ-фракции креатинкиназы (КК-МВ) и лактатдегидрогеназы (ЛДГ) – в плазме крови. Пептиды в дозе 0.5–3.0 мг/кг вводили внутривенно в момент восстановления коронарного кровотока.
В исходном состоянии систолическое артериальное давление (СAД) было практически одинаковым во всех группах и составляло 83 ± 4 мм рт. ст., ЧСС – 331 ± 11 мин–1. В контроле введение растворителя пептидов – 0.5% DMSO в физиологическом растворе – не приводило к изменению СAД и ЧСС при последующей региональной ишемии и реперфузии. Введение пептидов (I)–(VI) в дозах 0.5; 1.0; 2.0 или 3.0 мг/кг после региональной ишемии незначительно снижало САД и ЧСС в среднем на 15 и 7% соответственно, от исходного уровня ко второй минуте реперфузии; к окончанию реперфузии оба показателя восстанавливались до исходных значений.
Гистохимический анализ срезов левого желудочка (ЛЖ) сердца после реперфузии не выявил достоверных различий в ЗР между экспериментальными группами. Величина ЗР ЛЖ в контроле и в группах пептидов (I)–(VI) была близкой и составляла в среднем 40.2 ± 1.4%. Это означает, что ишемическое и реперфузионное повреждение сердца было моделировано стандартно у всех животных. Введение оптимальных доз пептидов (I)–(VI) достоверно ограничивало размеры ИМ (рис. 2). В наибольшей степени отношение ИМ/ЗР снижалось под действием пептида (VI) в дозе 1 мг/кг – на 40% от величины в контроле. Пептид (VI) достоверно эффективнее уменьшал размеры ИМ по сравнению с оптимальными дозами пептидов (II), (IV) и (V).
Рис. 2.
Размеры инфаркта миокарда (ИМ/ЗР) при внутривенном введении оптимальных доз пептидов (I)–(VI) после региональной ишемии миокарда у наркотизированных крыс in vivo. Данные представлены как М ± m для серий из 8–10 опытов. К – контроль. Дозы пептидов в мг/кг: 1.0 для (I), (III), (IV), (V) и (VI); 0.5 для (II); 2.0 для (I). P < 0.05 от: * контроля, # пептида (II).

Активность КК-МВ и ЛДГ в плазме крови в исходном состоянии (перед окклюзией передней нисходящей коронарной артерии) составляла 274.3 ± 27.3 и 91.7 ± 20.5 МЕ/л соответственно. Развитие ИМ в контроле сопровождалось значительным увеличением активности маркеров некроза в конце реперфузии по сравнению с исходным состоянием – до 2347.1 ± 78.7 и 1402.7 ± 107.9 МЕ/л для МВ-КК и ЛДГ, соответственно (рис. 3а, 3б). Введение пептидов (I)–(VI) в оптимальных дозах перед началом реперфузии достоверно снижало активность обоих ферментов по сравнению с контролем, что указывало на меньшие повреждения мембран кардиомиоцитов. Под действием наиболее эффективного пептида (VI) активность КК-МВ и ЛДГ в плазме была снижена на 38 и 32% соответственно. Достоверных различий в способности пептидов (I)–(VI) снижать активность маркеров некроза в плазме обнаружено не было. Полученные данные указывают на возможность уменьшения необратимого повреждения кардиомиоцитов и снижения размеров острого инфаркта миокарда с помощью пептидов (I)–(VI) при незначительных изменениях гемодинамических показателей у крыс in vivo. При этом, наибольший кардиопротективный эффект проявил аналог (VI), являющийся химерной молекулой.
Рис. 3.
Активность креатинкиназы-МВ (КК-МВ) (а) и лактатдегидрогеназы (ЛДГ) (б) в плазме крови наркотизированных крыс in vivo в конце реперфузии при внутривенном введении оптимальных доз пептидов (I)–(VI) после региональной ишемии миокарда. Данные представлены как М ± m для серий из 8–10 опытов. К – контроль. Дозы пептидов в мг/кг: 1.0 для (I), (III), (IV), (V) и (IV); 0.5 для (II); 2.0 для (I). P < 0.05 от: * контроля.

ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы производные L-аминокислот (Novabiochem, ФРГ), TBTU (Fluka, Швейцария). Для синтеза применяли N-метилпирролидон, дихлорметан и трифторуксусную кислоту (Applied Biosystems, США). DMF очищали перегонкой над нингидрином и окисью бария.
ВЭЖХ проводили на хроматографах (Gilson, Франция) и Knauer (ФРГ). Для ВЭЖХ использовали ацетонитрил и изопропиловый спирт фирмы (Panreac, Испания). Аналитическую ВЭЖХ проводили на колонке Kromasil 100-5 C18 (4.6 × × 250 мм), размер частиц сорбента 5 мкм; в качестве элюентов использовали: буфер А – 0.1% TFA, буфер Б – 80% ацетонитрил в буфере А, элюция со скоростью 1 мл/мин градиентом концентрации буфера Б в буфере А от 20 до 80% за 30 мин, детекция при 220 нм, а также на колонке Диасфер 110-С-18 (4.0 × 250 мм), размер частиц сорбента 5 мкм; в качестве элюентов использовали: буфер А – 0.05 М КН2РО4, pH 3.0, буфер Б – 70% ацетонитрил в буфере А, элюция со скоростью 1 мл/мин градиентом концентрации буфера Б в буфере А от 20 до 80% за 30 мин, детекция при 220 нм. Препаративная ВЭЖХ проводилась на колонке Kromasil С18 (30 × 250 мм), размер частиц сорбента 10 мкм. В качестве элюентов использовали буфер А – 0.1% TFA, буфер Б – 80% ацетонитрила в буфере А. Элюцию проводили градиентом 0.5% в минуту буфера Б в буфере А от 100% буфера А со скоростью 10 мл/мин. Пептиды детектировали при длине волны 220 нм. Фракции, соответствующие целевому веществу, объединяли, концентрировали в вакууме и лиофилизировали.
Синтезированные пептиды характеризовали данными 1Н-ЯМР-спектроскопии и масс-спектрометрии. 1Н-ЯМР-спектры регистрировали на спектрометре WH-500 Bruker 500 МГц (ФРГ) в DMSO-d6 при 300 K, концентрация пептидов составляла 2–3 мг/мл, химические сдвиги (δ, м.д.) измерялись относительно тетраметилсилана. Масс-спектры регистрировали на приборе Bruker Daltonics (ФРГ).
Растворимость пептидов в воде измеряли согласно методике [27].
Твердофазный синтез пептидов
Синтез пептидов проводили с С-конца ступенчатым наращиванием пептидной цепи с применением Fmoc-методологии на пептидном синтезаторе Tribute-UV (Protein Technologies, Inc., США) в соответствии со стандартным протоколом однократной конденсации. Для получения амидов пептидов (I)–(III) использовали полимер Ринка, представляющий собой сополимер стирола с 1% дивинилбензола с 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиметильной якорной группой (Novabiochem) с содержанием аминогрупп – 0.71 ммоль/г. Синтез пептидов (IV)–(VI) c С-концевой карбоксильной группой проводили на полимере Ванга, содержащем соответствующие стартовые аминокислотные остатки (Novabiochem, ФРГ). Все синтезы проводили, исходя из (0.375 ммоль) соответствующего полимера. Для блокирования функциональных групп боковых цепей аминокислот применяли следующие защиты: трет-бутильную для гидроксильной функции серина, треонина и тирозина, Trt-группу – для имидазольной функции гистидина и амидной функции аспарагина, Boc – для индольного кольца триптофана, Pbf – для гуанидиновой функции аргинина. Для деблокирования α-аминогрупп в процессе ТФС использовали раствор 25% 4-MePip в DMF.
Для создания амидной связи применяли 4-кратные избытки Fmoc-аминокислот (1.5 ммоль) и TBTU/NMM-метод [28]. Заключительное отщепление от носителя и деблокирование пептидов осуществляли действием смеси TFA–вода–триизопропилсилан–дитиотреитол (85 : 5 : 5 : 5) в течение 1.5 ч. По окончании реакции полимер отфильтровывали, промывали 2 × 2 мл деблокирующей смеси, фильтрат упаривали, продукт осаждали сухим диэтиловым эфиром, отфильтровывали, промывали на фильтре эфиром и DCM. Сырой продукт ТФС лиофилизировали из 5% АсОН, а в случае синтеза соединения (I) дополнительно обрабатывали 5% раствором аммиака с добавкой диоксана в течение 16 ч. После этого пептиды (I)–(VI) очищали методом ВЭЖХ, как описано выше, до 96–98%-й чистоты. Структура пептидов была подтверждена методами 1Н-ЯМР-спектроскопии и масс-спектрометрии. Выходы и характеристики пептидов (I)–(VI) приведены в табл. 1.
Модель региональной ишемии и реперфузии у крыс in vivo
У наркотизированных 20% уретаном (1200 мг/кг веса внутрибрюшинно) самцов крыс Вистар массой 300–350 г в условиях торакотомии осуществляли искусственную вентиляцию легких комнатным воздухом с помощью аппарата KTR-5 (Hugo Sacks Electronik/Harvard Apparatus, США). Яремную вену катетеризировали для окрашивания сердца 1% раствором Эванса в конце опыта. Сонную артерию катетеризировали для регистрации артериального давления. После присоединения артериального катетера к тензометрическому датчику регистрировали САД и ЧСС на полиграфе Biograph-4 (Cанкт-Петербургский ГУАП, Россия). Запись на компьютер выполнена с помощью аналого-цифрового преобразователя USB 6210 (National Instruments, США) в системе LabView 7 (National Instruments, США) [14].
После окончания препарирования животного следовал 30-минутный период стабилизации гемодинамических показателей (исходное состояние), затем окклюзия правой нисходящей артерии (ПНА) в течение 40 мин, продолжительность последующей реперфузии составляла 60 мин. В экспериментальной серии после периода региональной ишемии вводили пептиды (I)–(VI) в дозах 0.5; 1.0; 2.0 или 3.0 мг/кг веса одновременно с началом реперфузии внутривенно болюсом. Пептиды растворяли в 0.5% DMSO в физиологическом растворе. В контрольной серии опытов вводили такой же объем 0.5% DMSO в физиологическом растворе (0.5 мл). В дополнительных исследованиях было изучено влияние введения галанина на параметры гемодинамики и размеры ИМ у ложнооперированных животных. В конце опыта для идентификации ЗР и интактной области миокарда реокклюзировали ПНА и в яремную вену вводили болюсно 2% раствор Эванса (2 мл). Затем вырезали сердце и выделяли ЛЖ для последующего определения размеров ИМ.
Определение размеров инфаркта миокарда
Замороженный ЛЖ разрезали перпендикулярно длинной оси сердца на 4–5 срезов толщиной около 1.5–2.0 мм, которые затем инкубировали 10 мин в 1% растворе 2,3,5-трифенилтетразолий-хлорида в 0.1 М калийфосфатном буфере (рН 7.4 при 37°С). Полученные образцы сканировали, площади ИМ и ЗР на полученных изображениях определяли методом компьютерной планиметрии, используя программу Imagecal. После этого срезы взвешивали для определения массы ЛЖ. В каждой группе рассчитывали процентные отношения ЗР/ЛЖ и ИМ/ЗР [15].
Оценка повреждения клеточных мембран
Повреждение мембран кардиомиоцитов оценивали по увеличению активности маркеров некроза – ЛДГ и КK-MB – в плазме крови в конце реперфузии. Около 0.5 мл крови собирали в гепаринизированные пробирки из венозного катетера в исходном состоянии (перед окклюзией ПНА) и после часа реперфузии. Активность ферментов в плазме определяли на спектрофотометре Shimadzu UV-1800 (Япония) при λ 340 нм, используя наборы фирмы BioSystems.
Статистическая обработка результатов
Использован пакет программ SigmaPlot 11.2 (SysStat, США). Значения выражены как среднее значение ± стандартная ошибка среднего значения (M ± m). При сравнении нескольких групп с контролем использовали t-критерий Стьюдента с поправкой Бонферрони. Статистически значимыми отличия считали при p < 0.05.
ЗАКЛЮЧЕНИЕ
Настоящая работа была предпринята с целью создания пептидных агонистов рецепторов галанина, способных улучшать функцию сердца при ишемии и реперфузии. Выяснено, что экзогенные природные фрагменты пептида галанин (I) и (III) и их модифицированные аналоги (II), (IV), (V) и (VI) оказывают защитное действие на сердце крысы при моделировании ишемического и реперфузионного повреждения in vivo. Их внутривенное введение ограничивает размеры инфаркта миокарда и снижает активность маркеров некроза в плазме крови при незначительном влиянии на гемодинамические показатели. Эти эффекты обусловлены связыванием пептидов с рецепторами галанина, преимущественно с GalR2, инициирующим сигнальные каскады в ишемизированных кардиомиоцитах, результатом чего является снижение необратимых повреждений сердца. Наиболее эффективным из изученных пептидов оказался аналог (VI) (H-Trp-Thr-Leu-Asn-Ser-Ala-Gly-Tyr-Leu-Leu-Gly-Pro-βAla-His-OH). Полученные результаты указывают на целесообразность дальнейшего исследования механизмов действия этих соединений. Вероятно, создание синтетических лигандов рецепторов галанина и изучение их фармакологических свойств может привести к разработке новых лекарственных средств для терапии сердечно-сосудистых заболеваний.
ФИНАНСОВАЯ ПОДДРЕЖКА
Работа выполнена при поддержке Российского Фонда Фундаментальных Исследований (гранты 18-015-00008 и 18-015-00009).
Список литературы
Tatemoto K., Rökaeus A., Jörnvall H., McDonald T.J., Mutt V. // FEBS Lett. 1983. V. 164. P. 124–128.
Mitsukawa K., Lu X., Bartfai T. Galanin, galanin receptors and drug targets // Cell. Mol. Life Sci. 2008. V. 65 (12). P. 1796–1805.
Webling K., Runesson J., Bartfai T., Langel U. // Front. Endocrinol. 2012. V. 7(3). P. 146.
Wang S., He C., Hashemi T., Bayne M. // J. Biol. Chem. 1997. V. 272. P. 31949–31952.
Diaz-Cabiale Z., Parrado C., Vela H., Razani H., Covenas R., Fuxe K., Narvarez J. // Neuropeptides. 2005. V. 39. P. 185–190.
Fang P., Sun J., Wang X., Zang Z., Bo P., Shi M. // Life Sciences. 2013. V. 92. P. 628–632.
Land T., Langel U., Low M., Berthold M., Unden A., Bartfai T. // Int. J. Pept. Protein Res. 1991. V. 38. P. 267–272.
Liu H.X., Brumovsky P., Schmidt R., Brown W., Payza K., Hodzic L., Pou C., Godbout C., Hökfelt T. // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. P. 9960–9964.
Langel U., Bartfai T. // Ann. N.Y. Acad. Sci. 1998. V. 863. P. 86–93.
Lu X., Lundstrӧm L., Langel U., Bartfai T. // Neuropeptides. 2005. V. 39. P. 165–167.
Lundström L., Lu X., Langel Ü., Bartfai T. // Neuropeptides. 2005. V. 39. P. 169–171.
Runesson J., Saar I., Lundström L., Jarv J., Langel Ü. // Neuropeptides. 2009. V. 43. P. 187–192.
Runesson J. Galanin receptor ligands // Licentiate Thesis. Stocholm University. 2009.
Шульженко В.С., Серебрякова Л.И., Студнева И.М., Пелогейкина Ю.А., Веселова О.М., Молокоедов А.С., Овчинников М.В., Палькеева М.Е., Сидорова М.В., Писаренко О.И. // Кардиологический вестник. 2016. Т. 11(3). С. 12–21.
Timotin A., Pisarenko O., Sidorova M., Studneva I., Shulzhenko V., Palkeeva M., Serebryakova L., Molokoedov A., Veselova O., Cinato M., Tronchere H., Boall F., Kunduzova O. // Oncotarget. 2017. V. 8(13). P. 21241–21252.
Pisarenko O., Timotin A., Sidorova M., Studneva I., Shulzhenko V., Palkeeva M., Serebryakova L., Molokoedov A., Veselova O., Cinato M., Boall F., Tronchere H., Kunduzova O. // Oncotarget. 2017. V. 8(60). P. 101659–101671.
Webling K., Runesson J., Lang A., Saar I., Kofler B., Langel Ü. // Neuropeptides. 2016. V. 60. P. 75–82.
Korolkiewicz R., Sliwinski W., Recowski P., Halama-Borowiec A., Mucha P., Szczurowicz A., Korolkiewicz K.Z. // Pharm. Res. 1997. V. 35(1). P. 7–16.
Азьмуко А.А., Веселова О.М., Молокоедов А.С., Овчинников М.В., Палькеева М.Е., Писаренко О.И., Серебрякова Л.И., Сидорова М.В., Студнева И.М. // Патент РФ № 2648846 от 13.02.2017. Опубл. 28.03.2018. Бюлл. № 10.
Vlieghe P., Lisowski V., Martinez J., Khrestchatisky M. // Drug Discovery Today. 2010. V. 15(1/2). P. 40–56.
Boldyrev A., Koldobski A., Kurella F., Maltseva V., Stvolinski S. // Molec. Chem. Neuropathol. 1993. V. 19. P. 185–192.
Прокопьева В.Д., Лаптев Б.И., Афанасьев С.А. // Биохимия. 1992. Т. 57. С. 1389–1392.
Arvidsson K., Langel Ü., Ehrenberg A. // Eur. J. Biochem. 1994. V. 222. P. 573–581.
Iwai K., Ando T. // Methods Enzimol. 1967. V. 11. P. 263–282.
Fmoc Solid Phase Peptide Synthesis. Practical Approach / Ed. Chan W.C., White P.D. Oxford University Press. N.Y. 2004. P. 65–67.
Mant C., Kovacs J., Kim H., Pollock D., Hodges R. // Biopolymers. 2009. V. 92(6). P. 573–595.
Государственная фармакопея Российской Федерации. XIII редакция. Москва. 2015. ГФМ 1.2.1.0005.
Knorr R., Trzeciak A., Bannwarth W., Gillessen D. // Tetrahedron Lett. 1989. V. 30. P. 1927–1930.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


