Биоорганическая химия, 2019, T. 45, № 5, стр. 518-523
Синтетический фрагмент рецептора конечных продуктов гликирования и его аналог препятствуют ухудшению памяти в трансгенной мышиной модели болезни Альцгеймера
Д. О. Короев 1, *, О. М. Вольпина 1, Т. Д. Волкова 1, А. В. Камынина 1, А. Н. Самохин 2, М. П. Филатова 1, Н. В. Бобкова 2
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 ФГБУН Институт биофизики клетки Российской академии наук
142290 Пущино, ул. Институтская, 3, Россия
* E-mail: koroevd@gmail.com
Поступила в редакцию 05.03.2019
После доработки 18.03.2019
Принята к публикации 08.04.2019
Аннотация
Мембранный рецептор конечных продуктов гликирования вовлечен в развитие ряда патологических состояний, в том числе болезни Альцгеймера, при которой наблюдается его гиперэкспрессия в клетках головного мозга и рост активности. Ранее нами было показано, что синтетический фрагмент (60–76) рецептора конечных продуктов гликирования при интраназальном введении способен препятствовать нарушению пространственной памяти ольфакторно бульбэктомированных мышей, развивающих признаки болезни Альцгеймера. Мы предположили, что защита N-концевой аминофункции пептида ацетильной группой и превращение карбоксильной группы С-концевого аминокислотного остатка в амид повысит стабильность этого пептида в опытах in vivo и такой защищенный пептид проявит более высокую активность по сравнению с исходным свободным пептидом. В настоящей работе был синтезирован пептид Ac-(60–76)-NH2, являющийся защищенным аналогом синтетического фрагмента RAGE (60–76). Активность пептида (60–76) и его защищенного аналога была изучена на трансгенных 5xFAD мышах, являющихся общепринятой моделью болезни Альцгеймера. Тестирование состояния памяти проводили в водном лабиринте Морриса. Показано, что интраназальное введение обоих пептидов в течение двух месяцев трансгенным 5xFAD мышам в одинаковой степени препятствует нарушению их пространственной памяти. Различие в активности изучаемых пептидов было выявлено через 7 дней после прекращения введения препаратов, когда только животные, ранее получавшие модифицированный пептид Ac-(60–76)-NH2, проявили способность находить сектор обучения водного лабиринта Морриса. Животные, получавшие пептид (60–76), потеряли изначально выявленную способность находить сектор обучения и были полностью дезориентированы. Полученные данные позволяют сделать вывод о том, что модифицированный фрагмент (60–76) с защищенными N- и С-концевыми функциональными группами имеет более выраженное протективное и пролонгированное действие по сравнению со свободным пептидом (60–76), и делает его перспективным для разработки лекарственного препарата для терапии болезни Альцгеймера.
ВВЕДЕНИЕ
Мембранный рецептор конечных продуктов гликирования (receptor for advanced glycation endproducts, RAGE) в норме встречается и функционирует в разных тканях, однако при ряде патологических состояний, включая и болезнь Альцгеймера (БА), отмечают его гиперэкспрессию в клетках головного мозга и рост активности [1–4]. В организме RAGE существует в виде нескольких изоформ, среди которых особо выделяют растворимую изоформу sRAGE, состоящую только из внеклеточной части молекулы RAGE. Показано, что sRAGE, конкурируя с полноразмерным рецептором за связь с лигандами, подавляет его гиперактивность [5].
Нами ранее было выдвинуто предположение о том, что короткие фрагменты внеклеточной части RAGE, несущие сайты связывания с лигандами, подобно изоформе sRAGE будут способны блокировать активацию рецептора. Был синтезирован и изучен набор фрагментов внеклеточных доменов RAGE [6–8]. Активность пептидов изучали при интраназальном введении ольфакторно бульбэктомированным мышам, которые проявляли поведенческие и морфологические признаки, характерные для БА. В результате эксперимента был выявлен наиболее активный пептид, соответствующий последовательности 60–76 одной из экспонированных неструктурированных петель V-домена RAGE, который препятствовал ухудшению пространственной памяти и улучшал морфологические и биохимические характеристики нейронов головного мозга экспериментальных животных [8].
Целью настоящего исследования являлось создание модифицированного аналога RAGE (60–76) пептида с защищенными N- и C-концевыми функциональными группами и сравнение активности пептида (60–76) и его защищенного аналога на общепринятой модели БА – трансгенных 5xFAD мышах. Также задачей исследования явилось сопоставление протективной активности, проявляемой пептидом RAGE (60–76), на двух моделях БА in vivo: трансгенных и бульбэктомированных мышах, с целью доказательства валидности последней.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтетический фрагмент RAGE (60–76), проявляющий протективную активность на бульбэктомированных мышах [6, 8], имеет аминокислотную последовательность AWKVLSPQGGGPWDSVA (I). Наиболее широко распространенным способом повышения активности пептидных препаратов является синтез их аналогов, обладающих устойчивостью к протеолизу [9]. Мы предположили, что защита N-концевой аминофункции пептида ацетильной группой и замена карбоксильной группы С-концевого аминокислотного остатка амидной повысит стабильность этого пептида в опытах in vivo и что такой защищенный пептид проявит более высокую активность, чем свободный. Модифицированный аналог пептида (60–76) имеет формулу Ac-AWKVLSPQGGGPWDSVA-NH2 (II). Пептиды синтезировали по стандартным методикам твердофазного синтеза в автоматическом режиме. Очистку пептидов осуществляли методом обращенно-фазовой ВЭЖХ, индивидуальность пептидов (>98%) подтверждали методами аналитической ВЭЖХ и масс-спектрометрии.
Сравнительный анализ активности пептидов (I) и (II) был проведен на линии трансгенных мышей 5xFAD, характеризующихся оверэкспрессией предшественника амилоида АРР(695), содержащего мутации K670N/M671L, I716V, V717I, и мутациями в гене пресенилина PS1: M146L, L286V, обнаруживаемыми при наследственной форме БА человека [10]. Данная модель на животных воспроизводит основные признаки амилоидоза, характерного для БА, и широко используется в экспериментах как модель нейродегенерации с гиперпродукцией β-амилоида (1–42), отложением амилоидных бляшек и гибелью нейронов коры и гиппокампа.
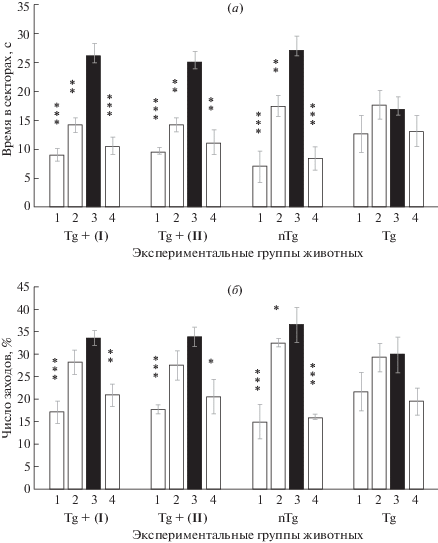
Пептиды (I) и (II) вводили интраназально трансгенным животным каждый день, начиная с двухмесячного возраста, в течение 70 дней. Контролем служили трансгенные и нетрансгенные мыши той же линии и возраста, получавшие физ. раствор. Спустя 65 дней после начала эксперимента, не прекращая введения пептидов, мышей в течение 5 дней обучали находить спасательную платформу в водном лабиринте Морриса (сектор 3), а затем тестировали состояние их памяти (1-е тестирование), оценивая время нахождения в 4 секторах водного лабиринта Морриса (рис. 1а) и число заходов в каждый из секторов (рис. 1б). Как видно из приведенных данных, трансгенные животные, получавшие исследуемые пептиды (I) и (II), достоверно выделяли сектор обучения (сектор 3) по времени нахождения в нем (рис. 1а), но не по числу заходов в этот сектор (рис. 1б). Контрольные нетрансгенные животные были способны узнать сектор обучения 3 как по числу заходов, так и по времени нахождения, в то время как трансгенные животные, не получавшие препарат, не выделяли сектор обучения ни по одному из изучаемых параметров. Таким образом, способность пептида (II) при длительном интраназальном введении защищать от нарушения пространственную память трансгенных животных по обоим параметрам оказалась сопоставима с эффективностью пептида (I). Оба пептида обладали способностью сохранять пространственную память трансгенных мышей только по одному из изучаемых параметров (время нахождения в секторе 3).
Рис. 1.
Влияние интраназального введения пептидов – фрагментов RAGE (I) и (II) на пространственную память 5xFAD мышей после 70 дней введения препаратов (1-е тестирование). а – время нахождения животных в секторах водного лабиринта Морриса; б – число заходов в секторы (% от общего числа заходов). 1–4 – секторы лабиринта Морриса, 3 – сектор обучения. Экспериментальные группы животных: Tg + (I) или Tg + (II) – трансгенные мыши, получавшие интраназально пептид (I) или (II), nTg – нетрансгенные мыши, получавшие физраствор, Tg – трансгенные мыши, получавшие физ. раствор. * p < 0.01; ** p < 0.001; *** p < 0.0001.
После первого тестирования состояния памяти мышам прекращали вводить пептиды и через 7 дней без дополнительного обучения проводили второе тестирование (рис. 2а, 2б). Трансгенные животные, ранее получавшие пептид (I), утратили способность выделять сектор обучения (сектор 3) лабиринта Морриса по времени нахождения (рис. 2а), и по числу заходов (рис. 2б). Животные, ранее получавшие пептид (II), не только сохранили выявленную при первом тестировании способность выделять сектор обучения по времени нахождения (рис. 2а), но и проявили способность выделять сектор 3 по числу заходов (рис. 2б). Активность контрольных животных не отличалась от активности, выявленной при первом тестировании (рис. 1а, 1б).
Рис. 2.
Состояние пространственной памяти 5xFAD мышей через 7 суток после прекращения введения пептидов (I) и (II) (2-е тестирование). а – время нахождения животных в секторах водного лабиринта Морриса; б – число заходов в секторы (% от общего числа заходов). 1–4 – секторы лабиринта Морриса, 3 – сектор обучения. Экспериментальные группы животных: Tg + (I) или Tg + (II) – трансгенные мыши, ранее получавшие интраназально пептид (I) или (II), nTg – нетрансгенные мыши, получавшие физраствор, Tg – трансгенные мыши, получавшие физраствор. * p < 0.01; ** p < 0.001; *** p < 0.0001.

Сравнительный анализ активности свободного пептида (I) и его защищенного аналога Ac-(60–76)-NH2 (II) позволил обнаружить важную особенность протективного действия пептида (II). Спустя 7 дней после прекращения введения только животные, получавшие пептид (II), сохранили способность находить сектор обучения водного лабиринта Морриса как по времени нахождения в секторе, так и по числу заходов в него. Животные же, получавшие пептид (I), способность к обучению полностью утратили. Полученные данные позволяют сделать вывод о том, что модифицированный фрагмент Ac-(60–76)-NH2 (II) имеет более высокую протективную активность по сравнению со свободным пептидом (I), причем очень важным является пролонгированное действие препарата (II), не только не прекращающееся, но и даже возрастающее после отмены его введения.
Кроме того, в результате проведенных исследований было показано, что синтетический фрагмент RAGE (60–76) (I) проявляет активность не только на бульбэктомированных [6, 8], но и на трансгенных животных, моделирующих БА. Данный результат исследований важен для доказательства активности пептида (60–76) (I), а также для подтверждения валидности бульбэктомированных мышей как модели БА.
Таким образом, результаты проведенной работы позволяют сделать вывод о том, что защищенный пептид (II) перспективен для разработки на его основе лекарственного препарата для терапии БА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали реактивы и производные аминокислот (Merck, ФРГ; Fluka, Швейцария), Rink-AM полимер (GL Biochem, Китай). Тведофазный синтез пептида осуществляли на автоматическом синтезаторе SYRO-I (Biotage, Швеция). Для ВЭЖХ применяли хроматограф System Gold (Beckman, США), хроматограф Стайер (Аквилон, Россия), колонки Jupiter 5μ C18 300A 250 × 4.60 мм (Phenomenex, США) для аналитической хроматографии; Jupiter 10μ C18 300A 250 × 10.00 мм (Phenomenex, США) для полупрепаративной хроматографии. Масс-спектрометрию осуществляли методом MALDI на приборе VISION 2000 (Bioanalysis, Великобритания).
Животные
Эксперименты проводили на самцах мышей трансгенной линии 5xFAD возрастом 2 месяца, полученных, как описано в работе [10]. Животных содержали по 5–7 особей в клетке при температуре 21–23°C, естественном режиме освещения, свободным доступом к питью и стандартном рационе питания. Мыши 5xFAD характризуются оверэкспрессией предшественника амилоида и несут мутации K670N, M671L, I716V и V717I в гене АРР(695) человека и мутации по пресенилину PS1: M146L, L286V. Контролем служат нетрансгенные мыши той же линии и возраста. Трансгенность мышей определялась путем их генотипирования методом ПЦР-анализа ДНК, выделяемого из образца ткани уха. Наличие трансгенной кассеты определялось с использованием праймеров (5'–3') AGGACT GACCACTCGACCAG и CGGGGGTCTAGTTCTGCAT и электрофоретической визуализации 377bp-фрагмента.
Исследование выполнено в соответствии с “Правилами работы с экспериментальными животными” (Постановление Министерства здравоохранения России, август 12, 1997, № 755).
Твердофазный синтез и очистка пептидов
Синтез пептидов проводили на 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидоаминометильном полимере (Rink-AM) с содержанием аминогрупп 0.7 ммоль/г в автоматическом режиме с применением Fmoc-группы в качестве временной Nα-защиты. Fmoc-группу удаляли 20% раствором 4-метилпиперидина в диметилформамиде. Для защиты боковых функций остатков Ser использовали But-группу, для Asp – OBut-группу, для Lys – Boc-группу. Наращивание пептидной цепи выполняли последовательно с использованием тетрафторбората О-(бензотриазол-1-ил)-N,N,N ',N '-тетраметилмочевины (TBTU). Отщепление пептидов от полимера с одновременным деблокированием функциональных групп боковых цепей проводили смесью TFA (81.5%), тиоанизола (5%), фенола (5%), воды (5%), этандитиола (2.5%) и триизопропилсилана (1%) из расчета 1–2 мл смеси на 100 мг пептидилполимера. Очистку пептидов осуществляли с помощью обращенно-фазовой ВЭЖХ в градиенте концентрации ацетонитрила 10–70% в 0.1% водной TFA за 1 ч при расходе элюента 3 мл/мин. Оптическое поглощение элюата измеряли при длине волны 226 нм.
Синтетические пептиды характеризовали данными аналитической ВЭЖХ и масс-спектрометрии MALDI. Аналитическую ВЭЖХ этих пептидов проводили в градиенте концентрации ацетонитрила 10–70% в 0.1% водной TFA за 15 мин при расходе элюента 1 мл/мин. Характеристики синтетических пептидов (tR – время удерживания в условиях аналитической ВЭЖХ, [M + H]+/M – масса молекулярного иона по данным МС/теоретическая молекулярная масса): (I) – tR 10.8 мин, [M + H]+ 1755.84/1753.87; (II) – tR 11.89, [M + H]+ 1795.91/1794.89.
Интраназальное введение пептидов
Животным ежедневно вводили интраназально по 4 мкл раствора пептида в стерильном физиологическом растворе в концентрации 5 мг/мл. Для этого каждой мыши с помощью микропипетки наносили каплю раствора в непосредственной близости от ноздри так, чтобы капля попадала в носовой проход в процессе нормального дыхания. В период обучения и тестирования памяти раствор вводили за 1 ч до проведения экспериментов в лабиринте Морриса.
Обучение животных и тестирование их пространственной памяти
Состояние пространственной памяти мышей оценивали после выработки у них пространственного навыка в водном лабиринте Морриса. Экспериментальная камера представляла собой круглый бассейн диаметром 80 см, заполненный на 30 см водой с температурой 23°С. Площадь бассейна условно делили на четыре равных сектора, в одном из которых (сектор 3) находилась спасательная платформа диаметром 5 см, погруженная на 0.5 см в воду. Воду закрашивали молоком, для того чтобы животные не могли визуально обнаружить спасательную платформу. До начала курса обучения проверяли способность всех животных плавать, а также сохранность зрения. Обучение проводили в течение пяти дней по четыре сеанса ежедневно, при этом фиксировали латентный период обнаружения платформы. Через 24 ч после окончания обучения и еще через 7 сут у животных тестировали уровень пространственной памяти в течение одной минуты в отсутствие спасательной платформы. При анализе полученных результатов были использованы два показателя: число заходов и время нахождения мышей в каждом секторе. Статистическую обработку результатов поведенческих данных проводили с использованием пакета статистических программ “Statistica 6.0”, результаты представлены как х ± SEM. Достоверность различий данных оценивали с использованием двустороннего критерия Стьюдента.
Схема эксперимента
В каждой исследуемой группе было по шесть трансгенных мышей, которым интраназально вводили пептиды. Контрольные группы состояли из шести трансгенных и десяти нетрансгенных мышей, которым интраназально вводили физиологический раствор.
— 1–70 дни – ежедневное интраназальное введение пептидов
— 65–69 дни – обучение в водном лабиринте Морриса;
— 70 день – первое тестирование пространственной памяти;
— 77 день – второе тестирование пространственной памяти.
Список литературы
Neeper M., Schmidt A.M., Brett J., Yan S.D., Wang F., Pan Y.C., Elliston K., Stern D., Shaw A. // J. Biol. Chem. 1992. V. 267. P. 14998–15004.
Yan S.D., Chen X., Fu J., Chen M., Zhu H., Roher A., Slattery T., Zhao L., Nagashima M., Morser J., Migheli A., Nawroth P., Stern D., Schmidt A.M. // Nature. 1996. V. 382. P. 685– 691.
Lue L.F., Walker D.G., Brachova L., Beach T.G., Rogers J., Schmidt A.M., Stern D.M., Yan S.D. // Exp. Neurol. 2001. V. 171. P. 29–45.
Leclerc E., Sturchler E., Vetter S.W. // Cardiovasc. Psychiatry Neurol. V. 2010. Article ID 539581. https://doi.org/10.1155/2010/539581
Yan S.F., Ramasamy R., Schmidt A.M. // Biochem. Pharmacol. 2010. V. 79. P. 1379–1386.
Вольпина О.М., Короев Д.О., Волкова Т.Д., Камынина А.В, Филатова М. П., Запорожская Я.В., Самохин А.Н., Александрова И.Ю., Бобкова Н.В. // Биоорган. химия. 2015. Т. 41. С. 709–716. (Volpina O.M., Koroev D.O., Volkova T.D., Kamynina A.V., Filatova M.P., Zaporozhskaya Ya.V., Samokhin A.N., Aleksandrova I.Yu., Bobkova N.V. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 638–644).
Короев Д.О., Вольпина О.М., Волкова Т.Д., Камынина А.В., Филатова М.П., Баласанянц С.М., Самохин А.Н., Бобкова Н.В. // Биоорган. химия. 2017. Т. 43. С. 174–179. (Koroev D.O., Volpina O.M., Volkova T.D., Kamynina A.V., Filatova M.P., Balasanyants S.M., Samokhin A.N., Bobkova N.V. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 150–154).
Volpina O.M., Samokhin A.N., Koroev D.O., Nesterova I.V., Volkova T.D., Nekrasov P.V., Tatarnikova O.G., Kamynina A.V., Balasanyants S.M., Voronina T., Bobkova N.V. // J. Alzheimers Dis. 2018. V. 61. P. 1061–1076.
Bogachouk A.P., Storozheva Z.I., Solovjeva O.A., Sherstnev V.V., Zolotarev Y.A., Azev V.N., Rodionov I.L., Surina E.A., Lipkin V.M. // J. Psychopharmacol. 2016. V. 30. P. 78–92.
Oakley H., Cole S.L., Logan S., Maus E., Shao P., Craft J., Guillozet-Bongaarts A., Ohno M., Disterhoft J., Van Eldik L., Berry R., Vassar R. // J. Neurosci. 2006. V. 26. P. 10129– 10140.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


