Биоорганическая химия, 2019, T. 45, № 5, стр. 534-541
Синтез и гипогликемическая активность цианопирролидинамидов арил(гетарил)пропеновых кислот
С. О. Куранов 1, *, М. Е. Блохин 1, 2, С. А. Борисов 1, М. В. Хвостов 1, 2, О. А. Лузина 1, Н. Ф. Салахутдинов 1, 2
1 Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
630090, Новосибирск, пр. Лаврентьева, 9, Россия
2 Новосибирский государственный университет
630090, Новосибирск, ул. Пирогова, 2, Россия
* E-mail: s.o.kuranov@chemomsu.ru
Поступила в редакцию 22.02.2019
После доработки 18.03.2019
Принята к публикации 02.04.2019
Аннотация
Синтезирована серия амидов на основе (2S)-цианопирролидина и α,β-ненасыщенных арил- и гетарилкарбоновых кислот. В глюкозотолерантном тесте на мышах изучена зависимость гипогликемической активности соединений от структуры ароматического фрагмента. Показано, что амиды на основе (Е)-3-фенил-2-пропеновой и (Е)-3-(4-метоксифенил)-2-проповой кислот и (2S)-цианопирролидина, достоверно снижают уровень глюкозы в крови у мышей. Обнаруженный гипогликемический эффект в дозе 10 мг/кг сопоставим с эффектом гипогликемического препарата вилдаглиптина.
ВВЕДЕНИЕ
Сахарный диабет второго типа (СД-2) – метаболическое заболевание, характеризующееся хронической гипергликемией, связанной с инсулинорезистентностью тканей. По оценкам ВОЗ в 2015 году количество больных, страдающих от СД-2, должно было превысить 392 миллиона человек, что составляет около 90% из всех случаев заболевания СД [1].
Дипептидилпептидаза-4 (ДПП-4) – фермент, расщепляющий пептиды с N-конца пролина, играет важную роль в метаболизме глюкозы. После приема пищи происходит выработка глюкагонподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), которые приводят к глюкозозависимому увеличению секреции инсулина, а также подавлению секреции глюкагона. Однако время жизни этих инкретинов крайне мало, поскольку они быстро дезактивируются ДПП-4 [2]. Ингибирование ДПП-4, таким образом, приводит к продлению полезных эффектов ГПП-1 и ГИП, что используется при терапии СД-2. Среди ингибиторов ДПП-4, также называемых глиптинами, существенную долю составляют соединения, например, вилдаглиптин (I) и саксаглиптин (II) (рис. 1), содержащие в своей структуре цианопирролидиновый фрагмент, который, как было показано [3], связывается с активным центром фермента. Несмотря на то что в настоящее время уже известны глиптины, которые используются в терапевтической практике, поиск новых гипогликемических средств, действующих по такому же механизму, по-прежнему актуален [4–6].
Важным направлением медицинской химии, позволяющим получить новые лекарственные препараты, является синтетическая трансформация природных соединений [7]. К ингибиторам ДПП-4 природного происхождения относятся, в частности, соединения, содержащие α,β-ненасыщенный стирольный фрагмент и ингибирующие ДПП-4 в тестах in vitro в наномолярном диапазоне концентраций – кофейная кислота (III), и ресвератрол (IV) [8]. Основным недостатком таких соединений является неселективность действия, что затрудняет их целенаправленное использование в качестве гипогликемических агентов. Так, для коричных кислот, помимо гипогликемических эффектов, описаны также антиоксидантная, антигипоксическая, церебропротекторная, гепатопротекторная, желчегонная, противовоспалительная, цитостатическая, гиполипидемическая, антикоагулянтная, противоаллергическая, антибактериальная, противовирусная, фунгицидная и другие виды активностей [9–12]. Поскольку усложнение структуры молекулы, обладающей широкой фармакофорностью, может привести к желаемому увеличению специфичности ее действия [13], то в нашем случае представляется перспективным комбинирование фрагментов, специфично связывающихся с активным центром ДПП-4, с молекулами, уже обладающими определенным сродством к ферменту.
Рис. 2.
Результаты глюкозотолерантного теста. Количество глюкозы в плазме измерено в начале эксперимента и через 30 и 60 мин после ее введения; значения представлены в виде среднего ± стандартная ошибка среднего (n =5). К – контрольная группа. * p < 0.05 по отношению к контролю.

Согласно результатам молекулярного докинга [14], ресвератрол связывается с тем же сайтом ДПП-4, что и коммерчески доступные глиптины. В данном случае одно из его ароматических колец, выполняя роль цианопирролидинового фрагмента, занимает S1-карман фермента, а оставшийся стирольный фрагмент участвует в связывании с белком за счет π–π-стэкинга. Можно предположить, что объединение стирольного фрагмента, присутствующего в кофейной кислоте и ресвератроле, с соответствующим фрагментом цианопирролидинамида будет приводить к соединениям, также проявляющим гипогликемическую активность.
Цель данной работы заключалась в синтезе новых соединений путем комбинирования фрагмента α,β-ненасыщенных ароматических кислот со структурным блоком (2-цианопирролидин) коммерчески доступных синтетических ингибиторов ДПП-4 и изучении гипогликемических свойств полученных соединений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез тозилата цианопирролидина (IX) был осуществлен исходя из коммерчески доступного L-пролина (V) (схема 1 ). Аминогруппу L-пролина (V) защищали действием Boc2O в водном диоксане в присутствии гидрокарбоната натрия с образованием кислоты (VI) [15]. Амид (VII) был получен при реакции N-Boc защищенной кислоты (VI) с Boc2O и NH4HCO3 в присутствии пиридина в диоксане [16]. Амид (VII) дегидратировали действием ангидрида трифторуксусной кислоты в присутствии триэтиламина в хлористом метилене c образованием нитрила (VIII) [17]. Обработка п-толуолсульфокислотой в ацетонитриле соединения (VIII) приводила к снятию Boc-защитной группы. (2S)-Пирролидинкарбонитрил выделяли из раствора в виде тозилата цианопирролидина (IX) [18].
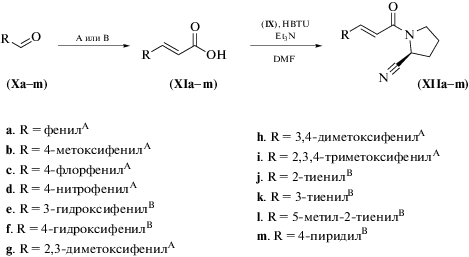
Серия α,β-ненасыщенных кислот (XIa–m) была синтезирована исходя из ароматических и гетероароматических альдегидов (Xa–m) (схема 2 ). Соединения (XIa–d, g–i) получали по методике, описанной в работе [19], взаимодействием соответствующего альдегида с малоновой кислотой в толуоле при кипячении в присутствии пиперидина и Et3N (метод А). Соединения (XIe, f, j–m) получали по методике [20] взаимодействием соответствующих альдегидов с малоновой кислотой в пиридине в присутствии каталитических количеств пиперидина (метод B), поскольку синтез по методу A приводил либо к неудовлетворительным выходам соединений (XIe, f), либо к образованию соответствующих дикарбоновых кислот (для соединений (XIj–m)). Выходы кислот (XI–m) составляли от 45 до 95%.
Целевые (2S)-цианопирролидинамиды (Е)-3-((гет)арил)-2-пропеновых кислот (XIIa–m) были получены конденсацией соответствующих пропеновых кислот (XIa–m) с тозилатом 2-цианопирролидина (IX) (схема 2 ) в присутствии гексафторфосфата (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU) и триэтиламина в DMF. Амиды (XIIa–m) были выделены с выходами 41–94%. Амид (XIIa) описан в патенте [21], однако авторы не приводят никаких спектральных данных.
Стоит отметить, что из-за заторможенного вращения вокруг амидной связи C–N полученные амиды (XIIa–m) в растворе существует в виде смеси ротамеров, что приводит к удваиванию некоторых сигналов в спектрах 1Н-ЯМР [22].
Гипогликемическая активность
Полученные амиды (XIIa–m) были исследованы на гипогликемическую активность в пероральном глюкозотолерантном тесте (ГТТ) на самцах мышей линии CD-1. Результаты ГТТ через 30 и 60 мин после введения глюкозы представлены на диаграмме 1. Через 90 мин уровень глюкозы был одинаков у животных всех групп. В качестве препарата сравнения был использован вилдаглиптин (I). Согласно полученным результатам, соединения (XIIa) и (XIIb) проявили гипогликемический эффект, сопоставимый с таковым у вилдаглиптина (I).
Замена метокси-группы на другой заместитель (фтор- (XIIc), нитро- (XIId), гидрокси- (XIIf)), увеличение количества метокси-групп в ароматическом фрагменте (XIIg, h, i), а также введение тиофенового цикла (XIIl) взамен бензольного, привели к потере гипогликемического эффекта в условиях эксперимента. В некоторых случаях такие трансформации приводили к повышению уровня глюкозы в крови по сравнению с контрольной группой (соединения (XIIe, g, j, k, m)).
Схема 1. Синтез цианопирролидинового фрагмента (IX).
Схема 2. Синтез (2S)-цианопирролидинамидов (Е)-3-((гет)арил)-2-пропеновых кислот (XIIa-m). Метод A: CH2(COOH)2, пиперидин, Et3N, PhCH3, Δ; метод B: CH2(COOH)2, пиперидин, пиридин, 67°С.
Прояснение механизма гипергликемии требует дальнейших исследований. В качестве одного из возможных вариантов можно предположить недостаточное повышение секреции инсулина в ответ на пероральное введение глюкозы, которое обычно опосредовано активацией инкретинов – (ГПП-1) и (ГИП) [23]. Можно предположить, что соединения (XIIe, g, j, k, m) уменьшают продукцию этих полипептидных гормонов, например, через блокирование натрий-зависимого ко-транспортера глюкозы (SGLT), являющегося важным для глюкоза-индуцированной секреции ГПП-1 [24].
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе работы были синтезированы амиды α,β-ненасыщенных арил- и гетарилзамещенных кислот и (2S)-пирролидинкарбонитрила. Соединения (2S)-цианопирролидинамид (Е)-3-фенил-2-пропеновой кислоты (XIIa) и (2S)-цианопирролидинамид (Е)-3-(4-метоксифенил)-2-проп-еновой кислоты (XIIb) проявили гипогликемическую активность в ГТТ на мышах в дозе 10 мг/кг, сопоставимую с вилдаглиптином (I). Также был отмечен гипергликемический эффект соединений (XIIe, g, j, k, m).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н и 13С регистрировали в CDCl3 (где не указано особо) на спектрометрах AV-400 и AV-300 (Brukеr, США), (δ, м.д., КССВ, Гц). В качестве внутреннего стандарта использовали сигналы остаточных протонов растворителя – CDCl3 (δH 7.26 м.д., δC 77.00 м.д.). ИК-спектры регистрировали на приборе “Bruker Tensor 27” в таблетках KBr, ν, см–1. Контроль реакции осуществлялся методом ТСХ на пластинках Merck TLC Silica gel 60 F254 в системе хлороформ–метанол, 10 : 1, обнаружение веществ в йодной камере или при облучении УФ-светом. Для колоночной хроматографии использовался силикагель Merck (70–230μ). Температуру плавления соединений определяли на приборе Mettler Toledo FP90 и на столике Коффлера. Исходные альдегиды, L-пролин (Sigma-Aldrich, ≥98.5%), реактивы и растворители были получены из коммерческих источников. Растворители очищали перед использованием согласно указанным методикам [25]. Соединения (VIа–н) и (VII–XI) были синтезированы по литературным методикам [15–20] и идентифицированы по спектрам ЯМР 1Н.
Общая методика синтеза амидов (XIIa–m). Смесь 1 ммоль соответствующей кислоты (XIa–m), 0.27 г (1 ммоль) тозилата цианопирролидина (IX) и 0.28 мл (2 ммоль) Et3N в 10 мл DMF перемешивали в инертной атмосфере при комнатной температуре в течение 24 ч. Реакционную массу выливали в 40 мл воды и экстрагировали продукт этилацетатом (3 × 10 мл). Объединенные органические вытяжки последовательно промывали 10 мл воды, 10 мл насыщенного раствора хлорида натрия и сушили над MgSO4. Осадок отфильтровывали и упаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии (элюент – хлороформ-метанол 10 : 1).
(2S)-Цианопирролидинамид (Е)-3-фенил-2-пропеновой кислоты (XIIa). Белый порошок, выход 43%. Т. пл. 125.0°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –129 (c 0.24, CHCl3). ИК-спектр: 2241 (–С≡N). 1Н-ЯМР (400 МГц): 2.10–2.49 (4 H, м, CH2CH2CH2CHCN), 3.57–3.88 (2 H, м, CH2CH2N), 4.79 (0.2 H, д, J 6.9, CHCN), 4.87 (0.8 H, д, J 5.9, CHCN), 6.66 (1 H, д, J 15.4, ArCHCHCO), 6.77 (1 H, д, J 15.6, ArCHCHCO), 7.35–7.44 (3 H, м, Ph-3,4,5), 7.50–7.60 (2 H, м, Ph-2,6), 7.79 (1 H, д, J 15.4, ArCHCHCO). 13С-ЯМР (126 МГц): 25.1 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.3 (CH2CH2N), 46.6 (CHCN), 116.8 (ArCHCHCO), 118.4 (CN), 128.0 (Ph-3,5), 128.8 (Ph-2,6), 130.2 (Ph-4), 134.6 (Ph-1), 144.3 (ArCHCH), 164.9 (ArCHCHCO). Найдено: m/z 226.1109 [M]+. С14H14N2O. Вычислено: M 226.1106. Найдено, %: С 74.46; Н 6.27; N 12.35. С14Н14N2O. Вычислено, %: С 74.31; Н 6.24; N 12.38.
(2S)-Цианопирролидинамид (Е)-3-(4-метоксифенил)-2-пропеновой кислоты (XIIb). Белый порошок, выход 65%. Т. пл. 107.2°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –114 (c 0.18, CHCl3). ИК-спектр: 2235 (–С≡N). 1Н-ЯМР (400 МГц): 2.09–2.45 (4 H, м, CH2CH2CH2CHCN), 3.57–3.65 (1 H, м, CH2CH2N), 3.77–3.85 (4 H, м, CH2CH2N, Ph-4-OCH3), 4.85 (1 H, д, J 5.6, CHCN), 6.51 (1 H, д, J 15.4, ArCHCHCO), 6.62 (1 H, д, J 14.9, ArCHCHCO), 6.89 (2 H, д, J 8.7, Ph-3,5), 7.48 (2 H, д, J 8.6, Ph-2,6), 7.73 (1 H, д, J 15.4, ArCHCHCO). 13С-ЯМР (101 МГц): 25.1 (CH2CH2CH2CHCN), 29.9 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.6 (CHCN), 55.3 (Ph-6-OCH3), 114.2 (Ph-3,5), 114.3 (ArCHCHCO), 118.5 (CN), 127.3 (Ph-1), 129.7 (Ph-2,6), 143.8 (ArCHCH), 161.2 (Ph-4), 165.2 (ArCHCHCO). Найдено: m/z 256.1217 [M]+. С15H16N2O2. Вычислено: M 256.1212. Найдено, %: С 70.27; Н 6.31; N 10.95. С15Н16N2O2. Вычислено, %: С 70.29; Н 6.29; N 10.93.
(2S)-Цианопирролидинамид (Е)-3-(4-фторфенил)-2-пропеновой кислоты (XIIc). Белый порошок. Выход 94%. Т. пл. 125.0°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –111 (c 0.19, CHCl3). ИК-спектр: 2237 (–С≡N). 1Н-ЯМР (400 МГц): 2.05–2.53 (4 H, м, CH2CH2CH2CHCN), 3.54–3.92 (2 H, м, CH2CH2N), 4.79 (0.2 H, д, J 6.4, CHCN), 4.87 (0.8 H, д, J 5.6, CHCN), 6.58 (0.8 H, д, J 15.4, ArCHCHCO), 6.64–6.74 (0.2 H, м, ArCHCHCO), 7.07 (2 H, т, J 8.5, Ph-3,5), 7.46–7.61 (2 H, м, Ph-2,6), 7.75 (1 H, д, J 15.4, ArCHCHCO). 13С-ЯМР (75 МГц): 25.0 (CH2CH2CH2CHCN), 29.9 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.6 (CHCN), 115.9 (Ph-3,5), 116.6 (ArCHCHCO), 118.4 (CN), 129.8 (Ph-2,6), 130.8 (Ph-1), 142.8 (ArCHCH), 163.7 (Ph-4), 164.7 (ArCHCHCO). Найдено: m/z 244.1008 [M]+. С14H14FN2O. Вычислено: M 244.1012. Найдено, %: С 68.90; Н 5.37; N 11.49. С14Н13N2OF. Вычислено, %: С 68.84; Н 5.36; N 11.47.
(2S)-Цианопирролидинамид (Е)-3-(4-нитрофенил)-2-пропеновой кислоты (XIId). Светло-желтый порошок. Выход 56%. Т. пл. 166.9°С с разложением. $[\alpha ]_{D}^{{24.3}}$ –129 (c 0.4, CHCl3). ИК-спектр: 1400 (NO2), 1537 (NO2), 2239 (–С≡N). 1Н-ЯМР (400 МГц): 2–2.51 (4 H, м, CH2CH2CH2CHCN), 3.56–3.94 (2 H, м, CH2CH2N), 4.82 (0.2 H, д, J 7.3, CHCN), 4.88 (0.8 H, д, J 6.4, CHCN), 6.79 (0.8 H, д, J 15.6, ArCHCHCO), 6.89 (0.2 H, д, J 15.2, ArCHCHCO), 7.68 (2 H, д, J 8.7, Ph-2,6), 7.81 (1 H, д, J 15.6, ArCHCHCO), 8.24 (2 H, д, J 8.7, Ph-3,5). 13С-ЯМР (126 МГц): 25.1 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.4 (CH2CH2N), 46.8 (CHCN), 118.1 (CN), 121.0 (ArCHCHCO), 124.1 (Ph-2,6), 128.6 (Ph-3,5), 140.7 (Ph-1), 141.4 (ArCHCH), 148.3 (Ph-4), 163.9 (ArCHCHCO). Найдено: m/z 244.1008 [M]+. С14H13N3O3. Вычислено: M 271.0957. Найдено, %: С 62.11; Н 4.84; N 15.50. С14Н13N3O3. Вычислено, %: С 61.99; Н 4.83; N 15.49.
(2S)-Цианопирролидинамид (Е)-3-(3-гидроксифенил)-2-пропеновой кислоты (XIIe). Светло-бежевый порошок, выход: 41%. Т. пл. 143.2°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –85 (c 0.19, CHCl3). ИК-спектр: 2239 (–С≡N). 1Н-ЯМР (400 МГц, CDCl3/DMSO-d6: 1/2): 2.01–2.34 (4 H, м, CH2CH2CH2CHCN), 3.57–3.85 (2 H, м, CH2CH2N), 4.77 (1 H, т, J 5.2, CHCN), 5.22 (0.2 H, д.д, J 6.6, 2.6, Ph-3-OH), 6.68 (0.8 H, д, J 15.4, ArCHCHCO), 6.74–6.79 (1 H, м, Ph-4), 6.84 (0.2 H, д, J 15.2, ArCHCHCO), 6.93–7.00 (2 H, м, Ph-2,6), 7.09–7.16 (1 H, м, Ph-3), 7.49 (1 H, д, J 15.4, ArCHCHCO), 9.25 (0.8 H, с, Ph-3-OH). 13С-ЯМР (75 МГц, CDCl3/DMSO-d6:1/2): 24.9 (CH2CH2CH2CHCN), 29.6 (CH2CH2CH2CHCN), 45.8 (CH2CH2N), 46.4 (CHCN), 114.7 (Ph-2), 117.3 (ArCHCHCO), 118.4 (Ph-4), 119.3 (Ph-6), 119.4 (CN), 129.9 (Ph-5), 136.0 (Ph-1), 142.5 (ArCHCH), 157.8 (Ph-2), 164.3 (ArCHCHCO). Найдено: m/z 242.1053 [M]+. С14H14N2O2. Вычислено: M 242.1055. Найдено, %: С 69.63; Н 5.85; N 11.58. С14Н14N2O2. Вычислено, %: С 69.41; Н 5.82; N 11.56.
(2S)-Цианопирролидинамид (Е)-3-(4-гидроксифенил)-2-пропеновой кислоты (XIIf). Белый порошок, выход: 44%. Т. пл. 137.6°С с разложением. $[\alpha ]_{D}^{{27.4}}$–72 (c 0.2, CHCl3). ИК-спектр: 2240 (–С≡N). 1Н-ЯМР (400 МГц): 2.05–2.42 (4 H, м, CH2CH2CH2CHCN), 3.51–3.76 (2 H, д т, J 7.9, CH2CH2N), 4.76–4.87 (1 H, м, CHCN), 6.44 (0.8 H, д, J 15.4, ArCHCHCO), 6.57 (0.2 H, д, J 15.2, ArCHCHCO), 6.90 (2 H, д, J 8.5, Ph-3,5), 7.36 (2 H, д, J 8.5, Ph-2,6), 7.66 (1 H, д, J 15.3, ArCHCHCO), 8.67 (1 H, уш.с, Ph-4-OH). 13С-ЯМР (101 МГц): 24.8 (CH2CH2CH2CHCN), 29.6 (CH2CH2CH2CHCN), 46.1 (CH2CH2N), 46.3 (CHCN), 114.8 (ArCHCHCO), 115.7 (Ph-3,5), 119.5 (CN), 125.7 (Ph-1), 130.1 (Ph-2,6), 142.4 (ArCHCH), 159.4 (Ph-4), 164.6 (ArCHCHCO). Найдено: m/z 242.1051 [M]+. С14H14N2O2. Вычислено: M 242.1055. Найдено, %: С 69.50; Н 5.84; N 11.58. С14Н14N2O2. Вычислено, %: С 69.41; Н 5.82; N 11.56.
(2S)-Цианопирролидинамид (Е)-3-(2,3-диметоксифенил)-2-пропеновой кислоты (XIIg). Белый порошок. Выход 69%. Т. пл. 134–136°С $[\alpha ]_{D}^{{24.3}}$ –31 (c 0.26, CHCl3). ИК-спектр: 2237 (–С≡N). 1Н-ЯМР (400 МГц): 2.10–2.44 (4 H, м, CH2CH2CH2CHCN), 3.58–3.67 (1 H, м, CH2CH2N), 3.78–3.90 (7 H, м, CH2CH2N, Ph-2,3-OCH3), 4.77 (0.2 H, д, J 7.7, CHCN), 4.87 (0.8 H, д, J 5.9, CHCN), 6.77 (0.9 H, д, J 15.7, ArCHCHCO), 6.93 (1.1 H, д, J 7.9, ArCHCHCO, Ph-6), 7.03–7.09 (1 H, м, Ph-5), 7.12 (1 H, д, J 7.1, Ph-4), 8.02 (1 H, д, J 15.7, ArCHCHCO). 13С-ЯМР (101 МГц): 25.1 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.3 (CH2CH2N), 46.6 (CHCN), 55.8 (Ph-3-OCH3), 61.1 (Ph-2-OCH3), 113.7 (ArCHCHCO), 118.5 (CN), 118.6 (Ph-4), 119.8 (Ph-5), 124.1 (Ph-6), 128.8 (Ph-1), 139.2 (ArCHCH), 148.5 (Ph-3), 153.2 (Ph-2), 165.2 (ArCHCHCO). Найдено: m/z 286.1315 [M]+. С17H20N2O4. Вычислено: M 286.1317. Найдено, %: С 67.05; Н 6.36; N 9.79. С16Н18N2O3. Вычислено, %: С 67.12; Н 6.34; N 9.78.
(2S)-Цианопирролидинамид (Е)-3-(3,4-диметоксифенил)-2-пропеновой кислоты (XIIh). Белый порошок, выход 48%. Т. пл. 139–140°С $[\alpha ]_{D}^{{27.4}}$ –98 (c 0.22, CHCl3). ИК-спектр: 2235 (–С≡N). 1Н-ЯМР (400 МГц): 2.10–2.47 (4 H, м, CH2CH2CH2CHCN), 3.57–3.71 (1 H, м, CH2CH2N), 3.79–3.98 (7 H, м, CH2CH2N, Ph-3,4-OCH3), 4.76–4.83 (0.2 H, м, CHCN), 4.87 (0.8 H, д, J 5.5, CHCN), 6.50 (0.8 H, д, J 15.4, ArCHCHCO), 6.55–6.63 (0.2 H, м, ArCHCHCO), 6.86 (1 H, д, J 8.3, Ph-5), 7.02 (1 H, с, Ph-2), 7.13 (1 H, д, J 7.9, Ph-6), 7.72 (1 H, д, J 15.4, ArCHCHCO). 13С-ЯМР (75 МГц): 25.1 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.6 (CHCN), 55.9 (Ph-3,4-OCH3), 110.1 (ArCHCHCO), 111.1 (Ph-5), 114.5 (Ph-2), 118.5 (CN), 122.3 (Ph-6), 127.6 (Ph-1), 144.2 (ArCHCH), 149.1 (Ph-3), 151.0 (Ph-4), 165.1 (ArCHCHCO). Найдено: m/z 286.1320 [M]+. С17H20N2O4. Вычислено: M 286.1317. Найдено, %: С 67.14; Н 6.37; N 9.77. С16Н18N2O3. Вычислено, %: С 67.12; Н 6.34; N 9.78.
(2S)-Цианопирролидинамид (Е)-3-(2,3,4-триметоксифенил)-2-пропеновой кислоты (XIIi). Светло-желтое масло, выход 66%. Т. пл. 87°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –23 (c 0.24, CHCl3). ИК-спектр: 2243 (–С≡N). 1Н-ЯМР (400 МГц): 2.11–2.45 (4 H, м, CH2CH2CH2CHCN), 3.55–3.67 (1 H, м, CH2CH2N), 3.75–3.95 (10 H, м, CH2CH2N, Ph-2,3,4-OCH3), 4.77 (0.2 H, д, J 7.4, CHCN), 4.88 (0.8 H, д, J 5.4, CHCN), 6.63–6.76 (1.8 H, м, ArCHCHCO,Ph-5), 6.89 (0.2 H, д, J 15.3, ArCHCHCO), 7.21 (1 H, д, J 8.7, Ph-6), 7.88 (1 H, д, J 15.6, ArCHCHCO). 13С-ЯМР (101 МГц): 25.1 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.6 (CHCN), 56.0 (Ph-2-OCH3), 60.8 (Ph-3-OCH3), 61.1 (Ph-4-OCH3), 107.4 (ArCHCHCO), 116.1 (Ph-5), 118.5 (CN), 121.6 (Ph-1), 124.1 (Ph-6), 139.6 (ArCHCH), 142.4 (Ph-3), 153.4 (Ph-4), 155.3 (Ph-2), 165.6 (ArCHCHCO). Найдено: m/z 316.1424 [M]+. С17H20N2O4. Вычислено: M 316.1423. Найдено, %: С 64.71; Н 6.38; N 8.88. С17Н20N2O4. Вычислено, %: С 64.54; Н 6.37; N 8.86.
(2S)-Цианопирролидинамид (Е)-3-(2-тиенил)-2-пропеновой кислоты (XIIj). Бежевый порошок, выход 59%. Т. пл. 123.2°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –160 (c 0.21, CHCl3). ИК-спектр: 2236 (–С≡N). 1Н-ЯМР (400 МГц): 2.09–2.45 (4 H, м, CH2CH2CH2CHCN), 3.55–3.85 (2 H, м, CH2CH2N), 4.77 (0.8 H, д, J 6.3, CHCN) , 4.85 (0.2 H, д, J 5.4, CHCN), 6.43 (0.8 H, д, J 15.0, ArCHCHCO), 6.53 (0.2 H, д, J 14.6, ArCHCHCO), 7.04 (1 H, д д, J 5.0, 3.6, Th-3), 7.25 (1 H, уш.с, Th-2), 7.35 (1 H, д, J 5.0, Th-4), 7.88 (1 H, д, J 15.0, ArCHCHCO). 13С-ЯМР (126 MГц): 25.2 (CH2CH2CH2CHCN), 30.3 (CH2CH2CH2CHCN), 46.1 (CH2CH2N), 46.4 (CHCN), 113.9 (ArCHCHCO), 118.2 (CN), 128.5 (Th-3), 129.0 (Th-2), 137.2 (ArCHCH), 130.5 (Th-4), 140.3 (Th-1), 164.8 (ArCHCHCO). Найдено: m/z 232.0674 [M]+. С12H12N2OS. Вычислено: M 232.0670. Найдено, %: С 62.14; Н 5.23; N 12.01. С12Н12N2OS. Вычислено, %: С 62.04; Н 5.21; N 12.06.
(2S)-Цианопирролидинамид (Е)-3-(5-метил-2-тиенил)-2-пропеновой кислоты (XIIk). Желтый порошок, выход 56%. Т. пл. 137.1°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –195 (c 0.17, CHCl3). ИК-спектр: 2237 (–С≡N). 1Н-ЯМР (300 МГц): 2.09–2.42 (4 H, м, CH2CH2CH2CHCN), 2.49 (3 H, с, Th-4-CH3), 3.53–3.84 (2 H, м, CH2CH2N), 4.85 (1 H, д, J 7.3, CHCN), 6.29 (0.8 H, д, J 15.0, ArCHCHCO), 6.38 (0.2 H, д, J 15.4, ArCHCHCO), 6.67–6.75 (1 H, м, Th-3), 7.06 (1 H, д, J 3.5, Th-2), 7.80 (1 H, д, J 15.0, ArCHCHCO). 13С-ЯМР (126 MГц): 15.8 (Th-4-OCH3), 25.0 (CH2CH2CH2CHCN), 30.0 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.6 (CHCN), 114.1 (ArCHCHCO), 118.5 (CN), 126.5 (Th-3), 132.0 (Th-2), 137.0 (ArCHCH), 137.7 (Th-4), 143.6 (Th-1), 164.9 (ArCHCHCO). Найдено: m/z 246.0831 [M]+. С13H14N2OS. Вычислено: M 246.0827. Найдено, %: С 63.38; Н 5.73; N 11.39. С13Н14N2OS. Вычислено, %: С 63.39; Н 5.73; N 11.37.
(2S)-Цианопирролидинамид (Е)-3-(3-тиенил)-2-пропеновой кислоты (XIIl). Серый порошок, выход 62%. Т.пл. 151.2°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –250 (c 0.19, CHCl3). ИК-спектр: 2240 (–С≡N). 1Н-ЯМР (400 МГц): 2.04–2.45 (4 H, м, CH2CH2CH2CHCN), 3.50–3.85 (1 H, м, CH2CH2N), 4.74–4.90 (1 H, м, CHCN), 6.46 (0.2 H, д, J 15.4, ArCHCHCO), 6.58 (0.8 H, д, J 15.2, ArCHCHCO), 7.22–7.37 (2 H, м, Th-4,5), 7.48 (1 H, д, J 1.5, Th-2), 7.73 (1 H, д, J 15.3, ArCHCHCO). 13С-ЯМР (126 MГц): 25.0 (CH2CH2CH2CHCN), 29.9 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.5 (CHCN), 116.5 (ArCHCHCO), 118.4 (CN), 125.0 (Th-2), 126.8 (Th-3), 128.0 (Th-4), 137.5 (ArCHCH), 137.6 (Th-2), 165.0 (ArCHCHCO). Найдено: m/z 232.0673 [M]+. С12H12N2OS. Вычислено: M 232.0670. Найдено, %: С 62.08; Н 5.23; N 12.07. С12Н12N2OS. Вычислено, %: С 62.04; Н 5.21; N 12.06.
(2S)-Цианопирролидинамид (Е)-3-(4-пиридил)-2-пропеновой кислоты (XIIm). Серый порошок, выход 62%. Т. пл. 158.7°С с разложением. $[\alpha ]_{D}^{{27.4}}$ –93 (c 0.21, CHCl3). ИК-спектр: 2238 (–С≡N). 1Н-ЯМР (300 МГц): 2.06–2.50 (4 H, м, CH2CH2CH2CHCN), 3.53–3.89 (2 H, м, CH2CH2N), 4.77–4.89 (1 H, м, CHCN), 6.80 (0.2 H, д, J 15.4, ArCHCHCO), 6.92 (0.8 H, д, J 15.4, ArCHCHCO), 7.34 (2 H, д, J 6.0, Py-3,5), 7.66 (1 H, д, J 15.5, ArCHCHCO), 8.62 (2 H, д, J 6.0, Py-2,6). 13С-ЯМР (101 MГц): 24.9 (CH2CH2CH2CHCN), 29.7 (CH2CH2CH2CHCN), 46.2 (CH2CH2N), 46.5 (CHCN), 118.0 (CN), 121.2 (ArCHCHCO), 121.6 (Py-3,5), 141.0 (ArCHCH), 141.5 (Py-4), 150.3 (Py-2,6), 163.7 (ArCHCHCO). Найдено: m/z 227.1055 [M]+. С13H13N3O. Вычислено: M 227.1059. Найдено, %: С 68.74; Н 5.75; N 18.54. С12Н12N2OS. Вычислено, %: С 68.70; Н 5.77; N 18.49.
Биологические испытания
В эксперименте использовали самцов мышей линии CD-1 массой 25–30 г. Животные были получены из вивария Института цитологии и генетики СО РАН и содержались в стандартных условиях со свободным доступом к пище и воде. Все эксперименты проводились в соответствии с “Европейской конвенцией о защите животных, используемых в экспериментальных и других научных целях”, 1986 г. После карантина животные были рандомизированы по весу и разделены на группы по 5 мышей в каждой. Все тестируемые соединения смешивали с несколькими каплями Tween 80 или DMSO и растворяли в дистиллированной воде. Затем перорально натощак (голод 12 ч) вводили животным за 0.5 ч до пероральной нагрузки глюкозой (2.5 г/кг). Животные контрольной группы получали только носитель (вода с Tween 80 или DMSO). Значения глюкозы в крови измеряли с помощью ONE TOUCH Select глюкометра (LIFESCAN Inc., США) перед дозированием (0) и через 30, 60, 90 мин после введения глюкозы. Вилдаглиптин (Галвус, Новартис) использовали в качестве положительного контроля. Статистический анализ проводился с использованием U-критерия Манна–Уитни. P < 0.05 считалось статистически значимым.
Список литературы
WHO | 10 facts on diabetes [Электронный ресурс] // http://www.who.int/features/factfiles/diabetes/en/. World Health Organization, 2016. URL: http://www.who.int/features/factfiles/diabetes/en/ (accessed: 17.05.2017).
Thornberry N.A., Gallwitz B. // Best Practice & Research Clinical Endocrinology & Metabolism. 2009. V. 23. P. 479–486.
Nabeno M., Akahoshi F., Kishida H., Miyaguchi I., Tanaka Y., Ishii S., Kadowaki T. // Biochem. Biophys. Res. Commun. 2013. V. 434. P. 191–196.
Spasov A.A., Popov Yu.V., Lobasenko V.S., Korchagina T.K., Vassiliev P.M., Kuznetsova V.A., Brigadirova A.A., Rashchenko A.I., Babkov D.A., Kochetkov A.N., Kovaleva A.I., Efremova O.S. // Russ. J. Bioorganic Chem. 2017. V. 43. P. 163–169.
Spasov A.A., Vasil’ev P.M., Babkov D.A., Prokhorova T.Y., Sturova E.A., Klimochkin Y.N., Leonova M.V., Baimuratov M.R. // Russ. J. Bioorganic Chem. 2017. V. 43. P. 449–455.
Li N., Wang L.-J., Jiang B., Guo S.-J., Li X.-Q., Chen X.-C., Jiao L., Li C., Wang Y., Shi D.-Y. // Bioorg. Med. Chem. Lett. Pergamon. 2018. V. 28. P. 2131–2135.
Newman D.J., Cragg G.M. // Journal of Natural Products. 2007. V. 70. P. 461–477.
Gao Y., Zhang Y., Zhu J., Li B., Li Z., Zhu W., Shi J., Jia Q., Li Y. // Future Medicinal Chemistry. 2015. V. 7. P. 1079–1089.
Sova M. // Mini Rev. Med. Chem. 2012. V. 12. P. 749–767.
Kepa M., Miklasinska-Majdanik M., Wojtyczka R. D., Idzik D., Korzeniowski K., Smolen-Dzirba J., Wasik T.J. // Biomed. Res. Int. Hindawi, 2018. V. 2018. P. 1–9.
Da Cunha F.M., Duma D., Assreuy J., Buzzi F.C., Niero R., Campos M.M., Calixto J.B. // Free Radic. Res. 2004. V. 38. P. 1241–1253.
Avanesyan A.A., Pashkov A.N., Simonyan N.A., Simonyan A.V., Myachina O.V. // Pharm. Chem. J. 2009. V. 43. P. 249–250.
Huggins D.J., Sherman W., Tidor B. // J. Med. Chem. American Chemical Society. 2012. V. 55. P. 1424–1444.
Jha V., Bhadoriya K.S // J. Mol. Struct. Elsevier. 2018. V. 1158. P. 96–105.
WO 2014/105926 A1. 2014.
Pace P., Francesco E.D., Gardelli C., Harper S., Muraglia E., Nizi E., Orvieto F., Petrocchi A., Poma M., Rowley M., Scarpelli R., Laufer R., Paz O.G., Monteagudo E., Bonelli F., Hazuda D., Stillmock K.A., Summa V. // J. Med. Chem. American Chemical Society. 2007. V. 50. P. 2225–2239.
Wang Z., Wei P., Xizhi X., Liu Y., Wang L., Wang Q. // J. Agric. Food Chem. American Chemical Society. 2012. V. 60. P. 8544–8551.
Wang J., Feng Y., Ji X., Deng G., Leng Y., Liu H. // Bioorg. Med. Chem. Pergamon. 2013. V. 21. P. 7418–7429.
Pawar H.S., Wagh A.S., Lali A.M. // New J. Chem. The Royal Society of Chemistry. 2016. V. 40. P. 4962–4968.
Robbins R.J., Schmidt W.F. // J. Label. Compd. Radiopharm. John Wiley & Sons. 2004. V. 47. P. 797–806.
CN 101417969 A. 2009.
Aitken R.A., Smith M.H., Wilson H.S. // J. Mol. Struct. Elsevier. 2016. V. 1113. P. 171–173.
White J. R. // Clin. Diabetes. American Diabetes Association. 2008. V. 26. P. 53–57.
Gribble F.M., Williams L., Simpson A.K., Reimann F. // Diabetes. 2003. V. 52. P. 1147–1154.
Armarego W.L.F., Perrin D.D. // Purification of Laboratory Chemicals. Butterworth Heinemann, 1997.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия