Биоорганическая химия, 2019, T. 45, № 6, стр. 650-657
Cинтез, антимикробная и противогрибковая активность ацетиленовых производных смоляных кислот
Е. В. Третьякова 1, *, Е. В. Салимова 1, Л. В. Парфенова 1
1 Институт нефтехимии и катализа Российской академии наук
450075 Уфа, пр. Октября, 141, Россия
* E-mail: tretyakovaelv@ gmail.com
Поступила в редакцию 10.04.2019
После доработки 22.04.2019
Принята к публикации 29.04.2019
Аннотация
На основе ацетиленовых производных абиетиновой, 7-формилабиетиновой, дегидроабиетиновой, малеопимаровой и дигидрохинопимаровой кислот получены производные, содержащие морфолиновый, пирролидиновый, бензильный, нитрофенильный и 1,2,3-тетразольный гетероциклические фрагменты. Изучена антибактериальная активность in vitro в отношении микроорганизмов и патогенных грибков, а также проведена первичная оценка цитотоксичности и гемолитической активности синтезированных соединений. Установлено, что ацетиленовые производные абиетиновой и дегидроабиетиновой кислот с остатком пирролидина способны эффективно ингибировать рост грибов Candida albicans и Cryptococcus neoformans, обладая при этом низкой гемолитической активностью.
ВВЕДЕНИЕ
В настоящее время, в связи с ростом резистентности многих бактерий к известным противомикробным препаратам, актуальным направлением исследований медицинской химии является поиск новых лекарственных средств, воздействующих на грамположительные и грамотрицательные патогены [1]. Наряду с синтетическими лекарственными средствами большую роль при создании новых перспективных препаратов играют природные соединения, получаемые на основе воспроизводимого растительного сырья [2].
Терпеноиды принадлежат к самому многочисленному классу природных соединений. Среди них немаловажное значение имеют природные смоляные кислоты – абиетиновая, левопимаровая и дегидроабиетиновая, легко получаемые из сосновой живицы [3].
Известно, что смоляные кислоты и их полусинтетические производные обладают широким спектром биологических свойств, в том числе противовоспалительными, противовирусными, противоопухолевыми, противосудорожными, антипротозойными, антилейшманиальными и др. [4–9]. Абиетиновая и дегидроабиетиновая кислоты проявляют фунгицидную, а также антибактериальную активности, в основном, в отношении грамположительных микроорганизмов [10]. Функционализация исходных смоляных кислот различными фармакофорными фрагментами привела к получению множества разнообразных производных, проявляющих биологическую активность в отношении Staphylococcus, Pseudomonas или Cladosporium sp. [11–16]. Обнаружена способность 7-формилпроизводного абиетиновой кислоты, содержащего пирролидиновый остаток, эффективно ингибировать рост культуры бактерий St. aureus, а также культур грибков Candida albicans и Cryptococcus neoformans [17]. Некоторые гетероциклические производные дегидроабиетиламина способны эффективно ингибировать рост патогенных микроорганизмов, в частности бактерий St. aureus и некоторых видов грибков [18]. Исходя из литературных данных [19–23], можно предположить, что механизм действия производных абиетановых кислот, по-видимому, заключается в их взаимодействии с фосфолипидами бактериальных мембран и ферментами, связанными с ними.
В продолжение исследований по поиску перспективных биологически активных веществ в ряду дитерпеноидов абиетанового ряда [24–26] мы осуществили синтез ряда производных абиетана, содержащих ацетиленовые и гетероциклические фрагменты, и исследовали их антимикробную активность in vitro в отношении грамположительных (St. aureus) и грамотрицательных (Escherichia сoli, Klebsiella pneumoniae, Acinetobacter baumannii, Ps. aeruginosa) бактерий, а также грибов (C. albicans и Cr. neoformans). Для наиболее активных соединений были также изучены цитотоксическое действие in vitro в отношении клеточной линии эмбриональных почек человека HEK29 и способность вызывать разрушение эритроцитов крови (гемолитическая активность).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
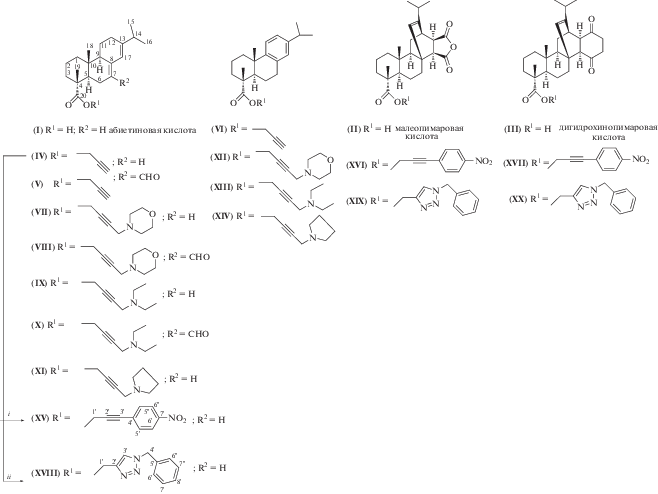
В качестве исходных соединений использовали абиетиновую (I), малеопимаровую (II) и дигидрохинопимаровую (III) кислоты, а также пропаргиловые эфиры абиетиновой, 7-формилабиетиновой и дегидроабиетиновой кислот (IV)–(VI). Пропаргиловые эфиры (IV)–(VI) вводили в реакции, характерные для тройной связи: аминометилирование по Манниху, кросс-сочетание с арилгалогенидами (реакция Соногаширы) и 1,3-диполярное циклоприсоединение ацетиленов с генерируемыми in situ азидами.
Однореакторный трехкомпонентный синтез оснований Манниха (VII)–(XIV) в результате аминометилирования пропаргиловых эфиров смоляных кислот (IV)–(VI) формальдегидом и вторичными аминами описан в работе [17].
Синтез замещенного ацетиленового эфира абиетиновой кислоты (XV) осуществляли кросс-сочетанием пропаргилового эфира (IV) в условиях реакции Соногаширы с п-иоднитробензолом в присутствии триэтиламина и CuI, PdCl2(PPh3)2 в качестве катализаторов. Реакция протекала при комнатной температуре в течение 3 ч с образованием соединения (XV), выделенного с выходом 89% после очистки колоночной хроматографией. В 1H-ЯМР-спектре нитробензилэтинильного производного (XV) наблюдаются сигналы протонов ароматического кольца в области δ 7.56–8.17 м.д., в 13С-ЯМР-спектрах сигналы бензильных атомов углерода регистрируются в области δ 123.52–147.32 м.д. Синтез замещенных ацетиленовых производных малеопимаровой и дигидрохинопимаровой кислот (XVI), (XVII) выполнен согласно работе [27].
Однореакторный синтез 1,2,3-триазольного производного (XVIII) абиетиновой кислоты был осуществлен в два приема. Первоначально, при взаимодействии эквимольных количеств бензилбромида, триэтиламина и азида натрия при комнатной температуре в хлористом метилене получали бензилазид, который без выделения вводили в реакцию с пропаргиловым эфиром абиетиновой кислоты (IV) в присутствии CuI в качестве катализатора с образованием 1,4-дизамещенного 1,2,3-триазола (XVIII) с выходом 80%. В 1H-ЯМР- спектре соединения (XVIII) отсутствовал сигнал протона ацетиленовой группы и наблюдался уширенный сигнал протона триазольного цикла при δ 7.52 м.д, который в HSQC и HMBC спектрах коррелировал с сигналами углеродных атомов С2' и С3' гетероциклического кольца в области 146.75 и 126.89 м.д. Сигналы ароматических протонов наблюдались при δ 7.15–7.40 м.д., в спектре 13C-ЯМР присутствовали резонансные линии атомов углерода ароматического кольца в области 128.66–143.57 м.д. 1,2,3-Триазольные производные (XIX), (XX) малеопимаровой и дигидрохинопимаровой кислот получали согласно работе [28].
Скрининг противомикробной активности соединений (I)–(XX) проводили CO-ADD (The Community for Antimicrobial Drug Discovery), финансируемом Wellcome Trust (Великобритания) и Университетом Квинсленда (Австралия), на пяти бактериальных штаммах: Escherichia coli (E. coli) ATCC 25922, Klebsiella pneumoniae (K. pneumoniae) ATCC 700603, Acinetobacter baumannii (A. baumannii) ATCC 19606, Pseudomonas aeruginosa (P. aeruginosa) ATCC 27853 и Staphylococcus aureus (St. aureus) ATCC 43300. Противогрибковую активность определяли на двух грибковых штаммах: Candida albicans (C. albicans) ATCC 90028 и Cryptococcus neoformans (Cr. neoformans) ATCC 208821.
Первичный скрининг противомикробной активности проводили путем тестов на ингибирование размножения клеток, используя образцы в одной (32 мкг/мл) концентрации. Аликвоту каждого образца в DMSO помещали в 384-луночный планшет и обрабатывали соответствующей бактериальной культурой. Ингибирование роста бактерий определяли спектрофотометрически при 600 нм на монохромном микропланшетном ридере Tecan M1000 Pro. Процент ингибирования роста рассчитывали для каждой лунки с использованием отрицательного контроля (только для среды) и положительного контроля (бактерии без ингибиторов) на той же пластинке. В случае если наблюдалось ингибирование роста ≥80%, соединение считалось активным (табл. 1).
Таблица 1.
Противомикробная активность in vitro соединений (I)–(XX) по отношению к патогенным микроорганизмам
| Соединение | Staphylococcus aureus |
Escherichia coli |
Klebsiella pneumoniae | Pseudomonas aeruginosa | Acinetobacter baumannii | Candida albicans | Cryptococcus neoformans |
|---|---|---|---|---|---|---|---|
| (I) | 10.79 | 5.93 | 28.63 | 38.28 | 22.22 | 4.59 | –30.81 |
| (II) | 12.87 | 7.65 | –0.30 | 24.69 | 7.80 | 9.49 | –29.23 |
| (III) | 26.67 | 13.60 | 12.59 | 13.71 | 17.13 | 12.31 | –32.62 |
| (IV) | –1.25 | 7.41 | 19.39 | –4.24 | 30.73 | 8.12 | –1.63 |
| (V) | 8.93 | 21.04 | 27.4 | –0.2 | 38.38 | 5.64 | 9.00 |
| (VI) | 5.03 | 14.47 | 28.07 | 2.82 | 45.86 | 0.39 | –2.12 |
| (VII) | 14.93 | 23.39 | 10.55 | –1.61 | 11.30 | 13.08 | –19.31 |
| (VIII) | 18.62 | 26.06 | 11.65 | 5.59 | 8.40 | 8.47 | –7.69 |
| (IX) | –1.5 | 1.61 | 13.65 | –5.13 | –16.97 | 8.12 | –0.14 |
| (X) | 5.08 | 3.61 | 23.43 | 7.10 | 12.16 | 4.93 | –23.80 |
| (XI) | 49.6 | 14.24 | 28.58 | 0.59 | 29.43 | 98.34 | 106.20 |
| (XII) | –16.36 | 11.39 | 17.18 | 0.12 | 25.06 | 11.74 | 35.18 |
| (XIII) | –1.50 | 1.61 | 13.65 | –5.13 | –16.97 | 8.12 | –0.14 |
| (XIV) | 11.21 | 10.94 | 22.47 | –6.38 | 38.16 | 99.92 | 106.20 |
| (XV) | –5.12 | 1.43 | 12.89 | –0.69 | –34.85 | 5.46 | 6.53 |
| (XVI) | 32.21 | 7.31 | 7.73 | 3.32 | 8.92 | –1.91 | –51.55 |
| (XVII) | 11.55 | 14.71 | 3.75 | 8.25 | –1.97 | 6.30 | –66.24 |
| (XVIII) | 22.92 | –1.23 | 10.27 | 13.11 | 2.89 | 4.78 | –29.03 |
| (XIX) | 13.65 | 24.03 | 4.04 | –2.04 | –38.68 | 2.58 | –20.46 |
| (XX) | 5.17 | 12.08 | 0.25 | –0.39 | 8.51 | 4.16 | –8.27 |
При первичном скрининге противомикробной активности установлено, что исходные абиетиновая, малеопимаровая и дигидрохинопимаровая кислоты (I)–(III), а также пропаргиловые эфиры абиетиновой, 7-формилабиетиновой и дегидроабиетиновой кислот (IV)–(VI) не проявляют ни бактерицидной, ни фунгицидной активности в отношении исследуемых микроорганизмов. Кроме того, ацетиленовые производные дитерпеновых кислот, содержащие фрагменты диэтиламина, нитробензола и морфолина (VII)–(X), (XII), (XIII), (XV)–(XVII), соединения с 1,2,3-триазольным заместителем (XVIII)–(XX) также не показали значимой противомикробной активности. В то же время, введение пирролидинового фрагмента в структуру ацетиленовых производных с образованием соединений (XI), (XIV) приводит к появлению антибактериальной и фунгицидной активности, причем фунгицидный эффект проявляется в большей степени, чем бактерицидный. Так, соединение (XI) показало активность в отношении культур бактерии метициллин-резистентного золотистого стафилококка (MRSA), ингибируя его рост на 49%. Наибольший фунгицидный эффект у производных (XI), (XIV) был обнаружен по отношению к культурам грибов C. albicans и Cr. neoformans (ингибирование роста С. albicans составило 98% для соединения (XI) и 99% для соединения (XIV) соответственно; Cr. neoformans – более 100% для обоих соединений) (табл. 1).
Для оснований Манниха (XI), (XIV) была определена минимальная ингибирующая концентрация в отношении вышеуказанных культур бактерий и грибов, а также концентрация, вызывающая гибель 50% клеток почки эмбриона человека HEK293 (ATCC CRL-1573) и концентрация, вызывающая 50%-й гемолиз эритроцитов человека (табл. 2).
Таблица 2.
Противомикробная, цитотоксическая и гемолитическая активность соединений (XI), (XIV)
| Соединение | MIC, мкг/мл | СС50, мкг/мл | HC50, мкг/мл | ||
|---|---|---|---|---|---|
| St. areus | C. albicans | Cr. neoformans | HEK293 | RBC | |
| (XI) | 32 | 16 | 16 | 16.5 | >32 |
| 32 | 16 | 8 | 18.8 | >32 | |
| (XIV) | >32 | 16 | 16 | 10.2 | >32 |
| >32 | 32 | 16 | 8.26 | >32 | |
Минимальную ингибирующую концентрацию (MIC; мкг/мл) устанавливали в соответствии с рекомендациями Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute (CLSI), США), определяя наименьшую концентрацию, при которой было обнаружено полное ингибирование бактерий или грибов. Тесты проводили в двойном повторе. Соединение считалось активным при MIC ≤ ≤ 16 мкг/мл в любой реплике (n = 2 на разных пластинах).
Цитотоксическое действие определяли на клеточной линии эмбриональных почек человека HEK293 путем определения концентрации, вызывающей гибель 50% клеток (СС50 (мкг/мл)). Ингибирование роста клеток HEK293 определяли, измеряя флуоресценцию после добавления 5 мкл (25 мкг/мл) резазурина (конечная концентрация 2.3 мкг/мл) и после инкубации в течение еще 3 ч при 37°C в 5% CO2. Интенсивность флуоресценции измеряли с использованием монохромного микропланшетного ридера Tecan M1000 Pro и автоматического вычисления коэффициента усиления. Соединение считалось токсичным при CC50 ≤ 32 мкг/мл.
Гемолитическую активность (HC50 (мкг/мл) – концентрация при 50%-м гемолизе) определяли путем измерения при 405 нм поглощения супернатанта – надосадочной жидкости, образованной после инкубации в течение 1 ч при 37°С планшетов, содержащих образцы соединений с добавленными к ним промытыми клетками крови человека, и последующего центрифугирования при 1000 об./мин в течение 10 мин. Абсорбцию измеряли с использованием монохромного микропланшетного ридера Tecan M1000 Pro. Образцы, обладающие гемолитической активностью, были охарактеризованы при НС50 ≤ 32 мкг/мл.
Из табл. 2 следует, что соединение (XI) обладает умеренной активностью в отношении метициллин-резистентных бактерий St. aureus (MIC = = 32 мкг/мл), соединение (XIV) имеет более слабое антимикробное действие в отношении указанной бактерии (MIC > 32 мкг/мл). Оба соединения показали также способность ингибировать рост исследуемых грибковых культур – в отношении C. albicans минимальная ингибирующая концентрация для обоих соединений составила 16 мкг/мл и в отношении Сr. neoformans – 8–16 мкг/мл для соединения (XI) и 16 мкг/мл для соединения (XIV) соответственно.
Для определения общей токсичности соединений (XI), (XIV) для клеток и специфичности действия в качестве потенциальных противогрибковых средств было изучено их действие на клеточную линию почки эмбриона человека и на эритроциты крови. Результаты исследования гемолитической активности соединений (XI), (XIV) показали, что они не оказывают влияния на эритроциты человеческой крови даже при максимально тестируемой концентрации >32 мкг/мл. Величины значений цитотоксичности (CC50) исследуемых соединений (XI), (XIV) оказались сравнимы со значениями минимальных ингибирующих концентраций в отношении грибов C. аlbicans и Cr. neoformans, что позволяет предположить, что эти соединения не обладают четкой селективностью в отношении клеток микробов или человека (табл. 2).
Таким образом, исследованы антибактериальные и фунгицидные свойства ряда синтезированных ацетиленовых и гетероциклических производных дитерпеновых кислот. Установлено, что пирролидиновые производные абиетиновой и дегидроабиетиновой кислот способны эффективно ингибировать рост патогенных грибов C. albicans и Cr. neoformans, обладают низкой гемолитической активностью, но плохой избирательностью к бактериальным клеткам и клеткам человека. Эти результаты свидетельствуют о потенциале оснований Манниха, полученных на основе производных смоляных кислот, в качестве отправной точки для поиска новых перспективных классов противогрибковых препаратов после более широких исследований и решения задачи снижения токсичности полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры 1Н- и 13С-ЯМР регистрировали на спектрометре “Bruker” Avance III (500.13 (1Н) и 125.47 МГц (13С)) в CDCl3, внутренний стандарт – тетраметилсилан (δ, м.д., J, Гц). ИК-спектры твердых веществ регистрировали в вазелиновом масле, жидких – в тонком слое на спектрофотометре “Bruker Vertex 70 v” (диапазон 4000–500 см–1). Температуры плавления определены на приборе РНМК 80/2617 (столик Кофлера). ТСХ проводили на пластинах Сорбфил (ЗАО Сорбполимер, Россия), используя систему растворителей гексан-этилацетат, 1 : 1. Вещества обнаруживали 10% раствором серной кислоты с последующим нагреванием при 100–120°С в течение 2–3 мин. Абиетиновая (I) [29], малеопимаровая (II) [30], дигидрохинопимаровая (III) [31] кислоты были получены по ранее описанным методикам. Синтез соответствующих пропаргиловых эфиров (IV)–(VI) абиетиновой, 7-формилабиетиновой и дегидроабиетиновой кислот, а также оснований Манниха (VII)–(XIV) описан в работе [17]. Замещенные ацетиленовые (XVI), (XVII) и 1,2,3-триазольные (XIX), (XX) производные малеопимаровой и дигидрохинопимаровой кислот получали согласно работам [27, 28].
3-(4-Нитрофенил)проп-2-ин-1-ил-aбиета-7,13-диен-20-оат (XV). К раствору 0.34 г (1.0 ммоль) пропаргилового эфира абиетиновой кислоты (IV) и 0.25 г (1 ммоль) п-иоднитробензола в 30 мл DMF при перемешивании последовательно добавляли 0.02 г (0.11 ммоль) CuI, 0.07 г (0.06 ммоль) PdCl2(PPh3)2 и 0.16 мл (1.1 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем промывали 5% раствором HCl (3 × 20 мл), водой (2 × 100 мл), сушили над CaCl2. Растворитель упаривали, продукт реакции хроматографировали на колонке с Al2O3, элюируя хлористым метиленом. Выход: 0.37 г (81%). Т. пл. 101–103°C. Спектр 1Н-ЯМР: 0.81 (3 H, с, Н18), 0.83–0.89 (2 H, м, Н1), 1.01 (3 H, д, J 6.9, H15), 1.02 (3H, д, J 6.9, H16,), 1.22 (3H, с, Н19), 1.28–2.22 (13Н, м, Н2, Н3, Н5, H6, Н9, Н11, Н12, Н14), 4.88 (2H, с, H1'), 5.34 (1Н, с, Н7), 5.77 (1H, с, H17), 7.56 (2H, д, J 8.5, HAr), 8.17 (2H, д, J 8.5, HAr). Спектр 13С-ЯМР: 14.01 (С18), 16.99 (С19), 18.01 (С2), 20.85 (С15), 21.42 (С16), 22.46 (С11), 25.63 (С6), 27.46 (С12), 34.54 (С10), 34.57 (С14), 36.99 (С3), 38.25 (С1), 45.17 (С5), 46.74 (С4), 50.91 (С9), 52.45 (С1'), 84.17 (C2'), 88.88 (C3'), 120.42 (С7), 122.35 (С17), 123.52 (С6'), 124.82 (C6''), 129.10 (C4'), 132.58 (C5'), 135.58 (C5''), 138.67 (С8), 145.43 (С13), 147.32 (C7'), 177.59 (С20). Найдено, %: C 75.02; Н 7.88; N 3.20. С29Н35NО4. Вычислено, %: C 75.46; H7.64; N3.03.
(1-Бензил-1H-1,2,3-триазол-4-ил)метилабиета-7,13-диен-20-оат (XVIII). Смесь 0.7 мл (1 ммоль) триэтиламина, 0.07 г (1 ммоль) азида натрия и 0.25 мл (1 ммоль) бензилбромида в 10 мл хлористого метилена перемешивали в течение 30 мин при комнатной температуре. К смеси добавляли 0.34 г (1 ммоль) пропаргилового эфира абиетиновой кислоты (IV) и 0.013 г иодида меди (I) и перемешивали 8 ч при комнатной температуре. Реакционную смесь выливали в 50 мл воды, экстрагировали хлороформом (2 × 50 мл), экстракт промывали водой до нейтральной реакции, сушили над CaCl2. Растворитель упаривали, продукт реакции хроматографировали на колонке с силикагелью, элюент – гексан – этилацетат, 40 : 1, 20 : 1, 1 : 1. Выход: 0.39 г, (84%). Т. пл. 120–122°C. Спектр 1Н-ЯМР: 0.85–0.92 (2H, м, Н1), 1.17 (3H, с, Н18), 1.20 (3H, д, J 6.9, H15), 1.25 (3H, д, J 6.9, H16), 1.27 (3H, с, Н19), 1.30–2.32 (13Н, м, Н2, Н3, Н5, H6, Н9, Н11, Н12, Н14), 5.14–5.17 (2H, м, H1'), 5.26–5.28 (2H, м, H4'), 5.55 (1H, c, H7), 6.85 (1Н, с, Н17), 7.15–7.40 (5H, м, НAr), 7.52 (1H, c, H3'). Спектр 13С-ЯМР: 16.48 (С18), 16.79 (С19), 18.53 (С2), 21.61 (С11), 23.99 (С15), 24.01 (С16), 25.17 (С6), 29.94 (С12), 33.47 (С10), 33.49 (С14), 36.37 (С3), 36.92 (С1), 37.99 (С5), 44.82 (С4), 47.57 (С9), 54.19 (С4'), 57.76 (C1'), 123.55 (С7), 124.17 (С17), 126.89 (C3'), 128.06 (C6', C6''), 128.83 (C8'), 129.17 (C7', C7''), 134.62 (С8), 143.57 (C5'), 145.69 (С13), 146.75 (C2'), 178.41 (С20). Найдено, %: C 75.02; Н 8.44; N 9.10. С30Н39N3О2. Вычислено, %: C 76.07; H 8.30; N 8.87.
Биологическая Часть
Скрининг антибактериальной активности проводили в Институте молекулярной биологии университета Квинсленда (The Institute for Molecular Bioscience of the University of Queensland, Australia) методом серийных разведений. Образцы готовились в DMSO в тестовой концентрации 32 мкг/мл. Все бактерии культивировались на агаре Мюллера Хинтона (Mueller Hinton) при 37°С в течение ночи. Образец каждой культуры затем разбавляли в 40 раз и инкубировали при 37°С в течение 1.5–3 ч. Полученные культуры добавляли в каждую лунку 384-луночного планшета, содержащую исследуемый образец (плотность клеток 5 × 105 КОЕ/мл и общий объем 50 мкл). Все планшеты накрывали и инкубировали при 37°С в течение 18 ч без встряхивания. Ингибирование роста бактерий определяли измерением поглощения при 600 нм с использованием монохромного микропланшетного ридера Tecan M1000 Pro. Процент ингибирования роста рассчитывался для каждой лунки с использованием отрицательного контроля (только для среды) и положительного контроля (бактерии без ингибиторов) на той же пластине.
Значения ингибирования определяли с помощью модифицированных Z-показателей, рассчитанных с использованием медианы и медианного абсолютного отклонения (MAD) образцов (без контроля) на той же пластине. Образцы с величиной ингибирования выше 80% и Z-оценкой выше 2.5 для обеих реплик классифицировали как активные вещества. Образцы с показателями ингибирования от 50 до 80% и Z-оценкой выше 2.5 для обеих реплик классифицировали как частично активные.
Схема 1. Условия: i.  , PdCl2(PPh3)2, CuI, TEA, DMF, 20°C;
ii. 1.
, PdCl2(PPh3)2, CuI, TEA, DMF, 20°C;
ii. 1.  , NaN3, TEA, Ch2Cl2, 2. CuI, 20°C.
, NaN3, TEA, Ch2Cl2, 2. CuI, 20°C.
В качестве положительных стандартов бактериального ингибирования для грамотрицательных и грамположительных бактерий были использованы колистин и ванкомицин, соответственно, в качестве стандартного ингибитора гриба для C. albicans и Cr. neoformans использовали флуконазол.
Цитотоксическое действие in vitro оценивали на клеточной линии эмбриональных почек человека HEK293 путем определения концентрации, вызывающей гибель 50% клеток (СС50). Ингибирование роста клеток HEK293 определяли, измеряя флуоресценцию после добавления 5 мкл (25 мкг/мл) резазурина (конечная концентрация 2.3 мкг/мл) и после инкубации в течение еще 3 ч при 37°C в 5% CO2. Интенсивность флуоресценции измеряли с использованием монохромного микропланшетного ридера Tecan M1000 Pro с использованием автоматического вычисления коэффициента усиления. Положительным стандартом цитотоксичности служил препарат тамоксифен.
Гемолитическую активность определяли путем измерения при 405 нм поглощения супернатанта – надосадочной жидкости, образованной после инкубации в течение 1 ч при 37°С планшетов, содержащих образцы соединений с добавленными к ним промытыми клетками крови человека, и последующего центрифугирования при 1000 об./мин в течение 10 мин. Абсорбцию измеряли с использованием монохромного микропланшетного ридера Tecan M1000 Pro. В качестве положительного гемолитического стандарта был использован препарат мелиттин.
Методика тестирования противомикробной, фунгицидной, цитотоксической и гемолитической активности in vitro соединений приведена также на сайте http://www.co-add.org.
Список литературы
Magiorakos A.-P., Srinivasan A., Carey R. B., Carmeli Y., Falagas M.E., Giske C.G., Harbarth S., Hindler J. F., Kahlmeter G., Olsson-Liljequist B., Paterson D.L., Rice L.B., Stelling J., Struelens M.J., Vatopoulos A., Weber J.T., Monnet D.L. // Clin. Microbiol. Infect. 2012. V. 18(3). P. 268–281.
Newman D.J., Cragg G.M., Snader K.M. // J. Nat. Prod. 2003. V. 66. P. 1022–1037.
Толстиков Г.A., Толстикова T.Г., Шульц Э.Э., Толстиков С.Е., Хвостов М.В. Смоляные кислоты хвойных России. Химия, фармакология. Новосибирск: Академическое изд-во “ГЕО”, 2011. С. 395.
Xu H.T., Liu L.L., Fan X.T., Zhang G.J., Li Y.C., Jiang B. // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 505–510.
Huang X.-Ch.,Wang M., Pan Y.-M., Yao G.-Y., Zhang Y. // Eur. J. Med. Chem. 2013. V. 69. P. 508–520.
González M. A., Correa-Royero J., Agudelo L., Mesa A., Betancur-Galvis L. // Eur. J. Med. Chem. 2009. V. 44. P. 2468–2472.
Hou W., Luo Zh., Zhang G., Cao D., Li D., Ruan H., Ruan B.H., Su L., Xu H. // Eur. J. Med. Chem. 2017. V. 138. P. 1042–1052.
Olmo F., Guardia J. J., Marin C., Messouri I., Rosales M. J., Urbanova K., Chayboun I., Chahboun R., Alvarez-Manzaneda E.J., Sánchez-Moreno M. // Eur. J. Med. Chem. 2015. V. 89. P. 683–690.
Pertino M.W., Vega C., Rolón M., Coronel C., De Arias A.R., Schmeda-Hirschmann G. // Molecules. 2017. V. 22. P. 369–379.
Zhang W.M., Yang T., Pan X.Y., Liu X.L., Lin H.X., Gao Z.B., Yang C.G., Cui Y.M. // Eur. J. Med. Chem. 2017. V. 127. P. 917–927.
Berger M., Roller A., Maulide N. // Eur. J. Med. Chem. 2017. V. 126. № 27. P. 937–943.
Helfenstein A., Vahermo M., Nawrot D.A., Demirci F., Iscan G., Krogerus S., Yli-Kauhaluoma J., Moreira V.M., Tammela P. // Bioorg. Med. Chem. 2017. V. 25. P. 132–137.
Hou W., Zhang G., Luo Zh., Li D., Ruan H., Ruan B. H., Su L., Xu H. // Bioorg. Med. Chem. Lett. 2017. V. 27. P. 5382–5386.
Caetano da Silva S.D., Mendes de Souza M.G., Oliveira Cardoso M.J., da Silva Moraes T., Ambrósio S.R., Sola Veneziani R.C., Martins C.H.G. // Anaerobe. 2014. V. 30. P. 146–152.
Chen N., Duan W., Lin G., Liu L., Rui Z., Li D. // Mol. Divers. 2016. V. 20. P. 897–905.
Manner S., Vahermo M., Skogman M. E., Krogerus S., Vuorela P.M., Yli-Kauhaluoma J., Fallarero A., Moreira V.M. // Eur. J. Med. Chem. 2015. V. 102. P. 68–79.
Tret’yakova E.V., Zakirova G.F., Salimova E.V., Kukovinets O.S., Odinokov V.N., Parfenova L.V. // Med. Chem. Res. 2018. V. 27. P. 2199–2213.
Ковалева К.С., Яровая О.И., Шернюков А.В., Зарубаев В.В., Штро А.А., Оршанская Я.Р., Салахутдинов Н.Ф. // Химия гетероцикл. соед. 2017. Т. 53. С. 364–370.
Manner S., Vahermo M., Skogman M.E., Krogerus S., Vuorela P.M., Yli-Kauhaluoma J., Fallarero A., Moreira V.M. // Eur. J. Med. Chem. 2015. V. 102. P. 68–79.
Aranda F. J., Villalaín J. // Biochim. Biophys. Acta. 1997. V. 1327. P. 171–180.
Ganewatta M.S., Miller K.P., Singleton S.P., Mehrpouya-Bahrami P., Chen Y.P., Yan Y., Nagarkatti M., Nagarkatti P., Decho A.W., Tang C. // Biomacromolecules. 2015. V. 16. P. 3336–3344.
González M.A. // Eur. J. Med. Chem. 2014. V. 87. P. 834–842.
Sekido H., Takezawa J.-I., Motoki G., Akatsuka T. // Agric. Biol. Chem. 1990. V. 54. P. 287–290.
Tretyakova E.V., Smirnova I.E., Salimova E.V., Odinokov V.N. // Bioorg. Med. Chem. 2015. V. 23. P. 6543–6550.
Третьякова Е.В., Смирнова И.Е., Салимова Е.В., Пашкова Т.М., Карташова О.Л., Одиноков В.Н., Парфенова Л.В. // Биоорган. хим. 2017. Т. 43. С. 317–323.
Третьякова Е.В., Салимова Е.В., Парфенова Л.В. // Биоорган. хим. 2018. Т. 44. С. 554–559.
Третьякова Е.В., Салимова Е.В., Парфенова Л.В., Одиноков В.Н. // Ж. орган. химии. 2016. Т. 52. С. 1496–1502.
Третьякова Е.В., Салимова Е.В., Шакурова Э.Р., Парфенова Л.В., Одиноков В.Н. // Ж. орган. химии. 2017. Т. 53. С. 1664–1667.
Nong W., Chen X., Liang J., Wang L., Tong Zh., Huang K., Wu R., Xie Q., Jia Y., Li K. // Adv. Mat. Res. 2014. V. 887–888. P. 551–556.
Zalkov L.U., Ford R.A., Cutney J.P. // J. Org. Chem. 1962. V. 27. P. 3535–3539.
Herz W., Blackstone R.C., Nair M.G. // J. Org. Chem. 1967. V. 32. P. 2992–2998.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия