Биоорганическая химия, 2019, T. 45, № 6, стр. 640-649
Влияние степени окисления остатка Сys34 альбумина на взаимодействие белка с параоксоном по данным молекулярного моделирования
Д. А. Белинская 1, *, М. А. Терпиловский 1, А. А. Баталова 1, Н. В. Гончаров 1, 2
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, просп. Тореза 44, Россия
2 ФГУП “НИИ гигиены, профпатологии и экологии человека” ФМБА России
188663 Ленинградская обл., г.п. Кузьмоловский, ст. Капитолово, корп. 93, Россия
* E-mail: d_belinskaya@mail.ru
Поступила в редакцию 04.02.2019
После доработки 03.06.2019
Принята к публикации 19.06.2019
Аннотация
Методами молекулярного моделирования исследовали влияние степени окисления свободного цистеина Cys34 альбумина человека на связывающую и каталитическую активность белка по отношению к параоксону. Рассматривали три модели степени окисления цистеина: 1) Cys34 восстановлен, 2) Cys34 окислен до сульфеновой кислоты и 3) Cys34 окислен до сульфиновой кислоты. Конформационные характеристики комплексов альбумина с параоксоном в сайтах Садлоу I и Садлоу II изучали методом молекулярной динамики. Возможность реакции фосфорилирования оценивали по расстоянию между атомом фосфора параоксона и гидроксильным атомом кислорода каталитических тирозинов сайтов Садлоу I и II. Свободную энергию связывания параоксона с альбумином оценивали методом, сочетающим использование молекулярной механики и решение уравнения Пуассона–Больцмана (molecular mechanics – Poisson Boltzmann surface area, MM-PBSA). Согласно полученным данным, окисление цистеина не оказывает влияния на возможность эстеразной реакции в сайте Садлоу I. Модификация Cys34 изменяет конформацию сайта Садлоу I и положение параоксона в этом сайте, но не влияет на аффинность сайта по отношению к лиганду. Выдвинуто предположение, что такая независимость эффективности связывания от конформации сайта может быть обусловлена небольшими размерами и конформационной подвижностью молекулы параоксона, и такой эффект не будет наблюдаться для более массивных и жестких молекул. Модификация цистеина практически не влияет на конформацию сайта Садлоу II. В окисленной форме альбумина стабилизируется положение молекулы параоксона в продуктивной конформации, то есть увеличивается вероятность реакции фосфорилирования в сайте Садлоу II. Окисление цистеина не оказывает значительного влияния на связывающую активность сайта Садлоу II по отношению к параоксону.
ВВЕДЕНИЕ
Сывороточный альбумин является мажорным белком сыворотки крови. Он поддерживает ее коллоидно-осмотическое давление, выполняет резервную функцию, играет важную роль в транспортировке воды, различных ионов и соединений [1]. Накапливаются данные о ферментативной активности альбумина: истинно эстеразной (связывание субстрата с активным центром альбумина с последующим распадом комплекса на фермент и продукт) и псевдоэстеразной (необратимое связывание субстрата с ферментом) [2]. Выявлены два основных сайта гидролитической активности белка. Сайт Садлоу I с каталитическим аминокислотным остатком Tyr150 отвечает за истинно эстеразную активность альбумина [2, 3], сайт Садлоу II с каталитическим аминокислотным остатком Tyr411 – за псевдоэстеразную [4]. Установлена гидролитическая активность альбумина и по отношению к некоторым фосфорорганическим соединениям (ФОС) [5–7]. Трехмерная структура альбумина достаточно лабильна, и при взаимодействии с разными веществами имеют место кооперативность и аллостерическая модуляция, присущие мультимерным белкам. Направленное воздействие на альбумин с помощью молекул, модулирующих его связывающие и/или эстеразные свойства, может усилить детоксикацию ФОС в кровеносном русле [7–10].
Одной из возможных точек направленного воздействия может стать содержащийся в молекуле альбумина остаток цистеина Cys34 со свободной SH-группой, который способен образовывать дисульфиды с гомоцистеином и другими тиолами или обратимо окисляться до сульфеновой и сульфиновой кислоты [11]. Альбумин, содержащий такую группу, называется меркаптоальбумином, а альбумин, модифицированный по остатку Cys34, – немеркаптоальбумином [12, 13]. Влияние степени окисления Cys34 на связывающие и каталитические свойства альбумина практически не изучалось, а в работах, посвященных этому вопросу, получены противоречивые данные. В работе [14] Cys34 альбумина человека окисляли этакриновой кислотой и методами масс-спектроскопии и кругового дихроизма измеряли связывающую способность альбумина до и после модификации. Было показано, что окисление цистеина не влияло на эффективность связывания фенилбутазона в сайте Садлоу I и диазепама в сайте Садлоу II, однако улучшало эффективность связывания билирубина в третьем мажорном сайте связывания альбумина (Сайт III).
Иные результаты были получены в экспериментах in vivo. Известно, что при некоторых патологических состояниях и в процессе старения организма содержание окисленной формы Cys34 может повышаться [15, 16]. В работе [17] было выявлено, что у пациентов с хронической болезнью почек и печени повышено содержание цистеинилированного по остатку Cys34 альбумина (альбумин-Cys34-S-S-Cys). У этих пациентов в крови была повышена концентрация свободного варфарина (лиганда сайта Садлоу I) и диазепама (лиганда сайта Садлоу II). Авторы пришли к заключению, что модификация Cys34 ухудшает сродство сайтов Садлоу I и II к варфарину и диазепаму соответственно. В другом исследовании было показано, что альбумин пациентов с циррозом печени (заболевание, при котором также повышен содержание окисленной формы альбумина) слабее связывает лиганды сайта Садлоу II [18].
Цель представленного исследования – на примере параоксона (диэтил-пара-нитрофенилфосфата) методами молекулярного моделирования оценить влияние степени окисления Cys34 на связывающую и (псевдо)эстеразную активность сывороточного альбумина человека (ЧСА) по отношению к ФОС. Для этого методом молекулярной динамики были изучены геометрические характеристики комплексов параоксона с сайтами Садлоу I и Садлоу II ЧСА при различном состоянии окисления Cys34. Были оценены значения свободной энергии образования этих комплексов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подготовка трехмерных моделей альбумина с разной степенью окисления Cys34
Были подготовлены 3 модели альбумина, соответствующие разной степени окисления Cys34.
Модель 1: Cys34 восстановлен.
Модель 2: Cys34 окислен до сульфеновой кислоты.
Модель 3: Cys34 окислен до сульфиновой кислоты.
Модели 1а, 2а, 3а представляют собой комплексы альбумина с молекулой параоксона в сайте Садлоу I, модели 1б, 2б, 3б – с молекулой параоксона в сайте Садлоу II.
Модель 1 соответствует неокисленной форме цистеина. Константа диссоциации кислоты бокового радикала цистеина в логарифмической шкале (pKa) составляет 8.3 [19], поэтому в диапазоне физиологических значений pH (7.2–7.4) атом серы будет преимущественно протонирован: Cys34-SH. Ранее мы проводили молекулярный докинг молекулы параоксона в сайты Садлоу I (модель 1а) и Садлоу II (модель 1б) альбумина человека с Cys34 в восстановленном состоянии [20]. Для исследования взаимодействия параоксона с сайтом Садлоу I использовали трехмерную структуру альбумина из базы данных белковых структур PDB [21] со связанной в сайте Садлоу I молекулой варфарина, код 2bxg [22]. Для сайта Садлоу II была отобрана трехмерная структура альбумина со связанной в сайте Садлоу II молекулой ибупрофена, код 2bxd [22].
Вторая модель (модель 2) соответствует первой стадии окисления цистеина – сульфеновой кислоте. Показано, что pKa сульфеновых кислот превышает 10 [23, 24]. Согласно этому значению, гидроксильная группа сульфеновой кислоты Cys34 при нейтральных значениях pH будет протонированной: Cys34(SОН). Следующая стадия окисления цистеина – сульфиновая кислота (модель 3). Благодаря низкому значению pKa (около 2) [24], в диапазоне физиологических значений pH сульфиновая кислота будет преимущественно депротонирована: Cys34(S(O)O–). Теоретически боковой радикал цистеина может необратимо окисляться и до сульфоновой кислоты (Cys34(S(O)O–O–)). Однако, согласно литературным данным, содержание Cys34 в виде сульфоновой кислоты в плазме крови крайне мало [11], поэтому эту степень окисления мы не рассматривали.
Модели 2 и 3 альбумина были построены следующим образом. На основании имеющейся информации о зарядах на атомах, длинах связей, значениях валентных и торсионных углов для разных типов атомов и атомных групп, представленной в базе данных программного пакета GROMACS 5.0.4 [25], были описаны структуры окисленных цистеинов. Затем описания были добавлены в библиотеку структур аминокислот этого пакета. На основании внесенных данных, из исходных моделей 1а и 1б альбумина программой были сгенерированы модели 2а, 2б, 3а, 3б, которые затем были оптимизированы методом минимизации энергии [26].
Молекулярная динамика комплексов параоксона с альбумином
На следующем этапе конформационные характеристики полученных на предыдущем шаге моделей 2 и 3 были изучены методом молекулярной динамики, аналогичный расчет для модели 1 уже был проведен нами ранее [20]. Длина всех траекторий составила 10 нс. По полученным траекториям были рассчитаны зависимости от времени величин среднеквадратичных отклонений (root mean square deviation – RMSD) атомов Сα молекулы альбумина от их начального положения. Значение RMSD для всех комплексов увеличивалось в течение первых 4–6 нс симуляции, затем выходило на плато и варьировало в диапазоне 0.4–0.5 нм, что указывает на стабилизацию полипептидной цепи молекулы альбумина.
По полученным траекториям были рассчитаны зависимости значений расстояния между атомом фосфора параоксона и гидроксильным атомом кислорода Tyr150 и Tyr411 (distP-О) от времени (рис. 1 и 2). Этот параметр важен для оценки продуктивности полученного белок-лигандного комплекса, поскольку именно между этими атомами образуется ковалентная связь в процессе реакции фосфорилирования тирозина. Для того чтобы могла произойти нуклеофильная атака кислорода каталитической аминокислоты на атом фосфора параоксона, значение distP-О не должно превышать 0.4 нм [27].
Рис. 1.
Зависимости от времени значений расстояния между атомом фосфора параоксона и гидроксильным атомом кислорода Tyr150 (distP-О) в молекуле альбумина с разной степенью окисления Cys34: (а) альбумин c восстановленным Cys34, (б) альбумин с Cys34, окисленным до сульфеновой кислоты, (в) альбумин с Cys34, окисленным до сульфиновой кислоты.

Рис. 2.
Зависимости от времени значений расстояния между атомом фосфора параоксона и гидроксильным атомом кислорода Tyr411 (distP-О) в альбумине с восстановленным Cys34 (а), с Cys34, окисленным до сульфеновой кислоты (б), с Cys34, окисленным до сульфиновой кислоты (в).

Анализ полученных данных показал, что в сайте Садлоу I продуктивный комплекс параоксона с альбумином (в котором значение distP-O меньше 0.4 нм) нестабилен независимо от степени окисления Cys34 (рис. 1). В случае восстановленного цистеина (рис. 1а) значение distP-O первые 2 нс симуляции колеблется в промежутке 0.4–1.0 нм, затем оставшиеся 8 нс симуляции остается неизменным и колеблется на уровне 0.6 нм. Анализ положения молекулы параоксона на этом участке траектории показал, что лиганд “зафиксирован” кулоновским взаимодействием между атомом фосфорильного кислорода параоксона и боковым радикалом аминокислотного остатка Arg257: в конечной конформации расстояние между фосфорильным атомом кислорода параоксона и ближайшим атомом водорода бокового радикала остатка Arg257 составляет 0.36 нм (рис. 3а). Нитрогруппа параоксона в этой устойчивой конформации расположена примерно на равном расстоянии между аминокислотами Arg218, Trp214 и Lys199. Значения расстояний между ближайшим к этим остаткам атомом кислорода NO2-группы лиганда и атомами Hε Arg218, Hε1 Trp214 и Hζ2 Lys199 варьирует в пределах 0.5–0.7 нм.
Рис. 3.
Устойчивая конформация параоксона, связанного в сайте Садлоу I альбумином с восстановленным Cys34 (а); с Cys34, окисленным до сульфеновой кислоты (б); с Cys34, окисленным до сульфиновой кислоты (в).
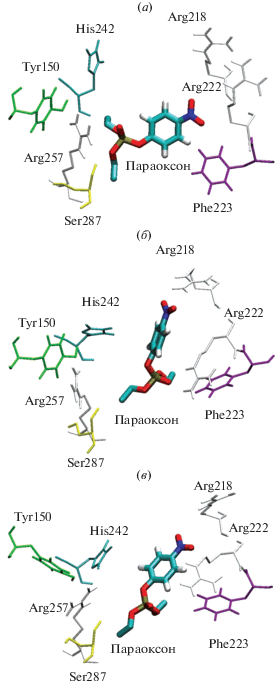
В случае сульфеновой кислоты значение distP-O увеличивается до 0.7 нм за 100 пс симуляции, затем остается неизменным и колеблется на уровне 0.7 нм в течение 4 нс, затем увеличивается до 0.9 нм и остается неизменным на протяжении оставшихся 6 нс (рис. 1б). Анализ положения молекулы параоксона показал, что в течение последних 6 нс симуляции лиганд “зафиксирован” электростатическим взаимодействием между группой NO2 параоксона и одной из NH2-групп бокового радикала Arg218: в конечной конформации расстояние между атомом кислорода NO2-группы параоксона и ближайшим атомом водорода бокового радикала Arg218 составляет 0.31 нм (рис. 3б). Положение фосфорной группы параоксона относительно Arg257 иное, чем в случае неокисленного цистеина: в конечной конформации траектории расстояние между фосфорильным атомом кислорода параоксона и ближайшим атомом водорода бокового радикала Arg257 составляет 0.88 нм.
В случае сульфиновой кислоты значение distP-O увеличивается до 0.7 нм за 100 пс симуляции, затем остается неизменным и колеблется на уровне 0.7 нм в течение 5 нс, затем увеличивается до 0.9 нм и остается неизменным на протяжении оставшихся 5 нс (рис. 1в). В целом, динамика конформационных изменений молекулы параоксона и аминокислот сайта Садлоу I схожа в моделях 2 и 3. Анализ положения молекулы параоксона на этом участке траектории показал, что группа NO2 параоксона “переключается” между боковыми радикалами Arg218 и Arg222. В конечной конформации расстояние между атомом кислорода NO2-группы параоксона и атомом Hε бокового радикала Arg218 составляет 0.49 нм (рис. 3в). В течение 10 нс симуляции это расстояние варьирует от 0.35 до 0.97 нм. Расстояние между атомом кислорода NO2-группы параоксона и атомом Hη1 в конечной конформации составляет 0.72 нм, а в течение симуляции варьирует от 0.21 до 0.84 нм. В конечной конформации расстояние между фосфорильным атомом кислорода параоксона и ближайшим атомом водорода бокового радикала Arg257 составляет 0.64 нм. В целом, в случае сульфиновой кислоты параоксон более подвижен внутри сайта Садлоу I, чем в случае восстановленного цистеина и сульфеновой кислоты.
Как видно из рис. 3, положение параоксона различно для всех трех моделей альбумина, но следует отметить, что конформации сайта Садлоу I в моделях 2 и 3 более близки между собой (рис. 3б, 3в) по сравнению с моделью 1 (рис. 3а). Таким образом, основное различие модели 1 от моделей 2 и 3 заключается в положении фосфорной группы параоксона относительно остатка Arg257, а также в положении бокового радикала остатка Arg222 относительно Arg218. Расстояния между атомами Cζ остатков Arg218 и Arg222 составляют 0.52, 0.95 и 0.81 нм в моделях 1, 2 и 3, соответственно.
Мы проанализировали конформацию остатка Cys34 и его окружения (рис. 4). В модели 1 остаток Cys34 взаимодействует с имидазольным кольцом His39, а в моделях 2 и 3 – нет. В модели 1 ориентация имидазольного кольца остатка His39 относительно Tyr140 иная, чем в моделях 2 и 3. Расстояния между атомом Nδ1 остатка His39 и атомом гидроксильного кислорода Tyr140 составляют 0.29, 0.77 и 0.81 в моделях 1, 2 и 3 соответственно. Это кардинальное отличие модели 1 от моделей 2 и 3 в “цистеиновом” сайте “перекликается” с отличием конформации остатка Arg257 в модели 1 от моделей 2 и 3 в сайте Садлоу I.
Рис. 4.
Конформация аминокислотного окружения Cys34 в зависимости от его степени окисления в комплексах альбумина с параоксоном, связанным в сайте Садлоу I: альбумин c восстановленным Cys34 (а), с Cys34, окисленным до сульфеновой кислоты (б); с Cys34, окисленным до сульфиновой кислоты (в).
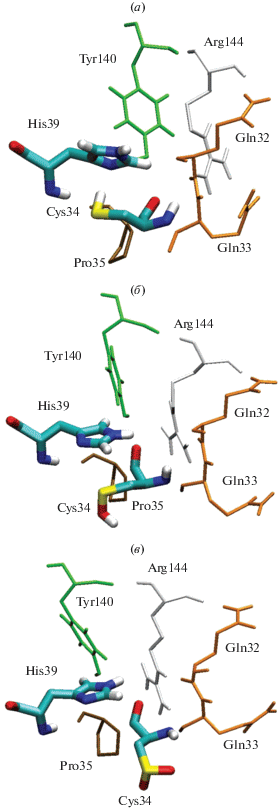
Кроме того, в случае восстановленного цистеина (рис. 4а) ориентация бокового радикала остатка Gln33 относительно Gln32 иная, чем в случае сульфеновой и сульфиновой кислот (рис. 4б, 4в). Расстояния между атомом Оε остатка Gln32 и атомом Hε22 остатка Gln33 составляют 0.37, 0.68 и 0.59 нм в моделях 1, 2 и 3 соответственно. Здесь также имеется корреляция с различиями в положении остатков Arg218 и Arg222 в сайте Садлоу I.
Что касается сайта Садлоу II, в случае восстановленного цистеина Cys34 участки стабильности, на которых значение distP-O колеблется около 0.4 нм, чередуются с участками нестабильности, на которых молекула параоксона отдаляется от тирозина Tyr411 (рис. 2а). На всех стабильных участках положение параоксона одинаково: молекула лиганда стабилизируется образованием водородной связи между группой ОН тирозина и фосфорильным атомом кислорода параоксона. Анализ зависимости расстояния между гидроксильным атомом водорода остатка Tyr11 и фосфорильным атомом кислорода лиганда показал, что периоды стабильного положения параоксона в сайте связывания совпадают с периодами существования водородной связи между этими атомами. А увеличению расстояния между параоксоном и тирозином, то есть уходу параоксона из сайта связывания, предшествует разрыв этой водородной связи.
В случае сульфеновой кислоты зависимость значения distP-O от времени выглядит схожим с моделью 1 образом: участки стабильности, на которых значение distP-O колеблется около 0.4 нм и существует водородная связь между группой ОН тирозина и фосфорильным атомом кислорода параоксона, чередуются с участками нестабильности, на которых молекула параоксона отдаляется от тирозина Tyr411, а водородная связь разрывается (рис. 2б). Единственное отличие состоит в том, что в модели 2 промежутки нестабильности существенно короче. Следовательно, окисление Cys34 до сульфеновой кислоты стабилизирует положение параоксона в продуктивной конформации в сайте Садлоу II. В случае сульфиновой кислоты значение distP-O остается неизменным на протяжении всего периода симуляции и колеблется на уровне 0.4 нм (рис. 2в), то есть в модели 3 положение параоксона еще более стабильно.
Как видно из рис. 5, конформации сайта Садлоу II для разных степеней окисления цистеина близки между собой. Наложение моделей друг на друга выявило, что конформация сайта в модели 2 немного отличается от моделей 1 и 3 положением бокового радикала Arg410. Однако это различие не влияет на ориентацию параоксона относительно аминокислотного окружения. В целом, это согласуется с нашими предыдущими результатами биохимических и расчетных экспериментов: для альбуминов разных видов (быка, крысы и человека), имеющих различный суммарный заряд, взаимодействие параоксона в сайте Садлоу II отличается в меньшей степени, чем в сайте Садлоу I [7, 20, 28].
Рис. 5.
Устойчивые конформации параоксона в сайте Садлоу II альбумина c восстановленным Cys34 (а); с Cys34, окисленным до сульфеновой кислоты (б); с Cys34, окисленным до сульфиновой кислоты (в).

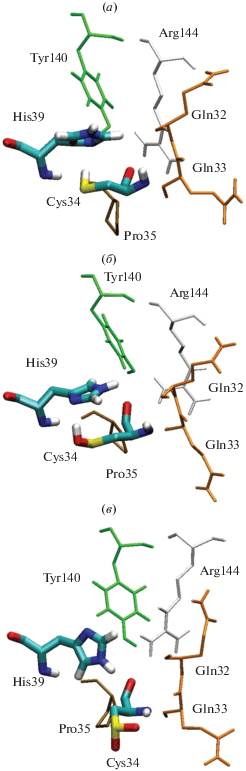
По аналогии с сайтом Садлоу I, для сайта Садлоу II мы проанализировали конформацию Cys34 и его окружения (рис. 6). В моделях 1 и 2 Cys34 взаимодействует с имидазольным кольцом His39, в модели 3 – нет, что влияет на положение гидроксильной группы Tyr140. Расстояния между атомом Оε остатка Gln32 и атомом Hε22 остатка Gln33 составляют 0.67, 1.10 и 1.01 нм в моделях 1, 2 и 3 соответственно. Следует отметить, что конформация “цистеинового” сайта зависит от того, связан ли параоксон в сайте Садлоу I или Садлоу II, что указывает на взаимное влияние лиганда и аминокислот сайта друг на друга.
Рис. 6.
Конформация аминокислотного окружения Cys34 в зависимости от его степени окисления в комплексах альбумина с параоксоном, связанным в сайте Садлоу II: (а) альбумин c восстановленным Cys34; (б) альбумин с Cys34, окисленным до сульфеновой кислоты; (в) альбумин с Cys34, окисленным до сульфиновой кислоты.
Оценка свободных энергий образования комплексов параоксона с альбумином
По полученным траекториям методом, сочетающим использование молекулярной механики и решение уравнения Пуассона–Больцмана (molecular mechanics – Poisson–Boltzmann surface area, MM-PBSA), были рассчитаны свободные энергии образования комплексов альбумин-параоксон (табл. 1).
В сайте Садлоу I значения свободных энергий образования комплексов альбумина с параоксоном практически идентичны. Тем не менее, вклад составляющих этой энергии различается в моделях 1, 2 и 3. Чем выше степень окисления Cys34, тем меньше вклад потенциальной энергии взаимодействия (EMM). Разницу в значение EMM вносит преимущественно энергия электростатических взаимодействий белка с лигандом (Eel): чем выше степень окисления цистеина, тем слабее электростатические взаимодействия параоксона с альбумином. В случае модели 3 значение Eel положительно. Поскольку в приближении классической механики заряды на атомах параоксона и аминокислот сайта неизменны с течением времени, ослабление электростатических взаимодействий связано с увеличением расстояния между заряженными атомами из-за конформационных различий в структуре сайта при разных степенях окисления цистеина. Анализ вклада различных аминокислот в энергию взаимодействия показал, что разница в значениях EMM связана с остатком Arg257. В модели 1 его вклад составляет –3.8 ккал/моль, в модели 2 – 0 ккал/моль и в модели 3 – 0.5 ккал/моль. Между моделями 2 и 3 основные различия состоят во вкладе остатка Ile290 (–1.8 и –1.0 ккал/моль в модели 2 и 3 соответственно), Arg218 (–1.7 и –0.8 ккал/моль) и Arg222 (–1.3 и –0.6 ккал/моль).
Однако “недостаток” электростатических взаимодействий лиганда с белком компенсируется слагаемым ΔGpolar – вкладом полярных взаимодействий в изменение свободной энергии сольватации системы при образовании комплекса белок-лиганд: чем слабее взаимодействие между лигандом и белком, тем меньше ощутима разница во взаимодействии белка и лиганда с водным окружением до и после образования комплекса. Параоксон – небольшое по размерам соединение с большим числом вращающихся связей. Возможно, в случае более массивных и менее гибких лигандов изменения в конформации сайта, вызванные окислением цистеина, будут существеннее влиять на эффективность связывания.
Для сайта Садлоу II не было выявлено существенных различий в значениях свободной энергии образования комплексов и ее составляющих. В случае модели 2 связывание чуть более сильное, чем в моделях 1 и 3, что согласуется с различиями в геометрии сайта Садлоу II в модели 2, описанными выше.
Подводя итог, можно отметить, что в комплексе альбумина с молекулой параоксона в сайте Садлоу I конформация окружения остатка Cys34 (а именно, положение His39 относительно Tyr140 и положение Gln32 относительно Gln33) коррелирует с конформацией сайта Садлоу I и параоксона (положение остатка Arg257 относительно фосфорной группы лиганда и положение Arg218 относительно Arg222). Окисление цистеина не изменяет связывающую активность сайта по отношению к параоксону, но влияет на соотношение энергетических слагаемых свободной энергии связывания. Для подвижных небольших молекул, таких как большинство известных ФОС, такое перераспределение, по всей видимости, не будет влиять на суммарную аффинность, но для более массивных и жестких молекул может сказаться на эффективности связывания. Окисление цистеина никак не влияет на стабилизацию параоксона в продуктивной конформации, то есть, по всей видимости, не влияет на истинно эстеразную активность альбумина по отношению к параоксону.
Что касается сайта Садлоу II, модификация цистеина не влияет на конформацию молекулы параоксона в сайте. Более того, в окисленной форме стабилизируется положение молекулы лиганда в продуктивной конформации, то есть увеличивается вероятность нахождения в продуктивной конформации, а значит и вероятность псевдоэстеразной реакции. Окисление цистеина не оказывает значительного влияния на связывающую активность сайта Садлоу II по отношению к параоксону.
Полученный результат в целом согласуется с данными работы [14], согласно которым окисление Cys34 этакриновой кислотой не влияло на связывающую способность сайтов Садлоу I и Садлоу II в условиях in vitro. Однако полученные нами данные не согласуются с результатом исследования [17], в котором у пациентов с патологией печени и почек повышенный уровень цистеинилированного по остатку Cys34 альбумина коррелировал с повышенным уровнем несвязанных варфарина и диазепама (специфических лигандов сайтов Садлоу I и Садлоу II).
Существует несколько возможных объяснений этому несоответствию. Одно из них заключается в том, что патология печени и почек может привести к повышенному содержанию определенных молекул в плазме крови, которые могут ингибировать (конкурентно или неконкурентно) связывание лигандов в сайтах Садлоу. Например, известно, что при циррозе печени в крови может быть повышен уровень глюкозы [29]. С другой стороны, авторы работы [30] показали в условиях in vitro, что окисление свободных SH-групп белка перманганатом калия приводит к увеличению числа сайтов на поверхности альбумина, доступных для связывания глюкозы. Имеются данные о том, что в молекуле альбумина происходят конформационные изменения после связывания таких соединений как билирубин [31] и мочевина [32], концентрация которых тоже может меняться при патологических состояниях [33, 34].
Таблица 1.
Энергетические характеристики комплексов альбумин-параоксон
| Сайт | Энергия, ккал/моль | Модель1 Cys34(SH) |
Модель 2 Cys34(SOH) |
Модель3 Cys34((S(O)O–) |
|---|---|---|---|---|
| Садлоу I | Evdw | –34.7 ± 2.0 | –35.8 ± 2.0 | –33.2 ± 1.7 |
| Eel | –5.7 ± 3.9 | –0.7 ± 2.1 | 2.5 ± 1.6 | |
| EMM | –40.5 ± 4.6 | –36.5 ± 3.7 | –30.7 ± 1.8 | |
| ΔGpolar | 23.2 ± 3.4 | 19.5 ± 3.9 | 14.0 ± 2.4 | |
| ΔGnon-polar | –3.5 ± 0.2 | –3.5 ± 0.2 | –3.6 ± 0.1 | |
| ΔG | –20.8 ± 2.5 | –20.6 ± 2.0 | –20.3 ± 2.0 | |
| Садлоу II | Evdw | –33.6 ± 2.6 | –34.1 ± 2.2 | –33.6 ± 2.2 |
| Eel | –4.7 ± 1.6 | –3.9 ± 1.6 | –4.7 ± 1.5 | |
| EMM | –38.3 ± 2.5 | –37.9 ± 2.8 | –38.3 ± 2.7 | |
| ΔGpolar | 16.6 ± 2.7 | 15.3 ± 2.8 | 17.0 ± 3.3 | |
| ΔGnon-polar | –3.6 ± 0.2 | –3.5 ± 0.2 | –3.6 ± 0.2 | |
| ΔG | –25.2 ± 2.8 | –26.1 ± 2.2 | –24.8 ± 2.4 |
EMM – потенциальная энергия взаимодействия лиганда с белком, рассчитанная методом молекулярной механики в вакууме. EMM = Evdw + Eel, где Evdw – энергия ван-дер-ваальсовых сил, Eel – энергия электростатических взаимодействий белка и лиганда. ΔGpolar и ΔGnon-polar – вклад полярных и неполярных взаимодействий в изменение свободной энергии сольватации системы при образовании комплекса белок-лиганд, ΔG – итоговое значение свободной энергии образования комплекса белок-лиганд (подробнее см. раздел “Экспериментальная часть”).
Другое возможное объяснение заключается в том, что важен не сам факт модификации цистеина, а то, как он был модифицирован. В случае цистеинилирования Cys34, помимо COO-группы (как в случае сульфиновой кислоты из представленной работы и этакриновой кислоты из работы [14]), в систему вносится еще и положительно заряженная NH3-группа, которая иным образом может влиять на конформацию альбумина и на его характеристики.
Особенности влияния модификации Cys34 на связывающую и гидролитическую активность альбумина, а также возможность экстраполяции данных экспериментов in silico и in vitro на условия in vivo требуют дальнейших исследований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Молекулярная динамика
Конформационные изменения комплексов альбумина с параоксоном во времени были рассчитаны методом молекулярной динамики с помощью программного пакета Gromacs 5.0.4 [25]. Каждый комплекс виртуально был помещен в периодическую кубическую ячейку, заполненную молекулами воды. Для описания молекул воды использовали модельный потенциал SPC (single point charge), приведенный в работе [35]. Для нейтрализации заряда в систему были добавлены ионы натрия: 15 ионов для моделей 1 (Cys34 в восстановленном состоянии) и 2 (Cys34 окислен до сульфеновой кислоты), 16 ионов – для модели 3 (Cys34 окислен до сульфиновой кислоты). Для поддержания в расчетном эксперименте постоянной температуры 300 К и постоянного давления 1 бар применяли термостат с масштабируемыми скоростями “V-rescale” [36] и баростат Берендсена [37] с временными константами 0.1 и 1 пс соответственно. Дальние электростатические взаимодействия рассчитывали методом Эвальда [38]. Взаимодействия Леннард-Джонса не учитывались при межатомном расстоянии больше 1 нм. Длины связей в молекулах альбумина и лигандов поддерживались постоянными с помощью алгоритма LINCS [39]. Расчету конформационных изменений комплексов белок-лиганд предшествовала минимизация энергии системы методом скорейшего спуска [26] и релаксация системы длиной 100 пс. Время симуляции конформационных изменений комплексов методом молекулярной динамики (длина траектории) составило 10 нс с шагом интегрирования 0.002 пс.
Оценка свободной энергии образования комплексов альбумина с лигандами
Оценка свободной энергии связывания параоксона с альбумином проводилась методом, сочетающим использование молекулярной механики и решение уравнения Пуассона–Больцмана (molecular mechanics – Poisson–Boltzmann surface area, MM-PBSA) [40] с помощью модуля g_mmpbsa [41], встроенного в программный пакет Gromacs. Метод MM-PBSA позволяет оценить энергию образования комплекса белок-лиганд из траекторий молекулярной динамики. В этом подходе свободная энергия связывания ΔGbind рассчитывается по формуле (1):
(1)
$\Delta {{G}_{{{\text{bind}}}}} = {{G}_{{{\text{RL}}}}}--{\text{ }}({{G}_{{\text{R}}}} + {{G}_{{\text{L}}}}),$Свободная энергия сольватации рассчитывается по формуле (3):
где Gpolar и Gnon-polar – вклад полярных и неполярных взаимодействий соответственно в свободную энергию сольватации.Предыдущие исследования [41] выявили, что в течение симуляции молекулярной динамикой происходят очень большие колебания энтропии. Было показано, что расчет только энтальпийного компонента лучше коррелирует с экспериментальными данными, чем расчет полной свободной энергии. Поэтому в нашей работе мы рассчитывали только энтальпийную составляющую свободной энергии образования комплекса.
В данной работе значение свободной энергии образования комплекса рассчитывалось каждые 100 пс в течение симуляции. Таким образом, результатом запуска модуля g_mmpbsa для одной траектории движения атомов, рассчитанной методом молекулярной динамики, являлось 100 значений свободной энергии. Итоговое значение рассчитывалось из полученных 100 значений как среднее ± стандартное среднее отклонение. В модуле g_mmpbsa в качестве размерности энергии используются кДж/моль, полученные значения энергий были переведены в ккал/моль.
Список литературы
Fasano M., Curry S., Terreno E., Galliano M., Fanali G., Narciso P., Notari S., Ascenzi P. // IUBMB Life. 2005. V. 57. P. 787–796.
Гончаров Н.В., Белинская Д.А., Разыграев А.В., Уколов А.И. // Биоорган. химия. 2015. Т. 41. № 2. С. 131–144. (Goncharov N.V., Belinskaya D.A., Ukolov A.I., Razygraev A.V. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 113–124.)
Radilov A., Rembovskiy V., Rybalchenko I., Savelieva E., Podolskaya E., Babakov V., Ermolaeva E., Dulov S., Kuznetsov S., Mindukshev I., Shpak A., Krasnov I., Khlebnikova N., Jenkins R., Goncharov N. // Handbook of the Toxicology of Chemical Warfare Agents / Ed. Gupta R.C. Oxford: Elsevier Inc., 2009. P. 69–91.
Li B., Nachon F., Froment M.T., Verdier L., Debouzy J.C., Brasme B., Gillon E., Schopfer L.M., Lockridge O., Masson P. // Chem. Res. Toxicol. 2008. V. 21. P. 421–431.
John H., Breyer F., Thumfart J.O., Höchstetter H., Thiermann H. // Anal. Bioanal. Chem. 2010. V. 398. P. 2677–2691.
Sogorb M.A., Vilanova E. // Chem. Biol. Interact. 2010. V. 187. P. 325–329.
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. // ЖЭБФ. 2017. Т. 53. № 4. С. 241–250. (Goncharov N.V., Terpilovskii M.A., Belinskaya D.A., Shmurak V.I., Avdonin P.V. // J. Evol. Biochem. Physiol. 2017. V. 53. P. 271–281.)
Lee P., Wu X. // Curr. Pharm. Des. 2015. V. 21. P. 1862–1865.
Белинская Д.А., Таборская К.И., Авдонин П.В., Гончаров Н.В. // Биоорган. химия. 2017. Т. 43. № 4. С. 347–356. (Belinskaia D.A., Taborskaya K.I., Goncharov N.V., Avdonin P.V. // Russ. J. Bioorg. Chem. 2017. V. 43. P. 359–367.)
Белинская Д.А., Терпиловский М.А., Баталова А.А., Гончаров Н.В. // ЖЭБФ. 2019. Т. 55. № 3. В печати. (Belinskaia D.A., Terpilovskii M.A., Batalova A.A., Goncharov N.V. // J. Evol. Biochem. Physiol. 2019. V. 55. In press.)
Grigoryan H., Li H., Iavarone A.T., Williams E.R., Rappaport S.M. // Chem. Res. Toxicol. 2012. V. 25. P. 1633–1642.
Anraku M., Chuang V.T., Maruyama T., Otagiri M. // Biochim. Biophys. Acta. 2013. V. 1830. P. 5465–5472.
Magzal F., Sela S., Szuchman-Sapir A., Tamir S., Michelis R., Kristal B. // PLoS One. 2017. V. 12. e0177799.
Bertucci C., Nanni B., Raffaelli A., Salvadori P. // J. Pharm. Biomed. Anal. 1998. V. 18. P. 127–136.
Oettl K., Stauber R.E. // Br. J. Pharmacol. 2007. V. 151. P. 580–590.
Suzuki Y., Suda K., Matsuyama Y., Era S., Soejima A. // Clin Nephrol. 2014. V. 82. P. 320–325.
Nagumo K., Tanaka M., Chuang V.T., Setoyama H., Watanabe H., Yamada N., Kubota K., Tanaka M., Matsushita K., Yoshida A., Jinnouchi H., Anraku M., Kadowaki D., Ishima Y., Sasaki Y., Otagiri M., Maruyama T. // PLoS One. 2014. V. 9. e85216.
Klammt S., Mitzner S., Stange J., Brinkmann B., Drewelow B., Emmrich J., Liebe S., Schmidt R. // Eur. J. Gastroenterol. Hepatol. 2007. V. 19. P. 257–263.
The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals / Ed. O’Neil M.J. Cambridge: Royal Society of Chemistry, 2013. 15th ed.
Белинская Д.А., Шмурак В.И., Таборская К.И., Авдонин П.П., Авдонин П.В., Гончаров Н.В. // ЖЭБФ. 2017. Т. 53. № 3. С. 170–177. (Belinskaya D.A., Taborskaya K.I., Goncharov N.V., Shmurak V.I., Avdonin P.P., Avdonin P.V. // J. Evol. Bochem. Physiol. 2017. V. 53. P. 191–199.)
Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T.N., Weissig H., Shindyalov I.N., Bourne P.E. // Nucleic Acids Res. 2000. V. 28. P. 235–242.
Ghuman J., Zunszain P.A., Petitpas I., Bhattacharya A.A., Otagiri M. // J. Mol. Biol. 2005. V. 353. P. 38–52.
McGrath A.J., Garrett G.E., Valgimigli L., Pratt D.A. // J. Am. Chem. Soc. 2010. V. 132. P. 16759–16761.
Ali S.T., Karamat S., Kóňa J., Fabian W.M. // J. Phys. Chem. A. 2010. V. 114. P. 12470–12478.
Van Der Spoel D., Lindahl E., Hess B., Groenhof G., Mark A.E., Berendsen H.J. // J. Comput. Chem. 2005. V. 26. P. 1701–1718.
Jensen J.H. Molecular Modeling Basics. Boca Raton; London; New York: CRC Press, 2010.
Jacob R.B., Michaels K.C., Anderson C.J., Fay J.M., Dokholyan N.V. // Sci. Rep. 2016. V. 6. e37175.
Goncharov N.V., Shmurak V.I., Belinskaia D.A., Terpilowski M.A., Jenkins R.O., Avdonin P.V. // Molecules. 2017. V. 22. e1201.
Nolte W., Hartmann H., Ramadori G. // Exp. Clin. Endocrinol. Diabetes. 1995. V. 103. P. 63–74.
Лотош Н.Ю., Савельев С.В., Селищева А.А. // Биоорган. химия. 2016. Т. 42. № 6. С. 689–696. (Lotosh N.Yu., Savel’ev S.V., Selishcheva A.A. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 624–630.)
Jacobsen J., Brodersen R. // J. Biol. Chem. 1983. V. 258. P. 6319–6326.
Uchida H., Hanano M. // Chem. Pharm. Bull. 1974. V. 22. P. 1571–1579.
Jang B.K. // Clin. Mol. Hepatol. 2012. V. 18. P. 357–359.
Liu X., Zhang H., Liang J. // Hepatogastroenterology. 2013. V. 60. P. 343–345.
Berendsen H.J.C., Postma J.P.M., van Gunsteren W.F., Hermans J. // Intermolecular Forces / Ed. Pullman B. Dordrecht: Reidel D. Publishing Company, 1981. P. 331–342.
Bussi G., Donadio D., Parrinello M. // J. Chem. Phys. 2007. V. 126. e014101.
Berendsen H.J.C., Postma J.P.M., di Nola A., van Gunsteren W.F., Haak J.R. // J. Chem. Phys. 1984. V. 81. P. 3684–3690.
Darden T., York D., Pedersen L. // J. Chem. Phys. 1993. V. 3. P. 10089–10092.
Hess B., Bekker H., Berendsen H.J.C., Fraaije J.G.E.M. // J. Comp. Chem. 1997. V. 8. P. 1463–1473.
Genheden S., Ryde U. // Expert Opin. Drug Discov. 2015. V. 10. P. 449–461.
Kumari R., Kumar R. Open Source Drug Discovery Consortium, Lynn A. // J. Chem. Inf. Model. 2014. V. 54. P. 1951–1962.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


