Биоорганическая химия, 2019, T. 45, № 6, стр. 624-632
Фармакокинетика пептида HLDF-6-АА в организме экспериментальных животных
Ю. А. Золотарев 1, *, А. К. Дадаян 1, В. С. Козик 1, С. И. Шрам 1, В. Н. Азев 2, А. П. Богачук 3, В. М. Липкин 3, Н. Ф. Мясоедов 1
1 ФГБУН Институт молекулярной генетики РАН
123182 Москва, пл. Курчатова, 2, Россия
2 ФГБУН Филиал Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Пущино, Московская обл., просп. Науки, 6, Россия
3 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ГСП-7, ул. Миклухо-Маклая 16/10, Россия
* E-mail: zolya@img.ras.ru
Поступила в редакцию 13.03.2019
После доработки 27.03.2019
Принята к публикации 29.04.2019
Аннотация
Изучена фармакокинетика перспективного противоопухолевого пептида HLDF-6-AA (Ac-ThrGlyGluAsnHisArg-NH2) с использованием его равномерно меченного тритием производного. Эксперименты проводили на самцах крыс линии Вистар, мышей Balb/c и кроликов Шиншилла. Меченный тритием пептид [3H]HLDF-6-АА с молярной радиоактивностью 50 Ки/ммоль был получен реакцией высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО). При внутривенном болюсном введении пептида HLDF-6-АА крысам и кроликам получены характеристики его фармакокинетического профиля в крови и рассчитаны значения основных фармакокинетических параметров пептида HLDF-6-АА и его активного метаболита HisArg-NH2. Показано, что показатели времени пребывания в организме и скорости элиминации пептидов HLDF-6-АА и HisArg-NH2 у крыс и кроликов близки и для крыс составляют около 7 и 21 мин соответственно. Показано, что многократное введение препарата не приводит к изменению его закономерной кумуляции и не вызывает изменения его фармакокинетики в сравнении с однократным введением. В экспериментах на крысах доказана линейность зависимости фармакокинетических параметров от количества вводимого пептида в интервале 2–22 мг/кг. В результате исследования распределения пептида HLDF-6-АА и его метаболита HisArg-NH2 между кровью и периферическими тканями мышей показано, что максимальная концентрация пептида HLDF-6-АА наблюдается в тканях почек и несколько меньшая – в сальниках. Обнаружено, что через 15–20 мин после внутрибрюшинного введения HLDF-6-АА мышам, концентрация пептида HisArg-NH2 начинает превышать концентрацию пептида HLDF-6-АА, что обусловлено его большей устойчивостью к протеолитическому гидролизу. Наибольшая концентрация пептида HisArg-NH2 наблюдается в тканях почек и печени.
ВВЕДЕНИЕ
К числу важнейших медико-социальных проблем современности относятся онкологические заболевания, являющиеся одной из основных причин смертности и инвалидизации населения в России и зарубежных странах. В настоящее время в мире наблюдается большой рост числа раковых заболеваний. В России, например, число пациентов с впервые диагностируемыми злокачественными новообразованиями увеличивается ежегодно на 2–3% и составляет на данный момент 550–600 тыс. человек.
Внимание многих исследователей сосредоточено сейчас на препаратах, вызывающих дифференцировку клеток, поскольку патогенез многих злокачественных опухолей связан с отклонениями в нормальной клеточной дифференцировке. Достоинством данного подхода является то, что эти вещества способны вызывать регрессию опухоли через активацию естественного механизма ингибирования роста клеток в результате индукции их дифференцировки. Одним из таких перспективных белков является фактор дифференцировки HLDF (Human Leukemia Differentiation Factor) – гликозилированный белок с молекулярной массой 8.2 кДа. Фактор HLDF вызывает дифференцировку исходных клеток HL-60 по гранулоцитарному пути и обнаруживается в организме человека в норме и при патологии [1, 2]. При изучении фактора был идентифицирован шестичленный пептидный фрагмент (HLDF-6), сохраняющий способность полноразмерного фактора индуцировать дифференцировку с сопутствующей остановкой клеточной пролиферации на клетках HL-60 [3].
Одним из специфических осложнений большинства средств противоопухолевой терапии является нейротоксичность. Особенно страдают системы, функционирование которых связано с высокой пролиферативной активностью клеток – костного мозга, иммунной системы, слизистых оболочек, а также центральной нервной системы. В экспериментах на культурах клеток и животных моделях было показано, что пептид HLDF-6 обладает как противоопухолевым, так и нейропротекторным действием [4–7]. В процессе исследования механизма фармакологического действия пептида было показано, что функциональной мишенью специфического фармакологического эффекта пептида HLDF-6 являются NMDA-рецепторы. Хроническое введение C-амидной формы пептида HLDF-6 нормализовало плотность NMDA-рецепторов, пониженную в результате патологии [8]. Показано, что специфическая нейропротекторная активность пептида HLDF-6 на модели болезни Альцгеймера связана со стимуляцией нейростероидогенеза, подавлением экспрессии 5-альфа-редуктазы и восстановлением уровней тестостерона, дигидротестостерона и эстрадиола [9].
В ходе разработки нового фармацевтического препарата с противоопухолевой и нейропротекторной активностью была исследована фармакокинетика наиболее устойчивого к протеолизу в организме экспериментальных животных ацетил-амидного производного пептида HLDF-6 (Ac-ThrGlyGluAsnHisArg-NH2, HLDF-6-АА) и его фрагментов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В соответствии с общепринятыми представлениями выбор дозы фармакологического средства осуществляется по данным его фармакодинамики у животных. Млекопитающие с разной массой имеют, по данным фармакодинамики, разную минимальную эффективную дозу. Вместе с тем принимается, что минимальная эффективная доза, отнесенная к площади поверхности тела, у млекопитающих с различной массой одинакова. Масса и площадь поверхности тела связаны между собой нелинейной зависимостью. Это приводит к тому, что минимальная эффективная доза, отнесенная к единице массы животного, снижается по мере увеличения массы животного. Фармакокинетика пептида в крови исследовалась при однократном введении крысам, кроликам и мышам в дозах, близких к минимальной эффективной дозе для этих животных. Кроликам, крысам, и мышам пептид вводился болюсно в дозах 2.5, 12 и 13 мг/кг соответственно.
Фармакокинетика пептида HLDF-6-АА при внутривенном болюсном введении кроликам. Для анализа фармакокинетики пептида HLDF-6-АА, самцам кроликов ввели 2000 мкКи меченного тритием пептида [3H]HLDF-6-АА в дозе 2.5 мг/кг. Хроматографические фракции, соответствующие пептиду HLDF-6-АА, а также его долгоживущему фрагменту HisArg-NH2, собирали и анализировали с помощью жидкостного сцинтилляционного счета (рис. 1).
Рис. 1.
Хроматографический анализ меченных тритием пептидов, содержащихся в 200 мкл конечного экстракта образца крови кролика после введения животному 2 мКи пептида [3H]HLDF-6-AA, в дозе 2.5 мг/кг в присутствии 10 мкг HisArg-NH2 (1) и 10 мкг HLDF-6-АA (2). Колонка Кромасил С18, 5 мкм, 4 × 150 мм, элюция в градиенте концентрации метанола в 0.1% HFBA, скорость элюции 0.8 мл/мин; УФ-детекция 220 нм, 1.0 A (Ch 2).

Для хроматографических фракций, соответствующих меченных тритием фрагментов пептидов ThrGlyGluAsnHisArg-NH2 и GluAsnHisArg-NH2, не было обнаружено достоверного превышения радиоактивности над фоном элюента. На этом основании был сделан вывод о том, что эти пептидные фрагменты не являются продуктами основного пути протеолитического гидролиза пептида Ac-ThrGlyGluAsnHisArg-NH2.
По результатам хроматографического анализа (рис. 1) определяли радиоактивную концентрацию пептида HLDF-6-АА и его фрагмента HisArg-NH2, образующегося под действием пептидаз, и рассчитывали объемную концентрацию пептидов в крови. Фармакокинетические кривые (“концентрация пептида–время”) для расчета фармакокинетических параметров были построены по усредненным значениям концентраций пептидов в крови, полученным из данных для каждой временной точки шести животных. Полученные этим методом фармакокинетические кривые пептидов HLDF-6-AA и HisArg-NH2 в крови самцов кроликов приведены на рис. 2.
Рис. 2.
Изменение во времени концентрации пептидов HLDF-6-АA (1) и HisArg-NH2 (2) в крови кроликов после внутривенного болюсного введения в дозе 2.5 мг/кг. Данные представлены в полулогарифмических координатах. Точками обозначены экспериментальные данные, сплошной линией – расчетные значения, полученные в результате наилучшего приближения к экспериментальным данным с помощью нелинейной регрессии.

Кинетика HLDF-6-АА и HisArg-NH2 в крови наилучшим образом формализуется в рамках однокамерной модели и математически описывается уравнениями однокомпонентной экспоненты:
Для полученных фармакокинетических кривых был проведен расчет основных фармакокинетических параметров (C0, T1/2(el), Kel, MRT, V1, Cl, AUC(0-∞)) пептида HLDF-6-AA в крови кроликов с использованием программ для анализа фармакокинетических данных (табл. 1). Полученные данные указывают на то, что пептид HLDF-6-АА характеризуется быстрым выведением из крови кроликов, обусловленным его быстрой биодеградацией. Установлено, что время полувыведения пептида HLDF-6-АА из крови кролика составляет около 5 мин.
Таблица 1.
Расчетные значения фармакокинетических параметров HLDF-6-АА и HisArg-NH2 в крови кролика (однократное внутривенное болюсное введение HLDF-6-АА в дозе 2.5 мг/кг
| Параметр* | HLDF-6-АА | HisArg-NH2 |
|---|---|---|
| D, нмоль | 6870 | – |
| мкг | 5180 | – |
| C0, нмоль/мл | 4.31 | – |
| мкг/мл | 3.25 | – |
| T1/2(el), мин | 5.11 | 8.30 |
| Kel, мин–1 | 0.136 | 0.084 |
| MRT мин | 7.37 | 11.97 |
| Cl, л/мин | 0.210 | – |
| V1, л | 1.549 | – |
| AUC(0-∞), (нмоль/мл)мин | 31.7 | 8.30 |
| (мкг/мл)мин | 23.9 | 2.58 |
| r2 | 0.9890 | 0.9858 |
Фармакокинетика пептида HLDF-6-АА при внутривенном болюсном введении крысам. Для анализа фармакокинетики пептида HLDF-6-AA, самцам крыс ввели 400 мкКи меченного тритием пептида HLDF-6-АА в дозе 12 мг/кг. Хроматографические фракции, соответствующие пептиду HLDF-6-АА, а также его пептидному фрагменту HR-NH2, собирали и анализировали с помощью жидкостного сцинтилляционного счета. Фармакокинетические кривые для расчета фармакокинетических параметров представлены на рис. 3. Исходя из полученных результатов, был проведен расчет фармакокинетических параметров пептида HLDF-6-АА в крови крыс, которые представлены в табл. 2.
Рис. 3.
Изменение концентрации пептидов HLDF-6-АA (1) и HisArg-NH2 (2) в крови крыс после внутривенного болюсного введения в дозе 12 мг/кг. Данные представлены в полулогарифмических координатах. Точками обозначены экспериментальные данные, сплошной линией – расчетные значения, полученные в результате наилучшего приближения к экспериментальным данным с помощью нелинейной регрессии.
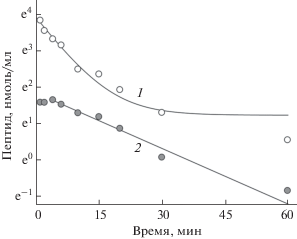
Таблица 2.
Расчетные значения фармакокинетических параметров для HLDF-6-АА и HisArg-NH2 в крови крысы (однократное внутривенное болюсное введение HLDF-6-АА в дозе 12 мг/кг)
| Параметр | HLDF-6-АА | HR-NH2 |
|---|---|---|
| D, нмоль | 3340 | – |
| мкг | 2520 | – |
| C0, нмоль/мл | 49.3 | – |
| мкг/мл | 37.2 | – |
| T1/2(el), мин | 4.57 | 14.79 |
| Kel, мин–1 | 0.152 | 0.047 |
| MRT мин | 6.59 | 21.35 |
| Cl, л/мин | 8.31 × 10–3 | – |
| V1, л | 54.7 × 10–3 | – |
| AUC(0-∞), (нмоль/мл)мин | 325 | 124.7 |
| (мкг/мл)мин | 245 | 38.7 |
| r2 | 0.9831 | 0.9863 |
Обозначения см. в экспериментальной части и табл. 1.
Установлено, что среднее время пребывания пептида HLDF-6-AA в крови крысы составляет около 7 мин, а для продукта его деградации – пептида HisArg-NH2, этот параметр составляет около 21 мин. У кролика значения времени выведения обоих пептидов из крови близки показателям, найденным для крысы. Можно отметить, что HisArg-NH2 характеризуется меньшей скоростью элиминации из крови, чем введенный пептид.
То есть в случае пептида HLDF-6-AA проявлялось явное отклонение от классической экспоненты. Экспонента описывает изменение, имеющее первый порядок по концентрации субстрата. Через 30 и 60 мин наблюдалось положительное отклонение концентрации от линейной зависимости логарифма концентрации пептида HLDF-6-AA от времени, что свидетельствует о наличии некоторого небольшого медленно выводящегося из крови пула пептида. Можно предположить, что это пул пептида, задерживался в клеточных элементах крови, в которых HLDF-6-AA (в отличие от HisArg-NH2) накапливался и, по всей вероятности, деградировал заметно медленнее, чем в плазме.
Обнаружено, что зависимость соотношения пептидов HisArg-NH2 и HLDF-6-АА от времени в крови кролей и крыс хорошо совпадают и математически аппроксимируются уравнением гиперболы (рис. 4). Наблюдаемый характер зависимости указывает на то, что в крови кролей и крыс фрагмент HisArg-NH2 образуется непосредственно из исходного пептида. При этом полученные результаты еще раз подтверждают сделанный выше вывод о близких скоростях элиминации HLDF-6-АА и HisArg-NH2 из организма кролика и крысы, что во многом определяется близкими активностями пептидаз, участвующими в метаболизме HLDF-6-АА и HisArg-NH2 в тканях этих животных.
Рис. 4.
Отношение концентраций HLDF-6-АА и продукта его протеолитического гидролиза – дипептида HisArg-NH2 в крови крыс и кроликов после внутривенного болюсного введения в дозе 12 и 2.5 мг/кг соответственно.

Проверка гипотезы линейности фармакокинетических параметров. В соответствии с рекомендациями по проведению доклинических исследований, была проверена гипотеза линейности дозовой зависимости фармакокинетики пептидного препарата HLDF-6-АА в крови самцов крыс Вистар при внутривенном болюсном введении [10]. Проверка этой гипотезы является важнейшим элементом фармакокинетического анализа, т.к. позволяет оценить предсказуемость изменений концентрации (С) в ответ на изменение дозы (D) фармакологического средства. Гипотеза принимается, если значения параметров фармакокинетики не зависят от дозы. Как правило, гипотеза линейности проверяется применительно к фармакокинетическим профилям фармакологического средства в крови.
С этой целью определяли концентрацию пептида HLDF-6-AA в крови крыс после введения меченого пептида в дозах 2, 12 и 22 мг/кг. Для анализа фармакокинетики пептида HLDF-6-AA, самцам крыс ввели 400 мкКи пептида [3H]HLDF-6-AA в 400 мкл физиологического раствора, содержащего соответствующую дозу пептида HLDF-6-AA. Хроматографические фракции, соответствующие пептиду HLDF-6-AA и его пептидному фрагменту HisArg-NH2, собирали по данным УФ-детекции и анализировали с помощью жидкостного сцинтилляционного счета. По результатам этого анализа определяли дозовую зависимость фармакокинетических параметров пептида HLDF-6-AA и его пептидного фрагмента HisArg-NH2 в крови крысы.
Для проверки гипотезы линейности был проведен анализ дозозависимых (по определению) фармакокинетических параметров: AUC(0-∞) и C0 от дозы. Расчеты показывают, что все вышеперечисленные фармакокинетические параметры прямо пропорционально зависели от использованной дозы пептида (рис. 5). В то же время значения ряда время-зависимых (MRT, Kel, T1/2(el)) и объем-зависимых (Cl, Vl) параметров, полученные для разных доз пептида, существенно не различались (данные не приводятся). Это указывает на то, что только дозо-зависимые фармакокинетические параметры демонстровали четкую линейную зависимость при изменении дозы пептида в диапазоне от 2 до 22 мг/кг. Вывод о линейности фармакокинетики HLDF-6-AA в крови крыс при внутривенном болюсном введении был сделан на основании найденных линейных зависимостей фармакокинетических параметров AUC(0-∞) и C0 от дозы (рис. 5).
Рис. 5.
Зависимость величины AUC(0-∞) (а) и C0 (б) от дозы пептида HLDF-6-АА при внутривенном болюсном введении крысам.

Фармакокинетическое исследование при многократном введении пептида HLDF-6-AA необходимо сопоставить с данными его фармакокинетики, полученными после однократного введения. Целью сравнения результатов фармакокинетических исследований при многократном и однократном введении является выявление возможных нарушений в закономерной кумуляции фармакологического средства. При многократном введении достаточно использовать один уровень дозы, установленной при фармакологических исследованиях [10]. Для анализа влияния длительного хронического введения пептида HLDF-6-AA на его фармакокинетическое поведение было проведено сравнительное исследование на двух группах крыс. Крысам лечебной группы в течение 28 дней внутрибрюшинно вводили 400 мкл физиологического раствора, содержащего пептид HLDF-6-AA в дозе 12 мг/кг, в контрольной группе, в том же объеме, вводился физиологический раствор. По истечении 28-дневного срока, животным этих двух групп внутривенно ввели 400 мкКи меченного тритием пептида [3H]HLDF-6-AA в дозе 12 мг/кг. Через определенные протоколом промежутки времени кровь отбирали и готовили пептидный экстракт для хроматографического анализа по приведенной методике.
Было установлено, что профили зависимостей концентрации пептида от времени для животных, подвергнутых хроническому и однократному введению пептида, статистически не отличаются друг от друга. Хроническое введение пептида HLDF-6-AA самцам крыс не приводит к изменениям его метаболизма и выведения из организма, что указывает на отсутствие кумулятивных и “истощающих” эффектов хронического введения пептида на фармакокинетику. Таким образом, многократное введение препарата не приводит к изменению его закономерной кумуляции и не вызывает изменения фармакокинетики пептида HLDF-6-AA в сравнении с однократным введением. Пептид HLDF-6-AA при многократном внутривенном болюсном введении крысам не вызывает токсических эффектов, является безопасным и может быть рекомендован для проведения дальнейших исследований.
Фармакокинетика пептида HLDF-6-АА при внутрибрюшинном болюсном введении мышам. В этом комплексном исследовании фармакокинетики наряду с крысами и кроликами были использованы линейные мыши Balb/c. Был проведен анализ фармакокинетики пептида HLDF-6-AA и его дипептидного фрагмента HisArg-NH2 крови и некоторых органах мыши при внутрибрюшинном введении пептида. Полученные результаты приведены в табл. 3.
Таблица 3.
Изменение концентрации пептидов HLDF-6-АА и HisArg-NH2 в тканях мышей Balb/c через 2–20 мин после внутрибрюшинного введения пептида HLDF-6-АА в дозе 13 мг/кг
| Время, мин | Кровь | Мозг | Почки | Печень | Сердце | Сальник |
|---|---|---|---|---|---|---|
| HLDF-6-АА, нмоль/мл | ||||||
| 2 | 2.8 ± 0.5 | 0.09 ± 0.03 | 10.7 ± 1.9 | 4.3 ± 0.8 | 1.4 ± 0.4 | 3.6 ± 0.5 |
| 4 | 6.9 ± 0.8 | 0.16 ± 0.04 | 8.8 ± 1.2 | 3.7 ± 0.7 | 5.5 ± 0.6 | 7.9 ± 1.5 |
| 6 | 12.3 ± 1.8 | 0.21 ± 0.05 | 10.5 ± 1.6 | 4.1 ± 0.9 | 5.8 ± 0.7 | 9.3 ± 1.6 |
| 10 | 6.8 ± 0.8 | 0.31 ± 0.07 | 9.4 ± 1.2 | 3,1 ± 0,6 | 3.6 ± 0.5 | 5.2 ± 0.7 |
| 15 | 3.4 ± 0.4 | 0.16 ± 0.03 | 5.2 ± 0.7 | 2.8 ± 0.5 | 1.5 ± 0.3 | 4.9 ± 0.6 |
| 20 | 1.4 ± 0.3 | 0.05 ± 0.02 | 3.7 ± 0.5 | 1.1 ± 0.3 | 1.3 ± 0.4 | 2.4 ± 0.5 |
| HisArg-NH2, нмоль/мл | ||||||
| 2 | 0.9 ± 0.2 | 0.05 ± 0.02 | 3.6 ± 0.9 | 1.2 ± 0.4 | 0.7 ± 0.2 | 4.1 ± 0.6 |
| 4 | 3.3 ± 0.6 | 0.09 ± 0.03 | 7.9 ± 1.3 | 4.6 ± 0.9 | 2.4 ± 0.3 | 1.6 ± 0.4 |
| 6 | 6.0 ± 0.9 | 0.11 ± 0.03 | 12.4 ± 1.9 | 6.9 ± 1.6 | 3.6 ± 0.5 | 1.7 ± 0.4 |
| 10 | 5.2 ± 0.6 | 0.17 ± 0.04 | 8.9 ± 1.1 | 4.7 ± 0.8 | 4.8 ± 0.6 | 3.7 ± 0.5 |
| 15 | 3.5 ± 0.5 | 0.06 ± 0.02 | 8.2 ± 0.9 | 2.1 ± 0,.5 | 1.6 ± 0.3 | 0.8 ± 0.2 |
| 20 | 1.5 ± 0.3 | 0.06 ± 0.02 | 5.8 ± 0.8 | 2.1 ± 0.5 | 1.3 ± 0.4 | 0.42 ± 0.1 |
Из приведенных в этой таблице данных можно видеть, что максимальная концентрация пептида HLDF-6-AA в крови наблюдается через 6 мин после внутрибрюшинного введения. Можно также видеть, что максимальное накопление пептида HLDF-6-AA наблюдается в тканях почек и несколько меньшая – в сальниках. Найдено, что через 15–20 мин после введения, концентрация пептида HisArg-NH2 начинает превышать концентрацию исходного пептида HLDF-6-AA, что отражает большую устойчивость фрагментарного пептида к протеолитическому гидролизу. Наибольшая концентрация пептида HisArg-NH2 наблюдается в тканях почек и печени. Показано, что пептид HLDF-6-AA способен преодолевать гематоэнцефалический барьер. Его динамически изменяющаяся концентрация в мозге примерно в 20–30 раз меньше концентрации пептида HLDF-6-AA в крови на этот момент.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные животные
Для исследований использовали 30 здоровых половозрелых крыс-самцов линии Вистар возрастом 8 недель, весом 200 ± 20 г; 36 самцов мышей линии Balb/c возрастом 6–7 недель, весом 20 ± 1 г; и 5 самцов кроликов породы Шиншилла возрастом 12 недель, весом 2000 ± 200 г. Содержание животных соответствовало действующим санитарным правилам по обустройству, оборудованию и содержанию экспериментально-биологических клиник. Стандартная лабораторная диета соответствовала действующим нормам. Крысы и мыши содержались по 4 в клетке в условиях свободного доступа к воде и корму при температуре 21°С и постоянном световом дне 14 ч (включение света в 8 ч утра). Факторы внешней среды (температура, влажность, освещенность, состав подстила) соответствовали требованиям по содержанию лабораторных животных. Исследование выполнялось согласно “Правилам лабораторной практики в Российской Федерации” [11], а также рекомендациям, изложенным в “Руководстве по проведению доклинических исследований лекарственных средств” [10], и в соответствии с международными требованиями по правилам GLP FDA и GLP OECD на лабораторных животных (экспериментальных биомоделях) SPF-статуса (свободные от патогенной флоры). Лабораторные животные SPF-статуса производились в Питомнике лабораторных животных ФИБХ РАН, который имеет международную аккредитацию AAALAC. Система управления качества производства лабораторных животных в Питомнике сертифицирована на соответствие международным требованиям ИСО 9001:2008. Все процедуры в исследовании выполнялись согласно утвержденным Комиссией по гуманному обращению с животными протоколам.
Твердофазный синтез пептида HLDF-6-AA и его фрагментов ThrGlyGluAsnHisArg-NH2, GluAsnHisArg-NH2 и HisArg-NH2 был осуществлен с использованием Boc/Bzl-методологии и схемы неполного блокирования боковых функций аминокислот [12].
Меченный тритием пептид [3H]HLDF-6-AA для фармакокинетических исследований получали с использованием реакции ВТКИО с газообразным тритием при температуре 170°С в твердой смеси, образованной немеченым пептидом, нанесенным на карбонат кальция, и высокодисперсным катализатором 5% палладий-на-карбонате кальция. В исследовании фармакокинетики был использован меченый пептид [3H]HLDF-6-AA с молярной радиоактивностью 50 Ки/ммоль, содержащий фрагмент [3H]HisArg-NH2 с молярной радиоактивностью 29 Ки/ммоль [12].
Введение животным пептидов и отбор крови. В экспериментах на кроликах введение пептида и отбор крови осуществляли через большие ушные вены. Кроликов фиксировали в ящике с отверстием для головы. В правое ухо, через большую ушную вену, инсулиновым шприцом вводили 0.8 мл раствора гепарина (5000 МЕ/мл; ФГУП “Московский эндокринный завод”) и через 5 мин в большую ушную вену левого уха устанавливали внутривенный катетер Flexicath G22, через который в дальнейшем осуществляли отбор крови. Пептид [3H]HLDF-6-AA (2 мКи, в дозе 2.5 мг/кг) вводили инсулиновым шприцом в правую ушную вену и через фиксированные промежутки времени (2, 4, 6, 10, 15, 20 и 30 мин) через катетер отбирали примерно по 1 мл венозной крови. Кровь собирали во взвешенные пластиковые пробирки и замораживали жидким азотом.
В экспериментах на крысах введение пептида (внутривенный способ введения) и отбор крови осуществляли через яремные вены. Крыс анестезировали хлоралгидратом (300 мг/кг), и через 5–10 мин с вентральной стороны в области, прилегающей к грудным конечностям и шее, удаляли шерсть и делали два продольных разреза кожи (справа и слева) длиной около 3 см, и препарировали яремные вены. В левую яремную вену устанавливали внутривенный катетер Flexicath G24 и вводили через него 80 мкл гепарина. Затем в правую яремную вену устанавливали катетер Flexicath G22 для отбора крови. Раствор пептида [3H]HLDF-6-AA (400 мкКи) в дозах, 2, 12 и 22 мг/кг, в объеме 200 мкл физиологического раствора вводили в левую яремную вену в течение 10–15 с. После чего, по истечении определенного времени (2, 4, 6, 10, 15, 20 и 30 мин), из правой яремной вены отбирали примерно по 0.5 мл венозной крови. Забор крови осуществляли, как описано выше, с использованием внутривенного катетера. Кровь собирали во взвешенные пластиковые пробирки и замораживали жидким азотом.
В экспериментах на мышах введение меченого пептида [3H]HLDF-6-AA (25 мкКи) осуществляли внутрибрюшинно в дозе 13 мг/кг. Животных декапитировали по окончании определенного протоколом времени, кровь и исследуемые ткани собирали во взвешенные пластиковые пробирки и замораживали жидким азотом.
Подготовка проб тканей и анализ фармакокинетики пептида [3H]HLDF-6-AA. При приготовлении тканей для ВЭЖХ анализа, замороженные и взвешенные образцы проб тканей в пластиковых пробирках подвергались лиофильной сушке в течение 2 сут. Лиофильно высушенные образцы тканей прогревали при 65°С в течение 30 мин, после чего измельчали и проводили экстракцию 90% водным ацетонитрилом, содержащим 1% TFA [13]. В водно-ацетонитрильный раствор, использованный для экстракции, добавляли по 10 мкг синтезированных пептидов Ac-ThrGlyGluAsnHisArg-NH2, ThrGlyGluAsnHisArg-NH2, GluAsnHisArg-NH2 и HisArg-NH2, предназначенных для идентификации фракций при хроматографии.
Количественный анализ пептидов проводили с помощью ВЭЖХ на колонке Kromasil C18, 8 × × 150 мм в градиенте концентрации метанола (0–40%), присутствии 0.08% TFA и 0.02% HFBA (гептафтормасляная кислота). Фракции, содержащие пептиды Ac-ThrGlyGluAsnHisArg-NH2, ThrGlyGluAsnHisArg-NH2, GluAsnHisArg-NH2 и HisArg-NH2, собирали и в них проводили определение радиоактивности с помощью жидкостного сцинтилляционного счета. Расчет фармакокинетических параметров производили с использованием внемодельного подхода. Для этого применяли специальную некоммерческую программу для анализа фармакокинетических данных Borgia 1.03 (НПП “Наука Плюс”), а также программу SigmaPlot 11.0 (Systat Software, USA). Фармакокинетические кривые (“концентрация пептида–время”) для расчета фармакокинетических параметров были построены по усредненным значениям концентраций пептидов HLDF-6-AA и HisArg-NH2 в крови, полученным из данных для 6 животных. Экспериментальные данные аппроксимировали экспоненциальной зависимостью и рассчитывали оптимальные параметры уравнения (макроконстанты) методом наименьших квадратов. С использованием полученных значений параметров уравнения экспоненты рассчитывали основные фармакокинетические параметры:
AUC(0-∞) – площадь под фармакокинетической кривой “концентрация–время”;
Cl – общий клиренс; отражающий объем тест-ткани, освобождающийся от фармакологического средства в единицу времени, определяется отношением дозы к площади под кривой “концентрация–время” (AUC, в пределах от нуля до бесконечности): С1Т = D/AUC
C0 – расчетное значение концентрация вещества в крови в начальный момент времени, определяется на участке моноэкспоненциальной зависимости фармакокинетической кривой;
T1/2(el) – время полувыведения вещества из крови, это период времени, в течение которого концентрация фармакологического средства снижается вдвое. Величина Т1/2 может быть рассчитана по формуле: Т1/2 = 0.693/λ, где λ — показатель экспоненты, характеризующий скорость снижения концентрации препарата на конечном (моноэкспоненциальном) участке фармакокинетической кривой;
Kel – константа скорости выведения вещества из крови;
MRT – среднее время пребывания фармакологического соединения в крови. Величина MRT может быть рассчитана по формуле: MRT = = AUMC/AUC, где AUMC – площадь под кривой “произведение времени на концентрацию фармакологического средства (t × С)”;
V1 – кажущийся объем распределения вещества в центральной камере;
r2 – коэффициент детерминации.
Все полученные количественные данные были подвергнуты статистическому анализу. В таблицах все количественные показатели приведены в виде среднее ± стандартное отклонение.
ЗАКЛЮЧЕНИЕ
С целью создания высокоактивного и низкотоксичного пептидного препарата с противоопухолевой и нейропротекторной активностью выполнено исследование фармакокинетики в организме экспериментальных животных пептида HLDF-6-AA на самцах ряда лабораторных животных: крыс линии Вистар, мышей Balb/c и кроликов породы Шиншилла. Определена зависимость концентрации пептида HLDF-6-АА и его основного метаболита HisArg-NH2 в крови и в различных органах лабораторных животных от времени после введения пептида. Рассчитаны значения основных фармакокинетических параметров пептида HLDF-6-АА в крови кролика и крысы при однократном внутривенном болюсном введении. Продемонстрирована линейная зависимость дозозависимых фармакокинетических показателей от количества внутривенно введенного крысам пептида HLDF-6-АА. На мышах изучен метаболизм и распределение пептида HLDF-6-АА и его основного долгоживущего метаболита HisArg-NH2 между кровью и периферическими тканями при внутрибрюшинном введении.
Список литературы
Kostanyan I.A., Astapova M.V., Starovoytova E.V., Dranitsyna S.M., Lipkin V.M. // FEBS Letters. 1994. V. 356 (2–3). P. 327–329.
Соснина А.В., Морозов Д.В., Вараксин Н.А., Вонаршенко А.В., Байдакова Л.К., Аутеншлюс А.И., Липкин В.М. // ДАН. 2014. Т. 454 (5). С. 603–605.
Костанян И.А., Астапова М.В., Наволоцкая Е.В., Лепихова Т.Н., Драницина С.М., Телегин Г.Б., Родионов И.Л., Байдакова Л.К., Золотарев Ю.А., Молотковская И.М., Липкин В.М. // Биоорган. химия. 2000. Т. 26 (7). С. 505–511. [Kostanyan I.A., Astapova M.V., Navolotskaya E.V., Lepikhova T.N., Dranitsyna S.M., Telegin G.B., Rodionov I.L., Baidakova L.K., Zolotarev Yu.A., Molotkovskaya I.M., Lipkin V.M. // R. J. Bioorg. Chem. 2000. V. 26. P. 505–511.]
Батенева А.В., Бабенко О.А., Даниленко Е.Д., Порываев В.Д., Карпышев Н.Н., Гончарова Е.П., Костанян И.А., Масычева В.И. // Экcп. клин. фаpмакол. 2010. Т. 73 (2) С. 21. [Bateneva А.V., Babenko О.А., Danilenko Е.D., Poryvaev V.D., Karpyshev N.N., Goncharova Е.P., Kostanyan I.А., Masycheva V.I. // Eksp. Klin. Farmakol. V. 73. № 2. P. 18–21.]
Костанян И.А., Сторожева З.И., Семенова Н.А., Липкин В.М. // Доклады академии наук. 2009. Т. 428 (4). С. 418–422. [Kostanyan I.A., Storozheva Z.I., Semenova N.A., Lipkin V.M. // Doklady Biol. Sci. 2009. V. 428. P. 418–422.]
Sewell R.D., Gruden M.A., Pache D.M., Storogeva Z.I., Kostanyan I.A., Proshin A.T., Yurasov V.V., Sherstnev V.V. // J. Psychopharmacol. 2005. V. 19. P. 602–608.
Bogachouk A.P., Storozheva Z.I., Solovjeva O.A., Sherstnev V.V., Zolotarev Yu.A., Azev V.N., Rodionov I.L., Surina E.A., Lipkin V.M. // J. Psychopharmacol. 2016. V. 30. 78–92.
Zolotarev Yu.A., Kovalev G.I., Kost N.V., Voevodina M.E., Sokolov O.Y., Dadayan A.K., Kondrakhin E.A., Vasileva E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // J. Psychopharmacol. 2016. V. 30. (9). P. 922–935.
Rzhevsky D.I., Zhokhov S.S., Babichenko I.I. Goleva A.V., Goncharenko E.N., Baizhumanov A.A., Murashev A.N., Lipkin V.M., Kostanyan I.A. // HLDF-6 peptide affects behavioural reactions and organism functions dependent on androgen hormones in normal and castrated male mice // Regul. Pept. 2005. V. 127. P. 111–121.
Миронов А.Н. Бунятян Н.Д., Васильев А.Н. Руководство по проведению доклинических исследований лекарственных средств / Под ред. Миронова А.Н. Часть первая. М.: Гриф и К., 2012. С. 944. [Rukovodstvo po provedeniyu doklinicheskikh issledovanii lekarstvennykh sredstv / Ed by Mironov A.N. Moscow: Grif i K., 2012. (In Russ.).]
Национальный стандарт Российской федерации, ГОСТ Р 53434. 2009. [Natsional’nyi standart Rossiiskoi federatsii, GOST R 53434. 2009. (In Russ.).]
Золотарев Ю.А., Дадаян А.К., Козик В.С., Шрам С.И., Нагаев И.Ю., Азев В.Н., Богачук А.П., Липкин В.М., Мясоедов Н.Ф. // Биоорган. химия. (2019, готовится к печати).
Золотарев Ю.А., Дадаян А.К., Кост Н.В., Воеводина М.Э., Соколов О.Ю., Козик В.С., Шрам С.И., Азев В.Н., Бочаров Э.В., Богачук А.П., Липкин В.М., Мясоедов Н.Ф. // Биоорган химия. 2015. Т. 41. С. 644–656. [Zolotarev Yu.A., Dadayan A.K., Kost N.V., Voevodina M.E., Sokolov O.Y., Kozik V.S., Shram S.I., Bocharov E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. // Russ. J. Bioorg. Chem. 2015. V. 41. P. 578–589.]
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


