Биоорганическая химия, 2019, T. 45, № 6, стр. 615-623
Моноклональные антитела к рекомбинантному белку vp7 вируса блютанга
Н. В. Руденко 1, 2, *, А. П. Каратовская 1, А. О. Шепеляковская 1, А. В. Замятина 1, 2, Ф. А. Бровко 1, 2, А. Ю. Кольцов 3, И. Р. Иматдинов 3, А. Р. Иматдинов 3, О. М. Стрижакова 3, К. А. Мима 3, В. М. Лыска 3, Д. В. Колбасов 3
1 Филиал Федерального государственного бюджетного учреждения науки Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
142290 Пущино, проспект Науки, 6, Россия
2 Пущинский государственный естественно-научный институт
142290 г. Пущино, проспект Науки, 3, Россия
3 Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр вирусологии и микробиологии”
601125 Владимирская обл., пос. Вольгинский, ул. Академика Бакулова, стр. 1, Россия
* E-mail: nrudkova@mail.ru
Поступила в редакцию 11.04.2019
После доработки 11.06.2019
Принята к публикации 11.07.2019
Аннотация
Блютанг, или катаральная лихорадка овец, – вирусная трансмиссивная инфекция жвачных, которая является одной из экономически значимых арбовирусных инфекций животных и передается кровососущими насекомыми рода Culicoides. Вирусный белок VP7 является группоспецифическим коровым белком вируса, консервативным для всех его известных серотипов, поэтому представляет собой наиболее подходящую мишень для создания диагностических тестов. Для разработки иммунохимического метода обнаружения вирусной инфекции получена панель моноклональных высокоаффинных антител к VP7. В качестве иммуногенов использовали экспрессированный в E. coli N-концевой фрагмент VP7 и инактивированные вирусные частицы. Полученные моноклональные антитела применимы для выявления вируса в зараженных клетках. В качестве видоспецифического антигена создан рекомбинантный белок TrxA‑VP7_а, который содержит пространственные эпитопы, подобные таковым в составе нативного вирусного антигена. С его помощью отобраны перспективные антитела для проведения диагностики заболевания конкурентным иммуноферментным анализом, позволяющим выявлять специфические антитела к вирусу блютанга в сыворотках инфицированных животных. Методом конкурентного твердофазного ИФА показано, что наиболее эффективно взаимодействующие с белком TrxA‑VP7_а антитела (Bt14, Bt15, Bt18, Bt26, Bt33, Bt34 и Bt35) узнают близкие или перекрывающиеся эпитопы VP7. Взаимодействие с антигеном практически всех полученных антител ингибировалось референтными специфическими сыворотками против вируса блютанга 24-х серотипов. Моноклональное антитело Bt14 демонстрировало максимальную способность блокировать взаимодействие VP7 со специфическими сыворотками против 24-х серотипов вируса блютанга. Таким образом, полученная панель моноклональных антител к VP7 вируса блютанга может быть использована для обнаружения вирусной инфекции, а также в качестве компонента наборов для серологической диагностики болезни.
ВВЕДЕНИЕ
Блютанг (катаральная лихорадка овец) – вирусная трансмиссивная инфекция домашних и диких жвачных животных. Ее распространение приводит к большим экономическим потерям. Блютанг включен Всемирной организацией по охране здоровья животных (до 2003 г. МЭБ – Международное эпизоотическое бюро) в перечень болезней, подлежащих регистрации. Возбудитель блютанга – РНК-содержащий вирус BTV, который относится к роду Orbivirus семейства Reoviridae. Геном вируса представлен двухцепочечной РНК длиной 19 × 103 п.о., состоящей из 10 сегментов. Он кодирует семь структурных белков (VP1–VP7) и четыре неструктурных белка (NS1, NS2, NS3 и NS4) [1–6].
Важной эпизоотологической особенностью блютанга, значительно усложняющей борьбу с болезнью, является способность вируса формировать природные очаги даже при однократном его заносе на определенную территорию. Это обусловлено вовлеченностью в инфекционный процесс насекомых и большого числа восприимчивых животных, в том числе и диких [7, 8].
Актуальность изучения блютанга для Российской Федерации значительно возросла с 2006 г. – начала импорта племенного крупного рогатого скота из стран Европейского Союза, в том числе из неблагополучных по блютангу государств – Германии, Голландии и др. [2, 9, 10]. В 2018 г. в 9 европейских странах (Германия, Испания, Греция, Италия, Швейцария, Албания, Франция, Португалия, Кипр) были отмечены вспышки болезни, вызванные семью различными серотипами вируса. Кроме того, в последние десятилетия наблюдается тенденция к расширению ареалов трансмиссивных инфекций, в том числе и блютанга, что делает актуальными вопрос изучения возбудителей данных болезней, а также разработку и совершенствование методов их диагностики.
В настоящее время для обнаружения BTV у животных используются молекулярно-биологические и иммунохимические методы. Молекулярно-биологические методы выявляют присутствие соответствующей вирусной нуклеиновой кислоты и самого вируса. Иммунохимические методы позволяют обнаружить не только вирус, но и специфические антитела к вирусным белкам в крови, как больного, так и переболевшего животного. Белок VP7 является наиболее часто используемой мишенью для серологических тестов, используемых для диагностики блютанга. VP7 является группоспецифическим антигеном, т.е. проявляет высокую степень перекрестных реакций в серологических исследованиях между различными штаммами BTV (независимо от серотипа или топотипа). В тоже время, в серологических реакциях с другими видами рода Orbivirus BTV не имеет перекрестных взаимодействий [11, 12]. Антитела против BTV могут быть обнаружены с помощью конкурентного ИФА с антителами к VP7. Этот быстрый метод позволяет выявлять антитела к вирусу в сыворотке или плазме крови уже на шестой день после инфицирования [13, 14].
Для изучения свойств возбудителей различных заболеваний и разработки методов их количественной детекции иммунохимическими методами широко применяются моноклональные антитела (мкАТ), как высокоспецифичные, направленные к одной антигенной детерминанте, биологически гомогенные, стабильные по специфичности и авидности [15]. Бессимптомное течение блютанга у крупного рогатого скота требует улучшения способов диагностики заболевания. Конкурентный ИФА на основе мкАТ является эффективным инструментом для крупномасштабного скрининга поголовья скота. Целью данной работы явилось получение и характеристика мкАТ к VP7 BTV, изучение их способности выявлять вирусные антигены в инфицированных клетках, а также специфические антитела в крови животных.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение мкАТ и их иммунохимическая характеристика. Поверхностный слой кора вирусной частицы BTV состоит из 780 копий белка VP7 (260 тримеров VP7), прикрепленного к наружной поверхности субкоровой оболочки и кодируемого 7-ым сегментом. 7-ой сегмент – третий наиболее вариабельный сегмент генома BTV после 2-го и 6-го [16]. Для получения мкАТ к VP7 BTV была разработана схема иммунизации, предполагающая развитие иммунного ответа, максимально направленного на поверхностные эпитопы VP7 в составе вириона. На поверхности интактных вирионов и коровых частиц вируса экспонированы эпитопы, расположенные вблизи N-конца белка VP7 [17]. Животных иммунизировали последовательно рекомбинантным белком VP7_a и инактивированным BTV первого серотипа, экстрагированным фреоном [18]. Белок VP7_a соответствует участку 114–257 а.о. белка VP7 и не содержит в своем составе дополнительных фрагментов, на которые теоретически могут быть получены мкАТ. Препарат вируса, экстрагированный фреоном, представляет собой цельные вирусные частицы, лишенные инфекционности и сохраняющие иммунохимические свойства поверхностных белков. Использование этих антигенов позволило предположить, что основная масса полученных мкАТ будет направлена против поверхностных антигенных детерминант BTV.
Относительное содержание антител в сыворотке крови иммунизированных животных (титр) составило 1/512 000. Титр определяли по взаимодействию сывороточных антител с инактивированным BTV, иммобилизированным на планшеты для ИФА. Титр сыворотки при взаимодействии с лизатом клеток почек сайги (ПС), которые использовали для культивирования вируса, составлял 1/16 000. Поэтому в ходе дальнейшего отбора гибридомных клонов, клонирований и культивирования гибридом, секретирующих мкАТ, проводили параллельный скрининг надклеточных супернатантов на предмет неспецифического взаимодействия с лизатом клеток ПС. В дальнейшей работе использовали только клоны, надклеточные супернатанты которых не взаимодействовали с лизатом клеток ПС.
Гибридные клетки получали путем слияния спленоцитов мыши и клеток миеломы с помощью раствора полиэтиленгликоля по методу Köhler и Milstein [19]. В результате получено 27 гибридомных клеточных линий, секретирующих мкАТ к VP7. Проведена иммунохимическая характеристика полученных антител. Типы легких и тяжелых цепей, составляющие антитела, и константы аффинности мкАТ, характеризующие эффективность их взаимодействия с инактивированным BTV (экстракция фреоном), представлены в табл. 1. Все полученные антитела принадлежат к классу G, имеют в своем составе легкую цепь κ. Значения констант аффинности лежат в диапазоне от 0.7 × 109 до 6.3 × 109 М–1, что свидетельствует о высоком сродстве полученных мкАТ по отношению к поверхностным антигенам цельного BTV.
Таблица 1.
Иммунохимическая характеристика моноклональных антител (мкАТ) против VP7
| № | мкАТ | Тип тяжелой (легкой) цепи | Кафф, ×109 М–1 |
№ | мкАТ | Тип тяжелой (легкой) цепи | Кафф, ×109 М–1 |
|---|---|---|---|---|---|---|---|
| 1 | Bt3 | IgG2a(κ) | 1.85 | 15 | Bt22 | IgG2a(κ) | 4.8 |
| 2 | Bt4 | IgG1(κ) | 1.32 | 16 | Bt23 | IgG2a(κ) | 3.8 |
| 3 | Bt5 | IgG1(κ) | 0.7 | 17 | Bt24 | IgG2b(κ) | 3.4 |
| 4 | Bt8 | IgG2a(κ) | 1.1 | 18 | Bt25 | IgG1(κ) | 6.3 |
| 5 | Bt9 | IgG2a(κ) | 5.7 | 19 | Bt26 | IgG1(κ) | 1.1 |
| 6 | Bt10 | IgG2b(κ) | 3.1 | 20 | Bt27 | IgG2a(κ) | 1.4 |
| 7 | Bt11 | IgG2a(κ) | 2.7 | 21 | Bt28 | IgG2a(κ) | 1.6 |
| 8 | Bt13 | IgG2a(κ) | 2.8 | 22 | Bt30 | IgG2a(κ) | 2.0 |
| 9 | Bt14 | IgG1(κ) | 1.1 | 23 | Bt31 | IgG1(κ) | 3.5 |
| 10 | Bt15 | IgG1(κ) | 0.37 | 24 | Bt32 | IgG2a(κ) | 2.9 |
| 11 | Bt16 | IgG2a(κ) | 1.9 | 25 | Bt33 | IgG1(κ) | 6.3 |
| 12 | Bt17 | IgG2a(κ) | 2.1 | 26 | Bt34 | IgG2b(κ) | 1.75 |
| 13 | Bt18 | IgG2b(κ) | 5.3 | 27 | Bt35 | IgG2b(κ) | 3.7 |
| 14 | Bt19 | IgG1(κ) | 1.8 |
Взаимодействие мкАТ с антигеном TrxA-VP7_а. Для обнаружения антител к BTV в сыворотках инфицированных животных необходимы как высоко специфические антитела, так и антиген с максимально приближенной к нативной конформацией антигенных детерминант. В качестве такого антигена в данной работе был использован рекомбинантный белок TrxA-VP7_а, который содержит в своем составе фрагменты тиоредоксина и VP7 (114–257 а.о.). Использование лидерной последовательности тиоредоксина в генетической конструкции, кодирующей антиген TrxA-VP7_a, обеспечило высокий уровень экспрессии, хорошую растворимость и способность к формированию максимально приближенной к нативной пространственной структуры фрагмента VP7 [20, 21].
Все полученные мкАТ взаимодействовали с TrxA-VP7_а, однако, мкАТ Bt14, Bt15, Bt18, Bt26, Bt33, Bt35 демонстрировали более эффективное связывание с иммобилизованным антигеном TrxA-VP7_а в сравнении с другими. Поэтому, эти антитела являются перспективными для применения в конкурентном твердофазном ИФА (тИФА) для выявления антител к BTV в образцах сыворотки крови животных.
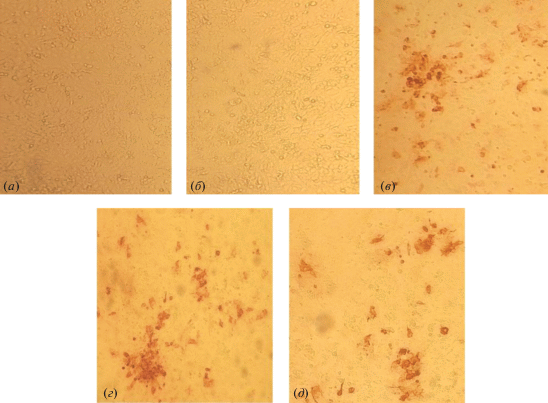
Определение вируса блютанга в зараженных клетках с помощью мкАТ. Была изучена способность мкАТ выявлять BTV в инфицированных клеточных линиях. Все полученные мкАТ эффективно окрашивали клетки, зараженные вирусом. В качестве примера на рис. 1 представлены результаты иммуногистохимического окрашивания зараженных BTV клеток VERO антителами Bt33, Bt3 и Bt10, демонстрирующие эффективное выявление вирусных частиц, в сравнении с интактными клетками. Таким образом, практически все полученные антитела применимы для скрининга зараженных клеток, а в случае анализа животных пригодны для гистохимических исследований опытных образцов.
Рис. 1.
Результаты иммуногистохимического окрашивания методом НГХ-ИФА культуры неинфицированных клеток VERO (а) и культуры клеток VERO, зараженной BTV 1-го серотипа и обработанной AlpA-2 [28] (б); мкАТ Bt33 (в); мкАТ Bt3 (г); мкАТ Bt10 (д). Доза заражения 0.001 ТЦД50/кл, время культивирования после заражения – 96 ч.
Характеристика мкАТ иммуноблотингом, полипептидная специфичность. При анализе полученных мкАТ иммуноблотингом наряду с рекомбинантным антигеном TrxA-VP7_a использовали универсальный инактивированный антиген BTV [22], так как в этом препарате упаковка вирусных белков не идеальна, белки не строго собраны в вирион, что позволяло получать лучшую картину электрофоретического разделения. На рис. 2 показана картина окрашивания полученными мкАТ препаратов рекомбинантного антигена TrxA-VP7_a (рис. 2а) и универсального инактивированного антигена BTV (рис. 2б) после электрофоретического разделения. Результаты иммуноблотинга для большинства антител совпадают при анализе взаимодействия антител с рекомбинантным полипептидом и препаратом вируса. Так, мкАТ Bt11, Bt14, Bt15, Bt18, Bt19, Bt24, Bt25, Bt27, Bt32 Bt33, Bt34, Bt35 окрашивают белковые полосы, соответствующие как рекомбинантному антигену TrxA-VP7_a (расчетная молекулярная масса 35 кДа) (рис. 2а, дорожки 11, 14, 15, 18, 19, 24, 25, 27, 32–35), так и VP7 (39 кДа) в составе вирусного антигена (рис. 2б, дорожки 11, 14, 15, 18, 19, 24, 25, 27, 32–35). По-видимому, эти антитела направлены против линейных антигенных детерминант в TrxA-VP7_a и вирусе блютанга. При этом мкАТ Bt14, Bt15, Bt18, Bt33, Bt34, Bt35 эффективно взаимодействуют с TrxA-VP7_a в тИФА, в котором препараты не подвергаются денатурации. В отличие от вышеперечисленных антител мкАТ Bt5, Bt9, Bt10, Bt16, Bt22, Bt23, Bt26, Bt28, Bt30, Bt31 не окрашивают TrxA-VP7_a (рис. 2а), но окрашивают VP7 в препарате вируса (рис. 2б, дорожки 5, 9, 10, 16, 22, 23, 26, 28, 30 и 31). В этом числе находится и мкАТ Bt26, – одно из наиболее эффективно взаимодействующих с TrxA-VP7_a в тИФА. По-видимому, при денатурации в одинаковых условиях экспонирование эпитопов в составе инактивированного препарата BTV происходит гораздо более эффективно, чем в рекомбинантном антигене TrxA-VP7_a. Также нельзя исключить возможность снижения доступности линейных эпитопов VP7 для взаимодействия с антителами вследствие ренатурации белков в процессе обработок на нитроцеллюлозной мембране.
Рис. 2.
Результаты иммуноблотинга рекомбинантного антигена TrxA-VP7_a (а) и универсального инактивированного антигена BTV (б) с мкАТ Bt3–Bt35, специфичными к VP7 (дорожки 3–35 соответственно). Для анализа использованы концентрации рекомбинантного антигена TrxA-VP7_a 8 мкг на дорожку, универсального инактивированного антигена BTV 38 мкг на дорожку. “К–” отрицательный контроль, нормальная сыворотка мыши; “К+” – положительный контроль, сыворотка мыши против BTV; “К1” – отрицательный контроль, лизат не зараженной культуры клеток (30.5 мкг на дорожку), взаимодействие с сывороткой мыши против BTV; “К2” – отрицательный контроль, лизат не зараженной культуры клеток, взаимодействие с нормальной сывороткой мыши.

Исследование полученных мкАТ в конкурентном тИФА. Для того чтобы выяснить, к одному или к разным эпитопам белка VP7 направлены полученные мкАТ, наиболее эффективно взаимодействующие с антигеномTrxA-VP7_a мкАТ Bt14, Bt15, Bt18, Bt26, Bt33, Bt34 и Bt35 были проверены на способность конкурировать друг с другом в тИФА. Данные реципрокного конкурентного анализа представлены в табл. 2. Bt14 в гораздо большей степени, чем остальные антитела, ингибирует взаимодействие с TrxA-VP7_a мкАТ Bt15, Bt18, Bt26, Bt33, Bt34 и Bt35, конъюгированных с пероксидазой (мкАТ-HRP). Все эти антитела ингибируют взаимодействие Bt14-HRP с TrxA-VP7_a. По-видимому, это свидетельствует о максимальном перекрывании эпитопа VP7, узнаваемого этим антителом, с эпитопами, узнаваемыми другими антителами.
Таблица 2.
Результаты исследования моноклональных антител (мкАТ) в конкурентном тИФА
| Немеченые мкАТ | мкАТ-HRP | ||||||
|---|---|---|---|---|---|---|---|
| Bt14 | Bt15 | Bt18 | Bt26 | Bt33 | Bt34 | Bt35 | |
| Bt14 | 5.7 | 4.6 | 12.0 | 5.0 | 6.0 | 10.0 | 10.0 |
| Bt15 | 27.0 | 17.0 | 100.0 | 15.0 | 42.0 | 100.0 | 51.0 |
| Bt18 | 8.2 | 6.0 | 20.0 | 7.0 | 8.5 | 19.0 | 15.0 |
| Bt26 | 15.0 | 6.0 | 15.7 | 5.3 | 7.9 | 15.0 | 11.0 |
| Bt33 | 17.0 | 12.0 | 57.0 | 13.0 | 17.7 | 56.0 | 29.0 |
| Bt34 | 8.0 | 7.0 | 27.0 | 6.7 | 7.5 | 27.0 | 14.0 |
| Bt35 | 6.0 | 6.5 | 28.0 | 6.5 | 6.8 | 23.0 | 13.0 |
В пересекающихся ячейках указано процентное отношение оптических сигналов, полученных при взаимодействии мкАТ, меченных пероксидазой (мкАТ-HRP), с иммобилизованным рекомбинантным антигеном TrxA-VP7_a в присутствии (S) и в отсутствие (N) конкурирующих исследуемых немеченых антител, найденное по формуле $\frac{S}{N} \times 100\% $. Чем больше полученное отношение, тем меньше конкуренция; при отношении, равном 100 конкуренция отсутствует.
Показано, что мкАТ Bt15 не конкурируют за связывание с эпитопами рекомбинантного антигена TrxA-VP7_a с мечеными мкАТ Bt18-HRP и Bt34-HRP. О несимметричном блокировании связывания антител с TrxA-VP7_a друг другом свидетельствуют значения от 10 до 57% отношения, характеризующего взаимодействие иммобилизованного антигена с мкАТ-HRP в присутствии и в отсутствие конкурирующих немеченых антител. Способность одних немеченых мкАТ конкурировать с другими мкАТ-HRP свидетельствует о перекрывании антигенных детерминант, к которым они направлены.
Специфичность мкАТ по отношению к серотипам BTV. Способность полученных мкАТ выявлять специфические антитела к вирусным частицам в сыворотках животных была показана конкурентным тИФА. Была изучена способность мкАТ-HRP конкурировать за взаимодействие с иммобилизованным антигеном TrxA-VP7_a с поликлональными сыворотками животных, зараженных различными серотипами BTV. Результаты опытов показали, что все мкАТ были способны конкурировать с поликлональными антителами за связывание с VP7, но степень ингибирования различается (табл. 3). Сыворотки всех серотипов не полностью блокируют взаимодействие мкАТ-HRP Bt15; Bt18; Bt26; Bt33; Bt34; Bt35 с TrxA-VP7_a. Референтные сыворотки 2-го и 22-го серотипов в меньшей степени влияют на степень связывания с антигеном. Например, сыворотка 2-го серотипа уменьшает связывание Bt18 только до 63%. Взаимодействие Bt14-HRP с антигеном наиболее эффективно блокируется всеми референтными сыворотками. Сыворотки животных, не содержащие антител к BTV, не конкурируют с мкАТ за связывание с VP7.
Таблица 3.
Анализ моноклональных антител в конкурентном тИФА с серогруппоспецифическими сыворотками
| Референтные специфические сыворотки против BTV 1–24 серотипов | мкАТ-HRP | ||||||
|---|---|---|---|---|---|---|---|
| Bt14 | Bt15 | Bt18 | Bt26 | Bt33 | Bt34 | Bt35 | |
| ssBt1 | 8.4 | 9.6 | 51.0 | 9.8 | 8.0 | 19.2 | 16.3 |
| ssBt2 | 26.7 | 27.8 | 63.0 | 44.3 | 31.0 | 48.2 | 49.1 |
| ssBt3 | 5.4 | 8.0 | 10.0 | 5.1 | 3.9 | 6.9 | 6.9 |
| ssBt4 | 7.5 | 13.2 | 7.70 | 3.7 | 9.6 | 6.6 | 10.3 |
| ssBt5 | 8.7 | 18.1 | 13.0 | 6.2 | 9.8 | 10.9 | 14.2 |
| ssBt6 | 14.7 | 16.7 | 20.0 | 10.8 | 13.7 | 17.1 | 22.9 |
| ssBt7 | 27.5 | 39.3 | 47.0 | 23.5 | 24.5 | 19.0 | 41.9 |
| ssBt8 | 6.7 | 6.9 | 5.6 | 3.5 | 3.4 | 4.3 | 4.1 |
| ssBt9 | 9.6 | 9.0 | 33.0 | 9.6 | 8.8 | 22.8 | 18.3 |
| ssBt10 | 6.4 | 7.7 | 17.0 | 7.4 | 5.3 | 10.9 | 10.1 |
| ssBt11 | 17.3 | 16.5 | 11.0 | 5.8 | 8.0 | 6.7 | 15.2 |
| ssBt12 | 5.0 | 6.7 | 6.0 | 5.5 | 3.6 | 8.2 | 8.2 |
| ssBt13 | 7.4 | 9.6 | 10.0 | 6.2 | 7.9 | 8.0 | 11.0 |
| ssBt14 | 13.5 | 15.6 | 28.0 | 16.2 | 33.0 | 25.7 | 24.0 |
| ssBt15 | 5.4 | 7.4 | 3.0 | 5.2 | 7.5 | 3.3 | 4.2 |
| ssBt16 | 10.5 | 11.1 | 31.0 | 14.0 | 9.5 | 24.1 | 24.2 |
| ssBt17 | 5.4 | 7.5 | 3.0 | 4.5 | 3.1 | 3.7 | 3.8 |
| ssBt18 | 9.5 | 18.4 | 7.0 | 3.9 | 7.3 | 6.1 | 9.6 |
| ssBt19 | 5.1 | 6.5 | 3.0 | 4.4 | 3.7 | 3.7 | 3.6 |
| ssBt20 | 15.5 | 23.1 | 17.0 | 9.2 | 14.0 | 12.9 | 19.0 |
| ssBt21 | 5.1 | 18.9 | 5.0 | 4.7 | 3.4 | 4.8 | 4.4 |
| ssBt22 | 22.9 | 15.2 | 42.0 | 39.2 | 27.1 | 38.0 | 38.6 |
| ssBt23 | 5.3 | 6.5 | 5.0 | 5.5 | 3.0 | 3.7 | 4.6 |
| ssBt24 | 8.5 | 8.8 | 9.0 | 4.7 | 8.7 | 6.7 | 14.5 |
В пересекающихся ячейках указано процентное отношение оптических сигналов, полученных при взаимодействии мкАТ, меченных пероксидазой (мкАТ-HRP) с иммобилизованным рекомбинантным антигеномTrxA-VP7_a в присутствии (S) и в отсутствие (N) референтных специфических сывороток против BTV 1–24 серотипов, найденное по формуле $\frac{S}{N} \times 100\% $.
Таким образом, при использовании в качестве иммуногенов рекомбинантного белка VP7_а, содержащего в своем составе иммуногенный фрагмент VP7 (114–257 а.о.), и инактивированного BTV, преимущественно состоящего из цельных вирусных частиц, получена представительная панель из 27 высоко аффинных мкАТ к VP7 BTV. Рекомбинантный антиген TrxA-VP7_a, содержащий лидерную последовательность тиоредоксина и фрагмент VP7, использовали для анализа гибридомных клонов. Определено, что мкАТ Bt14, Bt15, Bt18, Bt26, Bt33, Bt34 и Bt35 могут быть использованы в конкурентном тИФА для выявления антител к BTV в сыворотке крови инфицированных животных. Показано, что эти мкАТ направлены против близких или перекрывающихся эпитопов антигена, антитела Bt14, Bt15, Bt18, Bt33, Bt34, Bt35 узнают линейные антигенные детерминанты. Показано, что максимальную способность блокировать взаимодействие специфических сывороток против 24-х серотипов BTV с VP7 демонстрирует мкАТ Bt14. Практически все мкАТ из полученной панели способны эффективно выявлять вирус в зараженных клетках.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуры клеток: перевиваемые линии клеток CV-1, VERO и ПС. Культуры клеток получены из музея клеточных штаммов Федерального исследовательского центра вирусологии и микробиологии.
Вирусы и сыворотки: вирус блютанга 1 серотипа (BTV-1) (Spanish pool 1,2 ovine blood, 3 пассажа в культуре клеток CV-1 и 2 пассажа в культуре клеток VERO, титр вируса 6.5 lg ТЦД50/см3) получен из Государственной коллекции микроорганизмов Федерального исследовательского центра вирусологии и микробиологии. Инактивированные препараты BTV: 1) инактивированный BTV получен экстракцией фреоном по методике, описанной в работе [18]; 2) универсальный инактивированный антиген BTV получен по методике согласно патенту [22].
Получение рекомбинантных белков, содержащих фрагмент VP7. Последовательность, кодирующую фрагмент гена vp7 первого серотипа (342–770 п.о.), клонировали в E. coli штамм Rosetta по сайтам узнавания рестриктаз NcoI–NotI, с использованием плазмиды pET28b. Индукцию экспрессии соответствующего рекомбинантного белка VP7_a (фрагмент 114–256 а.о. белка VP7) проводили добавлением IPTG до концентрации 1 мМ при А600 = 0.5–0.6, с последующей инкубацией при 37°C с аэрацией в течение 3 ч. Биомассу клеток отделяли от культуральной жидкости центрифугированием при 3000 g и 4°C в течение 20 мин, бактериальные клетки суспендировали в буфере следующего состава 50 мМ NaH2PO4 ⋅ 2H2O, 300 мМ NaCl, 10 мМ имидазол, pH 8.0 и разрушали с помощью ультразвукового дезинтегратора (Cole Parmer Ultrasonic processor, США) в течение 3 мин в импульсном режиме по 5 с с такими же интервалами при температуре 4°С. Бактериальный лизат осветляли центрифугированием при 12 000 g, 4°C в течение 20 мин и наносили на колонку с Ni-NTA-агарозой; колонку промывали аналогичным буфером, содержащим 20 мМ имидазол; рекомбинантный белок элюировали буфером, содержащим 250 мМ имидазол.
Рекомбинантный химерный белок TrxA-VP7_a в дополнение к фрагменту VP7_a содержит в N‑концевой области последовательность тиоредоксина А. Размер гена, кодирующего trxA-vp7_a, – 936 п.о., молекулярная масса соответствующего белка ~35 кДа. Экспрессию химерного белка проводили в клетках E. сoli штамма KRX (Promega, США) под контролем промотора фага T7 в составе вектора pET32a (Invitrogen, США). Индукцию экспрессии и очистку белка TrxA-VP7_a проводили аналогично выделению белка VP7_a.
Непрямой твердофазный ИФА (тИФА) Антигены (экстрагированный фреоном инактивированный BTV и лизат клеток ПС) сорбировали в лунках планшетов для ИФА в объеме 100 мкл 0.05 М карбонатного буфера (рН 9.6) из раствора с концентрацией белка 1 мкг/мл. Сорбцию проводили в течение ночи при 4°C. Свободные центры связывания иммунопланшета блокировали 1% (w/v) раствором желатина в PBS (3 мМ KCl, 1 мМ KH2PO4, 140 мМ NaCl, 9 мМ Na2HPO4) в течение 30 мин. Затем в лунки планшета вносили исследуемые образцы, содержащие антитела: надклеточные супернатанты, иммунные сыворотки, асцитные жидкости, очищенные мкАТ. Образцы предварительно разводили PBST (PBS, содержащий 0.1% Tween 20). Гипериммунная к BTV мышиная сыворотка и сыворотка не иммунной мыши служили, соответственно, положительным и отрицательным контролями. Инкубацию с антигеном проводили в течение 1 ч при 37°C.
Далее планшеты отмывали PBST, добавляли конъюгат кроличьих антител против иммуноглобулинов мыши с пероксидазой хрена в рабочем разведении в PBST, инкубировали 40 мин. Для детекции использовали 4 мМ раствор орто-фенилендиамина в цитрат-фосфатном буфере (26 мМ лимонная кислота, 50 мМ Na2HPO4, рН 5.0), содержащем 0.003% (v/v) Н2О2. После развития окраски реакцию останавливали добавлением равного объема 10% (v/v) серной кислоты и определяли оптическое поглощение при 490 нм (А490) с помощью мультипланшетого ридера Anthos 2020.
Получение моноклональных антител. Мышей линии BALB/c (возраст 8–12 недель) иммунизировали подкожно и внутрибрюшинно. Инъекции проводили с интервалом в 2 недели. Первые три иммунизации проводили рекомбинантным белком VP7_a в количестве 10 мкг на одно животное. Первую иммунизацию проводили в полном адъюванте Фрейнда, две последующие – в неполном. Перед инъекцией раствор антигена в PBS эмульгировали c равным объемом адъюванта. Далее животных иммунизировали три раза препаратом инактивированного BTV первого серотипа, экстрагированного фреоном [18] (100 мкг на мышь) в PBS. Относительное содержание антител в сыворотке крови иммунных животных (титр) определяли по взаимодействию сывороточных антител с иммобилизованными на планшеты для ИФА инактивированным BTV, экстрагированным фреоном. Через 3 дня после последней (бустерной) инъекции у мыши стерильно извлекали селезенку, гомогенизировали и смешивали спленоциты с клетками мышиной миеломной линии SP2/0, которые предварительно культивировали в среде DMEM (Dulbecco’s Modified Eagle Medium), содержащей 5% (v/v) эмбриональной телячьей сыворотки (FCS). Гибридные клетки получали путем слияния спленоцитов мыши и клеток миеломы с помощью раствора полиэтиленгликоля (50%, w/v) по методу Köhler и Milstein [19], после чего клетки в среде DMEM, содержащей 20% (v/v) FCS, НАТ (0.1 мM гипоксантин, 0.4 мкМ аминоптерин, 16 мкМ тимидин), переносили в 96-луночные культуральные планшеты. В планшеты за сутки до слияния клеток помещали макрофаги из перитонеальной полости мышей для создания фидерного слоя. Гибридные клоны выращивали во влажной атмосфере с 5% СО2 при 37°С. Рост клонов контролировали визуально под микроскопом. Из лунок с выросшими клонами на 7–9-й день отбирали культуральную жидкость и проверяли наличие в ней специфических антител, взаимодействующих с вирусными частицами, методом непрямого тИФА. При положительном ответе клетки отбирали, наращивали и дважды клонировали методом лимитирующих разведений в среде DMEM, содержащей 20% FCS.
Наработка и выделение моноклональных антител. мкАТ выделяли аффинной хроматографией на белок А-сефарозе [23] из культуральных жидкостей гибридом, секретирующих мкАТ. Антиген-связывающую активность полученных препаратов мкАТ оценивали непрямым тИФА по взаимодействию с иммобилизованным на пластик инактивированным BTV, экстрагированным фреоном.
Определение концентрации белков. Концентрации белков в препаратах BTV и лизатах клеток интактной культуры измеряли по методу Бредфорд [24], концентрацию иммуноглобулинов ‒ по поглощению при 280 нм [25].
Определение констант аффинности моноклональных антител. Константы аффинности вычисляли по методу Битти [26], используя неконкурентный тИФА. Используя серийные разведения как антигена (инактивированного BTV, экстрагированного фреоном), иммобилизованного на иммунопланшете, так и вносимых мкАТ, проводили инкубацию с конъюгатом кроличьих антимышиных антител и пероксидазы хрена, фотометрически измеряли концентрацию продукта энзиматического окисления субстрата (OPD) и строили графики зависимости А490 от концентрации мкАТ в логарифмических координатах. Сигмоидный характер кривой позволял определить А490 при насыщающей концентрации антител и А490 – в “точке перегиба” кривой. По полученным графикам определяли концентрации мкАТ [мкАТ'] и [мкАТ] в точке перегиба, которые соответствовали концентрациям антигена [Ag'] и [Ag], сорбированного на иммунопланшет. При условии, что [Ag'] = [Ag]/2, Kафф = 1/2(2[мкАТ'] – [ мкАТ]).
Конкурентный тИФА. Предварительно готовили конъюгированные с пероксидазой мкАТ (мкАТ-HRP), используя метод окисления периодатом натрия, как описано Wilson and Nakane [27]. В лунки ИФА-планшетов, предварительно сенсибилизированных антигеном TrxA-VP7_a (8 мкг/мл), вносили очищенные мкАТ в концентрациях, уменьшающихся от 100 до 0.7 мкг/мл, и инкубировали 1 ч при 37°С. Затем вносили мкАТ-HRP в разведениях, подобранных в ходе предварительных экспериментов, которые позволяли при взаимодействии с TrxA-VP7_a в отсутствие конкурирующих мкАТ, получать оптическое поглощение (А490) в диапазоне от 1 до 1.5. Визуализацию сигналов проводили так же, как и в непрямом тИФА. Для каждой экспериментальной точки рассчитывали степень взаимодействия мкАТ-HRP с иммобилизованным TrxA-VP7_a в присутствии конкурирующих антител как процентное отношение S от N (S – А490 в лунке, куда были добавлены конкурирующие антитела, N – А490 в лунке без добавления конкурирующих антител).
Аналогичную методику использовали для выяснения способности мкАТ-HRP конкурировать с антителами из сывороток инфицированных животных за связывание с VP7. Для этого использовали специфические сыворотки крови против 24-х серотипов BTV в разведении 1 : 2. Оценку результатов также проводили, вычисляя процентное отношение S от N, где S – А490 в лунке, куда были добавлены сероспецифические сыворотки, N – А490 в лунке без их добавления.
Непрямой гистохимическиий иммуноферментный анализ (НГХ-ИФА). Тест-планшеты для определения активности мкАТ методом НГХ-ИФА готовили следующим образом: заражали BTV культуру клеток VERO, выращенную в лунках 96-и луночных планшетов в течение 1–2-х суток в ростовой среде Игла, содержащей 10% FCS, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2.5 ед./мл амфотерицина В. Вирус вносили в лунки планшетов в дозе заражения 0.001 ТЦД50/кл в 100 мкл среды Игла с указанными антибиотиками. Клетки инкубировали при 37°С в атмосфере 95% влажности и 5% СО2 в течение 96 ч. Среду культивирования из лунок удаляли, клеточный монослой двукратно промывали PBS, фиксировали 80% (v/v) ацетоном, охлажденным до –20°С. Далее в лунки планшетов вносили последовательные двукратные разведения исследуемых мкАТ и сывороток (нормальной и специфической) в PBS, содержащем 1% бычьего сывороточного альбумина. Планшеты инкубировали в течение 1 ч при 37°С. После трехкратной промывки PBST 20 в лунки добавляли антитела козы против иммуноглобулинов мыши, конъюгированные с пероксидазой в разведении, согласно рекомендации производителя, и инкубировали 1 ч при 37°С. После 3-х кратной отмывки, в лунки планшетов вносили раствор хромогенного субстрата 3,3'-диаминобензидина с 3-амино-9-этилкарбозолом. Реакцию развивали при комнатной температуре в течение 10–15 мин. Учет реакции проводили под световым микроскопом – в цитоплазме клеток в местах локализации иммунных комплексов наблюдали коричневое окрашивание.
Иммуноблотинг. К растворам, содержащим антигены, добавляли равные объемы буфера для нанесения образцов, после чего образцы прогревали при 96°С в течение 5 мин. Электрофоретическое разделение антигенов проводили в 10% полиакриламидном геле c 0.1% SDS. Электроперенос фракционированных полипептидов на нитроцеллюлозную мембрану осуществляли полусухим методом TransBlot Turbo system (BioRad) согласно инструкции. Далее проводили блокирование мембраны 1% раствором желатина в PBST в течение 30 мин при комнатной температуре на шейкере, вносили мкАТ и контрольные сыворотки, разведенные в PBST, инкубировали в течение ночи при 4–8°С. Рабочие концентрации мкАТ и контрольных сывороток были подобраны согласно данным НГХ-ИФА по их взаимодействию с фиксированными клетками VERO, зараженными BTV. Большинство антител использовали в концентрации 1 мкг/мл, кроме: Bt3, Bt9, Bt3, Bt10, Bt13, Bt22, Bt23, которые вносили в концентрации 0.3 мкг/мл; Bt5, Bt14, Bt15, Bt25 и Bt28 – 5 мкг/мл. После инкубации с антителами мембраны в течение 1 ч обрабатывали конъюгатом пероксидазы хрена с кроличьими антителами к иммуноглобулинам мыши в рабочем разведении. На каждой стадии нитроцеллюлозные мембраны тщательно не менее трех раз отмывали PBST. Мембрану помещали в субстратную смесь – PBST, 0.001 М 3,3‑диаминобензидин тетрагидрохлорид и 0.5% (v/v) перекись водорода. Выдерживали в данном растворе до появления окрашенных полос. Молекулярные массы полипептидов рассчитывали с помощью маркеров молекулярного веса “Prism Ultra Protein Ladder” (Abcam, США).
Список литературы
Mertens P.P, Diprose J., Maan S., Singh K.P., Attoui H., Samuel A.R. // Vet. Ital. 2004. V. 40. P. 426–437.
Макаров В.В., Шоопала Д., Джупина С.И., Сухарев О.И. // Ветеринария сегодня. 2013. Т. 1. С. 8–10. [Makarov V.V., Shoopala J., Dzupina S.I., Sukharev O.I. // Veterinary Today. 2013. V. 1. P. 8–10.]
Mellor P.S., Baylis M., Peter P.C., Mertens P.P. Bluetongue in the Indian subcontinent // London: Academic Press. 2009. P. 167–196.
Ratinier M., Caporale M., Golder M., Franzoni G., Allan K., Nunes S.F., Armezzani A., Bayoumy A., Rixon F., Shaw A., Palmarini M. // PLoS Pathog. 2011. V. 7. P. 1002477.
Mertens P.P., Brown F., Sangar D.V. // Virology. 1984. V. 135. P. 207–217.
Van Dijk A.A., Huismans H. // J. Gen. Virol. 1988. V. 69 (Pt 3). P. 573–581.
Savini G., Goffredo M., Monaco F., Di Gennaro A., de Santis P., Meiswinkel R., Caporale V. // Vet. Ital. 2004. V. 40. P. 286–291.
Meiswinkel R., Baldet T., De Deken R., Takken W., Delécolle J.C., Mellor P.S. // Prev. Vet. Med. 2008. V. 87. P. 55–63.
Захаров В.М. // Ветеринария. 2009. № 5. С. 3–5. [Zakharov V.M. // Veterinariya. 2009. № 5. P. 3–5.]
Макаров В.В., Сухарев О.И., Василевич Ф.И. // Ветеринария. 2014. № 6. С. 18–23.
Hewat E.A., Booth T.F., Wade R.H., Roy P. // J. Struct. Biol. 1992. V. 108. P. 35–48.
Afshar A. // Comp. Immunol. Microbiol. Infect. Dis. 1994. V. 17(3–4). P. 221–242.
Koumbati M., Mangana O., Nomikou K., Mellor P.S., Papadopoulos O. // Veterinary Microbiology. 1999. V. 64. P. 277–285.
Mars M.H., van Maanen C., Vellema P., Kramps J.A., van Rijn P.A. // Veterinary Microbiology. 2010. V. 146. P. 209–214.
Wu X., Liu Q., He J., Zang M., Wang H., Li Y., Tang L. // Monoclon. Antib. Immunodiagn. Immunother. 2015. V. 34. P. 116–121.
Wilson W.C., Ma H.C., Venter E.H., van Djik A.A., Seal B.S. // Virus Res. 2000. V. 67. P. 141–151.
Wang L.F., Hyatt A.D., Whiteley P.L., Andrew M., Li J.K., Eaton B.T. // Arch. Virol. 1996. V. 141. P. 111–123.
Verwoerd D.W., Els H.J., De Villiers E.M., Huismans H. // Journal of Virology. 1972. V. 10. P. 783–794.
Köhler G., Milstein C. // Nature. 1975. V. 256. P. 495–497.
La Vallie E.R., Di Blasio E.A., Kovacic S., Grant K.L., Schendel P.F., McCoy J.M. // Biotechnology (N.Y.) 1993. V. 2. P. 187–193.
Stevens R.C. // Structure. 2000. V. 8. P. 177–185.
Пат. 2352357 РФ, МПК7. A61K 39/12, G01N 33/569. Способ получения универсального инактивированного антигена вируса блютанга для серодиагностики / Балышева В.И., Новикова М.Б. (РФ). № 2007132285/13. Заявлено 28.08.07; Опубл. 20.04.09. Бюл. № 11. 5 с.
Baumgarten H., Franze R. // Monoclonal Antibodies / Eds. Peters J.H., Baumgarten H. Springer-Verlag, 1992. P. 223–233, 264–271.
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248–254.
Hay F.C., Westwood O.M.R. // Practical Immunology (4th ed.). London; Wolverhampton; Blackwell Science, 2002. P. 1–39.
Beatty J.D., Beatty B.G., Vlahos W.G. // Journal of Immunology Methods. 1987. V. 100. P. 173–179.
Wilson M.B., Nakane P.K. // Immunofluorescence and Related Staining Techniques / Eds. Knapp W., Wick G., Holubar K. Amsterdam: Elsevier-Academic Press, 1978. P. 215–224.
Karatovskaya A., Rudenko N., Tsfasman I., Guseva K., Laman A., Boziev K., Brovko F., Vasilyeva N. // Process Biochemistry. 2016. V. 51. P. 1521–1526.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


