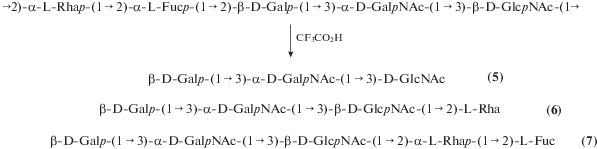Биоорганическая химия, 2019, T. 45, № 6, стр. 576-587
О-специфические полисахариды нового вида энтеробактерий Escherichia albertii, близкородственных E. coli
О. И. Науменко 1, С. Н. Сенченкова 1, Ю. А. Книрель 1, *
1 Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский просп., 47, Россия
* E-mail: yknirel@gmail.com
Поступила в редакцию 29.05.2019
После доработки 01.07.2019
Принята к публикации 18.07.2019
Аннотация
Приведены данные о строении О-специфических полисахаридов (О-антигенов) всех девяти известных молекулярных типов (потенциальных О-серотипов) нового вида энтеробактерий Escherichia albertii – возбудителей кишечных инфекций у людей и птиц. Рассмотрены преимущества и ограничения методов структурного анализа, использовавшихся для установления строения полисахаридов E. albertii. Сравнением с последовательностями в доступных базах данных проведена аннотация генов, входящих в генные кластеры биосинтеза О-антигенов E. albertii. Обсуждаются структурные и генетические взаимосвязи между О-антигенами E. albertii и близкородственного вида E. coli. Найдено, что в дополнение к О-антигену E. albertii O9 экпрессирует маннан, имеющий такое же строение, что и маннан E. coli O8.
ВВЕДЕНИЕ
Обзор посвящен О-специфическим полисахаридам (ОПС), или в биологичском контексте О‑антигенам, недавно открытого важного в медицинском отношении вида энтеробактерий – Escherichia albertii. ОПС представляет собой полисахаридную цепь липополисахарида, расположенного на поверхности клетки грамотрицательных бактерий. Его тонкая структура определяет специфичность иммунного ответа организма-хозяина на бактериальную инфекцию, а широкое структурное разнообразие ОПС позволяет бактериям избегать защитного действия механизма адаптивного иммунитета.
Вид E. albertii получил свое название в честь бангладешского микробиолога Джона Альберта (M. John Albert).11 Бактерии этого нового вида, близкородственные кишечной палочке (E. coli), являются возбудителями спорадических и эпидемических кишечных инфекций у людей и птиц [1–4]. Впервые штамм E. albertii был выделен от детей с диареей в Бангладеш и определен как штамм Hafnia alvei, но в 2003 году эта ошибка была исправлена [1]. Однако и после этого штаммы E. albertii продолжали ошибочно идентифицировать как E. coli, H. alvei и другие бактерии в связи с отсутствием описания их конкретных биохимических характеристик. Вследствие этого распространенность штаммов E. albertii может быть недооценена из-за отсутствия эффективных методов их дискриминации от других членов семейства Enterobacteriaceae.
До последнего времени бактерии E. аlbertii оставались малоизученными и в других аспектах. В частности, отсутствовала их классификация, необходимая для серодиагностики, эпидемиологического мониторинга и выявления источников инфекции. В 2015–2018 гг. геномы около 100 штаммов E. albertii, выделенных из пищевых источников, были секвенированы и на основании различий в генных кластерах О-антигенов (ГКО) разделены на девять молекулярных типов, потенциально отвечающих девяти О-серотипам (O1–O9) ([5]; а также: H. Zheng, Y. Xiong, J. Wang, H. Wang, Q. Li, неопубликованные данные). Последующее установление строения ОПС представителей этих типов подтвердило обоснованность такой классификации. С использованием полученных данных о строении ОПС методами биоинформатики был проведен функциональный анализ генов биосинтеза О-антигенов E. albertii. Полученные в результате этих исследований данные являются предметом настоящего обзора.
СОСТАВ И СТРОЕНИЕ О-СПЕЦИФИЧЕСКИХ ПОЛИСАХАРИДОВ Escherichia albertii
ОПС построены из повторяющихся олигосахаридных единиц (О-звеньев), включающих различные моносахариды и неуглеводные компоненты. В так называемом биологическом О-звене моносахариды расположены в том порядке, в каком они переносятся один за другим при сборке О-звена в процессе биосинтеза ОПС. Как правило, структурный анализ ОПС приводит к установлению строения олигосахаридного звена, которое может совпадать со строением биологического О-звена или отличаться от него пермутацией моносахаридных компонентов. Для выяснения структуры биологического О-звена в последнее время используются генетические данные (см. раздел “ГЕНЕТИКА БИОСИНТЕЗА О-АНТИГЕНОВ E. albertii”). С помощью такой комбинации химического и генетического подходов установлены структуры биологических О-звеньев всех типов E. albertii [6–12], приведенные в табл. 1.
Таблица 1.
Строение О-специфических полисахаридов и состав и организация генных кластеров О-антигенов E. albertii
 |
 |
Заместители, присутствующие в нестехиометрическом количестве, обозначены курсивом. Генам процессинга и гомологам генов путей биосинтеза нуклеотидных предшественников моносахаридов и генов трансфераз с известными функциями даны соответствующие названия; остальные гены обозначены как orf c номером, указывающим их положение в ГКО. Цветовые обозначения: гены синтеза нуклеотидных (UDP, GDP, dTDP, CMP) или ундекапренилдифосфатного (UndPP) предшественников моносахаридов – синим, гены гликозилтрансфераз – зеленым, ген ацетилтрансферазы – фиолетовым, ген глицерофосфотрансферазы – оранжевым, гены процессинга О-антигена (флиппазы wzx и полимеразы wzy) – красным, гены, фланкирующие генный кластер (galF, gnd), и гены с неизвестной функцией – белым. Аналогичные цветовые обозначения имеют кодируемые этими генами трансферазы, показанные на структурах полисахаридов рядом со связями, к которым они отнесены на основании гомологии с депонированными в базах данных аминокислотными последовательностями с предсказанными или экспериментально установленными функциями.
Размер О-звеньев E. albertii варьируется от трех до пяти моносахаридных остатков. Четыре из девяти типов E. albertii имеют линейные ОПС, а ОПС пяти типов являются разветвленными с одним боковым моносахаридным остатком, за исключением О-звена типа О6, в котором присутствуют две боковые гликозильные группы.
Из моносахаридов в ОПС E. albertii наиболее часто встречается D-Glc, D-Gal, D-GlcNAc и D-GalNAc, причем D-Gal является единственным сахаром, который найден не только в пиранозной, как все другие моносахариды, но и в фуранозной форме (в ОПС типов О5 и О7). Компонентами ОПС E. albertii являются также дезоксисахара L-Rha, L‑Fuc и колитоза (3,6-дидезокси-L-ксило-гексоза), дезоксиаминосахара L-QuiNAc и L-RhaNAc, диаминогексуроновые кислоты D-GlcNAm3NAcA и D-ManNAc3NAcA и сиаловая кислота Neu5Ac.
Большинство аминогрупп аминосахаров ацетилированы, но в положении 2 производного диаминоглюкуроновой кислоты в ОПС типа О1 находится ацетамидиновая (N-ацетимидоиламино) группа. ОПС двух типов фосфорилированные. В основной цепи ОПС E. albertii O3 присутствует гликозилфосфат, а в ОПС типа О9 фосфатная группа присоединяет глицерин к остатку галактозы.
Кроме собственно О-антигена – фосфорилированного полисахарида, строение которого приведено в табл. 1, – E. albertii O9 продуцирует маннан, имеющий такую же структуру повторяющегося звена →3)-β-D-Manp-(1→2)-α-D-Manp-(1→2)-α-D-Manp-(1→ (О.И. Науменко, А.С. Шашков, С.Н. Сенченкова, Ю.А. Книрель, неопубликованные данные), что и описанный ранее маннан E. coli O8 [13].
МЕТОДЫ СТРУКТУРНОГО АНАЛИЗА ПОЛИСАХАРИДОВ
Для структурного анализа ОПС получали мягкой кислотной деградацией липополисахаридов, выделенных из бактериальных клеток водно-фенольной экстракцией [14]. В результате расщеплялась кислотолабильная гликозидная связь остатка 3-дезоксиоктулозоновой кислоты, соединяющая углеводную и липидную части липополисахарида. В используемых для деградации условиях (2% СН3СО2Н, 100°С, 2 ч) гликозидные связи моносахаридных компонентов ОПС сохранялись за исключением кислотолабильной связи 3,6-дидезоксигексозы (колитозы), находящейся в боковой цепи ОПС E. albertii O8. Частичное отщепление этого моносахарида привело к нерегулярному полисахариду с нестехиометрическим (~60%) содержанием колитозы [10]. Из липополисахарида типа O9 образовались два полисахарида – ОПС и маннан, которые были разделены гель-проникающей хроматографией на Сефадексе G-50.
Моносахаридный состав ОПС определяли методом ГЖХ ацетилированных полиолов, которые получали из моносахаридов, высвобождавшихся полным кислотным гидролизом ОПС [15]. Этим методом были идентифицированы все моносахаридные компоненты ОПС E. albertii, за исключением 2,3-диамино-2,3-дидезоксигексуроновых кислот, входящих в состав ОПС типа О1, которые не удалось выделить в свободном виде из-за высокой кислотоустойчивости их гликозидных связей. В связи с этим производные диаминогексуроновых кислот идентифицировали с помощью спектроскопии ЯМР без их выделения. Такой же подход использовался для определения колитозы, которая не только присоединена кислотолабильной гликозидной связью, но и сама в значительной степени разрушается в условиях полного кислотного гидролиза.
Строение ОПС E. albertii устанавливали с помощью спектроскопии ЯМР на ядрах 1Н и 13С. Одномерные эксперименты ЯМР позволяли оценить степень регулярности ОПС, определить размер О-звена, природу моносахаридов и неуглеводных компонентов, в случае их присутствия.
Для дальнейшего структурного анализа проводилось отнесение сигналов в спектрах 1H и 13C с помощью двумерной корреляционной спектроскопии ЯМР, включая эксперименты 1Н,1Н COSY, 1H,1Н TOCSY и 1H,13C HSQC. Это открывало путь для определения конфигураций моносахаридов и гликозидных связей на основании констант спин-спинового взаимодействия вицинальных протонов моносахаридных циклов. Двумерные эксперименты 1Н,1Н ROESY или 1H,1H NOESY и 1H,13C HMBC выявляли корреляции между атомами соседних моносахаридных остатков и тем самым положения замещения и последовательность моносахаридов в О-звене. Типы гликозидных связей подтверждали химическими сдвигами 13С-ЯМР на основании известного эффекта – существенного сдвига в слабое поле сигналов связевых атомов углерода. Подробно основные принципы применения двумерной спектроскопии ЯМР для установления строения сложных углеводов рассмотрены в обзоре [16].
В ряде случаев спектроскопия ЯМР имела ограничения, связанные с нерегулярностью структуры полисахарида или совпадением сигналов в спектрах. Для преодоления этих трудностей применялись химические модификаци ОПС. Так, для частично O-ацетилированных ОПС E. albertii O2, O5 и O8 проводилось дезацетилирование в мягких щелочных условиях (12.5% NH4OH, 37°C, 16 ч). Для ОПС типов О2 и О8, содержащих боковые моносахаридные остатки (L-фукозу или колитозу) в нестехиометрическом количестве, применяли распад по Смиту или частичный кислотный гидролиз, соответственно, для удаления этих остатков.
Кислый ОПС E. albertii O9 модифицировали обработкой 48% фтористоводородной кислотой, приводящей к отщеплению глицерофосфатной группы без разрыва гликозидных связей и образованию нейтрального полисахарида.
Эффективный контроль за химическими превращениями осуществляли с помощью спектроскопии ЯМР. Например, рис. 1 показывает, какие изменения происходят в спектре 13С-ЯМР при дезацетилировании нестехиометрически (~70%) О-ацетилированного ОПС типа О5. Сравнение спектров ЯМР исходного и модифицированного полисахаридов использовалось также для подтверждения содержания и первоначального положения удаляемых моносахаридных остатков или неуглеводных заместителей.
Рис. 1.
Спектры 13С-ЯМР ОПС E. albertii О5 (внизу) и полученного из него регулярного О‑дезацетилированного полисахарида (вверху). Сигналы О-ацетилированного остатка Galp в ОПС обозначены курсивом. Цифры соответствуют атомам углерода в моносахаридных остатках, обозначенных буквами: А – GalNAc, В – Galf, С – Galp, D – GlcNAc.

Cтроение ОПС подтверждали избирательным расщеплением с образованием олигосахаридов, для которого использовались частичный кислотный гидролиз и сольволиз трифторуксусной или трифторметансульфоновой (трифликовой) кислотами [17–19].
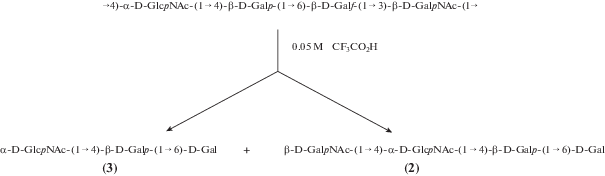
При сольволизе действием CF3CO2H и гидролизе разбавленной кислотой в ОПС E. albertii O5 [9] расщеплялись гликозидные связи остатков β-Galf и β-GalNAc и были получены трисахариды (1) из исходного ОПС или (3) из О-дезацетилированного полисахарида (рис. 2 и 3, соответственно). Кроме того, образовались продукты разрыва только одной из этих лабильных связей, причем сольволиз и гидролиз вызывали преимущественное расщепление разных связей, давая тетрасахариды (2) или (4) с остатком GalNAc или Gal на восстанавливающем конце (рис. 2 и 3, соответственно). Отметим, что сольволиз не затрагивал О‑ацетильные группы, присутствующие в ОПС.
Сольволиз ОПС E. albertii О4 [8] трифторуксусной кислотой привел к набору олигосахаридов (5)–(7) от трисахарида до пентасахарида, в результате разрыва одной или нескольких гликозидных связей остатков α-Fuc, α-Rha и β-GlcNAc (рис. 4). Эти олигосахариды боргидридным восстановлением превращали в соответствующие олигозилполиолы, более удобные для хроматографического выделения и ЯМР-спектроскопического анализа.
ОПС E. albertii О1 был устойчив к действию трифторуксусной кислоты, и для его избирательного расщепления использовалась трифликовая кислота. Как и ожидалось, при сольволизе CF3S-O3H разрывалась только связь α-GlcNAc и образовался трисахарид (8), соответствующий О‑звену ОПС (рис. 5) (О.И. Науменко, А.С. Шашков, Ю.А. Книрель, неопубликованные данные).
Строение полученных олигосахаридов устанавливали с помощью спектроскопии ЯМР и масс-спектрометрии высокого разрешения с ионизацией электрораспылением. При этом для кислого трисахарида (8) из ОПС E. albertii О1 регистрировали отрицательные ионы, а для нейтральных олигосахаридов, полученных из других ОПС, − положительные ионы.
ГЕНЕТИКА БИОСИНТЕЗА О-АНТИГЕНОВ E. albertii
У большинства грамотрицательных бактерий, включая E. albertii, синтез ОПС протекает по Wzx/Wzy-зависимому пути [20], который инициируется переносом гликозилфосфата D-GlcNAc-1-P из нуклеотидного производного UDP-D-GlcNAc на липидный носитель – ундекапренилфосфат (UndP) – при участии белка WecA. У бактерий, у которых первым моносахаридом О-звена является D-GalNAс (например, у E. albertii О5, О7 и О8), образующийся гликофосфолипид UndPP-D-GlcNAc превращается в UndPP-D-GalNAc с помошью 4-эпимеразы Gnu [21].
Последующая сборка олигосахаридного О-звена происходит путем последовательного переноса моносахаридов или гликозилфосфатов из соответствующих нуклеотид-активированных производных на UndPP-связанный аминосахар при участии специфических гликозилтрансфераз. Затем готовое О-звено, присоединенное к фосфолипиду Und-PP, переносится через внутреннюю мембрану с помощью транслоказы (флиппазы) Wzx, и заканчивается синтез ОПС полимеризацией О-звена О‑антигенполимеразой Wzy при участии регулятора Wzz, обеспечивающего модальное распределение длин полисахаридной цепи. В некоторых случаях имеет место постполимеризационная модификация ОПС, такая как, например, О-ацетилирование. После завершения синтеза ОПС переносится на олигосахаридный кор, присоединенный к липидной части (так называемому липиду А), и полученный липополисахарид экспортируется на внешнюю мембрану клеточной оболочки.
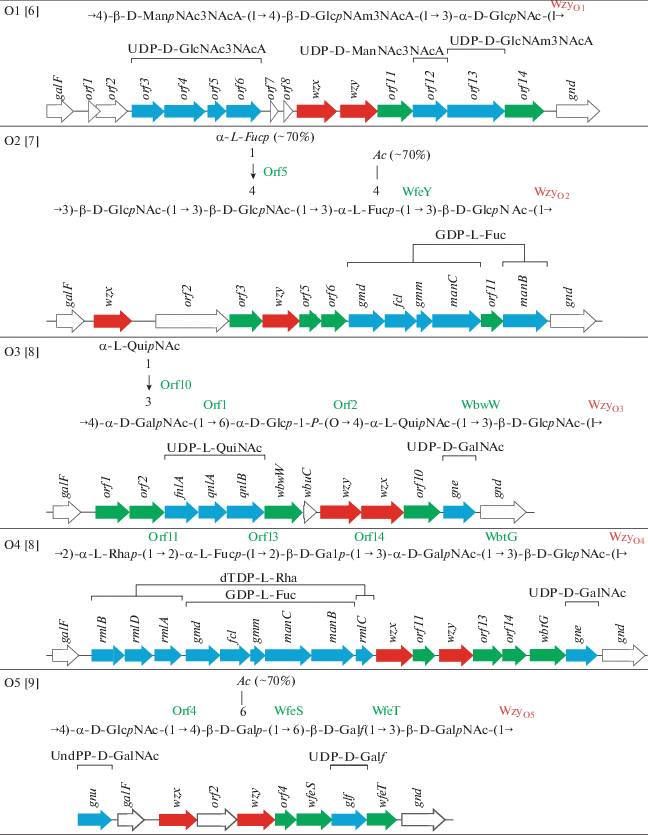
Большинство генов (открытых рамок считывания orf), участвующих в биосинтезе ОПС, организованы в генный кластер О-антигена (ГКО). У E. albertii он фланкирован консервативными генами galF и gnd и включает от 7 до 16 функциональных генов, имеющих одинаковое направление считывания от galF к gnd (табл. 1). Секвенирование ГКО всех типов E. albertii и аннотация входящих в них генов показали, что по своему составу и организации ГКО так же уникальны, как структуры ОПС этих бактерий.
В ГКО присутствуют гены синтеза нуклеотидных предшественников специфических моносахаридных компонентов ОПС и гены необходимого числа гликозилтрансфераз (на одну меньше, чем число моносахаридов в О-звене) (табл. 1). Большинство генов гликозилтрансфераз E. albertii отнесены к определенным гликозидным связям (табл. 1) путем сравнения с генами, кодирующими белки с известными функциями, которые депонированы в базе данных GenBank.
ГКО всех типов включают также гены процесинга wzx и wzy, а в генном кластере маннана E. albertii O9 вместо них присутствуют гены wzm и wzt (см. рис. 8 в следующем разделе), осуществляющие полимеризацию по альтернативному Wzm/Wzt-зависимому пути, который характерен для гомополисахаридов. Он заключается в наращивании полисахаридной цепи путем переноса моносахаридных остатков (в данном случае остатков маннозы) одного за другим без предварительной сборки олигосахаридного звена [20].
Кроме того, ГКО некоторых типов E. albertii содержат гены, кодирующие интегразы, транспозазы и другие белки с невыясненной ролью в синтезе ОПС.
Как это типично для грамотрицательных бактерий, предшественники D-Glcp, D-Galp и D-GlcNAc синтезируются генами “домашнего хозяйства”, расположенными вне ГКО E. albertii. В другом месте генома находится также ген wecA, необходимый для синтеза UndPP-D-GlcNAc. Ген gnu для синтеза UndPP-D-GalNAc из UndPP-D-GlсNAc, как и в геномах бактерий E. coli, находится вне ГКО рядом с геном galF (табл. 1), и его присутствие указывает на то, что первым моносахаридом О-звена является D-GalNAc.
ГКО E. albertii О3 и O9, в состав ОПС которых входят α-D-глюкозилфосфат или глицерофосфат, включают гены orf2 и orf3, кодирующие гликозилфосфотрансферазу и глицерофосфотрансферазу, соответственно. В ГКО E. albertii О8 присутствует ген ацетилтрансферазы wbsI для O-ацетилирования остатка D-галактозы, тогда как у бактерий E. albertii О2 и О5, ОПС которых также содержат О-ацетильные группы, гены ацетилтрансфераз в ГКО не обнаружены, и, следовательно, они находятся в другом месте генома.
Пути биосинтеза большинства нуклеотидных предшественников специфических моносахаридных компонентов ОПС E. albertii известны [22–27], и соответствующие гены присутствуют в ГКО (табл. 1). К таким нуклеотид-активированным моносахаридам относятся UDP-D-Galf (типы О5 и О7), UDP-D-GalNAc (O4 и O8), UDP-L-QuiNAc (O3), UDP-L-RhaNAc (O6), UDP-D-ManNAc3NAcA (O1), dTDP-L-Rha (O4), GDP-L-Fuc (O2, O4 и O8), GDP-Col (O8) и CMP-Neu5Ac (O7). Для каждого пути в ГКО присутствуют от одного гена (UDP-D-Galf, UDP-D-GalNAc) до шести генов (GDP-Col).
Путь биосинтеза нуклеотидного предшественника диаминоуроновой кислоты D-GlcNAm3NAcA, являющейся уникальным компонентом ОПС E. albertii О7, не установлен. Предположительно этот моносахарид активируется в виде UDP-производного, которое образуется из UDP-D-GlcNAc3NAcA, являющейся также предшественником UDP-D-ManNAc3NAcA – другого компонента этого ОПС. Очевидно в процессе участвует аминотрансфераза Orf13, которая превращает 2‑N-ацетильную группу остатка D-GlcNAc3NAcA в 2-N-ацетимидоильную.
Особенность ГКО E. albertii O9 – отсутствие генов биосинтеза нуклеотидного предшественника D-маннозы, входящей в состав ОПС, тогда как обычно у эшерихий и родственных бактерий, использующих GDP-D-Man для синтеза маннозосодержащих ОПС, два из трех необходимых генов (manB и manС) находятся в ГКО. Эти гены обнаружены в геноме бактерий типа О9 в генном кластере маннана, расположенном рядом с ГКО по направлению считывания (см. рис. 8 в следующем разделе), и в ГКО не дублируются.
СТРУКТУРНОЕ И ГЕНЕТИЧЕСКОЕ РОДСТВО ПОЛИСАХАРИДОВ E. albertii И E. coli
В то время как ОПС большинства типов E. albertii отличаются уникальными структурами и ГКО не только внутри вида, но и внутри рода эшерихий, ОПС типов O3 и O6-O8 имеют выраженные структурные и генетические взаимосвязи с ОПС E. соli.
Так, ОПС E. albertii О6 и E. соli О3 характеризуются идентичным строением, а ОПС E. albertii О3 отличаются от E. соli О181 только отсутствием О-ацетильной группы в положении 6 остатка GalNAc [8]. В ГКО обеих пар бактерий присутствуют гомологи одних и тех же генов, расположенных в одинаковом порядке (у E. соli О181 ген ацетилтрансферазы очевидно находится вне ГКО).
E. albertii О7 имеет такое же строение трисахаридной линейной части О-звена что и E. соli О124 и О164, и такой же трисахаридный фрагмент β-D-Galp-(1→6)-α-D-Galf-(1→3)-β-D-GalpNAc присутствует в линейном тетрасахаридном О-звене E. albertii О5 (рис. 6) [8, 9]. Соответственно ГКО этих четырех бактерий имеют гомологичные участки, включающие гены UDP-D-Galp-мутазы glf (для синтеза UDP-D-Galf) и двух гликозилтрансфераз wfeS и wfeT, ответственных за синтез общего трисахаридного фрагмента ОПС.
Рис. 6.
Строение структурно родственных ОПС E. albertii O5 и О7 и E. соli О124 и О164. Rlac обозначает (R)-1-карбоксиэтильную группу (остаток молочной кислоты). Гликозилтрансферазы показаны рядом с гликозидными связями, к которым они относятся.

ОПС E. albertii О8 характеризуется структурным сходством с ОПС E. соli О128 – оба имеют одинаковую основную цепь с повторяющимся тетрасахаридным звеном, но различные боковые моносахаридные заместители (α-Col у первого и α-L-Fuc у второго) [10]. Соответственно, их ГКО имеют высокогомологичные участки, ответственные за сборку О-звена и процессинг О-антигена (гомология генов гликозилтрансфераз, присоединяющих терминальные моносахаридные остатки, и генов процесинга wzx и wzy у этих двух бактерий очевидно обусловлена близким структурным родством α-L-фукозы и α-колитозы, являющейся 3-дезокси-аналогом L-фукозы). С другой стороны, ОПС E. albertii О8 и E. соli О55 имеют общий дисахаридный фрагмент, включающий терминальный остаток α-колитозы (рис. 7). ГКО этих двух бактерий роднит присутствие генов пути биосинтеза колитозы, а также гомологов гена гликозилтрансферазы, ответственной за образование первой гликозидной связи внутри О-звена α‑D-Galp-(1→3)-β-D-GalpNAc.
Рис. 7.
Строение близкородственных ОПС и сравнение ГКО E. albertii О8, E. соli О55 и E. соli О128. Гликозилтрансферазы и ацетилтрансфераза показаны рядом со связями, к которым они относятся. Черным обозначены гены процессинга, темно-серым – гены гликозилтрансфераз, светло-серым – гены синтеза моносахаридных предшественников. Степень идентичности гомологов генов и модулей генов указана между кластерами в процентах.

Рис. 8.
Структура маннана и сравнение генных кластеров О-антигенов и маннана E. albertii О9 и E. соli О8. Черным обозначены гены процессинга, темно-серым – гены гликозилтрансфераз, светло-серым – гены синтеза монсахаридных предшественников. В генном кластере маннана orf5 кодирует метилтрансферазу. Степень идентичности генов и модулей генов указана между кластерами в процентах.
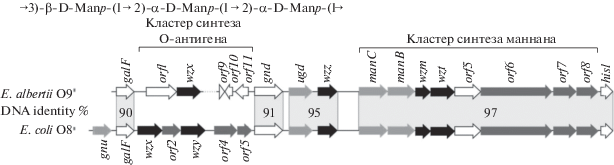
Маннан, второй полисахарид, продуцируемый Е. albertii О9, имеет такую же структуру повторяющегося звена, что и терминированный О-метильной группой маннан, обнаруженный ранее у Е. coli O8 [13]. Генные кластеры биосинтеза маннана у этих двух бактерий имеют одинаковые состав и организацию, и у обеих они находятся рядом с ГКО, расположенным между генами galF и gnd (рис. 8) (H. Zheng, Y. Sun, L. Bai, J. Wang, H. Wang, Q. Li, Y. Xiong, неопубликованные данные).22
ЗАКЛЮЧЕНИЕ
Проведенное исследование О-антигенов E. albertii позволило установить строение ОПС с одной стороны и провести аннотацию входящих в ГКО генов биосинтеза ОПС с другой стороны.
В отличие от ГЖХ ацетилированных полиолов, применяющейся для определения моносахаридного состава уже более 50 лет и ставшей классическим методом химии углеводов, структурный анализ полисахаридов в последние десятилетия претерпел существенные изменения. Так, как и во всех других современных структурных исследованиях полисахаридов, основным методом установления строения ОПС E. albertii была двумерная спектроскопия ЯМР. ОПС, лишенные строгой регулярности вследствие присутствия О-ацетильных группы или боковых моносахаридных заместителей в нестехиометрическом количестве, предварительно превращали в регулярные полисахариды путем удаления этих компонентов.
Для подтверждения установленных структур использовался избирательный сольволиз сильными органическими протонными кислотами с выходом на олигосахаридные фрагменты ОПС. В отличие от специфических методов избирательного расщепления, таких как распад по Смиту, дезаминирование аминосахаров или β-элиминирование из положения 4 уроновых кислот [19], этот подход не предъявляет определенных требований к составу и строению ОПС и может быть применен практически к любому гетерополисахариду. Полученные данные показали, что наименее устойчивы к сольволизу трифторуксусной кислотой гликозидные связи дезоксигексоз и гексофураноз, а также β-связанных N-ацетилгексозаминов, и в целом соответствовали выявленным ранее закономерностям [17, 19]. Связь N-ацетил-α-гексозаминов устойчива к действию этого реагента, и для ее расщепления потребовался более сильный сольволитический агент – трифликовая кислота.
Состав и строение ОПС E. albertii являются типичными для энтеробактерий. Как и для близкородственных микроорганизмов E. coli, для них характерны так называемые общие сахара D-Glc, D-Gal и D-GlcNAc, а также D-GalNAc. Один из этих аминосахаров является первым моносахаридом биологического О-звена, с переноса которого на липидный носитель начинается биосинтез ОПС. Большинство специфических компонентов ОПС E. albertii также были найдены в ОПС различных серотипов E. coli, за исключением производных 2,3-диамино-2,3-дидезоксигексурновых кислот, присутствие которых сближает ОПС E. albertii О1 с ОПС ряда О-серотипов Pseudomonas aeruginosa [33]. Как правило, один из специфических компонентов ОПС расположен в терминальном положении последнего О-звена и благодаря своей пространственной доступности вносит наибольший вклад в специфичность иммунного ответа на бактериальную инфекцию.
Как у E. coli и родственных энтеробактерий (Salmonella enterica, Citrobacter spp. и ряда других), ГКО E. albertii расположен в хромосоме между консервативными генами galF и gnd. В него входят большинство генов, участвующих в биосинтезе ОПС, и генный состав ГКО хорошо согласуется с установленными структурами ОПС всех типов E. albertii. Типичным для энтеробактерий является отсутствие в ГКО гена wecA для синтеза UndPP-D-GlcNAc, который находится в генном кластере биосинтеза общего энтеробактериального антигена и в ГКО не дублируются. В отличие от ГКО E. albertii O8, в ГКО E. albertii O2 и О5 не обнаружены гены ацетилтрансфераз. Вероятнее всего они расположены вне ГКО в профагах, модифицирующих ОПС штамма-хозяина. Предполагаемая биологическая роль таких модификаций заключается в подаче сигнала другим фаговым частицам, специфически узнающим ОПС на бактериальной поверхности, что данная клетка уже инфицирована бактериофагом.
Кроме общих особенностей строения ОПС и организации ГКО E. albertii и E. соli, между отдельными штаммами этих бактерий наблюдается более близкое О-антигенное родство. Для одних штаммов это одинаковые структуры ОПС и высокогомологичные ГКО (E. albertii О3/E. соli О181, E. albertii О6/E. соli О3), для других – фрагменты структуры ОПС и соответствующие модули генов в ГКО (E. albertii О5 и О7/E. coli О124 и О164, E. albertii О8/E. coli О55 и О28). Такое сходство указывает на происхождение ГКО от общего предка или горизонтальный перенос ГКО в первом случае и на рекомбинацию ГКО двух бактерий во втором случае.
Особенностью E. albertii О9 является экспрессия двух полисахаридов, один из которых является собственно ОПС, кодируемым ГКО, а второй – маннаном, генный кластер которого расположен рядом с ГКО. Маннан с такой же структурой, кодируемый таким же генным кластером, был ранее обнаружен у E. coli О8 [13]. Как и ГКО штаммов E. albertii и E. coli с одинаковыми ОПС, генный кластер биосинтеза маннана очевидно был приобретен одной бактерией от другой путем горизонтального переноса.
Обобщенные в настоящем обзоре данные по структуре и генетике ОПС создают молекулярную основу для классификации штаммов E. albertii. Они имеют также практическое значение, открывая возможность экспресс-диагностики инфекционных заболеваний с помощью полимеразной цепной реакции, удобной мишенью для которой являются высокоспецифичные гены биосинтеза О-антигенов.
Список литературы
Inglis T.J., Merritt A.J., Bzdyl N., Lansley S., Urosevic M.N. // New Microbes New Infect. 2015. V. 8. P. 171–173.
Wang H., Zheng H., Li Q., Xu Y., Wang J., Du P., Li X., Liu X., Zhang L., Zou N., Yan G., Zhang Z., Jing H., Xu J., Xiong Y. // Front. Microbiol. 2017. V. 8. Article 1857.
Huys G., Cnockaert M., Janda J.M., Swings J. // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 807–810.
Asoshima N., Matsuda M., Shigemura K., Honda M., Yoshida H., Hiwaki H., Ogata K., Oda T. // Jpn. J. Infect. Dis. 2014 V. 67. P. 139–140.
Ooka T., Ogura Y., Katsura K., Seto K., Kobayashi H., Kawano K., Tokuoka E., Furukawa M., Harada S., Yoshino S., Seto J., Ikeda T., Yamaguchi K., Murase K., Gotoh Y., Imuta N., Nishi J., Gomes T. A., Beutin L., Hayashi T. // Genome Biol. Evol. 2015. V. 7. P. 3170–3179.
Zheng H., Shashkov A.S., Xiong Y., Naumenko O.I., Wang H., Senchenkova S.N., Wang J., Knirel Y.A. // Carbohydr. Res. 2017. V. 446–447. P. 28–31.
Naumenko O.I., Xiong Y., Zheng H., Senchenkova S.N., Wang H., Shashkov A.S., Li Q., Wang J., Knirel Y.A. // Carbohydr. Res. 2018. V. 461. P. 80–84.
Naumenko O.I., Zheng H., Senchenkova S.N., Wang H., Li Q., Shashkov A.S., Wang J., Knirel Y.A., Xiong Y. // Carbohydr. Res. 2017. V. 449. P. 17–22.
Naumenko O.I., Zheng H., Xiong Y., Senchenkova S.N., Wang H., Shashkov A.S., Chizhov A.O., Li Q., Knirel Y.A., Wang J. // Carbohydr. Res. 2018. V. 457. P. 25–31.
Zheng H., Naumenko O.I., Wang H., Xiong Y., Senchenkova S.N., Wang J., Shashkov A.S., Li Q., Knirel Y.A. // Carbohydr. Res. 2019. V. 480. P. 73–79.
Naumenko O.I., Senchenkova S.N., Shashkov A.S., Knirel Y.A., Zheng H., Xiong Y., Wang H., Li Q., Wang J. // Abstr. 20th Eur. Carbohydr. Symp., 30 June–5 July 2019. Leiden, The Netherlands.
Eserstam R., Rajaguru T.P., Jansson P.-E., Weintraub A., Albert M.J. // Eur. J. Biochem. 2002. V. 269. P. 3289–3295.
Jansson P.-E., Lönngren J., Widmalm G., Leontein K., Slettengren K., Svenson S.B., Wrangsell G., Dell A., Tiller P.R. // Carbohydr. Res. 1985. V. 145. P. 59–66.
Westphal A., Jann K. // Methods Carbohydr. Chem. 1965. V. 5. P. 83–91.
Sawardeker J.S., Sloneker J.H., Jeanes A. // Anal. Chem. 1965. V. 37. P. 1602–1603.
Duus J.Ø., Gotfredsen C.H., Bock K. // Chem. Rev. 2000. V. 100. P. 4589–4614.
L’vov V.L., Filatov A.V., Perepelov A.V., Shpirt A.M., Shashkov A.S., Chizhov A.O., Knirel Y.A. // Mendeleev Commun. 2016. V. 26. P. 279–281.
Knirel Y.A., Perepelov A.V. // Aust. J. Chem. 2002. V. 55. P. 69–72.
Книрель Ю.А., Науменко О.И., Сенченкова С.Н., Перепелов А.В. // Успехи химии. 2019. Т. 88. С. 406–424.
Valvano M.A., Furlong S.E., Patel K.B. // Bacterial Lipopolysaccharides: Structure, Chemical Synthesis, Biogenesis and Interaction with Host Cells / Eds. Knirel Y.A., Valvano M.A., Wien: Springer, 2011. P. 275–310.
Cunneen M.M., Liu B., Wang L., Reeves P.R. // PLoS One. 2013. V. 8. P. e67646.
Hao Y., Lam J.S. // Bacterial Lipopolysaccharides: Structure, Chemical Synthesis, Biogenesis and Interaction with Host Cells / Eds. Knirel Y.A., Valvano M.A., Wien: Springer, 2011. P. 195–235.
Alam J., Nassau N., Liu H.W. // Biochemistry. 2004. V. 43. P. 16450–16460.
Nassau P.M., Martin S.L., Brwon R.E., Weston A., Monsey D., McNeil M.R., Duncan K. // J. Bacteriol. 1996. V. 178. P. 1047–1052.
King J.D., Kocincova D., Westman E.L., Lam J.S. // Innate Immun. 2009. V. 15. P. 261e312.
Westman E.L., McNally D.J., Charchoglyan A., Brewer D., Field R.A., Lam J.S. // J. Biol. Chem. 2009. V. 284. P. 11854–11862.
Liu B., Knirel Y.A., Feng L., Perepelov A.V., Senchenkova S.N., Wang Q., Reeves P.R., Wang L. // FEMS M-icrobiol. Rev. 2008. V. 32. P. 627–653.
Jonsson K.H., Weintraub A., Widmalm G. // Carbohydr. Res. 2006. V. 341. P. 2986–2989.
Linnerborg M., Weintraub A., Widmalm G. // Eur. J. Biochem. 1999. V. 266. P. 460–466.
Sengupta P., Bhattacharyya T., Shashkov A.S., Kochanowski H., Basu S. // Carbohydr. Res. 1995. V. 277. P. 283–290.
Ali T., Weintraub A., Widmalm G. // Carbohydr. Res. 2008. V. 343. P. 695–702.
Lindberg B., Lindh F., Lönngren J., Lindberg A.A., Svenson S.B. // Carbohydr. Res. 1981. V. 97. P. 105–112.
Knirel Y.A., Paramonov N.A., Vinogradov E.V., Shashkov A.S., Dmitriev B.A., Kochetkov N.K., Kholodkova E.V., Stanislavsky E.S. // Eur. J. Biochem. 1987. V. 167. P. 549–561.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия