Биоорганическая химия, 2020, T. 46, № 1, стр. 101-105
Синтез и цитотоксическая активность ряда функционализированных 2,3-алленоатов
Р. Н. Маликова *, И. М. Сахаутдинов *, М. А. Максимова **, У. Ш. Кузьмина **, Ю. В. Вахитова **, М. С. Юнусов *
* Уфимский Институт химии УФИЦ РАН, Россия, 450054, Республика Башкортостан, Уфа, пр-т Октября, 71
** Институт биохимии и генетики УФИЦ РАН, Россия, 450054, Республика Башкортостан, Уфа, пр-т Октября, 71
Поступила в редакцию 22.05.2019
После доработки 05.06.2019
Принята к публикации 09.07.2019
Аннотация
Получена серия новых фталимид- и малеопимаримид производных 2,3-диеноатов (алленоатов) и исследовано их цитотоксическое действие в отношении клеточных линий опухолевого (HepG2, Jurkat) и нормального происхождения (HEK293). Наибольшим цитотоксическим действием обладают N-производные аминоалленоатов, содержащие имидомалеопимаровый фрагмент, которые можно отнести к перспективным веществам с потенциальной противоопухолевой активностью.
ВВЕДЕНИЕ
На сегодняшний день известно около 200 природных и более 2700 синтезированных алленовых соединений [1, 2]. Интенсивные исследования по созданию потенциально биологически активных соединений привели к открытию целого ряда новых алленов, которые являются универсальными строительными блоками и обладают высокой противораковой, цитотоксической, антибактериальной, противовирусной и другими активностями [2–5]. Вдохновленные интригующей биоактивностью многих природных алленовых соединений, в том числе производимых живыми организмами, данный фрагмент в настоящее время систематически вводят в фармакологически активные классы соединений (стероиды, простагландины, аминокислоты, нуклеозиды). Например, феромон, выделенный из самца жука зерновки бобовой Acanthoscelides obtectus (Say), представляет собой интерес как пестицид [6]. Алленовый каротиноид фукоксантин, содержащийся в бурых, золотистых и диатомовых водорослях, получил повышенное внимание в связи с противораковой активностью [7]. Это соединение ингибирует рост клеток меланомы [8], лейкозных клеток человека [9], клеток рака простаты [10].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
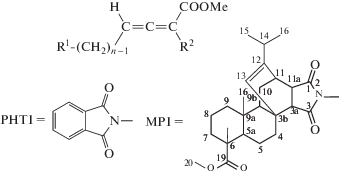
C целью выявления зависимости структура–активность в данной работе синтезированы новые и ранее известные алленоаты на основе фталимид- и малеопимаримид производных аминокислот. Выбор именно таких N-замещенных аминокислот обусловлен тем, что соединения, содержащие остаток фталимида присутствуют в структуре таких лекарственных препаратов, как фталазол, обладающий противомикробным действием, талидомид – седативное снотворное средство и ряда других. Малеопимаровая кислота и ее производные являются аддуктами канифоли с малеиновым ангидридом и так же обладают широким спектром биологической активности. Среди прочих методов получения алленов особый интерес вызывает реакция Виттига, которая протекает в мягких условиях и позволяет варьировать заместители в α-положении у исходных карбоновых кислот и илидов и получать ди-, три- и тетразамещенные аллены, которые сложно получить другими методами. В ходе реакции хлорангидриды N-замещенных карбоновых кислот с триэтиламином дают кетены, которые in situ вовлекаются в реакцию олефинирования по Виттигу с метил(трифенилфосфоранилиден)ацетатом (Ph3P=CHCO2Me) или метил-2-(трифенилфосфоранилиден)пропионатом (Ph3P=CMeCO2Me) с образованием ди- и тризамещенных алленоатов соответственно (схема 1 ).
Схема 1 . Синтез алленоатов из фталимид- и малеопимаримид производных аминокислот.
Структуры полученных соединений доказаны физико-химическими методами анализа. Для корректного отнесения сигналов в спектрах ЯМР продуктов реакций использовали методы гомо- и гетероядерной двумерной корреляции HSQC и HMBC. Для синтезированных алленоатов в спектре ЯМР 13С информативными являются сигналы двух терминальных углеродных атомов в области δс 87.72–106.49 м.д., а также центрального четвертичного углеродного атома алленового фрагмента, проявляющийся в области δс 208.31–219.84 м.д.
Как видно из табл. 1, большинство из изученных соединений (I)–(X) проявляют цитотоксическую активность in vitro. Наименьшую цитотоксическую активность имеют аллены (II), (V) – соединения с метильной группой в альфа-положении к сложноэфирному фрагменту. Наиболее выраженное действие в отношении клеток опухолевого происхождения проявляют алленоаты (VI), (IX), (X), полученные на основе N-малеопимаримидзамещенных глицина, аминовалериановой и аминогексановой кислот. Подчеркнем, что наибольшую чувствительность к данным соединениям проявляют клетки лимфобластной лейкемии Jurkat.
Таблица 1.
Цитотоксическая активность соединений (I)–(X) in vitro
 |
|||||||
|---|---|---|---|---|---|---|---|
| Соеди- нения | Выход, % | R1 | n | R2 | IC50, мкМ | ||
| HEK293 | Jurkat | HepG2 | |||||
| (I) | 63 | PHTI | 1 | H | 25.3 ± 2.9 | 10.4 ± 0.7 | 11.1 ± 0.2б (p = 0.0019) |
| (II) | 73 | PHTI | 1 | Me | 110.0 ± 12.5 | 23.0 ± 2.7а (p = 0.0003) |
71.2 ± 3.3б (p = 0.0004) |
| (III) | 87 | PHTI | 3 | H | 18.6 ± 2.1 | 5.5 ± 0.8а (p = 0.0002) |
22.9 ± 0.2б (p = 0.0139) |
| (IV) | 56 | PHTI | 5 | H | 42.2 ± 4.4 | 20.4 ± 1.7а (p = 0.0002) |
118.8 ± 7.8б (p = 0.0002) |
| (V) | 42 | PHTI | 5 | Me | 89.1 ± 4.9 | 31.3 ± 3.1а (p = 0.0002) |
>1 мМ |
| (VI) | 73 | MPI | 1 | H | 79.15 ± 3.99 | 3.82 ± 0.78а (p = 0.0002) |
81.22 ± 7.88 |
| (VII) | 84 | MPI | 2 | H | 20.98 ± 1.14 | 6.12 ± 1.36 | 30.69 ± 9.55 |
| (VIII) | 70 | MPI | 3 | H | 14.3 ± 0.8 | 4.4 ± 1.2а (p = 0.0327) |
8.1 ± 3.2 |
| (IX) | 75 | MPI | 4 | H | 11.82 ± 0.69 | 1.58 ± 0.16а (p = 0.0002) |
16.53 ± 1.12б (p = 0.0011) |
| (X) | 70 | MPI | 5 | H | 13.52 ± 0.22 | 2.02 ± 0.26а (p = 0.0002) |
18.87 ± 0.58 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК-спектры записывали на приборе IR-Prestige-21 (Fourier Transform Spectrophotometer – Shimadzu). Спектры ЯМР получены в CDCl3 (δ, м.д.) на спектрометре Bruker-AM 500 с рабочей частотой 500 (1Н), 125.76 МГц (13С), внутренний стандарт – тетраметилсилан (Me4Si). За ходом реакции следили с использованием тонкослойной хроматографии на пластинках Sorbfil ПТСХ-АФ-А (Россия), вещества обнаруживали с помощью УФ-облучения, паров йода, опрыскивания пластинок раствором нингидринового проявителя или раствором анисового альдегида с последующим нагреванием при 100–120°С. Масс-спектры получены на хроматомасс-спектрометре LCMS-2010EV фирмы “Shimadzu” в режиме химической ионизации при атмосферном давлении (ХИАД). Температуру плавления определяли на нагревательном столике “Boetius”. Продукты реакции выделяли с помощью колоночной хроматографии на силикагеле Chemapol с размером частиц 40/100 и 100/160 мкм, элюент петролейный эфир– этилацетат, 7/3. Элементный анализ выполнен с помощью автоматического CHNS-анализатора EUROEA-3000. N-Фталимидзамещенные аминокислоты получены по известной методике [4]. Основные физико-химические характеристики соединений (IV), (V), а также алленов (VI), (VII), (VIII), (X), полученных, соответственно, из метил-N-малеопимаримидзамещенных глицина, β‑аланина, γ-аминомасляной и аминокапроновой кислот, были описаны нами в предыдущих работах [11–15]. Характеристики впервые синтезированных алленоатов приведены ниже.
Общая методика получения алленоатов межмолекулярной реакцией Виттига. К суспензии 5 ммоль N-замещенной аминокислоты в 10 мл сухого бензола добавляли пятикратный избыток хлористого тионила. Смесь кипятили с обратным холодильником с хлоридкальциевой трубкой в течение 3 ч. Растворитель и избыток хлористого тионила упаривали на роторном испарителе. Полученный хлорангидрид кислоты далее использовали без дополнительной очистки. К раствору 1.67 г (5 ммоль) метил(трифенилфосфоранилиден)ацетата или 1.74 г (5 ммоль) метил-2-(трифенилфосфоранилиден)пропионата в CH2Cl2 прибавляли по каплям эквимольное количество Et3N, раствор охлаждали до –10°С. К этому раствору медленно по каплям добавляли охлажденный раствор полученного хлорангидрида кислоты. Реакционную массу перемешивали в течение 0.5 ч и в течение 4–6 ч выдерживали при 0○C. Растворитель отгоняли, продукты реакции выделяли колоночной хроматографией.
Метил-4-(1,3-диоксоизоиндолин-2-ил)-2-метилбута-2,3-диеноат (II). Получен на основе N-фталимидзамещенного глицина в количестве 1.03 г и метил-2-(трифенилфосфоранилиден)пропионата. Выход 0.94 г (73%). Белое кристаллическое вещество, т. пл. 102–104°С. Спектр ЯМР 1Н: 2.04 (c, 3 H, CH3), 3.72 (с, 3 Н, СН3), 7.08 (м, 1 H, CH), 7.74 (м, 2 Н, С6Н4),7.83 (м, 2 Н, С6Н4). Спектр ЯМР 13С: 18.54 (CH3), 53.83 (СH3), 91.95 (СН), 106.49 (С), 125.37 (СНаром), 133.79 (Саром), 136.61 (СНаром), 167.36 (С=O), 168.23 (С=О), 208.31 (=С=). Масс-спектр: m/z 258 [MH]+, 257 [M]–. Вычислено C14H11NO4 (257.24), %: С, 65.37; Н, 4.31; N, 5.44; O, 24.88. Найдено, %: С, 65.32; Н, 4.40; N, 5.39.
Метил-8-(1,3-диоксоизоиндолин-2-ил)окта-2,3-диеноат (IV). Получен на основе 5-N-фталимидзамещенной аминогексановой кислоты в количестве 1.3 г и метил(трифенилфосфоранилиден)ацетата. Выход 0.83 г (56%). Белое маслообразное вещество. Спектр ЯМР 1Н: 1.52 (м, 2H, CH2), 1.74 (м, 2H, CH2), 2319 (м, 2H, CH2), 3.65 (м, 2H, CH2), 3.69 (с, 3Н, СН3), 5.58 (м, 2H, 2=CH),7.70 (м, 2Н, С6Н4), 7.80 (м, 2Н, С6Н4). Спектр ЯМР 13С: 25.78 (CH2), 26.88 (CH2), 27.77 (CH2), 37.53 (CH2), 51.87 (СH3), 88.14 (СН), 94.78 (СН), 123.11 (СНаром), 132.05 (Саром), 133.84 (СНаром), 166.45 (С=O), 168.3 (С=О), 212.29 (=С=). Масс-спектр: m/z 300 [MH]+, 299 [M]–. Вычислено C17H17NO4 (299.32), %: С, 68.21; Н, 5.72; N, 4.68; O, 21.38. Найдено, %: С, 68.12; Н, 5.81; N, 4.65.
Метил-8-(1,3-диоксоизоинодолин-2-ил)-2-метилокта-2,3-диеноат (V). Получен на основе 5-N-фталимидзамещенной аминогексановой кислоты в количестве 1.3 г и метил-2-(трифенилфосфоранилиден)пропионата. Выход 0.65 г (42%). Прозрачное маслообразное вещество. Спектр ЯМР 1Н: 1.42 (м, 2H, CH2), 1.74 (м, 2H, CH2), 1.81 (с, 3Н, СН3), 2.13 (м, 2H, CH2), 3.63 (с, 3Н, СН3), 3.72 (м, 2H, CH2), 5.38 (м, 1H, CH), 7.65 (м, 2Н, С6Н4), 7.88 (м, 2Н, С6Н4). Спектр ЯМР 13С: 15.84 (СH3), 23.42 (CH2), 26.18 (CH2), 37.01 (CH2), 42.21 (CH2), 51.14 (СH3), 96.37 (С), 102.54 (СН), 123.08 (СНаром), 131.82 (Саром), 133.44 (СНаром), 162.35 (С=O), 171.63 (С=О), 219.84 (=С=). Масс-спектр: m/z 314 [MH]+, 313 [M]–. Вычислено C18H19NO4 (313.34), %: С, 68.99; Н, 6.11; N, 4.47; O, 20.42. Найдено, %: С, 68.90; Н, 6.19; N, 4.35.
Метил-12-изопропил-2-(7'-метокси-7'-оксогекса-4',5'-диен-1'-ил)-6,9а-диметил-1,3-диоксогексадекагидро-3б,11-этенонафто[2,1-e]изоиндол-6-карбоксилат (IX). Получен на основе метил-5-N-малеопимаримидзамещенной аминовалериановой кислоты в количестве 2.56 г и метил(трифенилфосфоранилиден)ацетата. Выход 2.05 г (75%), желтое маслообразное вещество. ИК, ν см–1: 2956, 2939, 1658, 1465, 740. Спектр ЯМР 1Н: 0.54 (с, 3Н, Н17), 0.90 (м, 6Н, Н15, 16), 0. 96 и 1.41 (м, 2Н, Н9), 1.12 (с, 3Н, Н18), 1.15 и 1.45 (м, 2Н, Н5), 1.20 и 1.66 (м, 2Н, Н10), 1.40 (м, 1Н, Н9b), 1.52 (м, 2Н, Н8), 1.54 и 1.70 (м, 2Н, Н7), 1.68 и 2.45 (м, 2Н, Н4), 1.72 (м, 2Н, Н2'), 1.74 (м, 1Н, Н5a), 2.18 (м, 1Н, Н14), 2.40 (м, 2Н, Н3'), 2.49 (м, 1Н, Н3a), 2.72 (м, 1Н, Н11a), 2.98 (м, 1Н, Н11), 3.31 (м, 2Н, Н1'), 3.61 (с, 3Н, Н20), 3.68 (с, 3Н, Н8'), 5.33 (с, 1Н, Н13), 5.54 (м, 1Н, Н4'аллен), 5.56 (м, 1Н, Н6'аллен). Спектр ЯМР 13C: 15.56 (С17), 16.57 (С18), 17.11 (С8), 20.06 (С15), 20.88 (С16), 21.65 (С5), 24.72 (С2'), 26.64 (С3'), 27.76 (С10), 32.87 (С14), 35.22 (С4), 35.34 (С11), 36.43 (С7), 38.03 (С1'), 37.03 (С9a), 38.09 (С9), 40.48 (С3b), 44.77 (С11a), 47.34 (С6), 49.55 (С5a), 51.89 (С20), 51.96 (С8'), 52.43 (С3a), 54.22 (С9b), 88.58 (С4'аллен), 94.24 (С6'аллен), 124.18 (С13), 146.91 (С12), 166.30 (С7'), 177.23 (С1), 178.40 (С3), 179.10 (С19), 212.13 (С5'). Масс-спектр: m/z 550 [M]–, 552 [MH]+. Вычислено C33H45NO6 (551.71), %: C, 71.84; H, 8.22; N, 2.54. Найдено, %: С, 71.98; Н, 8.40; N, 2.49.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цитотоксические свойства соединений определяли in vitro с помощью МТТ-метода в 96-луночных планшетах [16]. Клетки линии HEK293 и HepG2 культивировали в среде ДМЕМ (Биолот, Россия), клетки линии Jurkat – в среде RPMI (Биолот, Россия) в присутствии 10% эмбриональной телячьей сыворотки (Invitrogen, США), 2 мМ L-глутамин и 50 мкг/мл гентамицина сульфата. После 24 ч культивирования в каждую лунку вносили исследуемые соединения в конечных концентрациях 1, 10, 100 мкМ (в 0.1% DMSO) и инкубировали в течение 48 ч, после чего добавляли МТТ-реагент и определяли оптическую плотность при 540 нм за вычетом измеренного фонового поглощения при 600 нм с помощью планшетного анализатора (2300 EnSpire® MultimodePlateReader; PerkinElmer, США). Значение концентрации соединений, вызывающее 50%-е подавление жизнеспособности клеток (IC50), определяли на основе дозозависимых кривых с помощью программного обеспечения GraphPadPrism v. 5.02 (GraphPadSoftware Inc., США). Данные, полученные в 3 независимых экспериментах, выражали в виде среднего значения 3 измерений для каждой концентрации ± стандартная ошибка среднего, по отношению к значениям контроля (0.1% DMSO), принятого за 100%.
Список литературы
Dembitsky V.M., Maoka T. // Prog. Lipid Res. 2007. V. 46(6). P. 328–375.
Hoffmann-Röder A., Krause N. // Angew. Chem. Int. Ed. 2004. V. 43. P. 1196–1216.
Ban H.S., Onagi S., Uno M. // ChemMedChem. 2008. V. 3. P. 1094–1103.
Гринштейн Дж., Виниц М. Химия аминокислот и пептидов. М: Мир, 1965. С. 578.
Zhang F., Liu Sh., Lu X., Guo L., Zhang H., Che Y. // J. Nat. Prod. 2009. V. 72. P. 1782–1785.
Horler D.F. // J. Chem. Soc. C. 1970. V. 6. P. 859.
Dembitsky V. M., Maoka T. // Progress in Lipid Research. 2007. V. 46. P. 328–375.
Kim K.-N., Ahn G. // Environmental Toxicology and Pharmacology. 2013. V. 35. P. 39–46.
Hosokawa M., Wanezaki S. // Food Sci. Technol. Res. 1999. V. 5. P. 243.
Kotake-Nara E., Kushiro M., Zhang H., Sugawara T., Miyashita K., Nagao A. // J. Nutr. L. 2001. V. 131. P. 3303.
Сахаутдинов И.М., Батыршин И.Р., Фатыхов А.А. // Ж. структ. хим. 2013. Т. 54. № 2. С. 331–335.
Sakhautdinov I.M., Gumerov A M., Batyrshin I.R. // Heterocycles. 2014. V. 89. P. 641–651.
Сахаутдинов И.М., Гумеров А.М., Гибадуллина Г.Г. // Химия природ. соед. 2015. Т. 51. С. 332.
Сахаутдинов И.М., Гумеров А.М., Маликова Р.Н., Фатыхов А.А., Юнусов М.С. // Химия природ. соед. 2016. Т. 52. № 4. С. 562–565.
Malikova R.N., Sakhautdinov I.M., Abdullin M.F., Mukhametyanova A.F., Yunusov M.S. // Chem. Nat. Compd. 2017. V. 53. P. 341–344.
Mosmann T. // J. Immunol. Meth. 1983. V. 65. № 1–2. P. 55–63.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



