Биоорганическая химия, 2020, T. 46, № 1, стр. 92-100
Анксиолитическая активность производных 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола и 2-меркаптобензимидазола
А. А. Спасов *, **, О. Н. Жуковская ***, Д. В. Мальцев *, **, М. В. Мирошников *, М. О. Скрипка *, К. Т. Султанова *, **, А. С. Морковник ***
* ФГБОУ ВО “Волгоградский государственный медицинский университет” Министерства здравоохранения Российской Федерации, кафедра фармакологии и биоинформатики, Россия, 400131, Волгоградская обл., Волгоград, площадь Павших Борцов, 1
** ГБУ “Волгоградский медицинский научный центр”, лаборатория экспериментальной фармакологии, Россия, 400131, Волгоградская обл., Волгоград, площадь Павших Борцов, 1
*** ФГАОУ ВО “Южный федеральный университет”, научно-исследовательский институт физической и органической химии, Россия, 344006, Ростов-на-Дону, ул. Большая Садовая, 105/42
Поступила в редакцию 08.07.2019
После доработки 11.07.2019
Принята к публикации 22.08.2019
Аннотация
Изучена анксиолитическая активность соединений двух химических групп: бифенилметильных производных 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-а]бензимидазола (BIF) и функционально замещенных по алкильной группе 2-алкилтиобензимидазолов (AZH). Установлено, что изучаемые соединения обладают транквилизирующим действием различной степени выраженности; два из них – BIF-66 и AZH-57, с наиболее высокой анксиолитической активностью перспективны для углубленного изучения их нейропсихотропного профиля.
ВВЕДЕНИЕ
Антифобические средства имеют важное значение в лечении широкого спектра психических расстройств. За последние годы к назначению этой группы анксиолитических средств предъявляются все более серьезные требования, которые усложняют персональный подбор препарата, тем самым создавая трудности в расширении современного ассортимента лекарственных средств [1].
Анксиогенез является одним из самых сложных поведенческих процессов, в нем задействовано значительное количество нейромедиаторных и гормональных систем. На сегодняшний день, по оценкам ВОЗ, психическими расстройствами страдают по меньшей мере 300 млн людей на планете. Аксиолитики, применяемые сегодня при терапии данных патологий, обладают как правило, значительным перечнем побочных действий [2]. Для средств из группы “дневных” транквилизаторов отмечается низкий уровень противотревожной активности, что в совокупности с клинически длительным периодом проявления стойкого эффекта снижает их эффективность в терапии тревожных заболеваний [3]. В связи с этим современные рекомендации предлагают в качестве препаратов выбора группу веществ с антидепрессивной активностью, а именно ингибиторы обратного захвата моноаминов. Однако и для них отмечается ряд существенных недостатков, основными из которых являются: низкая эффективность (60–70%) и длительное развитие эффекта (спустя 2–3 недели после начала применения) [4]. На сегодняшний день заявлены новые соединений с потенциальным анксиолитическим действием: АP-521 (производное хинолина) (Япония), АVN-101 (производное индола) (США), D2AAK1 (производное хинолина и индола) (Финляндия), и другие [5]. Для многих из них показан мультитаргентный механизм действия. Направления, разрабатываемые существующими рабочими группами, представлены функционализированными представителями ряда химических классов – пиримидинов, диазепинов, бензимидазолов и многих других [6]. В ранее проведенных исследованиях показан высокий потенциал анксиолитической активности у соединений, содержащих бензимидазольный бицикл. Существенным фактором для оптимизации указанной химической структуры является значительный потенциал в мультитаргетности действия производных бензимидазола, полученных ранее, особенно при наличии в молекулах второго привилегированного структурного фрагмента, такого, например, как бифенильный.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В качестве объектов исследования были выбраны две группы бензимидазолсодержащих структур, а именно, 11-бифенилметилзамещенные 11Н-[1,3]диазепино[1,2-a]бензимидазолы под шифрами BIF, а также функционально-замещенные по алкильной группе 2-алкилтиобензимидазолы (AZH) (табл. 1). Синтез всех соединений с шифрами BIF [7], а также соединений AZH‑53, 54, 55 [8], AZH-61 [9], AZH-62 [10], AZH-63 [11] проведен по методикам, описанным в указанных работах. Препаратами сравнения послужили диазепам (7-хлор-1-метил-5-фенил-1,3-дигидро-2Н-1,4-бензодиазепин-2-он) и афобазол (дигидрохлорид 5-этокси-2-[(2-морфолино)-этилтио]бензимидазола).
Таблица 1.
Анксиолитический эффект в тесте “Приподнятый крестообразный лабиринт” производных 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола и 2-меркаптобензимидазола, пероральное введение (M ± m)
| Соединение | Химическая структура | Время нахождения в открытом рукаве, с | Количество выходов в открытый рукав |
|---|---|---|---|
| BIF-59 | 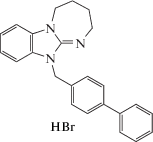 |
66.75 ± 4.80* | 2.75 ± 0.63* |
| BIF-60 |  |
31.00 ± 15.21 | 1.00 ± 0.71 |
| BIF-66 | 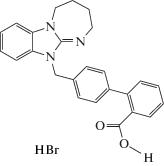 |
114.00 ± 16.49* | 5.75 ± 1.75* |
| BIF-69 | 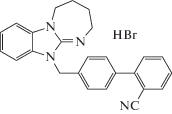 |
51.17 ± 10.82* | 3.25 ± 0.71* |
| AZH-53 | 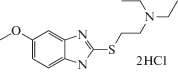 |
48.50 ± 14.20 | 4.00 ± 1.10* |
| AZH-54 |  |
18.00 ± 5.21 | 0.75 ± 0.47 |
| AZH-55 | 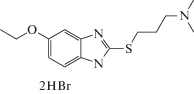 |
66.00 ± 8.08* | 3.25 ± 0.47* |
| AZH-56 |  |
20.75 ± 12.85 | 1.25 ± 0.95 |
| AZH-57 |  |
115.8 ± 19.96* | 5.25 ± 0.51* |
| AZH-61 |  |
51.75 ± 20.15 | 3.00 ± 1.23 |
| AZH-62 | 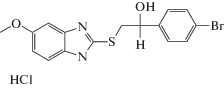 |
83.25 ± 22.63* | 3.75 ± 0.63* |
| AZH-63 |  |
45.75 ± 19.80 | 3.00 ± 1.00 |
| Контроль | – | 24.84 ± 7.55 | 0.75 ± 0.48 |
| Диазепам (1 мг/кг) | 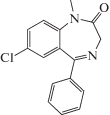 |
79.13 ± 14.96* | 1.25 ± 0.95 |
| Афобазол (5 мг/кг) | 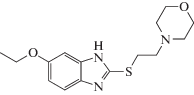 |
65.75 ± 5.54* | 2.25 ± 0.47 |
В результате проведенного исследования, было установлено, что оба типа структур обладают, в той или иной степени, анксиолитическим действием. Рассмотрим вначале данные, полученные для бифенилметилзамещенных 2,3,4,5-тетрагидро-11Н-[1,3]диазепино[1,2-a]бензимидазолов. Введение животным гидробромида метилового эфира 4'-(2,3,4,5-тетрагидро-11Н-[1, 3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил-2-карбоновой кислоты (BIF-60) оказывало лишь незначительный анксиолитический эффект: практически сохранялось чувство страха открытого пространства, почти не изменялось количество выходов в светлый рукав и время нахождения в нем по сравнению контрольной группой животных (табл. 1). В опытных группах, которым вводили гидробромид 4'-(2,3,4,5-тетрагидро-11Н-[1,3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил (BIF-59) и гидробромид 4'-(2,3,4,5-тетрагидро-11Н-[1,3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил-2-карбонитрил (BIF-69), указанный эффект уже был явным и выражался в примерно двукратном увеличении времени нахождения мышей в светлом рукаве и количества выходов в этот рукав в сравнении с группой, получавшей дистиллированную воду.
Наибольшую же анксиолитическую активность среди первой группы соединений продемонстрировал гидробромид 4'-(2,3,4,5-тетрагидро-11Н- [1,3]диазепино[1,2-a]бензимидазол-11-илметил) бифенил-2-карбоновая кислота (BIF-66), что свидетельствует о весьма важной роли, в данном случае, карбоксильной группы бифенильного фрагмента. Действительно, соединение BIF-66 более чем в 7 раз повышало количество выходов в светлый рукав и практически в 4 раза увеличивало время пребывания в нем в сравнении с контрольными значениями. По своей активности оно также явно превосходило препарат сравнения диазепам в дозе 1 мг/кг, который давал увеличение времени нахождения мышей в светлом рукаве более чем в 3 раза. Отметим также, что показатель количества выходов в светлый рукав у мышей, получавших диазепам, увеличивался лишь в 1.5 раза в сравнении с контрольным значением, но расхождение было статистически не слишком значимым. Это связано с тем, что диазепаму присуще не только анксиолитическое, но и седативное действие, что с одной стороны снижает страх лабораторного животного, а с другой, делает его в определенной степени заторможенным.
По отношению к второму препарату сравнения, афобазолу, сопутствующий эффект седации, при сопоставимом в сравниваемых дозах анксиолитическом эффекте, гораздо менее выражен, так как число выходов в светлый рукав, по сравнению с контрольной группой, было увеличено уже в 3 раза. Таким образом, для соединений под шифром BIF характерно проявление противотревожного действия. В этом отношении наиболее активный представитель этой группы, карбоновая кислота BIF-66, не только не уступало, но и заметно превосходило оба препарата сравнения (табл. 2).
Таблица 2.
Влияние Диазепама, Афобазола, BIF-59, BIF-60, BIF-61, BIF-66, AZH-53, AZH-54, AZH-55, AZH-56, AZH-57, AZH-61, AZH-62, AZH-63 на поведение мышей в условиях методики “Приподнятый крестообразный лабиринт”, пероральное введение (M ± m)
| Соединение | Количество переходов | |||
|---|---|---|---|---|
| общее | из светлого рукава в светлый | из светлого рукава в темный | из темного рукава в темный |
|
| Контроль | 5.25 ± 1.32 | 0.25 ± 0.25 | 1.50 ± 0.96 | 3.50 ± 0.29 |
| Диазепам (1 мг/кг) | 2.54 ± 0.66 | 0.13 ± 0.09 | 2.20 ± 0.58 | 1.4 ± 0.41 |
| Афобазол (5 мг/кг) | 5.00 ± 1.88 | 0.50 ± 0.44 | 4.21 ± 0.48 | 0.8 ± 0.45 |
| BIF-59 | 11.50 ± 2.63* | 2.00 ± 1.23 | 4.50 ± 1.66 | 2.75 ± 1.25 |
| BIF-60 | 4.00 ± 1.87 | 0.00 ± 0.00 | 1.00 ± 0.71 | 3.00 ± 1.92 |
| BIF-66 | 11.75 ± 3.57* | 3.25 ± 1.32* | 4.75 ± 1.49* | 3.75 ± 1.75* |
| BIF-69 | 9.83 ± 1.85* | 0.83 ± 0.31 | 4.83 ± 0.83* | 4.17 ± 1.14 |
| AZH-53 | 9.50 ± 1.91* | 1.00 ± 0.61 | 6.75 ± 1.91 | 1.50 ± 0.29 |
| AZH-54 | 3.00 ± 1.31 | 0.25 ± 0.25 | 1.00 ± 0.71 | 2.00 ± 0.91 |
| AZH-55 | 13.75 ± 1.81* | 2.00 ± 0.71* | 6.50 ± 0.31* | 2.25 ± 1.03 |
| AZH-56 | 4.00 ± 1.71 | 0.25 ± 0.25 | 2.00 ± 1.41 | 1.25 ± 0.75 |
| AZH-57 | 14.00 ± 1.23* | 2.25 ± 1.03* | 9.50 ± 1.01* | 2.50 ± 0.29 |
| AZH-61 | 8.50 ± 1.71 | 1.75 ± 0.75* | 3.75 ± 1.71 | 3.00 ± 0.91 |
| AZH-62 | 12.50 ± 1.71* | 1.00 ± 0.58 | 7.30 ± 1.21* | 4.75 ± 0.63* |
| AZH-63 | 8.00 ± 2.12 | 0.50 ± 0.50 | 4.75 ± 1.11 | 2.75 ± 0.63 |
Для второго типа бензимидазолсодержащих структур, являющихся производными 2-меркаптобензимидазола (AZH) также была выявлена противотревожная активность различной степени выраженности в тесте “Приподнятый крестообразный лабиринт”. Наименее выражена она для дигидробромида 5-этокси-2-[(3-диметиламино)-пропилтио]бензимидазола(AZH-55), дигидрохлорида 5-метил-2-[(2-морфолино)-этилтио]бензимидазола (AZH-57) и 5-метокси-2-[2-(4-бромфенил)-гидроксиэтилтио]бензимидазол (AZH-62). В этом случае регистрировалось статистически достоверное увеличение времени нахождения мышей в открытом рукаве лабиринта. Отмечалось также и увеличение количества выходов в светлый рукав. Дигидрохлорид 5-этокси-2-[(2-диэтиламино)этилтио]бензимидазол (AZH-53) при пероральном введении вызывал повышение количества выходов мышей в открытый рукав, хотя статистически значимых изменений времени нахождения на открытом пространстве отмечено не было. Для четырех вышеуказанных производных 2-меркаптобензимидазола характерно увеличение активности грызунов, что отражалось в повышении количества переходов как между темными-светлыми, так и между однотипными рукавами.
Далее нами было исследовано поведение мышей в тесте “Открытое поле” (табл. 3). Для диазепама в дозе 1 мг/кг, вследствие его седативного эффекта, отмечалось снижение практически всех видов активности в 2.8–4.8 раза, что согласуются с литературными данными, характерными для используемых доз препарата [12]. В то же время производные 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола (BIF) значимо не изменяли показатели горизонтальной активности животных в сравнении с контрольными значениями. Для соединения BIF-59 отмечалось увеличение количества вертикальных стоек, а также некоторое снижение поисковой активности животных. У мышей, получавших соединение BIF-60, статистически незначимо снижались горизонтальная и вертикальная активности, при этом поисковая активность падала в сравнении с результ атами контрольной группы животных в 7 раз (p < 0.05).
Таблица 3.
Влияние Диазепама, Афобазола и соединений с шифрами BIF и AZH на поведение мышей в тесте “Открытое поле”, пероральное введение (M ± m)
| Соединение | Горизонтальная активность | Вертикальная активность | Поисковая активность |
|---|---|---|---|
| Контроль | 94.34 ± 3.61 | 7.25 ± 0.61 | 7.00 ± 0.78 |
| Диазепам (1 мг/кг) | 33.83 ± 3.41* | 1.50 ± 0.43* | 1.5 ± 0.05* |
| Афобазол (5 мг/кг) | 68.33 ± 9.56* | 2.17 ± 1.67* | 5.00 ± 1.71* |
| BIF-59 | 123.3 ± 13.80* | 16.50 ± 3.20* | 3.50 ± 0.31* |
| BIF-60 | 68.33 ± 17.57 | 5.00 ± 1.71 | 1.00 ± 0.71* |
| BIF-66 | 103.3 ± 28.53 | 12.25 ± 5.50 | 6.00 ± 1.68 |
| BIF-69 | 90.33 ± 9.89 | 17.17 ± 2.85* | 3.00 ± 0.82* |
| AZH-53 | 110.00 ± 7.63 | 15.50 ± 4.25 | 7.75 ± 0.25 |
| AZH-54 | 99.50 ± 7.31 | 7.00 ± 0.71 | 10.50 ± 1.76* |
| AZH-55 | 109.80 ± 13.44 | 35.25 ± 4.52* | 13.75 ± 2.39* |
| AZH-56 | 95.00 ± 10.03 | 20.75 ± 3.43* | 15.75 ± 3.66 |
| AZH-57 | 109.50 ± 14.98 | 23.75 ± 6.42* | 11.00 ± 2.12* |
| AZH-61 | 87.25 ± 4.59 | 15.75 ± 0.85* | 12.25 ± 1.32* |
| AZH-62 | 111.5 ± 15.21 | 32.00 ± 9.17 | 11.75 ± 0.25* |
| AZH-63 | 101.80 ± 14.98 | 15.25 ± 5.54* | 12.25 ± 1.89* |
Для всех производных 2-меркаптобензимидазола (AZH) было характерно отсутствие влияния на горизонтальную двигательную активность животных, но для пяти из этой серии соединений – AZH-56, AZH-55, AZH-57, AZH-61 и AZH-63 – отмечалось увеличение количества вертикальных стоек, совершаемых животными в течение периода наблюдения. В большинстве экспериментальных групп наблюдалось также увеличение поисковой активности.
Проведенные тесты по изучению миорелаксирующего действия веществ дали результаты, согласующиеся с полученными в тесте “Открытое поле” (табл. 4). Так, препарат сравнения диазепам в дозе 1 мг/кг снижал способность животных удерживаться на сетке в 2 раза, проволоке в 1.3 раза и вращающемся стержне в 3 раза. В группах экспериментальных веществ для производных 2-меркаптобензимидазола и соединения BIF-66 не регистрировалось изменений наблюдаемых показателей, что позволяет говорить об отсутствии у них не только седативного, но и миорелаксирующего и действия в используемой дозе. Для иных соединений BIF-типа отмечалось снижение способности мышей удерживаться на вращающемся стержне в течение 30 с: в среднем исследуемый показатель составлял 19.6 с. Для соединения BIF-60 снижение времени удержания животных на проволоке составило 25%.
Таблица 4.
Миорелаксирующие свойстава Диазепама, Афобазола и соединений с шифрами BIF и AZH, пероральное введение (M ± m)
| Соединения | Сетка | Проволока | Ротарод |
|---|---|---|---|
| Контроль | 3.98 ± 0.01 | 3.98 ± 0.01 | 29.95 ± 0.01 |
| Диазепам (1 мг/кг) | 2.00 ± 0.32* | 3.00 ± 0.87* | 10.20 ± 2.44* |
| Афобазол (5 мг/кг) | 4.00 ± 0.01 | 3.17 ± 0.40 | 22.67 ± 0.67 |
| BIF-59 | 3.98 ± 0.01 | 3.98 ± 0.01 | 18.50 ± 3.95* |
| BIF-60 | 3.75 ± 0.25 | 3.00 ± 0.41* | 22.00 ± 3.94* |
| BIF-66 | 3.75 ± 0.25 | 3.75 ± 0.25 | 23.00 ± 3.58 |
| BIF-69 | 3.80 ± 0.13 | 3.80 ± 0.13* | 18.33 ± 3.63* |
| AZH-53 | 4.00 ± 0.01 | 4.00 ± 0.01 | 27.00 ± 2.38 |
| AZH-54 | 4.00 ± 0.01 | 3.75 ± 0.25 | 28.75 ± 0.75 |
| AZH-55 | 4.00 ± 0.01 | 4.00 ± 0.01 | 25.50 ± 3.57 |
| AZH-56 | 4.00 ± 0.01 | 4.00 ± 0.01 | 29.75 ± 0.25 |
| AZH-57 | 4.00 ± 0.01 | 4.00 ± 0.01 | 23.75 ± 3.12 |
| AZH-61 | 4.00 ± 0.01 | 4.00 ± 0.01 | 27.50 ± 1.66 |
| AZH-62 | 4.00 ± 0.01 | 4.00 ± 0.01 | 26.75 ± 2.36 |
| AZH-63 | 4.00 ± 0.01 | 4.00 ± 0.01 | 17.00 ± 6.61 |
При сравнении двух cерий соединений – производных 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола (BIF) и 2-меркаптобензимидазола (AZH) на предмет проявления анксиолитической и миорелаксирующей активности можно сделать вывод о том, что изучаемые субстанции обеих групп обладают разной степенью выраженности изучаемых эффектов. Так, в тесте “Приподнятый крестообразный лабиринт” среди соединений группы BIF было обнаружено 1 вещество BIF-60 с отсутствием анксиолитической активности и 3 соединения BIF-59, BIF-66, BIF-69 с умеренной и высокой степенью проявления противотревожного действия. При анализе зависимости “структура–эффект” данных соединений (табл. 1) было показано: животные, которым вводили соединение BIF-59, не содержащее дополнительных заместителей в структуре бифенила, показали результат, сопоставимый с результатами, полученными для группы афобазола, что говорит о перспективности данного соединения и необходимости дальнейшей химической модификации его структуры для достижения максимального анксиолитического действия.
В структурах соединений BIF-60 и BIF-69 помимо коровой части содержатся cложно-эфирный или нитрильный радикалы в положении 2' бифенила. Для данных соединений отмечалось снижение выраженной противотревожной активности, что может свидетельствовать о неэффективности присутствия данных радикалов у производных группы BIF в проявлении анксиолитического эффекта. Наиболее активное вещество BIF-66 содержит карбоксильную группу, отсутствующую у других соединений данного ряда. Ее присутствие, очевидно, может влиять на эффективность взаимодействия изучаемой молекулы с мишенями живого организма, в связи с выраженной склонностью карбоксильной группы к образованию двух типов водородных связей – за счет ее карбонильной и гидроксильной групп.
Среди производных серии AZH было выявлено 4 соединения, с низкой анксиолитической активностью – AZH-53, 54, 56, 63; остальные 4 соединения AZH-55, 57, 61, 62 – обладали противотревожным действием, сопоставимым, либо превышающим таковое у препаратов сравнения – диазепама и афобазола. При анализе зависимости “структура–эффект” производных 2-меркаптобензимидазола можно сделать вывод о важности наличия морфолиноэтильного радикал (соединение AZH-57), притом что сходный по строению пипиридиноэтильный радикал столь явного эффекта не оказывает. Таким образом, именно этот атом при наличии остального окружения, а именно, меркаптобензимидазольного скафолда в комбинации с морфолиноэтильным остатком играет критически важную роль в появлении у соединения AZH-57 выраженного противотревожного эффекта.
Соединения AZH-53, 54, 55 имеют определенное химическое сходство внутри своей группы производных, содержат диалкиламиноалкильный радикал. Данные вещества показали низкий уровень противотревожного действия, это свидетельствует о том, что включение названных радикалов в производные 2-меркаптобензимидазола, не приводит к возникновению выраженного анксиолитическогоэффекта. К ним можно отнести также соединения AZH-61 и AZH-63, имеющие 2-[(2-гидрокси-2-трет-бутил)этильные остатки.
Вещество AZH-62, проявившее противотревожную активность, сопоставимую с препаратом сравнения диазепамом, имеет в своей структуре 2-(4-бромфенил)-2-гидроксиэтильный заместитель. Можно сделать предположение о том, что наличие данного радикала у производного 2-меркаптобензимидазола способствует проявлению нейропсихотропных свойств. Данное вещество также является перспективным для дальнейшей химической модификации и углубленного изучения нейропсихотропной активности.
Результаты, полученные в тесте “Открытое поле”, по ряду показателей свидетельствуют о более выраженном активирующем действии производных 2-меркаптобензимидазола в сравнении с производными 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола. Так, средний показатель вертикальной активности животных, которым вводили соединения AZH, в 1.6 раз больше, чем показатель животных под действием соединений BIF. Средний показатель поисковой активности мышей после введения производных 2-меркаптобензимидазола оказался выше, чем показатель мышей, которым вводили производные 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола в 3.5 раза. Данные параметры свидетельствуют о развитии у животных, под действием соединений AZH, явного исследовательского интереса, превышающего данный показатель у мышей под действием соединений BIF. Этот эффект может быть интерпретирован как характерный признак более выраженного противотревожного действия, которым обладают соединения группы AZH.
Показатели количества груминга, уринаций, болюсов и выходов в центральную часть установки опытных групп животных не показали статистических различий между группами препаратов сравнения. Оценка миорелаксирующей активности животных которым вводили соединения AZH в тестах “Сетка”, “Проволока” и “Ротарод” так же подтверждает перспективность их дальнейшего изучения, так как данные, полученные в результате 3 тестов аналогичны показателям группы контроля, что может расцениваться как отсутствие развития, выраженного миорелаксирующего действия. Животные, которым вводили производные BIF, показали различный уровень миорелаксирующей активности, в целом уступающий как соединениям AZH, так и контролю, но превосходящий показатели групп диазепама и афобазола, что является перспективным моментом при дальнейших доклинических исследованиях данных веществ.
Концепция совмещения 2 подклассов (бензимидазола и бифенила) при синтезе базовой структуры, является перспективной, соединения проявляют различный уровень антифобического действия. В то же время, при оптимизации химической формулы производных имидазобензимидазолов необходимо обратить внимание на фармакологическую структуру наиболее сходного препарата сравнения – афобазола, а также его нейропсихотропные свойства и взаимодействие с различными видами мишеней (рецепторы гамма-аминомасляной кислоты, серотониновые, сигма-рецепторы), так как, исходя из химической схожести сравниваемых соединений двух подклассов, можно предположить аналогичный механизм их действия и прогнозировать основные и побочные эффекты.
При детальном рассмотрении двух серий веществ стоит отметить, что коровая структура 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола (BIF) не уступает структуре 2-меркаптобензимидазола по проявлению основного нейропсихотропного действия, что говорит о преспективности дальнейшей химической оптимизации и углубленного фармакологического изучения соединений-лидеров этой группы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические структуры соединений синтезированы сотрудниками НИИ ФОХ ЮФУ при финансовой поддержке Министерства образования и науки Российской Федерации (проект № 4.5821.2017/8.9).
Эксперименты проводили на половозрелых мышах самцах массой 18–23 г. Животных содержали в условиях вивария с естественным световым режимом на стандартной диете лабораторных животных, без ограничения доступа к еде и воде (ГОСТ Р 50258-92) с соблюдением Международных рекомендаций по защите позвоночных животных, используемых при экспериментальных исследованиях [13]. Животных разделили на группы по 6 животных в каждой. Изучаемые вещества вводили перорально за 30 мин до начала наблюдения. Контрольным группам вводили растворитель (дистиллированная вода), животным групп препаратов сравнения – диазепам (Реланиум, “Польфа”, Польша) в дозе 1 мг/кг, афобазол (ООО “Фармстандарт”, Россия) в дозе 5 мг/кг, исследуемые вещества вводили примерно в эквимолярных препарату сравнения (диазепам) дозах.
Метод изучения анксиолитической активности в тесте “Приподнятый крестообразный лабиринт” основан на естественном предпочтении грызунами темных пространств, а также на страхе нахождения на открытых площадках и падения с высоты [14]. Животных помещали в приподнятый крестообразный лабиринт и в течение 5 мин регистрировали следующие показатели анксиолитической активности: количество переходов между рукавами, количество выходов в светлый рукав, количество переходов из светлого рукава в светлый, количество переходов из светлого рукава в темный, количество переходов из темного рукава в темный и время нахождения в открытом рукаве (секунды).
Изучение влияния на поведение мышей проводили в тесте “Открытое поле”. В ходе наблюдения за животными регистрировали показатели: горизонтальную и вертикальную двигательную активность, поисковую активность (заглядывания животного в отверстия). В табл. 3 приведены усредненные количественные акты каждого изучаемого показателя, обработанные статистическим критерием Краскелла–Уоллиса. Время наблюдения составляло 5 мин.
Миорелаксирующую активность исследовали в установке “Вращающийся стержень” (ротарод) [15], а также с использованием тестов “Удержание на проволоке” и “Удержания на сетке”. В тесте “Вращающийся стержень” исследуемое животное помещалось в установку на 30-секундный период, все животные перед началом исследования подвергались приучению – нахождению на вращающемся стержне. В день проведения эксперимента, после 30-минутной инкубации (после введения веществ) животных помещали на вращающийся стержень и регистрировали время удержания на нем. Полученные данные представлены в табл. 4 и представляют собой усредненные значения времени нахождения животных на вращающемся стержне. В тестах “Удержания на проволоке” и “Удержание на сетке” (табл. 4) фиксировалась способность мышей удерживаться на них в течение 30 с. Измерение миорелаксирующей активности в тесте “Удержания на сетке” выражали в баллах таким образом: если животное все время эксперимента держалось за проволоку всеми 4 лапами – эта мышь оценивалась в 4 балла, если 3 лапами – 3 балла, 2 лапами – 2 балла, 1 лапой – 1 балл, если животное падало с установки – 0 баллов. Измерение миорелаксирующей активности в тесте “Удержания на проволоке” так же выражали в баллах: если животное во время эксперимента было способно подтянуться всем телом и забраться всеми 4 лапами на проволоку – 4 балла, если мышь была способна воспользоваться только 3 конечностями и оставалась в подвешенном состоянии – 3 балла, если животное все время эксперимента висело на 2 лапах – 2 балла, если висело на 1 лапе – 1 балл, если мышь падала с установки – 0 баллов.
Статистическую обработку результатов исследования осуществляли с использованием теста Вилкоксона, критерия Краскела–Уоллиса с постобработкой тестом Данна. Обсчет реализован в программе GraphPadPrism 5.0.
ЗАКЛЮЧЕНИЕ
Таким образом, изучение производных 11Н-2,3,4,5-тетрагидро[1,3]диазепино[1,2-a]бензимидазола (BIF) и 2-меркаптобензимидазола (AZH) на модели “Приподнятый крестообразный лабиринт” показало наличие у этих соединений анксиолитической активности. Для 6 из 12 соединений характерно проявление противотревожной активности в дозе 1 мг/кг, примерно эквимолярной диазепаму. Наиболее активным соединением среди изученных производных бифенилметилдиазепинобензимидазолов BIF оказался содержащий карбоксильную группу гидробромид 4'-(2,3,4,5-тетрагидро-11Н-[1,3]диазепино[1,2-a]бензимидазол-11-илметил)бифенил-2-карбоновой кислоты (BIF-66), а для производных 2-меркаптобензимидазола – AZH-57, соединение с морфолиноэтильным радикалом в качестве S-заместителя. Данные соединения не только не уступали по уровню активности диазепаму и афобазолу, но и превосходили их. Причем для них, в отличие от диазепама, не характерно проявление миорелаксирующего и седативного действия.
Список литературы
Ладыженский М.Я., Городничев А.В., Костюкова Е.Г. // Современная терапия психических расстройств. 2014. №. 2. С. 20–25.
Гафаров В.В., Гагулин И.В., Громова Е.А., Панов Д.О., Гафарова А.В. // Неврология, нейропсихиатрия, психосоматика. 2017. Т. 9. №. 4. С. 31–37.
Спасов А.А., Диваева Л.Н., Мальцев Д.В., Кузьменко Т.А., Морковник А.С., Мирошников М.В., Таран А.С., Золотова Е.А. // Вестник Волгоградского гос. мед. университета. 2018. Т. 67. № 3. С. 19–23.
Данилов Д.С. // Неврология, нейропсихиатрия, психосоматика. 2018. Т. 10. № 4. С. 4–12.
Domingues M., Casaril A.M., Birmann P.T., Bampi S.R., Lourenço D.A., Vieira B.M., Dapper L.H., Lenardão E.J., Sonego M., Collares T., Seixas F.K., Brüning C.A., Savegnago L. // Behavioural Brain Research. 2019. V. 366. P. 96–107.
Султанова К.Т., Яковлев Д.С., Мальцев Д.В., Мирошников М.В., Морковина Я.В., Анисимова В.А., Морковник А.С. // Вестник Волгоградского государственного медицинского университета. 2018. Т. 67. №. 3. С. 28–32.
Denis A. Babkov, Olga N. Zhukowskaya, Alexander V. Borisov, Valentina A. Babkova, Elena V. Sokolova, Anastasia A. Brigadirova, Roman A. Litvinov, Alexandra A. Kolodina, Anatolii S. Morkovnik, Vadim S. Sochnev, Gennady S. Borodkin, Alexander A. Spasov // Bioorg. Med. Chem. Lett. 2019. 29. № 17. P. 2443–2447.
Harsanyi Kalman, Maderspach Andrea, Javor Andras, Hajos Gyoergy, Fekete Gyoergy, Szporny Laszlo, Tetenyi Peter, Csomor Katalin, Karpati Egon // Ger. Offen. 1986. DE 3608032 A1 19860911.
Красновский А.Н., Kochergin, P. M. // Хим. гетероцикл. соед. 1969. № 2. 316–320.
Mohan Jag, Pujari H.K. // Ind. J. Chem. 1972. 10(3). 274–276.
Goldfarb David Scott // U.S. Pat. Appl. Publ. 2009, US 20090163545 A1 20090625.
Хомутов А.Е., Пурсанов К.А., Лушникова О.В., Романова Ю.А. // Вестник Нижегородского университета им. Н.И. Лобачевского. 2014. Т. 1. № 3. С. 48–52.
Воронина Т.А. // Руководство по проведению доклинических исследований лекарственных средств / Под ред. Миронова А.Н. 2012. Ч. 1. С. 264–275.
Таран А.С., Мальцев Д.В., Яковлев Д.С., Караваева Т.В., Ткаченко Ю.О., Диваева Л.Н., Морковник А.С., Кузьменко Т.А. // Волгоградский научно-медицинский журнал. 2017. Т. 53. № 1. С. 24–26.
Морковин Е.И., Куркин Д.В., Тюренков И.Н. // Журнал высшей нервной деятельности им. И.П. Павлова. 2018. Т. 68. № 1. С. 3–15.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


