Биоорганическая химия, 2020, T. 46, № 2, стр. 170-179
Одновременное определение тиреотропного гормона и свободного тироксина в сухих пятнах крови человека с использованием фосфоресцентных наночастиц
Н. И. Бекман 1, С. Ю. Ларичева 1, Т. А. Быченкова 2, В. Г. Помелова 1, Н. С. Осин 2
1 ФГУП “Государственный научно-исследовательский институт биологического приборостроения”
125424 Москва, Волоколамское шоссе, 75/1, Россия
2 ЗАО “ИММУНОСКРИН”
125424 Москва, Волоколамское шоссе, 75/1, Россия
Поступила в редакцию 21.06.2019
После доработки 27.08.2019
Принята к публикации 24.09.2019
Аннотация
На основе технологии фосфоресцентного анализа (ФОСФАН) разработана экспериментальная тестовая система для одновременного определения маркеров состояния функции щитовидной железы – свободного тироксина (fT4) и тиреотропного гормона (TSH) – в высушенных образцах крови человека. Иммуноанализ гормонов проводили с использованием специфических микроэрреев (диаметр 0.35 мм), напечатанных на дне лунок полистиролового 96-луночного микропланшета, и системы детекции на основе полистироловых наночастиц (диаметр 46 ± 14 нм), содержащих инкорпорированную длительно люминесцирующую фосфоресцентную метку (1960 молекул на частицу) на основе хелатных комплексов Eu(III). Интенсивность флуоресценции измеряли в режиме временного разрешения. Исследованы значения аналитических параметров и возможные ограничения разработанной системы. Система обеспечивала одновременное обнаружение высокомолекулярных и низкомолекулярных соединений в клинически значимых диапазонах концентраций – от 2.0 до 50 пмоль/л для fT4 и от 0.8 до 50 мкМЕ/мл для TSH. Чувствительность анализа составила 1.0 ± 0.2 пмоль/л (fT4) и 0.3 ± 0.1 мкМЕ/мл (TSH), что соответствовало порогам обнаружения 3 × 10–18 моль Т4 и 0.9 × 10–9 МЕ TSH. Тест правильно определил концентрации TSH и Т4 в стандартных образцах, используемых в программах оценки качества, а также тиреоидный статус исследованных пациентов (n = 48). Результаты определения гормонов в высушенных пятнах крови с помощью экспериментальной тестовой системы хорошо коррелировали с результатами определения гормонов в образцах сыворотки с использованием коммерческих наборов (r = 0.9730 для TSH и r = 0.8585 для свободного Т4). Основной недостаток системы состоит в высокой вариабельности результатов измерений (до 20%), что ограничивает возможность ее использования для количественного определения уровня гормонов в крови пациента. Мы считаем, что эта система может быть полезна для выявления нарушений функции щитовидной железы в рамках существующих программ неонатального скрининга на врожденный гипотиреоз, а также при массовых скрининговых обследованиях групп риска взрослого населения, в частности в экологически неблагоприятных регионах.
ВВЕДЕНИЕ
Перспективное направление в развитии современных иммуноаналитических методов связано с созданием мультиплексных тестовых систем для одновременного определения в исследуемом образце нескольких (множества) аналитов. Регистрация сигнала от каждого из аналитов в мультиплексном формате становится возможной благодаря использованию метчиков с различными спектрально-люминесцентными свойствами [1, 2] либо вследствие пространственного разделения аналитов на твердой поверхности [3–8]. Второй подход был реализован нами при создании отечественной технологии фосфоресцентного анализа (ФОСФАН); в этом случае биочипы (микроэрреи) формируют на дне лунок многолуночного полистиролового микропланшета и используют длительно люминесцирующие метчики, сигнал от которых регистрируется в режиме временного разрешения (TRF) при сканировании поверхности лунки с помощью импульсного индикатора фосфоресценции [9]. Были предложены мультиплексные тестовые системы для выявления ряда биологически активных соединений [10, 11], в том числе при проведении скрининговых программ обследования населения [12, 13].
Применение мультиплексных тестов несомненно актуально для решения такой важной задачи, как ранняя диагностика дисфункции щитовидной железы человека. В качестве основных маркеров тиреоидных заболеваний обычно используют гормон щитовидной железы тироксин (Т4) и тиреотропный гормон гипофиза (TSH) [14]. Определение их уровня обычно проводится при исследовании сывороток венозной крови [15]. Однако для массовых скрининговых исследований более перспективным источником биологического материала могут служить высушенные на фильтровальной бумаге образцы капиллярной крови (DBS); это связано со снижением стоимости сбора, транспортировки и хранения таких образцов, а также снижением травматичности и инфекционной опасности проводимого исследования [16–18].
Ранее нами предложен подход к одновременному определению TSH и Т4 в сухих образцах крови человека с использованием технологии ФОСФАН и длительно люминесцирующего комплекса Pt-копропорфирина в качестве метчика биомолекул [19]. Метод позволял измерять уровни TSH и общего Т4 в диапазонах концентраций, применяемых при скрининге новорожденных на врожденный гипотиреоз. Однако чувствительность этого подхода оказалась недостаточной для обследования взрослых пациентов, что было обусловлено рядом причин. Во-первых, у взрослых пациентов концентрация TSH может быть очень низкой [20]. Кроме того, при обследовании таких пациентов большей диагностической ценностью обладает определение свободной, не связанной с белками фракции Т4 (fT4), доля которой составляет лишь 0.03% от общего количества Т4 в крови [21]. Более того, поскольку для анализа используют бумажный диск диаметром 3.2 мм, способный впитать всего 3 мкл цельной крови человека, то экстрагируемый из него объем пробы примерно в 100 раз ниже, чем объем сывороточных проб. Попытки увеличить число исследуемых дисков приводили к снижению специфичности и необходимости введения стадии предварительной экстракции исследуемой пробы из диска, что усложняло процедуру проведения анализа.
Повышение чувствительности теста для одновременного определения указанных гормонов в сухих пятнах крови взрослых пациентов стало возможным с появлением новых методов детекции на основе фосфоресцентных наночастиц [22, 23]. Синтезированы и детально охарактеризованы полистироловые наночастицы, покрытые стрептавидином и содержащие инкорпорированную фосфоресцентную метку (хелатные комплексы Eu3+/2-нафтоилтрифторацетон) [22]; продемонстрирована возможность их применения для создания высокочувствительной системы для определения TSH [23].
В настоящей работе исследована возможность совмещения в едином формате конкурентной (выявление fT4) и неконкурентной (выявление TSH) схем анализа с применением детектирующей системы на основе фосфоресцентных наночастиц с целью создания тестовой системы для одновременного количественного определения уровня гормонов fT4 и TSH в сухих пятнах крови человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для разработки тестовой системы одновременного определения маркеров щитовидной железы TSH и fT4 в сухих пятнах крови использовали технологию ФОСФАН [9]. На дне лунок стандартных полистироловых 96-луночных планшетов для микроанализа (рис. 1а) иммобилизовали микроэрреи (микрозоны диаметром 0.35 мм), предназначенные для выявления TSH (TSH-эрреи) или Т4 (Т4-эрреи). На стадии иммуноанализа гормоны экстрагировали из исследуемого образца (пропитанного кровью бумажного диска диаметром 3.2 мм) в раствор, где взаимодействовали со специфическими биотинилированными антителами (рис. 1б). При этом в реакционном растворе одновременно осуществлялся сэндвич-анализ TSH и конкурентный анализ Т4 (рис. 1б). Образующиеся в результате иммунных реакций комплексы на микроэрреях TSH и Т4 детектировали с помощью универсального реагента, представляющего собой полистироловые наночастицы с инкорпорированным хелатом европия, покрытые ковалентно связанным стрептавидином (рис. 1в). Для регистрации результатов анализа дно лунки планшета сканировали в режиме TRF с помощью специального прибора-индикатора.
Рис. 1.
Схема одновременного определения TSH и fT4 методом ФОСФАН с использованием фосфоресцентных наночастиц, где (а) – лунка 96-луночного планшета с нанесенными на дне микроэрреями для выявления TSH и Т4; (б) – иммунореакции TSH и Т4, экстрагирующихся из исследуемого сухого образца крови (DBS), с меченными биотином (Bi) специфическими антителами и микроэрреями; (в) – детекция образовавшихся иммунных комплексов с помощью покрытых стрептавидином (Str) наночастиц с инкорпорированным европием (Eu).

В основу проведения иммуноанализа была положена схема, оптимизированная ранее для сэндвич-анализа TSH [23]. С учетом этого, было необходимо оценить пригодность выбранных для детекции TSH условий (длительность отдельных стадий иммуноанализа, концентрация биотинилированных антител и детекторных наночастиц) для конкурентного анализа свободной фракции гормона Т4. Определение данного низкомолекулярного гормона проводили с использованием биотинилированных моноклональных анти-Т4-антител и Т4-эрреев, содержащих конъюгированный с белком аналит. Так как метод определения fT4 в сухих пятнах крови должен обладать очень высокой чувствительностью (порог обнаружения не более 3 × 10–18 моль Т4 из образца, содержащего 3 мкл крови), мы использовали известный гетерологичный подход к построению иммуноанализа низкомолекулярных соединений [24].
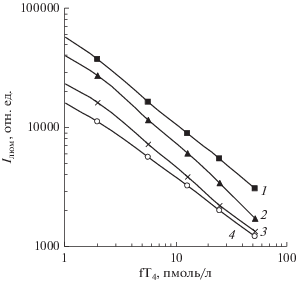
На Т4-эрреях иммобилизовали конъюгат трииодтиронина Т3-BSА, с которым используемые моноклональные анти-Т4-антитела связывались несколько слабее, чем с Т4, обеспечивая тем самым более сильное ингибирование связывания при низких уровнях аналита в исследуемой пробе. Для оптимизации иммуноанализа fT4 было изучено влияние количества анти-Т4-антител в реакционной смеси на характер кривых ингибирования сигнала люминесценции, регистрируемого на Т4-эрреях (рис. 2). Максимальный наклон кривых ингибирования достигался при добавлении 1 нг биотинилированных антител на лунку (рис. 2). Остальные условия, выбранные ранее для определения TSH, являлись оптимальными и для детекции fT4. При этом обеспечивался 1000-кратный динамический диапазон сигналов люминесценции, регистрируемых на Т4-эрреях: от 100 000 отн. ед. при исследовании образцов, не содержащих Т4, до фоновых значений менее 100 отн. ед. при исследовании образцов с высоким уровнем Т4, обеспечивающим полное ингибирование специфического связывания анти-Т4-антител с Т4-эрреями. Имеряемые концентрации охватывал клинически важный диапазон 0 (2)–50 пмоль/л fT4 (рис. 2).
Рис. 2.
Зависимость интенсивности регистрируемого сигнала на Т4-эрреях от концентрации гормона fT4 в исследуемом образце по результатам иммуноанализа в присутствии различных количеств биотинилированных анти-Т4-антител (1 – 2.0 нг/лунка; 2 – 1.0 нг/лунка; 3 – 0.5 нг/лунка и 4 – 0.25 нг/лунка).
Совмещение конкурентного иммуноанализа fT4 и сэндвич-анализа TSH в едином формате не оказывало влияния на специфичность определения гормонов из сухих образцов цельной крови человека, что подтверждалось отсутствием перекрестной реактивности компонентов иммунореакции. Наличие в пробе TSH в высокой концентрации (до 250 мкМЕ/мл) не влияло на результат определения fT4 (вариации в уровне сигнала не выходили за пределы приборной ошибки измерений); и наоборот, высокая концентрация fT4 (до 200 пмоль/л) не оказывала влияния на результат определения TSH. Использование в реакционной смеси биотинилированных анти-Т4-антител в выбранной концентрации (1 нг на лунку) не приводило к росту фонового сигнала, регистрируемого на TSH-эрреях. С другой стороны, для сохранения невысокого (не более 100 отн. ед.) уровня фонового сигнала на Т4-эрреях требовалось некоторое снижение содержания биотинилированных анти-TSH-антител. Добавление в реакционную смесь бумажного диска, пропитанного кровью человека, не содержащей Т4 и TSH, не приводило к заметному изменению уровня сигнала, регистрируемого на Т4- и TSH-эрреях; это свидетельствовало об отсутствии неспецифического влияния различных компонентов крови человека или бумажных волокон из диска на результат анализа.
При создании калибровочных проб для двойного теста (высушенные на бумаге пятна крови, содержащие смесь двух гормонов) возникла проблема выбора методов, способных правильно измерить содержание свободной (несвязанной с белками) фракции Т4 или очень низкие уровни TSH. Так как аттестованные наборы для решения этих задач отсутствуют, мы разработали свои подходы к ориентировочной оценке концентрации обоих гормонов в калибровочных пробах. При подготовке калибровочных проб путем добавления определенных количеств Т4 в раствор эритроцитарной массы, предварительно очищенной от гормонов и доведенной сывороточными белками, получаемые уровни свободной фракции Т4 не зависели линейно от уровня добавленного Т4. При увеличении уровня Т4 в крови доля гормона, связанного с белками крови, снижалась, что вызвано, по-видимому, ограниченным количеством мест связывания с Т4 на соответствующих белках крови. Высушивание проб крови на бумаге и последующая экстракция гормона в реакционный раствор вносили дополнительные изменения в состояние равновесия гормон-белок. В связи с этим, для правильной оценки уровня fT4 в калибровочных пробах были приготовлены специальные стандарты в виде высушенных пятен крови, получаемой смешением отмытой эритроцитарной массы с сыворотками крови человека с известным содержанием fT4. Концентрацию TSH в изготовленных калибровочных пробах измеряли с помощью коммерческого набора реагентов для неонатального скрининга. Так как чувствительность этого набора недостаточна для измерения уровней TSH ниже 2 мкМЕ/мл, была применена модифицированная методика анализа [20], включавшая стадию предварительной экстракции гормона из 5 дисков с последующим измерением концентрации TSH в полученном экстракте. Диапазоны измеренных таким образом концентраций в калибровочных пробах составили 0 (2)–50 пмоль/л fT4 и 0 (0.8)–50 мкМЕ/мл TSH.
Оценена возможность повышения чувствительности анализа обоих гормонов путем увеличения их концентрации в реакционном растворе за счет использования меньшего объема буфера, экстрагирующего гормоны из бумажного диска. Благодаря проведению реакции на микроэрреях, объем буферного раствора в лунке можно было снизить с 200 до 15 мкл. Однако, в ходе этих опытов было обнаружено, что наряду с ожидаемым повышением чувствительности анализа существенно возрастала вариабельность результатов. Яркость результирующего свечения микроэрреев, расположенных в центре дна некоторых лунок планшета, становилась заметно слабее или полностью исчезала, при этом доля таких лунок могла достигать 20%. Вероятно, наблюдаемый эффект вызван использованием интенсивного перемешивания при проведении реакции, что было необходимо для полной экстракции исследуемых гормонов из образца, но могло приводить к механическому стиранию микроэрреев бумажным диском в центре дна лунки планшета. В результате коэффициент вариации (КВ) измеряемых значений концентрации гормонов резко возрастал, особенно, при определении fT4, когда КВ мог превышать 50%. Существенное возрастание ошибки измерения fT4, по-видимому, свидетельствует о том, что конкурентный тип твердофазного иммуноанализа более чувствителен к вариациям в содержании иммобилизованных на твердой фазе аналитов, чем сэндвич-анализ. Выбранный объем реакционного буфера, при котором доля обнаруженных “дефектных” лунок не превышала 0.1%, составил 100 мкл. Увеличение объема не снижало вариабельность результатов, но приводило к пропорциональному уменьшению чувствительности анализа гормонов. Таким образом, в ходе проведенных исследований были выявлены определенные ограничения в использовании преимуществ метода микроэрреев при анализе высушенных на бумаге пятен биологических жидкостей.
Достигнутые параметры мультиплексной системы
Разработанная тестовая система позволяет проводить одновременное определение гормонов fT4 и TSH в диапазонах концентраций, клинически важных для обследования как новорожденных, так и взрослых пациентов. Калибровочные кривые имеют линейный характер в диапазоне от 2 до 50 пмоль/л тироксина (рис. 3а) и от 0.8 до 50 мкМЕ/мл тиротропина (рис. 3б). Чувствительность анализа (рассчитана по формуле, описанной в эксперимент. ч.), составила 1.0 ± ± 0.2 пмоль/л fT4 и 0.3 ± 0.1 мкМЕ/мл TSH, что соответствует порогам обнаружения в сухом образце 3 × 10–18 моль Т4 и 0.9 × 10–9 МЕ TSH. По данному параметру двойной тест значительно опережает коммерческие тестовые системы для анализа fT4 (40 × 10–18 моль Т4), но уступает наиболее чувствительным из существующих в настоящее время тестам на TSH (0.1 × 10–9 МЕ TSH) [15]. Однако, следует учитывать, что коммерческие тесты предназначены для анализа жидких сывороток, а не высушенных образцов цельной крови.
Рис. 3.
Типичные калибровочные графики для одновременного определения TSH (а) и fT4 (б) в сухих пятнах крови: кривая зависимости интенсивности люминесценции (Ilum) на TSH-эррреях от концентрации TSH в исследуемых образцах и кривая зависимости степени ингибирования интенсивности люминесценции $\left( {{{{{I}_{{{\text{lum}}}}}} \mathord{\left/ {\vphantom {{{{I}_{{{\text{lum}}}}}} {I_{{{\text{lum}}}}^{0}}}} \right. \kern-0em} {I_{{{\text{lum}}}}^{0}}}} \right)$ на Т4-эрреях от концентрации fT4 в исследуемых образцах. Приведены средние значения интенсивностей при 10 повторных измерениях.

Воспроизводимость и правильность измерений концентрации гормонов оценивали по результатам анализа контрольных проб с известным содержанием гормонов (процедура расчета этих показателей описана в эксперимент. ч.). Двойной тест позволил правильно определить концентрации TSH и Т4 в стандартных образцах, полученных в рамках международных и российских программ внешней оценки качества измерений (табл. 1). Исследование воспроизводимости метода выявило значительную вариабельность (до 20%) результатов анализа обоих гормонов как в одной постановке, так и между постановками анализа. Согласно ГОСТ Р 51352-2013, допустимое значение коэффициента вариации результатов при количественном определении аналитов в высушенных на бумаге пятнах крови составляет 15%. Наблюдаемые в двойном тесте более высокие значения этого показателя связаны, по-видимому, с использованием меченых наночастиц, часть которых может десорбироваться с микроэрреев в составе крупных иммунокомплексов.
Таблица 1.
Результаты одновременного определения концентрации TSH и fT4 в стандартных образцах сухих пятен крови человека
| Исследуемый материал | Концентрация TSH, мкМЕ/мл | Концентрация fT4, пмоль/л | ||
|---|---|---|---|---|
| заданная | измеренная тестовой системой | заданная | измеренная тестовой системой | |
| Стандартный образец из тестовой системы | 6.5–11.2 | 7.8 ± 1.2 | 5.2– 9.1 | 7.0 ± 1.1 |
| Стандартные образцы CDC* | ||||
| лот 1411 | 8.0–14.3 | 9.3 ± 1.4 | ||
| лот 1412 | 14.9–23.6 | 18.3 ± 2.9 | ||
| лот 1413 | 30.2–49.1 | 39.4 ± 6.1 | ||
| лот 1302 | 5.0–8.6 | 7.4 ± 1.2 | ||
| лот 1303 | 8.8–14.1 | 11.4 ± 1.8 | ||
| Стандартные образцы ФСВОК** | ||||
| лот 1–17 | 3.9–6.1 | 4.8 ± 0.8 | ||
| лот 2–17 | 18.5–28.1 | 24.2 ± 3.8 | ||
| лот 3–17 | 11.8–18.1 | 14.7 ± 2.3 | ||
Таким образом, использование детекторной системы на основе фосфоресцентных наночастиц позволяет кардинально (более чем в 10 раз) повысить чувствительность анализа, однако приводит к существенному увеличению вариабельности его результатов. Экспериментальные подходы к улучшению воспроизводимости результатов прорабатываются нами в настоящее время.
Исследование клинических образцов
Аналитические характеристики двойного теста оценивали при анализе клинических образцов крови от пациентов с различным тиреоидным статусом, в том числе от 24 пациентов с эутиреозом (TSH и Т4 в норме), 14 пациентов с гипотиреозом (Т4 снижен и/или TSH повышен) и 10 пациентов с гипертиреозом (Т4 повышен и/или TSH снижен). Сыворотки крови этих пациентов были аттестованы по содержанию тиреоидных гормонов соответствующими коммерческими наборами для ИФА. Сравнение результатов детекции гормонов в сухих пятнах и в сыворотках крови показало высокую степень корреляции при анализе ТТГ (r = 0.9730, n = 48) (рис. 4а). Корреляция результатов определения fT4 была несколько ниже (r = 0.8585, n = 48) (рис. 4б); это можно объяснить тем, что разные методы определения уровня свободного, несвязанного с белками, гормона вносят свои искажения в равновесие гормон – белок, особенно при использовании различных типов исследуемых образцов (сывороток или высушенных на бумаге пятен цельной крови).
Рис. 4.
Сравнение результатов одновременного определения гормонов TSH (а) и fT4 (б) в высушенных образцах крови пациентов с результатами исследования сывороток крови этих пациентов коммерческими ИФА-тестами фирмы ХЕМА. Для удобства сравнения значения концентрации гормонов приведены в пересчете на содержание в крови.

Важным условием для применения разработанного двойного теста для диагностики состояний функции щитовидной железы является способность правильно оценивать тиреоидный статус пациента по результатам исследования высушенных образцов крови. Было показано, что у здоровых пациентов измеренные концентрации обоих гормонов соответствовали нормальным значениям (3.0–8.0 пмоль/л fT4 и 0.15–1.8 мкМЕ/мл TSH); у всех 4 пациентов с высоким уровнем fT4 в сыворотке обнаружены повышенные значения fT4 в сухих образцах; и, наконец, у всех 5 пациентов с пониженным содержанием fT4 в сыворотке выявлены низкие уровни fT4 в двойном тесте. Аналогичная корреляция результатов была выявлена при измерении концентрации TSH в сухих образцах и сыворотках крови от 9 и 6 пациентов с высоким и низким уровнем этого гормона соответственно. У 4 пациентов, в сыворотках которых (по данным ИФА) были определены очень низкие уровни ТТГ (менее 0.001 мкМЕ/мл), значения его концентрации в двойном тесте были существенно ниже расчетной чувствительности анализа. В целом, проведенные исследования показали, что использование двойного теста для измерения уровня TSH и fT4 в сухих пятнах крови позволило правильно оценить тиреоидное состояние всех обследованных пациентов.
Таким образом, разработана тестовая система для одновременного определения основных маркеров состояния функции щитовидной железы (TSH и fT4) в высушенных образцах крови человека. Исследованы возможности и ограничения таких систем для выявления высокомолекулярных (TSH) и низкомолекулярных (Т4) соединений при совмещении технологии микроэрреев и детекторных фосфоресцентных наночастиц в многолуночном формате полистироловых планшетов. Аналитические параметры теста позволяют проводить измерение гормонов в клинически важных диапазонах концентраций. Используя результаты анализа, можно правильно диагностировать тиреоидный статус пациента – эутиреоз, гипотиреоз или гипертиреоз. Высокая вариабельность результатов ограничивает возможность использования тестовой системы для количественного обследования уровня гормонов у конкретного пациента. Предложенный подход более применим для массовых скрининговых исследований с целью выявления тиреоидных патологий как у новорожденных, так и в группах риска взрослого населения, особенно в экологически неблагополучных регионах, для которых характерен высокий уровень развития патологий щитовидной железы.
Полученные результаты могут быть использованы при создании мультиплексных систем для одновременного иммунохимического определения аналитов (TSH, иммунореактивный трипсин, Т4 и 17α-гидроксипрогестерон) в рамках существующих программ неонатального скрининга, а также при разработке других программ массового обследования населения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Биологические материалы и реагенты, использованные в работе, перечислены ниже:
– стандартные образцы сухих пятен крови с известным содержанием TSH и Т4, полученные из Centers for Disease Control and Prevention (CDC, Atlanta, USA) в рамках международной программы контроля качества измерений в неонатальном скрининге (NSQAP);
– стандартные образцы сухих пятен крови с известным содержанием TSH, полученные из Центра внешнего контроля качества клинических лабораторных исследований (Россия) в рамках Федеральной системы внешней оценки качества (ФСВОК);
– стандартные образцы сывороток крови человека с известным содержанием fT4 (Bio-Rad);
– пятна крови от 48 пациентов, сыворотки крови которых были предварительно охарактеризованы по содержанию TSH и fT4 в лаборатории ХЕМА. Из них у 9 пациентов уровень TSH был повышен и у 6 пациентов – понижен, fT4 повышен у 4 пациентов и понижен у 5 пациентов;
– первичные (немеченые) моноклональные антитела (МКА) к β-субъединице молекулы TSH (ИММУНОСКРИН, Россия) для иммобилизации в виде улавливающих микроэрреев в лунках планшета;
– детекторные МКА к другому эпитопу β-субъединицы молекулы TSH (ИММУНОСКРИН) и МКА к Т4 (ИММУНОСКРИН) в виде конъюгатов с биотином, синтезированных по стандартной методике в соответствии с инструкцией для биотин-N-гидроксисукцинимидному эфиру компании “Sigma”. Концентрация белка в конъюгатах – 1 мг/мл, нагрузка биотина – 5–10 моль/ моль белка.
Получение конъюгированного антигена Т3-BSA. Для синтеза использовали Т3 – 3,3',5-трийодотиронин (triiodo-L-thyronine, Sigma, 95–98%), DMSO (Helicon, ACS Grade, 99.9%), BSA (Sigma, 99%) и водорастворимый карбодиимид EDC (Sigma). 5 мг Т3 растворяли в 5 мл смеси DMSO и дистиллированной воды (1 : 1) и приливали в раствор 5 мг BSA в 2 мл воды. Добавляли 20 мг EDC. Перемешивали в течение 24 ч при температуре 2–8°С, диализовали против дистиллированной воды и концентрировали до 1 мг/мл. Полученный конъюгат содержал 15 моль Т3 на 1 моль BSA.
Формирование эрреев. Для формирования эрреев использовали планшеты полистироловые 96-луночные с плоским дном (Nunc, MaxiSorb). Микроэрреи печатали контактным способом с помощью наноплоттера (ИММУНОСКРИН) с использованием игл диаметром 0.5 мм. На дне каждой лунки планшета формировали по 4 одинаковые микрозоны для TSH- и Т4-эрреев (схема расположения микрозон приведена на рис. 1а), с использованием, соответственно, первичных анти-TSH-МКА и Т3-BSA в концентрации 0.1 мг/мл. Планшет инкубировали в течение 18 ч при температуре 4°С, затем отмывали промывочным раствором (0.01 М Трис-HCl-буфер, pH 7.75, содержащий Tween-20 – 0.02%, NaCl – 8.7 мг/мл и NaN3 – 0.02%), вносили блокировочный раствор (0.5% раствор BSA) по 100 мкл в лунку и инкубировали в течение 1 ч при комнатной температуре с последующей аспирацией и высушиванием на воздухе.
Приготовление сухих калибровочных проб. Для приготовления проб использовали бланки из фильтровальной бумаги (Watman, 903), L-тироксин (Sigma), TSH (НИИ Эндокринологии, активность 7 МЕ/50 мкл) и эритроцитарную массу крови доноров, очищенную от гормонов Т4 и TSH (не более 5 нмоль/л Т4 и 0.001 мкМЕ/мл TSH). Для приготовления 6 калибровочных проб в раствор эритроцитарной массы (значение гематокрита 50–55%) добавляли TSH и L-тироксин в соотношении: 0/0; 0.8/2.5; 2/30; 5/60, 15/120; 50/240 мкМЕ/мл TSH/нмоль/л Т4, перемешивали и наносили по 100 мкл на бумажные бланки с последующим высушиванием на воздухе. Полученные пробы аттестовали по уровню TSH с помощью тест-системы TSH-НЕОСКРИН (ИММУНОСКРИН) с использованием методики постановки анализа, модифицированной, как описано ранее [23]. Для аттестации проб по уровню fT4 использовали образцы сухих пятен крови, приготовленные добавлением сывороток крови человека с известным содержанием fT4 в очищенную эритроцитарную массу (значение гематокрита 50–55%).
Характеристика наночастиц для детекции. В работе использованы биоспецифичные наночастицы, синтезированные по методике, подробно описанной в работе [22]. Диаметр синтезированных наночастиц находился в диапазоне от 40 до 60 нм (среднечисленный диаметр 46 ± 14 нм). Включение фосфоресценцентной метки составило 1960 молекул на частицу. Для покрытия поверхности наночастиц стрептавидином применяли одностадийный метод с использованием EDC. Полученная нагрузка – 123 молекул стрептавидина на частицу. Концентрация полученных биоспецифичных наночастиц 1012 частиц/мл.
Одновременное определение TSH и fT4 с использованием фосфоресцентных наночастиц. В лунки планшета с иммобилизованными эрреями вносили по 1 диску диаметром 3.2 мм, вырезанному панчером из калибровочных проб. Затем в лунки наливали по 100 мкл реакционного буфера (0.05 М Трис-HCl-буфер, pH 7.75, содержащий BSA – 0.5% и NaN3 – 0.01%), инкубировали при встряхивании при 750 об./мин в течение 5 мин, добавляли в каждую лунку по 25 мкл смеси биотинилированных анти-TSH-МКА (2 нг на лунку) и анти-Т4-МКА (1 нг на лунку), инкубировали при встряхивании в течение 1 мин и продолжали процедуру инкубации в течение 18 ч при температуре 4°С. После удаления дисков (DiscRemover, Perkin Elmer) и промывки планшета в лунки добавляли суспезию покрытых стрептавидином фосфоресцентных наночастиц в реакционном буфере (4 × 108 частиц на лунку). После завершения 2-часовой инкубации при встряхивании при 200 об./мин и проведения 6-кратной промывки (3 раза промывным буферным раствором и 3 раза дистиллированной водой) планшет высушивали и измеряли интенсивность фосфоресценции путем последовательного сканирования отдельных участков дна лунки планшета лазерным лучом с длиной волны излучения 340 нм в режиме выделения длительной люминесценции с максимумом 615 нм. Использовали индикатор фосфоресценции импульсный ИФИ-03 “Диагем” (регистрационное удостоверение № ФСР 2012/13913 от 08.08.2013 г., ИММУНОСКРИН). Результаты сканирования представляли в виде цветовой диаграммы пространственного распределения интенсивности регистрируемого сигнала по дну лунок планшета, а также в цифровом формате в виде средних значений сигналов, измеренных при сканировании 4 микрозон, предназначенных для выявления каждого аналита. Регистрируемая интенсивность люминесценции TSH-эрреев, была прямо пропорциональна, а интенсивность люминесценции Т4-эрреев, – обратно пропорциональна концентрации гормона в крови.
Чувствительность, воспроизводимость и правильность определения TSH и fT4. Чувствительность и воспроизводимость рассчитывали в соответствии с ГОСТ Р 51352-2013. При оценке чувствительности для каждого исследуемого гормона на оси ординат соответствующего графика зависимости интенсивности люминесценции (Ilum) от концентрации гормона откладывали среднее арифметическое значение Ilum$(I_{{{\text{lum}}}}^{{{\text{ср}}}})$ для калибровочной пробы, не содержащей гормонов, плюс (в случае TSH) или минус (в случае Т4) удвоенное среднеквадратичное отклонение (SD) и по графику определяли соответствующее значение на оси абсцисс (минимально достоверно определяемая концентрация гормона). Воспроизводимость оценивали величиной коэффициента вариации, который рассчитывали (в процентах) как отношение среднеквадратичного отклонения к среднему арифметическому значению концентрации гормона в контрольных пробах (число повторных измерений не менее 10). Правильность измерений концентраций TSH и fT4 проверяли по результатам исследования стандартных образцов сухих пятен крови человека. Если полученные значения находились в пределах заданного диапазона концентраций, то результат анализа считали правильным.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Для проведения исследования использовались образцы крови пациентов. Сведения о пациентах и полученные от них пробы анализировали ретроспективно, после удаления информации, позволяющей идентификацию результатов, следовательно, информированное согласие пациентов не требовалось.
Список литературы
Vignali D.A. // J. Immunol. Methods. 2000. V. 243 (1–2). P. 243–255.
Xu Y.Y., Pettersson K., Blomberg K., Hemmilä I., Mikola H., Lövgren T. // Clin. Chem. 1992. V. 38. № 10. P. 2038–2043.
Kricka L.J., Joos T., Fortina P. // Clin. Chem. 2003. V. 49. P. 2109.
Kingsmore S.F. // Nature Reviews Drug Discovery. 2006. V. 5. P. 310–321.
Kusnezow W., Syagailo Y.V., Rueffer S. et al. // Mol. Cell. Proteomics. 2006. P. 1–53.
Vasiliskov, A.V., Timofeev E.N., Surzhikov S.A., Drobyshev A.L., Mirzabekov A.D. // BioTechniques. 1999. 27:592–600.
Ekins R.P. // Clin. Chem. 1998. V. 44. P. 2015–2030.
FitzGerald S.P., Lamont J.V., McConnell R.I. // Clin. Chem. 2005. V. 51. P. 1165–1176.
Осин Н.С., Помелова В.Г., Соколов А.С., Быченкова Т.А., Бекман Н.И., Шарафудинова Т.Ю. и др. // Вестник РАМН. 2007. № 12. С. 7–9.
Pomelova V.G., Korenberg E.I., Kuznetsova T.I., Bychenkova T.A., Bekman N.I., Osin N.S. // PLoS One. 2015. V. 10. № 7. P. 1–4.
Osin N.S., Pomelova V.G. // Frontiers in Research. National Institute of Allergy and Infectious Diseases, NIH / Eds. Georgiev V.S., Western K.A., McGowan J.J. Totowa, NJ: Humana Press, 2008. P. 233–240.
Бекман Н.И., Ларичева С.Ю., Быченкова Т.А., Помелова В.Г., Осин Н.С. Мультианалитные фосфоресцентные иммуночипы для скрининга врожденных аномалий у новорожденных // I Международная научно-практическая конференция “Постгеномные методы анализа в биологии, лабораторной и клинической медицине” 17–19 ноября 2010 г. Москва.
Бекман Н.И., Помелова В.Г., Осин Н.С. // Клиническая лабораторная диагностика. 2018. № 3. С. 173–178.
Sterling K., Lazarus J.H. // Ann. Rev. Physiol. 1977. V. 39. P. 349–371.
Aoki Y., Belin R.M., Clickner R.J. // Thyroid. 2007. V. 17. P. 1211–1223.
Помелова В.Г., Осин Н.С. // Вестник РАМН. 2007. T. 12. С. 10–16.
Lehmann S., Delaby C., Vialaret J., Ducos J., Christophe Hirtz C. // Clin. Chem. Lab. Med. 2013. V. 51(10). P. 1897–1909.
Bellisario R., Colinas R.J., Pass K.A. // Clin. Chem. 2000. V. 46. P. 1422–1424.
Бекман Н.И., Быченкова Т.А. Ларичева С.Ю., Канаева Т.А., Смирнова В.Г., Демина Л.А., Помелова В.Г. Способ одновременного детектирования тиротропина и общего тироксина в сухих пятнах крови. Патент РФ № 2480772 // Б.И. 2013. № 12.
Помелова В.Г., Бекман Н.И., Ларичева С.Ю. Быченкова Т.А., Осин Н.С., Злобин В.Н. // Медицина экстремальных состояний. 2009. № 3. С. 43–50.
Oppenheimer J.H. // N. Engl. J. Med. 1968. V. 278. P. 1153–1162.
Парамонов Д.В., Кострюкова Т.С., Быченкова Т.А., Помелова В.Г., Осин Н.С. // Биоорган. химия. 2016. № 6. С. 1–10. [Paramonov D.V., Kostryukova T.S., Bychenkova T.A., Pomelova V.G., Osin N.S. // Russ. J. Biorgan. Chem. 2016. № 6. P. 1–10].
Помелова В.Г., Осин Н.С., Быченкова Т.А., Парамонов Д.В., Кострюкова Т.С. // Биоорган. химия. 2017. № 4. С. 367–376. [Pomelova V.G., Osin N.S., Bychenkova T.A., Paramonov D.V., Kostryukova T.S. // Russ. J. Biorgan. Chem. 2017. № 4. P. 367–376].
Данилова Н.П., Мертц М.В., Локшин Д.Р., Василов Р.Г. // Биоорган. химия. 1996. Т. 22. № 1. С. 34–38. [Danilova N.P., Mertz M.V., Lokshin D.R., Vasilov R.G. [Russ. J. Biorgan. Chem. 1996. V. 22. № 1. P. 34–38].
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


