Биоорганическая химия, 2020, T. 46, № 2, стр. 151-157
Димеры и тримеры хондроитина в молекулярном докинге с бычьей тестикулярной гиалуронидазой
А. В. Максименко , Р. Ш. Бибилашвили
Институт экспериментальной кардиологии, Национальный медицинский исследовательский центр кардиологии Министерства здравоохранения Российской Федерации
121552 Москва, 3-я Черепковская ул., 15А, Россия
Поступила в редакцию 12.09.2019
После доработки 27.09.2019
Принята к публикации 21.10.2019
Аннотация
Выполнен молекулярный докинг 3D модели бычьей тестикулярной гиалуронидазы с димерами и тримерами хондроитина. Установлено наличие на поверхности глобулы фермента восьми мест присоединения его лигандов. При биологических концентрациях хондроитиновых лигандов наиболее значимыми центрами их присоединения к биокатализатору оказываются позиции, обозначенные 6, 3 и 1, в результате чего обратимо искажается 3D структура белка. Взаимодействия 3D модели гиалуронидазы с лигандами хондроитина обусловлены, в основном, электростатическими силами. Для молекулы свободной гиалуронидазы (без лигандов) при температурах выше 300 К отмечались конформационные переходы, ведущие к инактивации фермента. Ее доминирующее проявление определялось притяжением молекулярного участка около аминокислотного остатка Glu-105 и белковых областей вокруг Arg-59 и Arg-96, которое оказывалось необратимым, когда снижение температуры не вызывало восстановления исходного вида 3D структуры молекулы фермента. Присоединение к ней лигандов хондроитина по центрам 6, 3 и 1 повышало температуру денатурации биокатализатора примерно на десять градусов. Наиболее заметный эффект стабилизации структуры гиалуронидазы вызывало связывание лиганда хондроитина по центру 6. Отмеченный эффект превосходил эффекты тримеров хондроитинсульфата в отношении ингибирования фермента тетрамером гепарина, для чего требуется связывание четырех-пяти лигандов хондроитинсульфата на молекулярной поверхности биокатализатора.
ВВЕДЕНИЕ
Микроокружение гиалуронидаз предстает одним из факторов регуляции их активности. Такое рассмотрение интересно с позиций понимания функционирования гликозидаз (проявляющих эндогликозидазную и трансгликозилазную активность), а так же в отношении направленного изменения тканевой проницаемости в терапевтических целях. Моделировать микроокружение гиалуронидаз можно в результате ковалентного присоединения к ферменту гликанов. Ранее было продемонстрировано, что при глубоких степенях модификации декстраном (96–98% по поверхностным аминогруппам белка от их исходного количества в нативном ферменте, главным образом, по Lys остаткам) гиалуронидаза приобретает выраженную резистентность к ингибированию гепарином [1]. Модификация аминогрупп биокатализатора декстрансульфатом (после его активации бензохиноном) уже при ее низких степенях (~15%) приводила к существенному снижению эндогликозидазной активности фермента, заметно ингибируемой избытком гепарина [2]. Можно полагать, что в результате сульфатирования нейтрального гомополимерного декстрана [Glc(α1-6)]n его структура становится более объемной и жесткой (с развитием в сульфатированном производном электростатических взаимодействий) и усиливается инактивирующее воздействие (посредством деформирующих конформационных и стерических затруднений) молекулы декстрансульфата на структуру гиалуронидазы [2]. Известно, что тестикулярная гиалуронидаза быстрее деструктурирует гиалуронан, чем хондроитинсульфат [3], подчеркивая влияние эффекта сульфатирования взаимодействующих компонентов. Более того, отмечена сходная активность гиалуронидазы с гиалуронаном и хондроитином (ХН) без сульфогрупп в их составе [4]. Экспериментальные данные демонстрируют, что ковалентное присоединение к гиалуронидазе гликозаминогликанов (ГАГ) разного вида вызывает инактивацию фермента сополимерными ГАГ (как гепарин (ГП) и дерматансульфат), а связывание с хондроитинсульфатом (ХС, полимерный ГАГ) стабилизирует биокатализатор против гепаринового ингибирования. Разнонаправленное (стабилизация/инактивация) влияние декстрана и декстрансульфата на гиалуронидазу может предполагать наличие на молекулярной поверхности фермента участков/центров лимитирующих взаимодействий с этими полисахаридами [2].
Экспериментальное изучение взаимодействий в области поверхностных контактов гиалуронидазы с ГАГ весьма затруднено высокомолекулярной природой последних. В настоящее время обоснованным и продуктивным предстает выполнение молекулярного докинга короткоцепочечных фрагментов/лигандов ГАГ. Следует заметить, что для такого теоретического (расчетного) исследования взаимодействия одной молекулы фермента с лигандами их размер не должен превышать по длине линейный размер белковой молекулы (для нашего случая не более двенадцати глюкозных звеньев полимерной цепи). Докинг тримеров ХС и тетрамеров ГП на бычью тестикулярную гиалуронидазу (БТГ) был проведен нами и обнаружил на молекулярной поверхности фермента наличие восьми потенциальных мест связывания ГАГ лигандов [5]. В соответствии с расчетами ГП лиганд может инактивировать фермент (при вхождении в его активный центр), а ХС лиганды могут оказывать протективное действие (так при занятости ими четырех-пяти центров связывания на биокатализаторе полностью предотвращалась инактивация БТГ лигандом ГП). Проведенные вычисления указывали на возможную регуляцию стабильности БТГ в результате конкурентных взаимодействий разных ГАГ лигандов с биокатализатором, обусловленных, главным образом, электростатическими силами. Последовательное составление расширенной картины докинга, оценка влияния сульфатирования его небольших компонентов, выявление взаимодействий перспективных для модифицирования БТГ с целью дизайна новых белковых структур медицинского назначения обосновывали значимость и определили задачи последующего этапа выполнения молекулярного докинга БТГ с короткоцепочечными лигандами (димер, тример) ХН. В настоящей работе предпринята попытка анализа механизма тепловой денатурации БТГ и влияния на нее ГАГ лигандов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведение молекулярного докинга 3D-модели БТГ [6] с димерами и тримерами ХН (несульфатированная форма ГАГ вида ([–4)GlcA(β1-3)GalNAc(β1–]n), где n равняется 2 или 3 соответственно [7]) выявило на поверхности глобулы фермента восемь потенциальных центров связывания этих лигандов (рис. 1). Отмеченные участки весьма близки, но не идентичны тем, по которым предсказывалось связывание тримера ХС и тетрамера ГП [5]. Следует напомнить об ограничениях построенной нами 3D модели БТГ, в которой отсутствуют 36 аминокислот с N-конца и несколько десятков аминокислот с С-конца [6]. Весьма вероятно, что N конец размещается в области между местами связывания ГАГ лигандов по центрам 1 и 2, тогда как расположение С-конца пока не определено даже предположительно.
Рис. 1.
Присоединение по восьми центрам/позициям связывания димеров и тримеров ХН (обозначенных как 1, 2, 3 и т.д.) на молекулярной поверхности БТГ. Молекула гиалуронидазы на рисунке ориентирована параллельно главной оси инерции белка вдоль горизонтальной оси, а субстратная долина так, что главная ось инерции додекамерного субстрата перпендикулярна плоскости рисунка. Молекула гиалуронидазы представлена в ленточной форме, альфа-спиральные участки показаны красным, бета-структура – зеленым, остальные желтым. ГАГ лиганды представлены в виде мелких шариков, соединенных цилиндрами, ионы Na и Cl – мелкими шариками, а молекулы воды – тонкими голубыми линиями. Участки 1, 2, 3 и 7 расположены в плоскости рисунка (1 и 7 посередине, 2 ближе к наблюдателю, а 3 дальше от наблюдателя), 4, 5 и 8 с дистальной стороны молекулы белка, а 6 занимает субстратную долину и его позиция перпендикулярна плоскости рисунка.

Статистически, при 12 кратном избытке ХН над БТГ (в “большой” ячейке) при температуре 300 К (27°С) структура, показанная на рис. 1, никогда не наблюдалась. Большей частью отмечалось образование комплексов с четырьмя лигандами на одну молекулу БТГ. Остальные лиганды были в свободном состоянии. Осуществлялось связывание с молекулой белка и трех лигандов (25%), очень редко двух, и никогда – пяти. Почти всегда были заняты позиции, обозначенные 1, 3 и 6 (нумерация центров связывания та же, что и при докинге лигандов ХС [5]). Среди указанных на белковой поверхности позиций наибольшей величиной свободной энергии связывания отличался центр 6 (–(620–690) ккал/моль). Для центра 3 эта величина составляла –(310–420) ккал/моль, а для центра 1 –(280–320) ккал/моль (при последовательном насыщении центров 6, затем 3 и 1). В роли четвертого центра присоединения ХН лигандов с равной вероятностью могли выступать позиции 2 и 7, характеризуемые величиной свободной энергии связывания –(150–180) и –(120–140) ккал/моль (при условии, что центры 6, 3 и 1 заняты, а при связывании со свободной БТГ величина свободной энергии связывания на 160–200 ккал/моль выше). Довольно редко были заняты центры 8 и 5, только один раз 4. Следует отметить, что величина энергии самих свободных ХН лигандов в водном растворе хлористого натрия (три катиона натрия вблизи тримера ХН и два катиона натрия около димера ХН) оказывается для тримера ХН ориентировочно как –320 ккал/моль, для его димера –(180–220) ккал/моль. Сравнение приведенных величин свидетельствует, что при биологических концентрациях ХН интерес представляют центры связывания ХН с БТГ по местам 6, 3 и 1, тогда как значимостью остальных вполне можно пренебречь.
БТГ в комплексе с природным субстратом (согласно расчетам [5]) стабильна против тепловой денатурации до 340 К. В отсутствие субстрата или других ГАГ олигосахаридов она должна денатурировать уже при температуре 320 К. Основной движущей силой деформации молекулы БТГ, приводящей к денатурации, является разность потенциалов между положительно заряженой средней частью молекулы и отрицательно заряжеными участками правой и левой периферийными зонами (рис. 1 и 2).
Рис. 2.
Электростатический потенциал молекулы БТГ в воде (рН 7.5) без учета влияния ионов Na и Cl. Изопотенциальные поверхности обозначены синим +1.6 В и красным цветом –1.2 В. Между правой и левой стороной субстратной долины (выделена черной окружностью) имеется существенная разность потенциалов. При низкой температуре под влиянием ионов Na и Cl разность потенциалов существенно снижается, и молекула БТГ сохраняет структуру даже в отсутствие субстрата. Но при повышении температуры, благодаря увеличению подвижности ионов, происходит деформация молекулы, приводящая к инактивации фермента. На заднем плане зеленым цветом показана поверхность молекулы БТГ. Цифрами обозначены центры присоединения ХН лигандов (позиция 8 расположена с дистальной стороны молекулы белка, как показано на рис. 1).

Вся система, изображенная на рис. 1 и 2, заключена в непроницаемое пространство, образованное 14 гексагональными гранями одинакового размера. Система состоит из молекулы гиалуронидазы при рН 7.5. При этом все Asp и Glu предполагаются электроотрицательными, Lys и Arg – положительно заряженными, а His, Cys и Tyr – электронейтральными. Возможности реполяризации соседних аминогрупп лизина и карбоксилов Asp и Glu с переносом протона и нейтрализации обоих в данной работе не учитывалась. Также игнорировался перенос протона между соседними His и Tyr с Asp или Glu. Молекула фермента имеет заряд +8.5 ае (атомных единиц) и дипольный момент 631 дебай с направленным вверх вектором (по рис. 1). Он в основном складывается из двух векторов, направленных под углом 45° к вертикали справа от 426 и 427 аминокислот к центральной плоскости и слева от 171, 104 и 105 аминокислот к центральной поперечной к рисунку плоскости молекулы. Хондроитиновые лиганды заряжены отрицательно: тримеры –3.2, а димеры –2.5. Вся система, показанная на рис. 1, содержит 8600 молекул воды и электронейтральна за счет избытка 15 ионов Na над Cl. Слои воды при конструировании водной оболочки разделены на три слоя под разными именами. Первый слой 1200 молекул, заполняющий пространство, отстоящее от макромолекулы на 5 Å, второй слой 7400 молекул, заполняющий 14-гранное пространство (показано на рис. 1), и третий – самый обширный слой, заполняющий шестигранную коробку с прямоугольными гранями, размеры которых вдвое превышали размеры длины макромолекулы вдоль ее осей инерции (77.5; 51.9; 53.8 Å) или зеркальный шар с радиусом 56 Å, описанный вокруг Tyr-265, локализованного вблизи центра инерции БТГ. Такая система содержит около 20 000 молекул воды и позволяет разместить около 100 ионов Na и Cl и 12 молекул олигосахарида, способствуя последним находить свои места на поверхности БТГ в динамике при 300 К. Основные расчеты тепловой денатурации производились для системы с 14 гексагональными гранями с 8600 молекулами воды. Докинг или анализ занятости БТГ лигандами проводились в “большой” ячейке. Разные названия для молекул воды позволяли при демонстрации структур либо вовсе не показывать воду, либо показывать только внутреннюю воду (1200 молекул воды), либо 8600. Слои воды в динамике, естественно, частично перемешивались.
Участки БТГ, ассоциированные с 1 участком вероятного связывания ГАГ, обогащены лизином (непосредственно K430, K446, K447 и R448 и в небольшом удалении R391, K392), ассоциированные со 2 участком – обогащены аргининами K244, R245, R246, R289 и K292, с 3 участком – аргининами (R59, R63 и R64). С 4 участком соседствуют K106, K109, K122, K127, с 5 – R72, K416, с 6 – R82, R96, K160, K162, R152, R307, с 7 – K152, R157, R166, K187, K190 и K198, с 8 – К122, К127, К129, K206, K209, R212.
Рис. 3 показывает динамику изменения структуры БТГ в отсутствие ГАГ при температуре выше 37°С. Деформация 3D структуры свободной БТГ без лигандов ХН была заметна уже при 37°С/310 К. С ростом температуры процесс сильно ускоряется. При температуре 320 К движение отрицательно заряженного белкового участка с Asp-104 и Glu-105 у его вершины по направлению к положительно заряженой зоне, образованной Arg-59, Arg-63, Arg-64 у участка 3 и Arg-96 в удаленном конце субстрат-связывающей долины, приводит к ее быстрому (за 35–40 пс) перекрыванию (рис. 3а, 3б, 3в). Такие конформационные изменения БТГ в отсутствии лигандов ХН были необратимы и снижение температуры не вызывало восстановления исходного вида структуры молекулы фермента (рис. 3г). Полученные данные внятно прогнозировали термоинактивацию биокатализатора. При этом интересны изменения расстояний между определенными аминокислотными остатками в 3D структуре БТГ (при 320 К в зависимости от времени наблюдения /пс/) (рис. 4). Наиболее заметным оказалось перемещение между позициями Glu-105 и Arg-59 (т.е. между пиком белковой цепи с Glu-105 на его вершине и положительно заряженным участком вокруг R59), представляющими важный начальный этап рассчитанной денатурации БТГ. Расстояния между другими аминокислотными остатками БТГ (ответственными за каталитическое действие аминокислотами Asp-147 и Glu-149, располагающимися в активном центре, и аминокислотами рядом и вокруг них Asp-147 и Asn-150, Glu-149 и Lys-162, Glu-149 и Trp-148) не оказались столь изменчивыми, но относительная ориентация отмеченных аминокислотных остатков изменялась значительно. Эти данные демонстрировали существенное искажение активного центра БТГ и полное закрытие входа для проникновения к нему субстрата, что определенно прогнозирует инактивацию фермента. Другие области БТГ также испытывали значительные изменения (рис. 3).
Рис. 3.
Кинетика тепловой денатурации свободной от ГАГ лигандов гиалуронидазы при температуре 320 К со временем расчетного наблюдения: (а) 1 пс, (б) 17 пс, (в) 40 пс, (г) 20 пс после снижения температуры до 287 К.

Рис. 4.
Изменение расстояний между позициями аминокислотных остатков E105R59 – 1, D147N150 – 2, E149W148 – 3, D147E149 – 4, E149K162 – 5 в зависимости от времени расчетного наблюдения (пс) при 320 К.

Симуляция поведения БТГ в комплексе с лигандами ХН обнаруживает их стабилизирующее действие на 3D структуру фермента при 320 и 340 К (рис. 5а–5в) в сравнении с рис. 3 для свободной БТГ. Присоединение лигандов ХН по центрам 6, 3 и 1 БТГ повышало виртуальную температуру денатурации фермента примерно на 10–15 K, значительно замедляло процессы деформации структуры БТГ и изменяло характер конформационных переходов в молекуле биокатализатора. Следует отметить значимый защитный эффект стабилизации структуры БТГ в результате присоединения лиганда ХН именно по центру 6 на белковой поверхности. Присутствие лиганда в позиции 6 не позволяло белковому пику с Glu-105 блокировать вход в субстратную долину, хотя движение в сторону смыкания с Arg-59, Arg-63, Arg-64 наблюдалось. Расчеты, симулирующие поведение системы при снижении температуры, в этом случае предсказывают высокую вероятность обратимости денатурации БТГ в присутствии ХН лиганда в субстратной долине (рис. 5г).
Рис. 5.
Кинетика тепловой денатурации БТГ в комплексе с ХН в положениях 1, 3 и 6 при температуре 340 К со временем наблюдения: (а) 3 пс, (б) 18 пс, (в) 36 пс, (г) 36 + 18 пс после снижения температуры до 287 К.
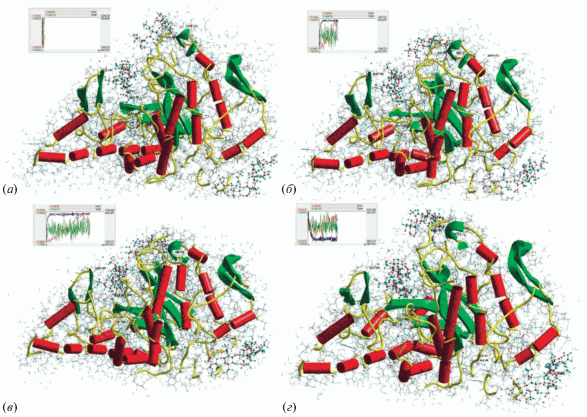
Необходимо отметить, что связывание ХН лигандов по центрам 6, 3 и 1 на молекуле БТГ (рис. 5а–5г) не вызывает заметных и необратимых конформационных изменений структуры фермента. Отметим, что ранее мы показали стабилизирующее действие субстрата (додекасахарида гиалуронана) БТГ на структуру фермента [5].
Интересно отметить, что малореалистичная (на экспериментальной практике) ситуация, когда ХН связан только по участкам 1, 2 и 3, виртуально также оказывает протективное действие на тепловую денатурацию БТГ, повышая температуру денатурации до 345 K и на порядок замедляя скорость реакции.
Учитывая, что в докинге БТГ с ХН лигандами с заметной вероятностью могут быть заняты на глобуле биокатализатора только центры 1, 2, 3 и 6, целесообразно оценить влияние ХН лигандов на структуру фермента.
ЗАКЛЮЧЕНИЕ
Стереоконфигурация специфического субстрата БТГ гиалуронана и использованного нами при выполнении молекулярного докинга ХН отличаются лишь конфигурацией атома С(4) в гексозаминовом остатке [8]. Предположительно, такие тонкие структурные различия лигандов могут заметно регулировать соотношение структура-функция гиалуронидаз. Полученные в работе данные демонстрируют, что ХН (в форме димера или тримера), N-ацетилированный по галактозному остатку, но несульфатированный, обладает стабилизирующим эффектом на 3D структуру БТГ (благодаря присоединению лиганда к ней, главным образом, по центру 6) при ее расчетной термоинактивации. Отметим, что влияние ХН лиганда превосходит влияние ХС лигандов в отношении ингибирования фермента тетрамером ГП, для чего необходимо присоединение четырех-пяти ХС лигандов по центрам их связывания на молекулярной поверхности биокатализатора [5]. Стабилизирующее влияние на 3D структуру БТГ тримерных лигандов ХС и ХН против различных воздействий (ингибирование гепарином и термоинактивация биокатализатора соответственно) обуславливает актуальность прямого сравнительного теоретического изучения эффектов этих лигандов с учетом взаимодействий БТГ с другими ГАГ компонентами природного микроокружения фермента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3D-модель БТГ в свободном виде, построенная нами ранее [6], была использована в качестве исследуемой молекулы фермента для выполнения расчетного молекулярного докинга с димерными и тримерными лигандами ХН.
Программы UCSF Chimera, Amber и DOCK были использованы для осуществления молекулярного докинга [9–11]. Выбор ХН лигандов проводили с базы данных Pubchem.ncbi.nlm.nih.gov, используя димер и тример ([–4)GlcA(β1-3)GalNAc(β1– ]n), где n равняется 2 или 3 соответственно [7]) ХН. Их докинг на молекулярной поверхности БТГ (в виде смеси десяти димеров и десяти тримеров ХН на одну молекулу фермента) воспроизводили сто раз (при рН 7.5, 0.1 М NaCl, 18 M H2O (обычное значение концентрации воды), при 300, 310, 320, 330 и 340 К). Пояснение о различии слоев воды в ячейке для расчетного рассмотрения докинга указано в четвертом абзаце раздела Результаты и обсуждение. При таких же условиях рассчитывали термоинактивацию свободной молекулы БТГ (без лигандов ХН). За обратной динамикой 3D структуры БТГ следили после снижения температуры (от указанных выше величин) до 287 К.
Список литературы
Максименко А.В., Щечилина Ю.В., Тищенко Е.Г. // Биохимия. 2001. Т. 66. № 4. С. 563–572. [Maksimenko A.V., Schechilina Y.V., Tischenko E.G. // Biochemistry (Moscow). 2001. V. 66. № 4. P. 456–463].
Максименко А.В., Щечилина Ю.В., Тищенко Е.Г. // Биохимия. 2003. Т. 68. № 8. С. 1055–1062. [Maksimenko A.V., Schechilina Y.V., Tischenko E.G. // Biochemistry (Moscow). 2003.V. 68. № 8. P. 862–868].
Meyer K., Rapport M.M. // Arch. Biochem. 1950. V. 27. № 2. P. 287–293.
Hoffman P., Meyer K., Linker A. // J. Biol. Chem. 1956. № 2. 653–663.
Максименко А.В., Бибилашвили Р.Ш. // Биоорган. химия. 2018. Т. 44. № 2. С. 147–157. [Maksimenko A.V., Beabealashvili R.S. // Russ. J. Bioorgan. Chem. 2018. V. 44. № 2. P. 165–172].
Максименко А.В., Турашев А.Д., Бибилашвили Р.Ш. // Биохимия. 2015. Т. 80. № 3. С. 348–357. [Maksimenko A.V., Turashev A.D., Beabealashvili R.S. // Biochemistry (Moscow). 2015. V. 80. № 3. P. 284–295].
Yang J., Chi L. // Carbohyd. Res. 2017. V. 452. P. 54–63.
Максименко А.В., Бибилашвили Р.Ш. // Изв. АН. Сер. Хим. 2018. № 4. С. 1–11. [Maksimenko A.V., Beabealashvili R.S. // Russ. Chem. Bull. Intl. Ed. 2018. V. 67. № 4. P. 1–11].
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. // J. Comput. Chem. 2004. V. 25. № 13. P. 1605–1612.
Sanuer M.F., Olson A.J., Spehner J.C. // Biopolymers. 1996. V. 38. № 3. P. 305–320.
Lang P.T., Brozell S.R., Mukherjee S., Pettersen E.F. Meng E.C., Thomas V., Rizzo R.C., Case D.A., James T.L., Kuntz I.D. // RNA. 2009. V. 15. № 6. P. 1219–1230.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


