Биоорганическая химия, 2020, T. 46, № 5, стр. 528-539
Механизм ингибирующего действия анионных полиамидоамин дендримеров генерации 1.5–3.5 на активность фибринолитической системы
Р. Б. Айсина 1, *, Л. И. Мухаметова 1, Е. М. Иванова 1
1 ФГБОУ МГУ им. М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1/3, Россия
* E-mail: aisina2004@mail.ru
Поступила в редакцию 26.02.2020
После доработки 26.03.2020
Принята к публикации 28.03.2020
Аннотация
Полиамидоамин (PAMAM) дендримеры находят применение в медицине для системной доставки лекарств. Оценка безопасности биоматериалов, которые будут контактировать с компонентами крови и тканями, особенно важна. Например, PAMAM-NH2 дендримеры G4–G7 вызывают агрегацию тромбоцитов и фибриногена. Мы изучили влияние PAMAM-COOH дендримеров G1.5–G3.5 на ключевые компоненты системы фибринолиза. Дендримеры не влияли на активность плазмина, но амидолитические активности тканевого активатора плазминогена (tPA) и урокиназы (uPA) заметно снижались с ростом генерации и концентрации дендримера. Интенсивность пика при 340 нм флуоресцентного спектра Glu-плазминогена в отсутствие и присутствии 0.15 М NaCl снижалась с увеличением концентрации дендримеров, что указывает на изменения в микроокружении остатков Trp и молекулярной конформации открытой и закрытой форм Glu-плазминогена. Из сравнения констант тушения флуоресценции сделан вывод, что анионный дендример и хлорид ион одновременно связываются с плазминогеном и, что каждый из этих лигандов проявляет свои независимые эффекты через отдельные сайты связывания. С увеличением концентрации и генерации дендримера скорость tPA- и uPA-инициированной активации Glu-плазминогена в буфере, рН 7.4 резко снижалась, вероятно, из-за образования комплексов дендример * плазминоген с возрастающим содержанием дендримера, в результате чего расщепляемая активаторами связь плазминогена становится менее доступной. Скорость tPA- и uPA-индуцированного лизиса плазменного сгустка в плазме снижалась умеренно с ростом концентрации дендримера, возможно, из-за снижения эффекта дендримера на фибринсвязанный плазминоген. Таким образом, механизм ингибирующего действия анионных PAMAM дендримеров на активацию и тромболизис, индуцированные tPA и uPA, связан с заметной инактивацией активаторов и значительным изменением конформации плазминогена. В циркуляции, PAMAM-COOH дендримеры могут влиять на другие физиологические и патологические процессы, в которых система плазминоген/плазмин играет важную роль.
ВВЕДЕНИЕ
В последнее время возрастающий интерес в области наномедицины вызывают дендримеры – новый тип монодисперсных полимеров с сильно разветвленной трехмерной глобулярной архитектурой и функциональными группами на поверхности. Наиболее изученными на сегодняшний день являются полиамидоамин (PAMAM) дендримеры, которые содержат этилендиаминное ядро, отдельные ветви, сконструированые из метилакрилата и этилендиамина, функциональные терминальные группы (–NH2, –OH, или –COOH) на поверхности и относительно гидрофобные полости. С ростом генерации (G) дендримера, увеличивается количество терминальных ветвей и функциональных групп. Их размеры в зависимости от поколения колеблются от 1.1 нм (для G1) до 12.4 нм (для G10) [1]. PAMAM дендримеры хорошо растворимы в полярных растворителях, не иммуногенны [2] и способны проникать через гематоэнцефалический барьер [3]. Показано, что дендримеры позволяют изменять характер фармакокинетики лекарственного препарата путем его инкапсулирования внутрь или ковалентной или нековалентной сорбции непосредственно на поверхности молекулы дендримера [4, 5]. Мультивалентные дендримеры, способные присоединять значительное количество лиганда, являются хорошей альтернативой традиционным полимерам в качестве систем доставки лекарственных препаратов [6, 7]. Благодаря уникальной структуре и свойствам, различные производные PAMAM дендримера имеют множество многообещающих биомедицинских применений, особенно при системном введении для доставки лекарств, контрастных веществ, генов, антител и других биомакромолекул [8–12].
Использование PAMAM дендримеров в качестве носителей позволяет уменьшить клиренс из кровотока, продлить время системной циркуляции и увеличить доставку лекарственного средства к месту назначения. С увеличением времени циркуляции в крови увеличивается продолжительность контакта дендримеров с белками, а также с клетками крови и эндотелиальными клетками кровеносных сосудов. С этой точки зрения, важным аспектом является оценка безопасности биоматериалов, которые будут контактировать с компонентами крови и тканями. Большинство публикаций последних лет было сфокусировано на исследовании влияния PAMAM дендримеров на структуру и функцию компонентов системы коагуляции. Выявлено, что катионные PAMAM дендримеры с концевыми аминогруппами вызывают более значительный гемолиз эритроцитов in vitro и in vivo, чем дендримеры с карбоксильными и гидроксильными концевыми группами [13, 14]. Цитотоксичность катионных PAMAM дендримеров повышается с увеличением концентрации и генерации дендримера, а частичная модификация поверхностных NH2-групп полиэтиленгликолем снижает их цитотоксичность [15, 16]. Показано, что PAMAM-NH2 дендример G7 нарушает ключевые функции тромбоцитов, вызывает агрегацию фибриногена и свертывание крови [17, 18]. Только крупные катионные дендримеры G4–G6, но не анионные, нейтральные или небольшие катионные дендримеры, индуцируют агрегацию тромбоцитов человека [19]. Изучено влияние дендримеров G3–G5 на активацию и реактивность тромбоцитов крови и на ключевые параметры коагуляции плазмы [20–22]. Влияние PAMAM дендримеров на компоненты системы фибринолиза не было изучено.
Мы недавно сообщили результаты сравнения эффектов PAMAM-NH2 и PAMAM-COOH дендримеров низких поколений на различные гемостатичекие параметры [23]. Результаты показали, что даже небольшие катионные PAMAM дендримеры G2–G3, особенно при использовании в высоких концентрациях, ведут себя очень похоже на прокоагулянтный PAMAM дендример G7 [17]. Кроме того, мы впервые обнаружили, что анионные PAMAM дендримеры G1.5–G3.5 влияют на структуру и активацию плазминогена. Плазминоген – предшественник ключевого фермента системы фибринолиза плазмина (КФ 3.4.21.7), непосредственно растворяющего фибрин сгустка, циркулирует в крови в концентрации ~2 мкМ. Под действием активаторов плазминогена тканевого (tPA, КФ 3.4.21.68) и урокиназного типа (uPA, урокиназа, КФ 3.4.21.31), специфически расщепляющих активационную связь Arg561–Val562 в одноцепочечной молекуле плазминогена, образуется двухцепочечный фермент плазмин. Ранее было показано, что анионные PAMAM дендримеры являются перспективными в качестве наноносителей стрептокиназы (активатора плазминогена бактериального происхождения) и других биомакромолекул, поскольку белки могут образовывать нековалентные и ковалентные комплексы с концевыми карбоксильными группами дендримеров без значительной потери их биофункции [12, 24–27]. Следовательно, для биомедицинских внутривенных применений биобезопасность анионных PAMAM дендримеров также должна быть оценена.
Данная работа посвящена детальному изучению влияния анионных PAMAM дендримеров низкой генерации (G1.5–G3.5) на активность системы фибринолиза. С этой целью, изучены in vitro концентрационные эффекты указанных дендримеров на собственные амидолитческие активности ключевых ферментов этой системы – плазмина, tPA и uPA, на конформацию нативного Glu-плазминогена (а также его Lys-формы) с использованием флуоресцентной спектроскопии, на скорость активации обеих форм плазминогена и скорость лизиса плазменных сгустков, индуцированных tPA и uPA. На основании полученных данных будет выяснен механизм ингибирующего действия анионных дендримеров на активность фибринолитической системы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
В этом исследовании были использованы PAMAM дендримеры половинной генерации G1.5, G2.5 и G3.5, которые содержат 16, 32 и 64 периферических карбоксильных групп [24] и имеют диаметры 2.6, 3.6 и 4.4 нм соответственно [28]. Как упоминалось выше, анионные, нейтральные и катионные PAMAM дендримеры низких генерации (<G4) не индуцируют агрегацию тромбоцитов человека в плазме in vitro [19].
Мы изучили гемолиз эритроцитов человека, индуцированный дендримерами G1.5–G3.5. Для оценки гемолитического уровня, были использованы высокие концентрации указанных дендримеров, принимая во внимание, что количество заряженных поверхностных групп у них значительно меньше, чем у дендримеров более высоких генераций (G > 4). Степень гемолиза эритроцитов в присутствии даже 600 мкМ концентрации исследованных дендримеров, составляла всего около 5–8% по сравнению с полным гемолизом, вызываемым 1%-ным Тритон Х-100 (данные не показаны). Следовательно, концентрации PAMAM дендримеров G1.5–G3.5 ниже 600 мкМ (<8 мг/мл для самого большого G3.5) не являются цитотоксичными. Эти результаты подтверждают, что дендримеры с концевыми отрицательно заряженными группами имеют низкий гемолитический уровень [13, 14].
В экспериментах по выявлению возможных отрицательных эффектов на активность компонентов системы фибринолиза концентрации PAMAM-СООН дендримеров G1.5–G3.5, имеющих меньшую плотность поверхностных зарядов по сравнению с дендримерами высоких генераций, варьировали в интервале 0–300 мкМ.
Влияние анионных дендримеров на активность ферментов
Амидолитические активности плазмина, tPA и uPA были измерены по начальным скоростям гидролиза их специфических хромогенных субстратов НСО-Ala-Phe-Lys-pNA (AFK-pNA), H-D-Ile-Pro-Arg-pNA (S-2288) и р-Glp-Gly-Arg (S-2444), соответственно. PAMAM дендримеры G1.5–G3.5 вплоть до 300 мкМ концентрации практически не влияли на активность фермента плазмина, в то время как вызывали заметное ингибирование амидолитических активностей uPA и tPA. Ингибирующий эффект анионных дендримеров на собственную активность обоих активаторов плазминогена усиливался с увеличением плотности поверхностного заряда и концентрации дендримера (табл. 1). Наиболее сильное ингибирование активности двух ферментов вызывал дендример G3.5, в то время как дендример G1.5 оказывал слабое ингибирующее действие лишь на активность uPA при концентрациях выше 200 мкМ.
Таблица 1.
Влияние концентрации и генерации PAMAM-COOH дендримеров на амидолитическую активность uPA (20 нM), и tPA (20 нM) (0.1 M PBS буфер, pH 7.4, 25°С), p < 0.001
| Концентрация дендримера, мкМ |
Амидолитическая активность, % | |||||
|---|---|---|---|---|---|---|
| tPA | uPA | |||||
| G1.5 | G2.5 | G3.5 | G1.5 | G2.5 | G3.5 | |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 95 | 101 | 95 | 91 | 99 | 95 | 90 |
| 190 | 100 | 93 | 88 | 92 | 88 | 82 |
| 300 | 99 | 91 | 87 | 80 | 75 | 70 |
Более выраженное ингибирование дендримерами амидолитической активности uPA позволило определить константы ингибирования (Ki) активности этого фермента с использованием высоких концентраций дендримеров. Значения констант ингибирования активности uPA дендримерами G1.5, G2.5 и G3.5 найдены равными: 2.30 ± 0.03, 0.56 ± 0.04 и 0.21 ± 0.03 мМ соответственно. Анализ зависимостей Лайнуивера-Берка показал, что PAMAM-СООН G1.5–G3.5 дендримеры являются слабыми неконкурентными ингибиторами uPA, т.е. они взаимодействуют не с активным центром uPA, а с другими участками фермента. Полученные результаты по ингибированию амидолитических активностей uPA и tPA предполагают, что связывание поливалентных PAMAM-COOH дендримеров с доступными положительно заряженными центрами этих ферментов вызывает некоторые нарушения конформации белков, которые влияют на их активные центры, приводящие к снижению ферментативной активности. Тем не менее, снижение собственных амидолитических активности uPA и tPA на 13 и 30% соответственно, в присутствии 300 мкМ концентрации G3.5 означает, что эти ферменты сохраняют высокую способность расщеплять их белковый субстрат плазминоген.
Влияние дендримеров на конформацию плазминогена
Нативный Glu-плазминоген (Glu-Pg, 93 кДа) – одноцепочечный гликопротеин, который содержит N-терминальный домен (Pap), пять гомологичных крингл домена (KR1–КR5), содержащие лизинсвязывающие центры (LBS), и серин-протеазный (SP) домен. В циркуляции он принимает закрытую плотную (Т) конформацию, устойчивую к активации, т.к. петля, содержащая расщепляемую активаторами плазминогена связь Arg561–Val562, недоступна. Компактная T-конформация Glu-плазминогена поддерживается ключевыми междоменными взаимодействиями Pap/LBS KR-5 и Pap/LBS KR-4 [29–31]. В его кристаллической структуре обнаружены четыре хлорид иона: два Cl– находятся на границах раздела KR-4/PAp и KR-2/ SP, а два других Cl– связываются с доменом KR-2 и SP соответственно. Интактный Glu-плазминоген в отсутствие Cl– принимает высоко активируемую открытую R-конформацию [32]. Только LBS КR1 является незащищенным в закрытой молекуле и, вероятно, опосредует начальное связывание профермента с мишенями [29]. При удалении Pap домена плазмином во время пре-активации Glu-плазминогена образуется Lys-плазминоген (85 кДа, Lys-Pg), который имеет открытую R-конформацию. Существуют различия в пространственных взаимосвязях отдельных доменов между T- и R‑формами Glu-плазминогена. Сами домены конформационно не изменяются, но их взаимодействие при связывании небольших лигандов может изменяться, что существенно влияет на общую конформацию белка.
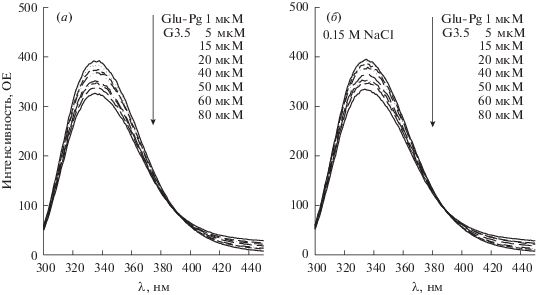
Конформация плазминогена важна для реализации его биологической функции и она чувствительна к окружающей среде. Мы использовали метод флуоресцентной спектроскопии для регистрации изменений конформации Glu-плазминогена при комплексообразовании с анионными дендримерами. Влияние различных концентраций G3.5 PAMAM дендримера, как представителя трех анионных дендримеров, на спектр флуоресценции Glu-плазминогена в отсутствие (а) и в присутствии хлорид иона (б) показано на рис. 1. Как видно, пики флуоресценции при 340 нм равномерно уменьшаются по интенсивности, но не сдвигаются с увеличением концентрации дендримера. Пики при 340 нм представляют собой спектры флуоресценции Trp-остатков Glu-плазминогена, возбужденного при 280 нм. Подобные, но немного меньшие изменения спектра флуоресценции Glu-плазминогена наблюдались и в присутствие дендримеров G1.5 и G2.5 (данные не представлены). Снижение интенсивности флуоресценции Glu-плазминогена в присутствии возрастающих концентраций дендримера G3.5 и G2.5 были проанализированы с использованием уравнения Штерна–Фольмера, описывающего процесс тушения [33]:
где F0 и F – флуоресценция белка без и с дендримером, соответственно, KSV – константа тушения Штерна–Фольмера и [Q] – концентрация дендримера.Рис. 1.
Влияние PAMAM дендримера G3.5 на флуоресцентный спектр 1 мкМ Glu-плазминогена в отсутствие (а) и в присутствии 0.15 M NaCl (б) в 10 мМ фосфатном буфере (рН 7.4; 25°C) (возбуждение при 280 нм). p > 0.001.
Зависимости Штерна–Фольмера и вычисленные константы тушения флуоресценции Glu-плазминогена дендримерами G2.5 и G3.5 в отсутствие и в присутствии 0.15 M NaCl приведены на рис. 2 и табл. 2. Из результатов следует, что анионные дендримеры образуют комплексы как с R-, так и с T-формой Glu-плазминогена, что приводит к изменениям в микроокружении остатков Trp и молекулярной конформации обеих форм белка. При этом, константа тушения дендримерами R-формы Glu-плазминогена была почти в 2 раза выше, чем его T-формы.
Рис. 2.
Зависимости Штерна–Фольмера для тушения флуоресценции Glu-плазминогена PAMAM дендримерами G2.5 (а) и G3.5 (б) в отсутствие (1) и присутствии 0.15 M NaCl (2). p > 0.001.
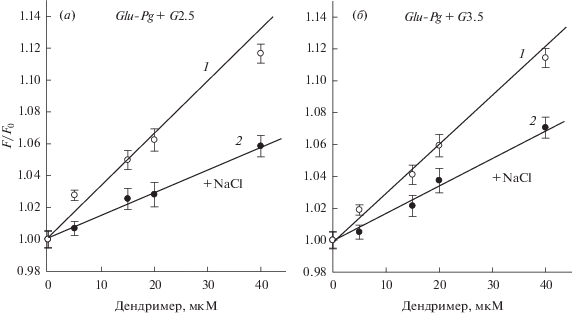
Таблица 2.
Константы тушения флуоресценции (KSV) Glu-плазминогена и Lys-плазминогена PAMAM-COOH дендримерами G2.5 and G3.5 в отсутствие и в присутствии 0.15 М NaCl
| NaCl | Форма плазминогена |
KSV, M–1 | ||
|---|---|---|---|---|
| дендример G2.5 | дендример G3.5 | |||
| Glu-плазминоген | – | R | (3.12 ± 0.12) × 103 | (3.25 ± 0.13) × 103 |
| + | T | (1.62 ± 0.17) × 103 | (1.71 ± 0.13) × 103 | |
| Lys-плазминоген | – | R | (2.22 ± 0.11) × 103 | (2.83 ± 0.12) × 103 |
| + | R | (1.84 ± 0.14) × 103 | (2.54 ± 0.13) × 103 | |
В связи с этим мы изучили влияние этих дендримеров на флуоресцентный спектр Lys-плазминогена, который не содержит N-терминальный Pap домен. Поэтому в Lys-плазминогене, в отличие от Glu-плазминогена, отсутствуют междоменные ионные взаимодействия Pap/LBS KR-5 и Pap/ LBS KR-4 и он имеет открытую R-конформацию независимо от присутствия хлорид иона [29, 30]. Рис. 3 показывает влияние дендримера G3.5 на флуоресцентный спектр Lys-плазминогена в отсутствие (а) и присутствии 0.15 М NaCI (б). Как видно, анионный дендример G3.5 образует комплекс и с Lys-плазминогеном и снижает интенсивность его флуоресценции. Зависимости Штерна–Фольмера и вычисленные константы тушения флуоресценции Lys-плазминогена дендримерами G2.5 и G3.5 в отсутствие и в присутствии 0.15 M NaCl приведены на рис. 4 и табл. 2.
Рис. 3.
Влияние PAMAM-COOH дендримера G3.5 на флуоресцентный спектр 1 мкМ Lys-плазминогена в отсутствие (а) и в присутствии (б) 0.15 М NaCl (рН 7.4; 37°С). p > 0.001.
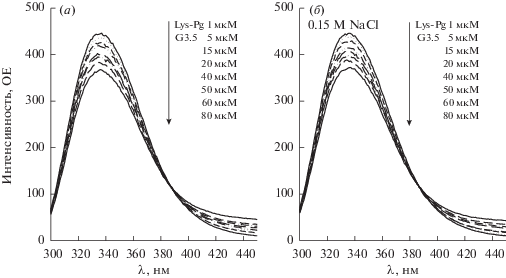
Рис. 4.
Зависимости Штерна–Фольмера для тушения флуоресценции Lys-плазминогена PAMAM дендримерами G2.5 (а) и G3.5 (б) в отсутствие (1) и в присутствии 0.15 M NaCl (2). p > 0.001.
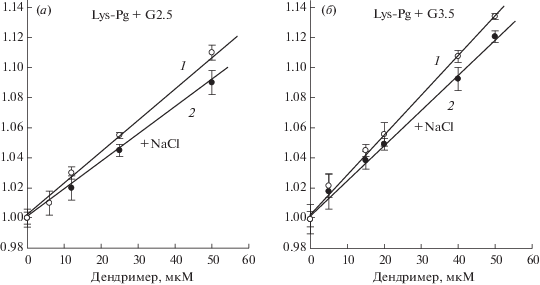
Сравнительный анализ констант тушения (KSV) разных форм плазминогена (табл. 2) показывает, что анионные дендримеры G2.5 и G3.5 связываются с Glu-плазминогеном и Lys-плазминогеном как в отсутствие, так и в присутствии хлорид иона, что приводит к изменению в микроокружении остатков Trp и молекулярной конформации как закрытой, так и открытой форм зимогена. Наблюдаемое на рис. 1 и 3 уменьшение интенсивности флуоресценции Glu-плазминогена и Lys-плазминогена при связывании дендримера G3.5 аналогично описанному ранее эффекту хлорид иона на флуоресценцию Glu-плазминогена [34, 35]. Известно, что хлорид ион, который поддерживает ключевые взаимодействия Pap домена с KR4 и KR5, отвечает за R → T-переход конформации Glu-плазминогена. Однако дендримеры G2.5 и G3.5 изменяли конформацию Glu-плазминогена и в присутствие хлорид иона, т.е. когда он уже имеет T-форму (табл. 2). Кроме того, дендримеры изменяли конформацию и Lys-плазминогена, который имеет R-конформацию и не может трансформироваться в T-форму из-за отсутствия Pap домена. Полученные данные указывают, что анионный дендример и хлорид ион одновременно связываются с плазминогеном и, что каждый из этих лигандов проявляет свои эффекты через отдельные сайты связывания, т.е. независимо друг от друга. Экспонированные аминогруппы на поверхности обоих плазминогенов могут быть сайтами связывания анионного дендримера.
Более сильное тушение флуоресценции Glu-плазминогена анионными дендримерами в отсутствие хлорид иона, чем в его присутствии, вероятно связано с тем, что открытая R-форма белка содержит больше экспонированных аминогрупп, чем его закрытая Т-форма (табл. 2). Значения KSV для R-формы Lys-плазминогена в отсутствие и в присутствии хлорид иона различаются не сильно, но они существенно ниже, чем KSV для R-формы Glu-плазминогена, что может быть связано с меньшим количеством доступных аминогрупп на поверхности Lys-плазминогена (85 кДа), чем на поверхности R-формы Glu-плазминогена (93 кДа). Тушение флуоресценции различных форм плазминогена анионным дендримером можно объяснить тем, что с ростом концентрации дендримера увеличивается их связывание с экспонированными аминогруппами зимогена как в присутствие, так и в отсутствие хлорид иона. При этом, вероятно, образуются комплексы с возрастающим соотношением дендример : плазминоген, в которых изменение конформации белка продолжается. Этот механизм объясняет конформационное изменение Lys‑плазминогена независимо от присутствия хлорид иона и Glu-плазминогена в присутствии постоянной концентрации хлорид иона.
При образовании тромба, Glu-плазминоген, циркулирующий в крови в концентрации 2 мкМ, захватывается в сгусток. Лизис сгустка индуцируется tPA и uPA через активацию плазминогена, локализованного на его поверхности. Дендримеры, введенные в циркуляцию, могут связываться с tPA, uPA и плазминогеном в циркуляции, а также с плазминогеном, локализованным на поверхности сгустка. Мы решили изучить влияние дендримера G3.5 (как представителя трех дендримеров с наибольшей плотностью отрицательного заряда) на скорость активации Glu-плазминогена в буфере, содержащем 0.15 М хлорид ион (по аналогии с условиями циркуляции), в отсутствие и присутствии растворимого фибрин-мономера (FM) и на скорость лизиса твердофазного плазменного сгустка под действием tPA и uPA.
Влияние дендримеров на активацию плазминогена
Кривые 1 на рис. 5 показывают влияние концентрации дендримера G3.5 на скорость активации нативного Glu-плазминогена, индуцированнного tPA (а) и uPA (б), в буфере, содержащем 0.15 М NaCl (рН 7.4). Рост концентрации дендримера вызывал значительное снижение скорости активации Glu-плазминогена под действием обоих его активаторов. При этом, скорость активации падала более резко до 50 мкМ концентрации дендримера в случае действия uPA (рис. 5б, кривая 1). чем в случае действия tPA (рис. 5а, кривая 1). Ингибирование активации Glu-плазминогена с ростом концентрации дендримера G3.5 вызвано, главным образом, изменением структуры плазминогена (рис. 1) в результате образования комплексов дендример*плазминоген с возрастающим содержанием в них дендримера. Уменьшение собственной каталитической активности tPA и uPA (табл. 1) с ростом концентрации дендримера также дает вклад в ингибирование скорости активации Glu-плазминогена.
Рис. 5.
Влияние концентрации PAMAM дендримера G3.5 на скорость активации 0.3 мкМ Glu-плазминогена под действием tPA (а) и uPA (б) в отсутствие (1) и в присутствии 60 мкМ фибрин мономера (2) в 0.1 М Трис-НСl буфере, 0.15 М NaCl, pH 7.4. Концентрация активаторов: (а) 20 МЕ/мл (1) и 2 МЕ/мл tPA (2); (б) 1 МЕ/мл uPA. p < 0.001.
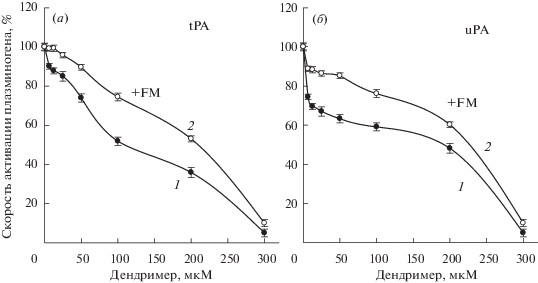
Известно, что фибрин резко увеличивает скорость активации Glu-плазминогена под действием tPA и мало влияет на плазминоген-активаторную активность uPA т.к. tPA является фибринспецифическим активатором плазминогена [36], в то время как uPA не имеет сродства к фибрину [37]. В связи с этим, мы проверили влияние растворимого FM на ингибирование дендримером G3.5 плазминоген-активаторной активности двух активаторов. Данные рис. 5а, 5б демонстрируют, что скорости активации Glu-плазминогена под действием обоих активаторов в присутствии 60 мкМ FM значительно выше (кривые 2), чем в его отсутствие (кривые 1), хотя продолжают падать с ростом концентрации дендримера. При низких концентрациях дендримера, FМ значительно сильнее повышал скорость активации плазминогена под действием tPA (а), чем под действием uPA (б), что объясняется различием сродства к фибрину двух активаторов. Наблюдаемый частичный защитный эффект FM от инактивирующего действия дендримера указывает на наличие конкуренции между FM и дендримером за связывание молекул плазминогена и его активаторов. Как было сказано выше, с увеличением концентрации дендримера, вероятно, образуются комплексы дендример*плазминоген с возрастающим содержанием в них дендримера, в которых продолжается изменение конформации Glu-плазминогена, в результате чего связь Arg561–Val562 становится менее доступной и скорость активации Glu-плазминогена под действием и tPA, и uPA падает (рис. 5, кривые 1). Напротив, связывание FM с LBS Glu-плазминогена вызывает разрушение междоменных взаимодействий Pap/LBS K4 и Pap/LBS K5 [29, 30] и T → R-переход его конформации. Это приводит к повышению доступности активационной связи Glu-плазминогена и увеличению скорости его активации под действием и tPA, и uPA (рис. 5а, 5б, кривые 2). Дополнительный вклад в повышение скорости tPA-индуцированной активации Glu-плазминогена в присутствии FM может давать солокализация tPA и зимогена на растворимом фибрине.
Таким образом, наблюдаемое снижение ингибирующего действия анионного дендримера на скорость активации Glu-плазминогена в присутствии растворимого фибрина является результатом конкуренции стимулирующего эффекта постоянной 60 мкМ концентрации FM и ингибирующего эффекта возрастающих концентраций анионного дендримера (рис. 5а, 5б, кривые 2). Так при 200 мкМ концентрации дендримера G3.5, скорость активации плазминогена падала на 64 и 47% в случае с tPA и на 52 и 40% в случае uPA соответственно, в отсутствие и в присутствии FM. Драматическое падение скорости активации Glu-плазминогена обоими активаторами (на 90–95%), наблюдаемое при увеличении концентрации дендримера от 200 до 300 мкМ даже в присутствии 60 мкМ FM, можно объяснить истощением уровня последнего в результате протеолитической деградации образующимся плазмином. Данные рис. 5а, 5б моделируют влияние дендримера на скорость активации Glu-плазминогена под действием tPA и uPA в циркуляции и возможный эффект на эти процессы фиксированной концентрации растворимого фибрина.
Влияние дендримера на фибринолиз
Рис. 6 демонстрирует влияние двух высоких концентраций дендримера G3.5 на кинетику лизиса плазменного сгустка, погруженного в плазму человека, под действием tPA (а) и uPA (б). Вычисленные из кинетических кривых скорости лизиса (Δl/t) составляли: 0.030 ± 0.002, 0.023 ± 0.002 и 0.018 ± 0.003 мм/мин для tPA и 0.026 ± 0.002, 0.017 ± 0.003 и 0.016 ± 0.002 мм/мин для uPA в отсутствие и в присутствии 200 и 300 мкМ дендримера соответственно. Дендример G3.5, добавленный в плазму над сгустком, вызывал снижение скорости тромболизиса на 23 и 40% в случае действия tPA и на 35 и 38% в случае действия uPA, при концентрации дендримера 200 и 300 мкМ соответственно. Из сравнения данных рис. 5 и рис. 6 следует, что дендример G3.5 ингибирует лизис твердофазного плазменного сгустка, индуцированный двумя активаторами, значительно слабее, чем активацию Glu-плазминогена этими активаторами в буфере даже в присутствии растворимого фибрина.
Рис. 6.
Кинетика лизиса плазменного сгустка в плазме человека под действием 50 нМ tPA (а) и 90 нМ uPA (б) в отсутствие (1) и в присутствии 200 (2) и 300 мкМ (3) PAMAM дендримера G3.5. p < 0.01.
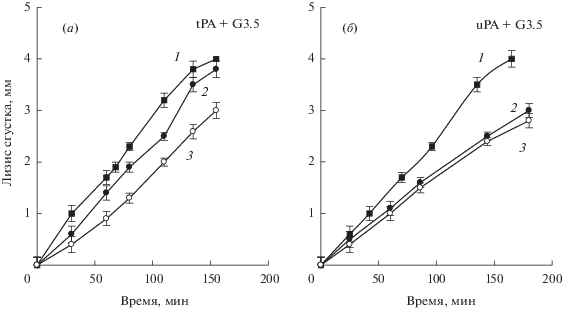
Наблюдаемое на рис. 6а, 6б умеренное снижение скорости тромболизиса, индуцированного uPA и tPA, с ростом концентрации дендримера обусловлено с эффектами дендримеров на структуру и функцию плазминогена как на поверхности сгустка, так и в плазме. Активация Glu-плазминогена при связывании с фибрином сгустка усиливается из-за T → R-изменения его конформации, а ингибирующий эффект дендримеров на активацию фибринсвязанного плазминогена значительно снижен из-за меньшего количества поверхностных аминогрупп в молекуле фибринсвязанного зимогена, доступных для связывания дендримеров. Вероятно, ингибирование тромболизиса дендримерами, в большей степени, связано с образованием в плазме комплексов дендример * плазминоген. С ростом соотношения дендример : плазминоген, связывание этих комплексов с новыми центрами связывания плазминогена на поверхности фибрина, образующимися в ходе специфического расщепления пламином его лизиновых связей, ухудшается. Снижение сорбции и активируемости комплексов дендример*плазминоген, а также заметное ингибирование активности uPA и tPA приводят к уменьшению скорости образования плазмина на фибрине и тромболизиса.
Из полученных результатов следует, что PAMAM-СООН дендримеры связываются с Glu-плазминогеном с образованием комплексов дендример*плазминоген, в которых содержание полимера увеличивается с ростом концентрации добавленного дендримера. Это приводит к значительному изменению конформации Glu-плазминогена и резкому падению скорости его превращения в плазмин под действием активаторов. Связывание анионных дендримеров с tPA и uPA вызывает заметное снижение их собственной амидолитической активности. Эти эффекты увеличиваются с ростом концентрации и генерации дендримера (от G1.5 до G3.5). Растворимый фибрин-мономер заметно снижает, но не аннулирует, ингибирующий эффект дендримеров на активацию Glu-плазминогена в буфере (0.15 М NaCl, рН 7.4). Однако ингибирующий эффект дендримеров на лизис твердофазного плазменного сгустка в плазме существенно ниже, чем на скорость активации плазминогена в жидкой фазе под действием tPA и uPA. Таким образом, ингибирующее действие анионных PAMAM дендримеров на активность системы фибринолиза включает значительное изменение конформации и функции циркулирующего Glu-плазминогена и, в меньшей степени, снижение активности его tPA и uPA.
Следует отметить, что PAMAM-СООН дендримеры более высоких генераций (G4.5–G6.5) должны изменять конформацию и функцию Glu-плазминогена при значительно меньших концентрациях, чем изученные нами PAMAM-СООН дендримеры низких генераций (G ≤ 3.5). Поэтому при использовании анионных PAMAM дендримеров различных генераций в качестве носителей для системной доставки лекарств необходимо оценивать их концентрационные эффекты на структуру и функцию циркулирующего плазминогена, поскольку система плазминоген/плазмин, помимо тромболизиса, играет важную физиологическую и патологическую роль в ряде других жизненно-важных процессах: деградации внеклеточного матрикса, эмбриогенезе, миграции клеток, ремоделировании тканей, заживлении ран, ангиогенезе, воспалении и миграции опухолевых клеток.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе были использованы рекомбинантный тканевый активатор плазминогена (tPA, КФ 3.4.21.68) (NIBSC, Великобритания), урокиназа (uPA, КФ 3.4.21.31) (Медак GmbH, Германия), рептилаза (КФ 3.4.21.29) из яда змеи Bothrops atrox (≈36 кДа, Diagnostica Stago, Франция), п-нитроанилид H-D-Ile-Pro-Arg (S-2288) (Diapharma, USA), п-нитроанилид р-Glp-Gly-Arg (S-2444) (Sigma, CША), п-нитроанилид HCO-Ala-Phe-Lys (AFK-pNA), тромбин и фибриноген человека (Технология-Стандарт, Россия), апротинин Gordox (Gedeon Richter, Венгрия), Lys-сефароза 4B (GE Healthcare Life Sciences, Швеция), PAMAM дендримеры поколений G1.5 (2934.6 Да), G2.5 (6265.6 Да) и G3.5 (12 900 Да) с концевыми карбоксильными группами были любезно предоставлены кафедрой химии нефти и органического катализа химического факультета МГУ им. М.В. Ломоносова. Чистота дендримеров была подтверждена 1Н ЯМР спектроскопией. Донорская цитратная плазма крови получена на станции переливания крови, Москва, Россия. 96-луночные планшеты (Биомедикал, Россия). Трис (2-амино-2-(гидроксиметил)-1.3-пропандиол) (Sigma, США). Остальные реактивы отечественного производства марки “ос.ч.” или “х.ч.”
Оборудование. Спектрофотометр Biochrom WPA Lightwave II, шейкер-инкубатор для планшет (ST-3, Elmi, Эстония), планшетный фотометр Antos-2020 (Австрия), флуоресцентный спектрофотометр Varian Cary Eclipse (American Laboratory Trading, Inc., США), прибор для электрофореза BIO-RAD Mini-Protean Tetra Cell, коллектор фракций BIO-RAD, модель 2110 (Великобритания), катетометр КМ-6 (Россия).
Статистический анализ результатов был проведен с помощью программы Sigma Plot 11.0. Данные считались достоверными при р < 0.05.
Гемолиз эритроцитов (RBC). Свежую кровь доноров отбирали в пробирки, содержащие 3.2% натрий цитратный буфер, центрифугировали (при 2000 × g в течение 15 мин при 4°С), удаляли плазму, и осадок трехкратно промывали фосфатно-солевым буфером, рН 7.4 (PBS). Затем к осадку добавляли PBS для получения суспензии RBC при 2% (v/v) гематокрите. Аликвоты суспензии RBC инкубировали с 600 мкМ PAMAM дендримерами G1.5, G2.5 или G3.5.Тритон Х-100 (1%, в/в) добавляли к другим аликвотам суспензии RBC для получения полного гемолиза. После инкубации при 37°C в течение 4 ч при мягком встряхивании, суспензии RBC центрифугировали при 1500 × g в течение 10 мин при 4°C, и супернатанты анализировали с помощью спектрофотометра Lightwave II (Biochrom Ltd., Великобритания) на высвободившийся из эритроцитов гемоглобин при 540 нм [15]. Эксперименты с каждым образцом проводились пять раз.
Фибрин-мономер (FM) (des-AA-фибрин) получали обработкой фибриногена человека (20 мг/мл) тромбиноподобным ферментом рептилазой (0.05 МЕ/мл) и растворением образовавшегося сгустка поперечнонесшитого полимера в равном объеме 7 М мочевины.
Glu-плазминоген и Lys-плазминоген получали из пула плазмы человека с добавлением и без апротинина, соответственно. Lys- и Glu-формы плазминогена выделяли из плазмы аффинной хроматографией на Lys-сефарозе 4B при 4°С по методу, описанному нами в работе [38]. Чистоту препаратов проверяли с помощью Ds-Na-ПААГ-электрофореза в невосстанавливающих условиях в 12%-ном геле методом Лэммли [39]. По данным титрования апротинином плазмина, полученного активацией Lys- или Glu-форм плазминогена стрептокиназой, содержание зимогена в препаратах составляло 90 и 95% соответственно.
Плазмин получали активацией 2 мкМ раствора Lys-плазминогена каталитической концентрацией стрептокиназы ([Pg] : [SK] = 100 : 1 (М/М)) в 0.1 М Tris-HCl буфере, рН 7.4, содержащем 0.15 М NаС1, 20%-ный глицерин (V/V) и 0.01%-ный Tween-80, при 25°С. Полноту превращения зимогена в фермент определяли по максимальной амидазной активности отобранных проб. Раствор плазмина хранили в аликвотах при –20°С.
Амидолитические активности ферментов. Собственные активности плазмина (20 нМ), tPA (20 нM) и uPA (20 нM) измеряли по скоростям гидролиза их специфических хромогенных субстратов AFK-pNA (0.6 мМ), S-2288 (1 мМ) и S-2444 (0.1 M), соответственно, в 0.1 M PBS (pH 7.4), содержащем различные концентрации PAMAM дендримеров (от 0 до 300 мкМ), в 96-луночных планшетах при комнатной температуре. Изменение поглощения при 405 нм регистрировались через 1-минутные интервалы в течение 15–20 мин с помощью планшетного фотометра Anthos 2020 (Anthos, Австрия). Активности плазмина, tPA и uPA вычисляли из начальных скоростей гидролиза их специфических субстратов. Каждый эксперимент выполняли 3 раза.
Флуоресцентный спектр. Спектр флуоресценции плазминогена (1 мкМ) в 10 мМ фосфатном буфере, pH 7.4, содержащем различные концентрации PAMAM дендримера, сканировали в диапазоне 300–450 нм в кварцевых ячейках (4 × 1 × 1 см) при комнатной температуре, с использованием флуоресцентного спектрофотометра Varian Cary Eclipse (American Laboratory Trading, Inc., США). Эти сканирования были выполнены при фиксированных условиях измерения: λexc 280 нм, ширина щели возбуждения и излучения 10 нм и скорость сканирования 1200 нм/мин. Все эксперименты были повторены три раза.
Активация плазминогена. Кинетику активации Glu-плазминогена под действием tPA и uPA изучали с помощью сопряженного метода, описанного в работе [41] с некоторыми модификациями. В лунки микропланшета вносили 150 мкл 0.1 М Трис-HCl буфера, 0.15 М NaCl, pH 7.4, содержащего 0.8 мМ AFK-pNA, 0.4 мкМ Glu-Pg и различные концентрации PAMAM дендримера. После инкубации плазминогена с дендримерами в течение 15 мин при 37°С в термостатируемом шейкере-инкубаторе для планшетов (ST-3, Elmi) в рабочие лунки вносили 50 мкл 80 нМ tPA или 4 нМ uPA в том же буфере, а в контрольные лунки вносили 50 мкл буфера. Конечные концентрации дендримера в реакционной смеси варьировали от 0 до 300 мМ. В экспериментах по изучению влияния растворимого фибрина на скорость активации плазминогена реакционная смесь содержала 0.02 мг/мл FM, а концентрацию tPA снижали до 2 нМ. За кинетикой активации плазминогена следили по высвобождению продукта гидролиза AFK-pNA образующимся плазмином при 405 нм (37°С) с помощью планшетного фотометра Anthos 2020 (Австрия). Скорости активации плазминогена (ΔА405/t2) вычисляли так, как описано в работе [41]. Каждый эксперимент выполняли 4 раза.
Лизис плазменных сгустков. Кинетику лизиса плазменного сгустка в плазме человека, индуцированного tPA или uPA, изучали с помощью метода, описанного нами в работе [41] c некоторыми модификациями. К сформированным плазменным гелям добавляли 0.45 мл плазмы человека, содержащей различные концентрации дендримера (0–300 мкМ). После термостатирования при 37°С в течение 15 мин, реакцию фибринолиза инициировали добавлением 50 мкл раствора tPA или uPA до конечной концентрации 50 и 90 нМ соответственно. Каждый эксперимент выполняли 4 раза. За кинетикой фибринолиза следили по уменьшению высоты столба геля (l) во времени при 37°С с помощью катетометра (КМ-6, Россия). Скорость фибринолиза определяли как тангенс угла наклона начальных участков кинетических кривых (Δl/t, мм/мин).
ФОНДОВАЯ ПОДДЕРЖКА
Работа выполнена на Химическом факультете Московского государственного университета им. М.В. Ломоносова в рамках Госрегистрационной темы № ААА-А16-116052010081-5 “Молекулярный дизайн, структурно-функциональный анализ и регуляция ферментных систем, клеточных конструкций, бионаноматериалов: фундаментальные основы и приложения в технологии, медицине, охране окружающей среды”.
Список литературы
Tomalia D. // Prog. Polym. Sci. 2005. V. 30. P. 3–4.
Srinivasa-Gopalan S., Yarema K. // Nanotechnologies for the Life Sciences. 2007. V. 7. P. 1–43.
Kannan S., Dai H., Navath R.S., Balakrishnan B., Jyoti A., Janisse J., Romero R., Kannan R.M. // Sci. Transl. Med. 2012. V. 4. P. 130–146.
Cheng Y., Wang J., Rao T., He X., Xu T. // Frontiers in Bioscience. 2008. V. 1. P. 1447–1471.
Wyszogrodzka M., Haag R. // Chemistry. 2008. V. 14. P. 9202–9214.
Orive G., Hernandez R., Gascon A., Pedraz J.L. // Cancer Therapy. 2005. V. 3. P. 131–138.
Patri A., Majoros I., Baker J. // Curr. Opin. Chem. Biol. 2002. V. 6. P. 466–471.
Madaan K., Kumar S., Poonia N., Lather V., Pandita D. // J. Pharm. Bioall. Sci. 2014. V. 6. P. 139–150.
Bielinska A., Eichman J.D., Lee I., Baker J.R., Jr., Balogh L. // J. Nanoparticle Res. 2002. V. 4. P. 395–403.
Shadrack D.M., Swai H.S., Munissi J.J.E., Mubofu E.B., Nyandoro S.S. // Molecules. 2018. V. 23. P. 1419.
Pan B., Cui D., Xu P., Ozkan C., Feng G., Ozkan M., Huang T., Chu B., Li Q., He R., Hu G. // Nanotechnology. 2009. V. 20. P. 125 101.
Mukhametova L.I., Aisina R.B., Zakharyan E.M., Karakhanov E.A., Gershkovich K.B., Varfolomeyev S.D. // Thromb. Res. 2017. V. 154. P. 50–52.
Han M.H., Chen J., Wang J., Chen S.L., Wang X.T. // J. Biomed. Nanotechnol. 2010. V. 6. P. 82–92.
Greish K., Thiagarajan G., Herd H., Price R., Bauer H., Hubbard D., Burckle A., Sadekar S., Anwar T., Yu A., Ray A., Ghandehari H. // Nanotoxicology. 2012. V. 6. P. 713–723.
Wang W., Xiong W., Zhu Y., Xu H., Yang X. // J. Biomed. Mater. Res. Part B. 2010. V. 93. P. 59–64.
Diaz C., Benitez C., Vidal F., Barraza L.F., Jiménez V.A., Guzman L., Fuenteala J., Yevenes G.E., Alderete J.B. // Nanomedicine: Nanotechnology, Biology, and Medicine (NBM). 2018. V. 14. P. 2227–2234.
Jones C.F., Campbel R.A., Franks Z., Gibson C.C., Thiagarajan G., Vieira-de-Abreu A., Sukavaneshvar S., Mohammad S.F., Li D.Y., Ghandehari H., Weyrich A.S., Brooks B.D., Grainger D.W. // Mol. Pharm. 2012. V. 9. P. 1599–1611.
Jones C.F., Campbell R.A., Brooks A.E., Assemi S., Tadjiki S., Thiagarajan G., Mulcock Ch., Weyrich A.S., Brooks B.D., Ghandehari H., Grainger D.W. // ACS Nano. 2012. V. 6. P. 9900–9910.
Dobrovolskaia M.A., Patri A.K., Simak J., Hall J.B., Semberova J., De Paoli Lacerda S.H., McNeil S.E. // Mol. Pharm. 2012. V. 9. P. 382–393.
Watala C., Karolczaka K., Kassassira H., Talara M., Przygodzkia T., Maczynskaa K., Labieniec-Watala M. // Intern. J. Pharmaceutics. 2016. V. 503. P. 247–261.
Fu Y., Hu R., Li C., Wang Q., Liu Z., Xue W. // J. Bioact. Compat. Polym. 2014. V. 29. P. 165–179.
Markowicz-Piasecka M., Sadkowska A., Podsiedlik M.E., Mikiciuk-Olasik E., Sikora J. // Toxicology in Vitro. 2019. V. 59. P. 87–99.
Aisina R., Mukhametova L., Ivanova E. // Materials Science and Engineering: C. April. 2020. V. 109. 110 605.
Wang X., Inapagolla R., Kanna S., Lieh-Lai M., Kannan R.M. // Bioconjug. Chem. 2007. V. 18. P. 791–799.
Айсина Р.Б., Мухаметова Л.И., Гершкович К.Б., Иванова Е.М., Захарян Е.М., Караханов Э.А. // Биоорган. химия. 2018, Т. 44. С. 533–543. [Aisina R.B., Mukhametova L.I., Gershkovich K.B., Ivanova E.M., Zakharyan E.M., Karakhanov E.A. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 528–537.]
Singh P. // Bioconjug. Chem. 1998. V. 9. P. 54–63. https://doi.org/10.1021/bc970048a
Thomas T.P., Patri A.K., Myc A., Myaing M.T., Ye J.Y., Norris T.B., Baker J.R., Jr. // Biomacromolecules. 2004. V. 5. P. 2269–2274.
Bustos E., Godinez L.A. // Int. J. Electrochem. Sci. 2011. V. 6. P. 1–36.
Law R.H.P., Caradoc-Davies T., Cowieson N., Horvath A.J., Quek A.J., Encarnacao J.A, Steer D., Cowan A., Zhang Q., Lu B.G., Pike R.N., Smith A.I., Coughlin P.B., Whisstock J.C. // Cell Reports. 2012. V. 1. P. 185–190.
Ponting C.P., Marshall J.M., Cederholm-Williams S.A. // Blood Coagul. Fibrinolysis. 1992. V. 3. P. 605–614.
Айсина Р.Б., Мухаметова Л.И. // Биоорган. химия. 2014, Т. 40, С. 642–657. [Aisina R.B., Mukhametova L.I. // Russ. J. Bioorg. Chem. 2014. V. 40. P. 590–605.]
Castellino F.J., Ploplis V.A. // Thromb. Haemost. 2005. V. 93. P. 647–654.
Lakowicz J.R. // Principles of Fluorescence Spectroscopy. 3rd ed. Springer US, 2006.
Urano T., Chibber B.A.K., Castellino F.J. // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 4031–4034.
Urano T., de Serrano V.S., Chibber B.A.K., Castellino F.J. // J. Biol. Chem. 1987. V. 262. P. 15959–15964.
Rijken D.C., Hoylaerts M., Collen D. // J. Biol. Chem. 1982. V. 257. P. 2920–2925.
Duffy M.G. // Fibrinolysis. 1993. V. 7. P. 295–302.
Левашов М.Ю., Айсина Р.Б., Гершкович К.Б., Варфоломеев С.Д. // Биохимия 2007. Т. 72. С. 872–882. [Levashov M.Yu., Aisina R.B., Gershkovich K.B., Varfolomeyev S.D. // Biochemistry (Moscow). 2007. V. 72. P. 707–715.]
Laemmli, U.K. // Nature. 1970. V. 227. P. 680–685.
Aisina R., Mukhametova L., Gershkovich K., Varfolomeyev S.D. // Biochim. Biophys. Acta. 2005. V. 1725. P. 370–376.
Aisina R., Mukhametova L., Varfolomeyev S. // Biochim. Biophys. Acta. 2016. V. 1860. P. 629–635.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


