Биоорганическая химия, 2020, T. 46, № 5, стр. 517-527
Получение и характеризация гуманизированного нейтрализующего антитела против интерферона-бета человека
В. С. Рыбченко 1, *, А. А. Панина 2, В. Н. Новоселецкий 1, Д. С. Балабашин 2, С. А. Якимов 2, О. Н. Солопова 3, 5, П. Г. Свешников 3, Т. К. Алиев 4, Д. А. Долгих 1, 2, М. П. Кирпичников 1, 2
1 ФГБОУ ВО МГУ им. М.В. Ломоносова, биологический факультет
119192 Москва, Ленинские горы, 1/12, Россия
2 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
3 Всероссийский научный центр молекулярной диагностики и лечения
117638 Москва, Симферопольский бульвар, 8, Россия
4 ФГБОУ ВО МГУ им. М.В. Ломоносова, химический факультет
119234 Москва, Ленинские горы, 1/3, Россия
5 ФБГУ “НМИЦ онкологии им. Н.Н. Блохина”
115478 Москва, Каширское ш., 23, Россия
* E-mail: vladislavrusia@yandex.ru
Поступила в редакцию 29.04.2020
После доработки 06.05.2020
Принята к публикации 07.05.2020
Аннотация
Гуманизация антител с целью создания новых терапевтических средств с низкой иммуногенностью остается актуальной задачей современной науки. В данной работе представлено получение гуманизированного антитела hB16, нейтрализующего интерферон-бета человека, методом “CDR-графтинга” на основе последовательностей иммуноглобулинов зародышевых линий человека. Созданы математические модели вариабельных доменов мышиного и гуманизированного антител В16 и с помощью метода молекулярной динамики показано, что конформации исходного мышиного и модифицированного антител практически не отличаются. Рекомбинантные химерные (chB16) и гуманизированные (hB16) антитела, полученные в транзиентной культуре клеток СНО, выделены аффинной хроматографией, их свойства изучены биохимическими и иммунохимическими методами. Показано, что гуманизированное антитело hB16 обладает теми же параметрами аффинности, специфичности и способности к нейтрализации интерферона-бета, что и исходное мышиное антитело B16. В дальнейшем планируется использование антитела hB16 для терапии патологических состояний, вызванных действием интерферона-бета.
ВВЕДЕНИЕ
Гуманизация моноклональных антител, полученных с использованием гибридомной технологии, является одним из наиболее значимых способов снижения иммуногенности этих молекул для человека и представляет собой сложную задачу современной биоинженерии и молекулярной иммунологии [1].
Получение химерных антител является первым этапом создания гуманизированных антител. Химеризация антител заключается в замене константных доменов антитела животного константными доменами иммуноглобулина человека (рис. 1а, 1б) методами генной инженерии. По сравнению с исходными моноклональными антителами химерные антитела обладают меньшей иммуногенностью [1–3], но уступают по данному параметру гуманизированным антителам [1, 4, 5].
Рис. 1.
Схематическое изображение имммуноглобулинов G. Мыши и человека (а), химерного антитела (б), участки возможных замен в гуманизированных антителах (в).
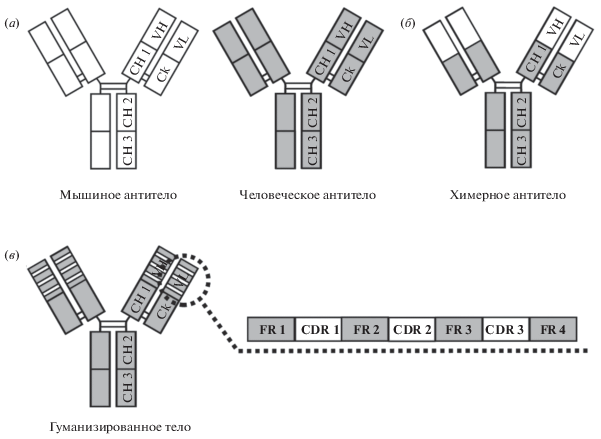
Следующим этапом гуманизации является максимальное приближение первичной структуры вариабельных доменов к выбранной из базы данных антител структуре антител человека, при этом вторичная структура, пространственная организация, биологические и биохимические параметры антитела не должны изменяться драматически. Существуют разные подходы к гуманизации антител, например, метод пересадки областей, участвующих в распознавании антигенов (CDR – Complementarity-determining region – гипервариабельные участки) (“CDR-графтинг”), метод пересадки остатков CDR, определяющих специфичность (“SDR-графтинг”), метод корректировки поверхности и другие [6]. При гуманизации методом “CDR-графтинга” каркасные участки FR (framework region,) исходного антитела заменяют аналогичными участками гомологичного антитела человека с сохранением исходных CDR-участков (рис. 1в) [7]. При гуманизации антител необходимо обращать внимание на аминокислотные остатки, находящиеся в зоне Вернье, которые играют существенную роль в позиционировании петель, содержащих гипервариабельные участки, и способствуют тонкой настройке взаимодействия антител с антигеном [8]. При возникновении неблагоприятных с точки зрения размера, заряда или степени гидрофобности замен необходимо введение возвратных мутаций в зоне Вернье, которое, как правило, приводит к благоприятному уменьшению энтальпии [9]. Также важным аспектом гуманизации антител представляется анализ остатков, участвующих в образовании водородных и электростатических связей с CDR. Валидацию предложенных замен можно осуществить с помощью биоинформатических методов, таких как моделирование белковых структур антител, молекулярной динамики и других методов. Степень корректности выбранной стратегии гуманизации антитела определяют сравнением биологических параметров и свойств моноклональных, химерных и гуманизированных антител.
Целью данной работы являлось, используя мышиное антитело-прототип, получение химерного и гуманизированного антитела hB16, исследование их молекулярных параметров и антиген-связывающих свойств, а также нейтрализующей активности по отношению к интерферону-бета человека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Планирование аминокислотных последовательностей тяжелой и легкой цепей гуманизированного антитела hB16
Для гуманизации вариабельных участков тяжелых и легких цепей мышиного антитела B16 использовали метод “СDR-графтинга”. Для отбора человеческих FR-участков могут быть использованы два основных источника: последовательности зрелых антител и последовательности генов иммуноглобулинов зародышевых линий человека. Использование последовательностей генов зародышевой линии имеет два существенных преимущества. Во-первых, физическая карта локусов генов тяжелых и легких цепей человеческих иммуноглобулинов и функциональный репертуар генов зародышевых линий охарактеризованы, что позволяет осуществить поиск наиболее гомологичных генов антител среди большого количества вариантов. Во-вторых, сравнение кристаллографических структур белков показало, что антитела на основе зародышевых генов имеют более подвижную структуру, чем зрелые антитела [10, 11]. Такая подвижность теоретически может позволить замещать СDR-участки зародышевых антител на СDR-участки антител, подвергающихся гуманизации, без серьезных изменений конформации. Для того, чтобы заменить каркасные участки вариабельного домена мышиного антитела на человеческие, осуществляли поиск наиболее гомологичных зародышевых линий человека в базе данных IMGT (http://www.imgt.org/).
Последовательности аминокислотных остатков вариабельных доменов мышиного антитела-прототипа B16 были картированы в соответствии с классификацией Кабата [12], определены границы CDR и FR-участков. При анализе базы данных IMGT среди последовательностей зародышевых линий генов тяжелой и легкой цепей антител были обнаружены наиболее гомологичные гены: IGHV3-23*04 для тяжелой цепи и IGKV1-9*01 для легкой цепи антитела B16. Степень идентичности генов вариабельного домена тяжелой цепи антитела B16 и IGHV3-23*04 составила 80%, степень идентичности генов вариабельного домена легкой цепи антитела B16 и IGKV1-9*01 – 65%. Количество и характер отличий генов зародышевой линии и антитела B16 в CDR и FR участках приведены в табл. 1.
Таблица 1.
Количество аминокислотных замен, обнаруженных при сравнении последовательностей легкой и тяжелой цепей антитела B16 с наиболее гомологичными последовательностями зародышевых линий человека. С – синонимичные замены, Н – несинонимичные замены
| Участок | FR1 | CDR1 | FR2 | CDR2 | FR3 | CDR3 | FR4 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Тип замены | С | Н | С | Н | С | Н | С | Н | С | Н | С | Н | С | Н |
| Размер участка, а. к. | 23 | 10 | 16 | 7 | 32 | 9 | 10 | |||||||
| Легкая цепь, количество замен | 3 | 4 | 4 | 3 | 2 | 0 | 1 | 3 | 5 | 4 | 2 | 2 | 0 | 1 |
| Размер участка, а. к. | 25 | 10 | 14 | 17 | 32 | 7 | 13 | |||||||
| Тяжелая цепь, количество замен | 2 | 0 | 1 | 1 | 1 | 3 | 1 | 4 | 6 | 0 | 0 | 5 | 1 | 0 |
Аминокислотные остатки CDR-участков зародышевых линий заменили соответствующими CDR-участками мышиного антитела В16, в каркасных участках определили положения остатков, соответствующих зоне Вернье. Были проанализированы неблагоприятные аминокислотные замены с точки зрения размера, заряда и гидрофобности аминокислотных остатков. С целью возможного предотвращения потери аффинности антитела были предложены 4 возвратные мутации в участках зоны Вернье: в последовательности вариабельного домена тяжелой цепи – S49A, K94R и в последовательности вариабельного домена легкой цепи – L4M, L78V.
Исследование моделей структур вариабельных доменов гуманизированного и мышиного антител hB16 и B16
Для предложенных последовательностей VH и VL hB16 были созданы модели пространственной структуры с помощью метода моделирования на основании гомологии. Реализация этого метода в веб-сервисе Rosetta Antibody включала следующие шаги: 1) поиск шаблонов среди антител с известной пространственной структурой и сходной аминокислотной последовательностью, 2) построение начальных моделей с использованием консервативных фрагментов шаблонов и VH/VL-последовательностей запроса, 3) улучшение начальных моделей путем подбора оптимальных конформаций основной цепи VH/VL и боковых цепей по всем моделям в целом. Полученные стартовые модели были дополнительно оптимизированы с учетом влияния растворителя, для чего в программе Gromacs с использованием силового поля charmm36 был проведен расчет молекулярной динамики (МД) моделей в водном растворе при температуре 300 К и физиологической концентрации NaCl в течение 10 нс. Анализ МД показал, что модели принимают свои равновесные конформации уже через 1 нс. Полученные траектории МД были подвергнуты кластерному анализу и наиболее представительные конформации для каждой из стартовых моделей в дальнейшем рассматривались в качестве окончательных моделей, анализ которых позволил сформулировать ряд возвратных замен в каркасных участках VH и VL гуманизированного антитела к интерферону-бета.
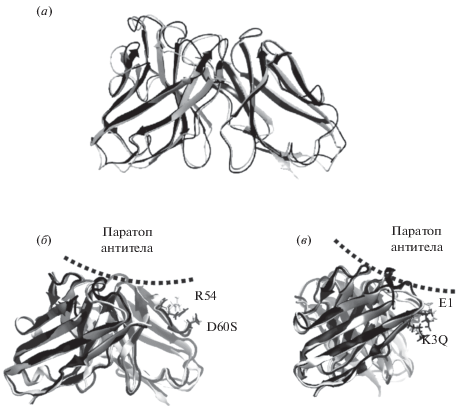
Введенные замены FR-участков в аминокислотные последовательности легкой и тяжелой цепей мышиного антитела B16 в ходе гуманизации не оказали существенного влияния на ход основной цепи углеродного скелета, и модельные структуры вариабельных доменов химерного антитела сhB16 и гуманизированного антитела hB16 демонстрируют высокое сходство (СКО по Cα-атомам 1.0 Å, рис. 2а). Отметим, что некоторые замены, в частности H8P в легкой цепи и R44G в тяжелой цепи, привели к заметному локальному искажению хода основной цепи углеродного скелета, однако конформация остатков, образующих вероятную поверхность паратопа, не претерпела значительных изменений. Исключением являются замены K3Q в последовательности FR1 тяжелой цепи и D60S в последовательности FR3 легкой цепи. Остаток K3 в легкой цепи мышиного антитела взаимодействует с остатком E1, поддерживая стабильную ориентацию последнего. При введении замены K3Q электростатическое взаимодействие между этими остатками исчезает, что приводит к увеличению подвижности остатка E1, возможному изменению его ориентации и смещению в область паратопа антитела, что может негативно сказаться на взаимодействии антитела с интерфероном (рис. 2б). Аналогично, остаток D60 в мышином антителе взаимодействует с остатком R54, ограничивая его подвижность. Введение замены D60S приводит к смещению остатка R54 в область, прилегающую к паратопу антитела (рис. 2в). Таким образом, для того чтобы конформация паратопа гуманизированного антитела соответствовала конформации паратопа мышиного антитела и взаимодействие с эпитопом сохранялись, было решено ввести дополнительные возвратные мутации в последовательности FR-участков зародышевой линии человека. Были введены следующие возвратные мутации: в последовательность FR1 тяжелой цепи – K3Q и D60S в последовательности FR3 легкой цепи.
Рис. 2.
Cуперпозиция моделей вариабельных доменов гуманизированного антитела hB16 (черным цветом) и мышиного антитела B16 (серым цветом). Сопоставление хода основной цепи углеродного скелета вариабельных доменов мышиного и гуманизированного антител (а). Изменение конформации остатка R54 в легкой цепи при введении замены D60S (б). Изменение конформации остатка Е1 в тяжелой цепи, при введении замены K3Q (в).
Получение рекомбинантных антител hB16 и chB16
Получение химерных антител является одним из этапов гуманизации. Нуклеотидные последовательности VH и VL мышиного антитела состыковывали с фрагментами, кодирующими Ck и CH1-CH3 человека, на 5'-конец последовательностей вводили последовательность Козак, необходимую для трансляции гена, и последовательности лидерных пептидов тяжелой и легкой цепей мышиного антитела B16, необходимых для секреции антитела. Нуклеотидные последовательности VH и VL клонировали в экспрессионный вектор pcDNA 3.4 (Invitrogen, USA) под контроль сильного промотора цитомегаловируса CMV и терминатора гена тимидинкиназы TK. Таким образом, были получены векторы для экспрессии химерных антител pcDNA3.4-chB16Lc и pcDNA3.4-сhB16Hc.
После валидации предложенных аминокислотных последовательностей вариабельных доменов гуманизированного антитела с помощью методов моделирования и молекулярной динамики, химико-ферментативным способом синтезировали нуклеотидные последовательности VH и VL антитела hB16. Вариабельные домены в составе плазмид для экспрессии химерного антитела заменили гуманизированными VH/VL и получили экспрессионные плазмиды pcDNA3.4-hB16Lc и pcDNA3.4-hB16Hc.
Экспрессионные векторы использовали для трансфекции суспензионной культуры клеток СНО. Транзиентную культуру клеток культивировали в течение 14 дней, после чего клетки осаждали центрифугированием. Антитела из культуральной жидкости выделяли аффинной хроматографией на колонке HiTrap MabSelect SuRe (GE Life Sciences, США). Полученные белки диализовали против буфера ФБС, стерилизовали фильтрацией с помощью 0.22 мкм фильтра Millex-GV и хранили при 4°C.
Биохимическая и иммунохимическая характеристика рекомбинантных антител chB16 и hB16
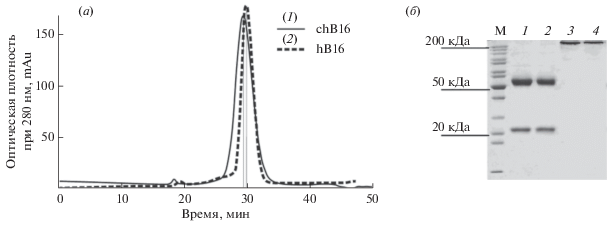
Качество выделения образцов антител после аффинной хроматографии оценивали гель-фильтрацией и электрофорезом в полиакриламидном геле. Профили элюции после гель-фильтрации как химерного, так и гуманизированного антитела представлены симметричными монопиками, что свидетельствует об их чистоте и отсутствии детектируемых количеств олигомерных форм (рис. 3а). Анализ препаратов гуманизированного и химерного антител методом ДСН-ПААГ электрофореза в восстанавливающих условиях (5% β-меркаптоэтанола) показал наличие в каждом образце двух полипептидов с молекулярными массами 22.5 и 55 кДа, которые соответствуют полипептидам легкой и тяжелой цепей антител (рис. 3б). В невосстанавливающих условиях для обоих антител можно было наблюдать одну полосу с молекулярной массой, превышающей расчетную. Подобного рода несоответствие расчетной и экспериментально определенной молекулярных масс антител класса IgG в 10% ДСН-ПААГ показано и другими исследователями ранее [13, 14].
Рис. 3.
Оценка чистоты препаратов рекомбинантных антител chB16 и hB16. (а) профиль элюции образцов рекомбинантных антител chB16 и hB16. (1) – препарат химерного антитела chB16, (2) – препарат гуманизированного антитела hB16. (б) электрофореграмма препаратов антител chB16 и hB16 в 10% ДСН-ПААГ (1, 2) – 2 мкг chB16 и hB16 в восстанавливающих условиях, (3, 4) – 0.5 мкг chB16 и hB16 в невосстанавливающих условиях, М – маркер молекулярных масс.
Способность выделенных антител специфически взаимодействовать с интерфероном-бета проверяли с помощью непрямого ИФА. Было показано, что и химерные и гуманизированные антитела связываются с интерфероном-бета (рис. 4). Определенные значения эффективных концентраций EC50 составили 14.3 нг/мл для химерного антитела и 8.7 нг/мл для гуманизированного антитела. Поскольку EC50 для гуманизированного антитела оказалось даже меньшим, чем для химерного, то можно говорить об отсутствии потери аффинности антитела в процессе гуманизации.
Рис. 4.
Непрямой иммуноферментный анализ взаимодействия химерного и гуманизированного антител с интерфероном бета человека. Пунктирная линия 1 – химерное антитело chB16, сплошная линия 2 – гуманизированное антитело hB16.
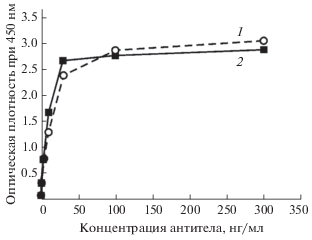
Также важной характеристикой антител являются значения констант диссоциации комплекса антиген-антитело. Константы диссоциации мышиного, химерного и гуманизированного антител определяли методом конкурентного ИФА по Фриге [15]. Полученные значения Kd cоставили 2.9 × × 10–9 М для мышиного антитела B16, 3.9 × 10–9 М для химерного антитела chB16 и 3.3 × 10–9 М для гуманизированного антитела hB16. Определенные величины констант более достоверно свидетельствуют о том, что в ходе гуманизации аффинность антитела не претерпела существенных изменений, и сродство гуманизированного антитела к интерферону-бета оказалось даже большим, чем у химерного, что говорит о корректности выбранной стратегии гуманизации.
Сравнительный анализ нейтрализующей интерферон-бета активности рекомбинантных и мышиных моноклональных антител
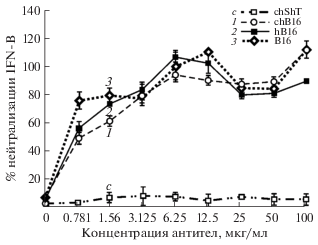
Биологическую активность полученных антител определяли в тесте подавления пролиферации. Принцип метода основан на регистрации антипролиферативного действия интерферона-бета по отношению к опухолевым клеткам в присутствии мононуклеаров периферической крови человека (МПК). Ранее было установлено, что среди нескольких опухолевых клеточных линий наибольший эффект интерферон-бета оказывает на клетки аденокарциномы толстой кишки человека HT29 (ATCC® HTB-38™, США), в связи с чем данная линия была использована в антипролиферативном тесте. Для определения степени нейтрализации интерферона опухолевые клетки инкубировали в присутствии МПК, интерферона-бета и серийных разведений антител. По окончании инкубации уровень пролиферации оценивали по количеству метаболически активных клеток с помощью МТТ-теста [17]. Обнаружено, что все три антитела показали высокую степень нейтрализации интерферона-бета человека (рис. 5). Максимальная степень нейтрализации для всех трех антител достигалась при концентрациях выше 6.25 мкг/мл. И, хотя при концентрациях гуманизированного антитела более 25 мкг/мл степень нейтрализации интерферона оказывалась ниже, чем при добавлении химерного или мышиного антитела, ее значения оказывались высокими и превышали 80%. Таким образом, можно сделать вывод, что гуманизация мышиного антитела B16 не оказала существенного влияния на способность антитела hB16 нейтрализовать интерферон-бета в используемом в работе тесте.
ВЫВОДЫ
В данной работе описана гуманизация связывающего и нейтрализующего интерферон-бета человека мышиного антитела B16. Гуманизация произведена методом “CDR-графтинга”, в качестве доноров FR-участков выбраны два гена антител зародышевой линии человека IGHV3-23*04 и IGKV1-9*01, найденные в ходе поиска наиболее гомологичных генов тяжелой и легкой цепей антитела B16. Для предотвращения возможной потери аффинности гуманизированного антитела в зонах Вернье были введены возвратные мутации в генах вариабельных доменов тяжелой цепи S49A, K94R и легкой цепи L41M, L78V. Для гуманизированного и исходного мышиного антитела были получены и сопоставлены модели структур вариабельных доменов. Замена FR-участков мышиного антитела на участки антитела зародышевой линии человека при введении возвратных мутаций в зонах Вернье не оказала существенного влияния на ход основной цепи углеродного скелета гуманизированного антитела. Расчет молекулярной динамики для начальных моделей показал необходимость введения дополнительных возвратных мутаций, не находящихся в зонах Вернье: K3Q в последовательности вариабельного домена тяжелой цепи и D60S в последовательности вариабельного домена легкой цепи. На основании полученных аминокислотных последовательностей были синтезированы нуклеотидные последовательности, кодирующие вариабельные домены гуманизированного антитела hB16, которые были объединены последовательностями константных доменов антитела человека. Гуманизированное антитело hB16 и химерное антитело chB16 были экспрессированы в транзиентной культуре клеток СНО, выделены и очищены методом аффинной хроматографии. Качество полученных препаратов антител изучали методом ДСН-ПААГ электрофореза и гель-фильтрации. Было показано, что полученные образцы антител содержали мономерные формы без примесей других белков. С помощью ИФА оценивали способность выделенных антител связывать интерферон-бета человека. Было найдено, что в ходе гуманизации мышиного антитела B16 его сродство к интерферону-бета не изменилось. Значения EС50 составили 14.3 нг/мл для химерного антитела и 8.7 нг/мл для гуманизированного. Полученные методом конкурентного ИФА значения Kd cоставили 2.9 × 10–9 М для мышиного антитела B16, 3.9 × 10–9 М для химерного антитела и 3.3 × 10–9 М для гуманизированного антитела hB16. Сравнение нейтрализующей способности химерного, мышиного и гуманизированного антитела также показало, что гуманизация не оказала существенного влияния на способность антитела нейтрализовать интерферон-бета человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование: наноспектрофотометр Implen P300; камера для горизонтального электрофореза 15*20 Sub-Cell GT Cell, камера для вертикального электрофореза Bio-Rad Mini-Protean 3 cell, источник питания PowerPack Basic (Bio-Rad, США); колонка с носителем HiTrap MabSelect Sure объемом 5 мл, хроматограф ActaPure 25, суперпетля объемом 150 мл, колонка Superdex 200 GL объемом 23.5 мл (GE Healthcare Life Sciences).
Реактивы, штаммы бактерий и клеточные линии: питательная среда OptiCHO, раствор пенициллин-стрептамицин-фунгизон, реагент для трансфекции lipofectamine 2000 (Invitrogen, США); планшеты для ИФА Nunc Maxisorp, 96-луночные плоскодонные планшеты для адгезионных культур (Corning Inc., США, PN 3598), реагент для выделения нуклеиновых кислот “TRIzol Reagent” (Thermo Fisher Scientific, США), обратная транскриптаза M-MuLV, эндонуклеазы рестрикции, T4-ДНК-лигаза, маркер молекулярных масс PageRuller Unstained Protein Ladder 10–200 кДа (Thermo Scientific, США); Tween-20; ДНК-полимераза Tersus, ДНК-полимераза Taq, набор для выделения плазмидной ДНК Plasmid miniprep, набор для выделения нуклеиновых кислот из агарозного геля и реакционных смесей Cleanup mini, вектор pAL-TA, cоосадитель нуклеиновых кислот “satellite red” (Евроген, Россия); DMSO (Sigma); бактоагар, дрожжевой экстракт, триптон (BD, Франция); фосфатно-солевой буфер таблетированный ФБС (10 мМ Na(H2PO4)–Na2(HPO4), 137 мМ NaCl, 2.7 мМ KCl, рН 7.2, (Amresco, США); 0.22 мкм фильтры Millex-GV (Millipore, США); нитроцеллюлозная мембрана (Membrane filters cellulose nitrate; pore size 0.45 μm, Advantec MFS Inc., США), набор белков HMW Gel Filtration Calibration Kit, (Ge Healthcare, США), интерферон-бета человека, гликозилированный (“ООО Фармапарк”, Россия), штамм E. coli XL1-Blue (a, b 3 recA1 endA1 gyrA96 thi_1 hsdR17 supE44 relA1 lac [F' proABlacIqZΔM15 Tn10 (Tetr)]) (Stratagene, США); клеточная линия HT29 (ATCC® HTB-38™, США).
Cписок олигонуклеотидов для амплификации нуклеотидных последовательностей тяжелой цепи:
VHB16F 5'-AGGGAAGCTAGCGCCACCATGAATTTCGGGCTCAGCTTGATTTTC-3'
VHB16R 5'-AGACCGATGGGCCCTTCGTGCTGGCTGCAGAGACAGTGACCAGAGTCC-3'
Cписок олигонуклеотидов для амплификации нуклеотидных последовательностей легкой цепи:
VLB16F 5'-AGGGAAGCTAGCGCCACCATGGAGACACATTCTCAGGTCTTTGTATAC-3'
VLB16SoeR – 5'-CAGCCACAGTCCGTTTTATTTCCAGCTTGGTCC-3'
hVLB16SoeR – 5'-GCAGCCACAGTCCGTTTGAT-3'
hVHB16R – 5'-AGACCGATGGGCCCTTCGTGCTGGCAGAGGACACTGTCACAA-3'.
Получение нуклеотидных последовательностей вариабельных доменов мышиного антитела B16 против IFN-β
Из клеток гибридомы В16 выделяли тотальную РНК с помощью реактива TRIzol Reagent (Thermo Fisher Scientific, США) из 5 × 105 клеток согласно протоколу производителя [18]. Качество полученной РНК оценивали по соотношению коэффициентов поглощения А260/А280, принимая допустимыми значения 1.95–2.0, а также с помощью электрофореза в 1% агарозном геле. Обратную транскрипцию осуществляли с помощью фермента M-MuLV RT (Thermo Fisher Scientific, США) с Oligo(dT)18 праймером согласно протоколу производителя. Для амплификации генов вариабельных доменов методом ПЦР использовали полимеразу Tersus и праймеры, специфичные к последовательностям СH1 IgG1 и Ck. Температуру отжига олигонуклеотидов устанавливали 60°C, время элонгации – 45 с. Фрагменты размером 321 и 342 п. о. выделяли из 1% агарозного геля и лигировали в pAL2-T вектор при 12°C в течение ночи. ДНК переосаждали изопропанолом, растворяли в воде и использовали для электропорации электрокомпетентных клеток E. coli XL1-Blue. Отбор клонов проводили с использованием бело-голубой селекции и анализа колоний с помощью ПЦР с праймерами М13. Отобранные колонии культивировали в течение ночи, культуру клеток осаждали центрифугированием и выделяли плазмидную ДНК с помощью набора Plasmid Miniprep. Нуклеотидные последовательности вариабельных доменов определяли секвенированием по методу Сэнгера (Евроген).
Получение экспрессионных плазмид для продукции рекомбинантных антител chB16 и hB16 в культуре эукариотических клеток CHO
Нуклеотидную последовательность VH мышиного антитела B16 амплифицировали с помощью ПЦР с праймерами VHB16F и VHB16R, содержащими участки узнавания эндонуклеаз рестрикции NheI и Bsp120I. Продукты реакции разделяли в 1% агарозном геле при напряжении поля 5 В/см, получали фрагмент размером 450 п. о., который обрабатывали соответствующими эндонуклеазами рестрикции и клонировали в подготовленный экспрессионный вектор pcDNA3.4-Hc, содержащий нуклеотидные последовательности CH1-CH3 антитела изотипа IgG1 человека. Последовательность VL состыковали с помощью SOE-PCR с последовательностью Сk человека. Для наработки фрагмента, кодирующего ген вариабельного домена, использовали олигонуклеотиды VLB16F и VLB16SoeR. Амплификацию осуществляли с помощью программы, содержащей два типа циклов. При выполнении циклов типа № 1 отжигали друг на друга фрагменты, кодирующие вариабельный и константный домены, и объединяли их в ходе элонгации. Количество циклов реакции устанавливали 5, температуру отжига – 52°С, время элонгации – 1 мин. В ходе циклов типа № 2 амплифицировали фрагменты, полученные на предыдущем этапе. Реакцию проводили с праймерами, количество циклов реакции – 15, температура отжига – 62°С, время элонгации – 1 мин. В ходе реакции ген химерной легкой цепи был снабжен лидерным пептидом и участками узнавания эндонуклеаз рестрикции NheI и XhoI. Из реакционной смеси получали фрагмент размером 820 п. о., который клонировали в вектор pcDNA3.4. Последовательности гуманизированных вариабельных доменов антитела hB16 синтезировали химико-ферментативным способом (Евроген). Получение экспрессионных плазмид, содержащих гены антитела hB16, проводилось аналогично. Для амплификации фрагментов, кодирующих гуманизированные вариабельные домены были использованы олигонуклеотиды VLB16F, hVLB16SoeR, VHB16F и hVHB16R.
Продукция рекомбинантных антител chB16 и hB16
Рекомбинантные антитела chB16 и hB16 получали транзиентной экспрессией в клетках СНО, культивирование которых проводили в колбах Эрленмейера в 30 мл среды CD DG44 (Invitrogen, США) при 37°С, 8% СО2, при скорости вращения 135 об./мин в термостатируемом СО2-инкубаторе в течение 14 суток. Трансфекцию клеток осуществляли с помощью трансфектагента Lipofectamine 2000 согласно протоколу производителя при начальной клеточной плотности 3 × 105 клеток/мл. Для трансфекции использовали 16.6 мкг плазмидной ДНК для экспрессии гена легкой цепи антитела, и 8.3 мкг плазмидной ДНК для экспрессии гена тяжелой цепи антитела. После культивации клетки осаждали центрифугированием в течение 5 мин при 700 g, культуральную жидкость собирали и центрифугировали при 3000 g в течение 30 мин при 4°С. К супернатанту добавляли 0.1 объема 10-кратного буфера ФБС, азид натрия и PMSF до конечных концентраций 7.5 и 0.7–1.4 мМ соответственно. Из осветленной культуральной жидкости выделяли антитела аффинной хроматографией.
Аффинная хроматография антител
Антитела выделяли аффинной хроматографией на колонке объемом 5 мл, содержащей носитель HiTrap MabSelect SuRe. Колонку уравновешивали 5 объемами буфера Трис-HCl (20 мМ Трис-HCl, 150 мМ NaCl, pH 7.2) и наносили культуральную жидкость со скоростью 2–3 мл/мин при давлении не более 0.5 МПа. После этого колонку промывали 5 объемами буфера Трис-HCl (20 мМ Трис-HCl, 150 мМ NaCl, pH 7.2). Антитела элюировали цитратным буфером (20 мМ лимонная кислота, 200 мМ NaCl, рН 3.0). Фракцию, содержащую искомый продукт, нейтрализовали добавлением 0.1 объема буфера для нейтрализации (1 М Tris-HCl, pH 8.0). Детекцию белков в ходе хроматографии осуществляли по поглощению при длине волны 280 нм. Элюат диализовали ФБС, дважды меняя раствор, и стерилизовали фильтрацией через фильтры Millex-GV, 0.22 мкм, полученные препараты хранили при температуре 4°C.
Аналитические методы
Гель-фильтрацию выделенных антител проводили на колонке Superdex 200 GL (10/300). Образцы диализовали против трис-буфера (0.1 М Трис-HСl, 0.15 М NaCl, pH 7.8) и наносили на колонку в количестве 80 мкг в объеме 50–200 мкл. Разделение белков осуществляли в Трис-буфере с добавлением 5% изопропанола, со скоростью потока 0.4 мл/мин. Молекулярную массу антител определяли с использованием набора калибровочных белков “HMW Gel Filtration Calibration Kit” согласно инструкции производителя [16]. Чистоту препарата и его полипептидный состав оценивали электрофорезом в 10% ДСН-ПААГ, в восстанавливающих и невосстанавливающих условиях [19].
Иммунохимические методы
Непрямой ИФА. В лунки планшета наносили 100 мкл раствора ФБС, содержащего 250 нг интерферона-бета человека, и инкубировали в течение ночи при 4°С. В первую лунку планшета вносили 100 нг антитела, далее делали трехкратные разведения 6 раз. Разведения антител осуществляли в трех повторах. Лунки планшета блокировали 1% раствором БСА в ФБС при 37°С в течение часа и промывали 5 раз ФБСТ (с добавлением 0.05% Tween-20), после чего добавляли раствор, содержащий коньюгат антител против IgG человека. Планшет инкубировали при 37°С в течение часа и промывали 9 раз ФСБТ, далее в лунки добавляли раствор субстрата – тетраметилбензидина, реакцию останавливали, добавляя 100 мкл 0.5 М фосфорной кислоты. Оптическое поглощение измеряли при длине волны 450 нм на планшетном спектрофотометре Microplate Reader 680 (BioRad, США).
Определение интерферон-бета нейтрализующей активности антител
Для исследования нейтрализующей активности антител против интерферона-бета готовили серийные разведения гуманизированного, химерного и мышиного антител, а также химерного антитела против шига-токсинов первого типа в качестве отрицательного контроля, в полной ростовой среде с 2% телячьей сывороткой. Опухолевые клетки HT29 культивировали в смеси с МПК в присутствии ИФН-бета и антител в различных концентрациях. В лунки 96-луночного планшета для адгезионных культур вносили среду DMEM, содержащую 2% сыворотку, 10 пг интерферона-бета, 5 тыс. клеток HT29 и 50 тыс. клеток МПК, а также разведенные антитела в конечных концентрациях от 100 до 0.781 мкг/мл, с уменьшением концентрации антитела в каждой следующей лунке в 2 раза. Суммарный объем суспензии в каждой лунке составлял 100 мкл, каждое разведение осуществляли в четырех повторениях. Суспензии инкубировали в течение 4 суток при 37°С в атмосфере 5% СО2. В лунки добавляли раствор МТТ до конечной концентрации 0.5% и инкубировали в течение 4 часов при 37°С в атмосфере 5% СО2. Планшеты центрифугировали, супернатанты удаляли, в лунки добавляли 100 мкл ДМСО, инкубировали в течение 20 мин при комнатной температуре. После этого измеряли оптическое поглощение при длине волны 560 нм и определяли среднее значение оптической плотности (ОПi) для i-го разведения антител по трем повторам. Также определяли среднее значение оптической плотности в лунках без интерферона-бета (ОПmax) и в лунках с интерфероном без антител (ОП0). Процент нейтрализации для каждой концентрации антител вычисляли по формуле:
На основании полученных значений процента нейтрализации и концентрации антитела строили графики зависимости процента нейтрализации от концентрации антител.
Моделирование структуры вариабельных доменов антител
Для создания моделей пространственной структуры антител был выбран метод моделирования на основании гомологии, реализованный в веб-сервисе Rosetta Antibody (http://antibody.graylab.jhu.edu/antibody) [20]. Для проведения дополнительной оптимизации, направленной на упорядочивание взаимодействия аминокислотных остатков как между собой (образование водородных связей, солевых мостиков и т.п.), так и с окружающим растворителем был проведен расчет молекулярной динамики начальных моделей в водном растворе при температуре 300 К и физиологической концентрации NaCl в течение 10 нс. Расчет выполняли с использованием программы Gromacs [21] с использованием силового поля charmm36. Анализ траектории МД показал, что модели принимают свои равновесные конформации уже через 1 нс. Полученные МД траектории были подвергнуты кластерному анализу с целью выявления наиболее представительных конформаций для каждой из моделей. Визуализация траекторий и структур была выполнена с помощью программы VMD [22]. Полученные конформации антител B16 и hB16 были сопоставлены визуально с использованием молекулярного редактора Maestro.
Список литературы
Hwang W.Y., Foote J. // Methods. 2005. V. 36. P. 3–10. https://doi.org/10.1016/j.ymeth.2005.01.001
Scott A.M., Lee F., Hopkins W., Cebon J.S., Wheatley J.M., Liu Z. // JCO. 2001. V. 19. P. 3976–3987. https://doi.org/10.1200/JCO.2001.19.19.3976
Buist M.R., Kenemans P., van Kamp G.J., Haisma H.J. // CII. 1995. V. 40. P. 24–30. https://doi.org/10.1007/BF01517232
Roque-Navarro L., Mateo C., Lombardero J., Mustelier G., Fernández A., Sosa S., Morrison S.L., Pérez R. // Hybridoma and Hybridomics. 2004. V. 22. P. 245–257. https://doi.org/10.1089/153685903322328974
Richards J., Auger J., Peace D., Gale D., Michel J., Koons A., Haverty T., Zivin R., Jolliffe L., Bluestone J.A. // Cancer Research. 1999. V. 59. P. 2096–2101.
Almagro J., Franson J. // Bioscience. 2008. V. 13. P. 1619–1633.
Hale G., Phillips M. // Biochemical Society Transactions. 1995. V. 23. P. 1057–1063. https://doi.org/10.1042/bst0231057
Safdari Y., Farajniaa S., Asgharzadehb M., Khalili M. // BGER. 2013. V. 29. P. 175–186. https://doi.org/10.1080/02648725.2013.801235
Makabe K., Nakanishi N., Tsumoto K., Tanaka Y., Kondo H., Umetsu M., Sone Y., Asano R., Kumagai I. // JBC. 2008. V. 283. P. 1156–1166. https://doi.org/10.1074/jbc.M706190200
Wedemayer G.J., Patten P A., Wang L.H., Schultz P.G., Stevens R.C. // Science. 1997. V.276. P. 1665–1669.
Zimmermann J., Oakman E.L., Thorpe I.F., Shi X., Abbyad P., Brooks C.L., Boxer S.G., Romesberg F.E. // PNAS. 2006. V. 103. P. 13 722–13 727.
Kabat E.A. // Sequences of Immunological Interest, 5 ed. Public Health Service, NIH, Bethesda, Md, USA, 1991.
Ильина E.H., Солопова O.Н., Балабашин Д.С., Ларина М.В., Алиев Т.К., Гребенникова Т.В., Лосич М.А., Зайкова О.Н., Свешников П.Г., Долгих Д.А., Кирпичников М.П. // Биоорган. химия. 2019. Т. 45. С. 58–68. [Ilina E.N., Solopova O.N., Balabashin D.S., Larina M.V., Aliev T.K., Grebennikova T.V., Losich M.A., Zaykova O.N., Sveshnikov P.G., Dolgikh D.A., Kirpichnikov M.P. // Rus. J. Bioorg. Chem. 2019. V. 45. P. 59–68.]https://doi.org/10.1134/S0132342319010081
Rizner T.L. // Biochemistry and Molecular Biology Education. 2014. V. 42. P. 152–159. https://doi.org/10.1002/bmb.20764
Friguet B., Chaffotte A.F., Djavadi-Ohaniance L., Goldberg M.E. // J. Immunol. Meth. 1985. V. 77. P. 305–319.
https://cdn.gelifesciences.com/dmm3bwsv3/AssetStream.aspx?mediaformatid=10061&destinationid=10016&assetid=14782.
Supino R. // In Vitro Toxicity Testing Protocols. Humana Press, 1995. P. 137–149.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685. https://doi.org/10.1038/227680a0
https://www.thermofisher.com/order/catalog/product/15596026#/15596026.
Weitzner B.D., Jeliazkov J.R., Lyskov S., Marze N., Kuroda D., Frick R., Bryfogle A.A., Biswas N., Gray J.J. // Nature Protocols. 2017. V. 12. P. 401–416. https://doi.org/10.1038/nprot.2016.180
Abraham M.J., Murtola T., Schulz R., Páll S., Smith J.C., Hess B., Lindahl E. // SoftwareX. 2015. V. 1–2. P. 19–25.https://doi.org/10.1016/j.softx.2015.06.001
Humphrey W., Dalke A., Schulten K. // Journal of Molecular Graphics. 1996. V. 14. P. 3338. VMD – Visual Molecular Dynamics.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия