Биоорганическая химия, 2020, T. 46, № 5, стр. 540-545
Новые структурные фрагменты молекул химических регуляторов роста и развития растений, стимулирующие ризогенез
Р. Г. Гафуров 1, *, И. В. Мартынов 1, Г. А. Романов 2
1 Институт физиологически активных веществ РАН
142432 Московская обл., Черноголовка, Северный проезд, 1, Россия
2 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: ravig@icp.ac.ru
Поступила в редакцию 24.02.2020
После доработки 28.02.2020
Принята к публикации 01.03.2020
Аннотация
На основе результатов, полученных с помощью биотеста на модели укоренения листовых и стеблевых черенков фасоли, предложенный его авторами как специфический тест на ауксины, ранее был сделан вывод, что бензиловым спиртам, бензиламинам и их четвертичным аммониевым производным присуща ауксиновая активность. В данной работе установлено, что указанные соединения не имеют ауксиновой активности. Это сделано с помощью количественного молекулярного биотеста на модели трехдневных проростков трансгенного арабидопсиса Arabidopsis thaliana L., трансформированного конструкцией, содержащей ген β-глюкуронидазы под контролем чувствительного к ауксину полусинтетического промотора DR5. В результате найдено, что биотест на модели укоренения листовых и стеблевых черенков фасоли не является специфически ауксиновым и отражает лишь ризогенезную, но не собственно ауксиновую активность исследуемых соединений. С помощью биотеста по влиянию на ризогенез десятидневных проростков гороха (Pisum sativum L.) сорта “Шестинедельный” установлено, что по ризогенезной активности исследованные стресспротекторы-фиторегуляторы сопоставимы с природным ауксином индолил-3-уксусной кислотой (ИУК), хотя не являются ауксинами. Это согласуется с прежними данными о ризогенезной активности, полученными на моделях укоренения листовых и стеблевых черенков фасоли и проращивания семян ячменя. Показано, что оксабензильная –OBzl и азабензильная –NHBzl группы являются новыми структурными фрагментами, которые придают химическим регуляторам роста растений высокую ризогенезную активность.
ВВЕДЕНИЕ
Растение, как живой организм, прикреплено к земле и не может уклониться от воздействий окружающей среды. Жизнь растения полностью зависит от почвенных, климатических, погодных и других текущих условий среды. При этом устойчивость его роста и развития, а также постоянство внутренней среды обеспечивается высокочувствительными системами регуляции физиологических процессов, включая ферментную, генетическую, мембранную, трофическую, гормональную, электрофизиологическую системы. Они объединены в единую надсистему организменной интеграции и раздражимости [1].
Физиология растения выстроена так, что определенные внешние воздействия оно может воспринимать как стресс и в ответ до некоторого уровня повышать энергетику роста и развития, решая главную задачу – дать семена, оставить потомство. На этой основе реализован целый ряд физических методов активации всхожести семян и развития растений, путем воздействия на семена теплом или холодом, магнитным полем, лазерным излучением, радиоволнами и т.д. [2]. В качестве регуляторов роста и развития растений (РРРР) описаны тысячи химических веществ [2, 3]. Отдельные из них широко вошли в практику растениеводства и имеют такое же значение для защиты и сохранения урожая, как и известные пестициды – инсектициды, фунгициды, гербициды [4]. РРРР повышают устойчивость сельскохозяйственных растений, массу и качество урожая, будучи применены для предпосевной обработки семян, опрыскивания вегетирующих растений, обработки полученных плодов или с помощью иных операций, Например, ретарданты позволяют выращивать высокоурожайные длннностебельные сорта зерновых с применением высоких доз минеральных удобрений для повышения урожайности и при этом избежать потерь от полегания хлебов в период уборки [4].
Синтез и системный поиск новых химических соединений, превосходящих по эффективности известные регуляторы роста и развития растений, до сих пор остается актуальной задачей.
Исследования, проведенные в научно-исследовательских институтах бывшей Россельхозакадемии, показали, что объединение в молекуле фрагментов с ретардантной (антигиббереллиновой) и проауксиновой активностью резко повышает эффективность полученных соединений как стресспротекторов-фиторегуляторов. Если гектарная доза хлорохолинхлорида, наиболее распространенного ретарданта, составляет по действующему веществу (д. в.) на зерновых 1800–4000 г/га [5], то стресспротектор-фиторегулятор бензихол (N,N,N,N-диметилбензил-(2-бензоксиэтил)-аммонийхлорид) в опытах на яровом ячмене был максимально эффективен в дозе 3 г/га по д. в. [6, 7], т.е. меньшей более, чем на три порядка. При этом биологическая эффективность бензихола была выше, чем у эталона хлорохолинхлорида.
Рис. 1.
Влияние индолил-3-уксусной кислоты ИУК, N,N,N,N-диметилбензил-(2-бензилоксиэтил)-аммонийхлорида (бензихола) и N,N,N,N-триэтил-(2-бензилоксиэтил)-аммонийхлорида (этихола) на экспрессию DR5::GUS и изменение активности β-глюкуронидазы в трехдневных проростках Arabidopsis thaliana. Погрешности средних значений соответствуют диапазонам стандартных отклонений.
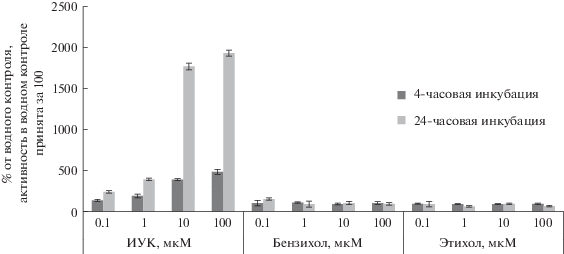
Ранее было показано, что соединения, содержащие в молекуле оксабензильный –OBzl или азабензильный –NHBzl фрагмент, в том числе, бензиловый спирт, бензиламины и их четвертичные аммониевые производные, например, N,N,N,N-диметилбензил-(2-бензоксиэтил)-аммонийхлорид (стресспротектор-фиторегулятор бензихол) и N,N,N,N-триэтил-(2-бензоксиэтил)-аммонийхлорид (стресспротектор-фиторегулятор этихол) (рис. 1) стимулируют укоренение листовых и стеблевых черенков фасоли, а также ризогенез и развитие проростков ячменя, проявляя при этом ризогенезную активность на уровне ауксинов-эталонов – 3-индолилуксусной (ИУК) и 2-нафтилуксусной кислот [8–10]. Исследования проводили с помощью применявшегося в то время доступного биотеста на ауксиновую активность [11], хотя уже были указания на то, что “биологические методы недостаточно специфичны, получаемые результаты зависят от практически не контролируемых колебаний чувствительности и реакционной способности” [12].
Авторы [11] указывали, что “тест на черенках фасоли обладает высокой специфичностью: только индолил-3-уксусная кислота (ИУК), как природный ауксин, вызывала активное корнеобразование, тогда как другие фитогормоны и ингибиторы на этом тесте были инертны или подавляли указанный процесс”. На основе результатов такого биотестирования был сделан вывод, что азабензильный и оксабензильный фрагменты придают вышеуказанным соединениям ауксиновую активность [8–10].
В этой связи цель настоящей работы состояла в том, чтобы путем применения современных высокочувствительных методов получить количественные данные об ауксиновой активности отдельных стресспротекторов-фиторегуляторов. В дальнейшем планировалось умножить их число путем синтеза на основе стратегии химического дизайна [13], затем количественно определить ауксиновую активность полученных соединений и, применив методы QSAR, выйти на уравнения структура – ауксиновая активность для этой группы. Ранее это было сделано для антигиббереллиновой активности группы ретардантов [14]. Применение методов QSAR является мощным современным средством, ускоряющим поиск химических соединений с полезными свойствами [15].
Предполагаемая ауксиновая активность у 2‑бензоксиэтиловых производных четвертичных аммониевых солей была оценена с помощью молекулярного биотеста [16] на модели трехдневных проростков трансгенного арабидопсиса Arabidopsis thaliana, трансформированного конструкцией, содержащей ген репортерного фермента β-глюкуронидазы (GUS) под контролем чувствительного к ауксину полусинтетического промотора DR5. Ранее данный биотест активно использовался для обнаружения как аналогов ауксина [17], так и его антагонистов [18].
Параллельно исследовали ризогенезную активность бензихола, этихола и их аналогов аквихола (N,N,N,N-триметил-[2-бензоксиэтил]-аммонийхлорид) и хлорохолинхлорида (N,N,N,N-триметил-[2-хлорэтил-аммоний]хлорид) (рис. 1) в биотесте по их влиянию на ризогенез гороха (Pisum sativum L.) сорта Шестинедельный в сопоставлении с эталонным ауксином индолил-3-уксусной кислотой (ИУК).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 2 приведены результаты биотестирования N,N,N,N-диметилбензил-(2-бензилоксиэтил)-аммонийхлорида (бензихол) и N,N,N,N-триэтил-(2-бензилоксиэтил)-аммонийхлорида (этихол) на ауксиновую активность по их влиянию на активность β-глюкуронидазы. Видно, что в молекулярном биотесте ауксиновая активность не регистрировалась ни у бензихола, ни у этихола даже при 24-часовой инкубации. На сегодняшний день этот биотест на ауксины на основе DR5::GUS арабидопсиса считается одним из самых чувствительных и специфичных. Таким образом, биологический биотест [11] для определения ауксиновой активности по укоренению листовых и стеблевых черенков фасоли оказался неспецифичным, он фиксировал ризогенезную, но не ауксиновую активность испытуемых веществ.
Рис. 2.
Влияние N,N,N,N-триметил-(2-хлорэтил)-аммонийхлорида (хлорхолинхлорида), N,N,N,N-триметил-(2-бензоксиэтил)-аммонийхлорида (аквихола), N,N,N,N-диметилбензил-(2-бензоксиэтил)-аммонийхлорида (бензихола) и N,N,N,N-триэтил-(2-бензоксиэтил)-аммонийхлорида (этихола) в концентрации 10 мкМ на развитие корневой системы десятидневных проростков гороха (Pisum sativum L.) сорта “Шестинедельный”. Результаты в водном контроле приняты за 100%. Погрешности средних значений соответствуют диапазонам стандартных отклонений.
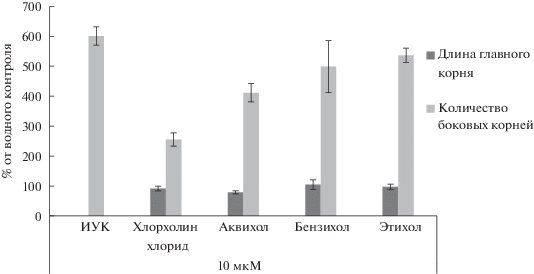
Ризогенезная активность бензихола, этихола и их аналога аквихола (N,N,N,N-триметил-(2-бензилоксиэтил)-аммонийхлорида) была проверена в опытах по их влиянию на формирование корневой системы проростков гороха (Pisum sativum L.) сорта Шестинедельный в сопоставлении с влиянием эталонов ИУК и хлорхолинхлорида. Как видно из рис. 2, все три испытуемых соединения, содержащие оксабензильный фрагмент –OBzl5, вызывали у проростков мощное развитие боковых корней. Активности всех трех соединений сопоставимы с ризогенезной активностью ИУК. В хлорохолинхлориде оксабензильная группа отсутствует, ее заменяет атом хлора. Соответственно ризогенезная активность хлорохолинхлорида в этом биотесте была существенно ниже и проявлялась лишь на уровне характерном для ретардантов – производных солей четвертичного аммония [19].
Итак, экспериментально показано, что оксабензильная группа –OBzl, соединенная с четвертичным аммониевым фрагментом через диметиленовый линкер (рис. 1), придает исследованным соединениям существенную ризогенезную активность, которая не имеет ауксиновой природы. Ранее было найдено, что высокой ризогенезной активностью обладают также соединения, содержащие азабензильную группу –NHBzl [8–10]. Следовательно, эти два химических фрагмента на основе остатка бензила являются теми структурными единицами, которые придают химическому соединению, где они присутствуют, высокую ризогенезную активность. Природа этого феномена требует дальнейшего изучения, которое может иметь три направления.
Во-первых, изучаемые 2-бензоксиэтиловые производные четвертичных аммониевых солей, не имея собственной ауксиновой активности, могут тем или иным образом действовать на ферменты метаболизма ауксина, например, подавляя активность белков семейств GH3 и/или UGT, инактивирующих ауксин. Это может приводить к локальному повышению концентрации эндогенного ауксина в месте воздействия изучаемых соединений. В пользу этого предположения свидетельствуют указания на то, что опрыскивание вегетирующих растений ячменя раствором бензихола повышало содержание ауксинов в стебле и листьях [20]. Во-вторых, существует ненулевая вероятность того, что аппарат рецепции ауксинов в растениях разных видов может иметь различную специфику в отношении веществ с ауксиновой активностью. В частности, тестируемые сельскохозяйственные растения теоретически могут, в отличие от модельных растений арабидопсиса, идентифицировать определенные 2-бензоксиэтиловые производные как ауксины. Однако это предположение представляется маловероятным, т.к. подобные видоспецифичные ауксины, насколько нам известно, до сих пор не обнаружены, а аппарат рецепции ауксинов у разных видов растений очень консервативен [21, 22]. Более вероятным представляется третье предположение о том, что изучаемые соединения могут иметь антицитокининовую активность. Цитокинины, другой важный класс гормонов растений, известны тем, что подавляют рост и развитие корневой системы, в том числе образование боковых корней. Умеренное снижение сигналинга цитокининов в корнях, достигнутое тем или иным способом, благоприятно влияет на развитие корневой системы. Таким путем действуют, кстати, и ауксины, которые подавляют синтез и снижают концентрацию цитокининов в тканях [23]. В пользу данного предположения свидетельствует определенное структурное сходство описываемых здесь окса- и азабензил-содержащих соединений с известными антицитокининами, которые структурно представляют собой бензильные производные аденина [24].
Ранее сообщалось, что исследованные соединения, как производные четвертичного аммония, проявляют также ретардантную активность на уровне хлорхолинхлорида [13]. Поэтому в данном случае физиологическая активность соединения является по сути суммой активности его эффекторных фрагментов, а именно ризогенезной и ретардантной, как и сообщалось ранее [24]. Термин “физиологическая активность” вещества, на самом деле подразумевает понятие “спектр физиологической активности”.
Таким образом, установлено, что ранее предложенный биотест [11] по укоренению черенков фасоли выявлял не ауксиновую, а лишь ризогенезную активность. На проростках гороха показано, что стресспротекторы-фиторегуляторы N,N,N,N-диметилбензил-(2-бензилоксиэтил)-аммоний-хлорид (бензихол) и N,N,N,N-триэтил-(2-бензилоксиэтил)-аммонийхлорид (этихол) и их аналог N,N,N,N-триметил-(2-бензилоксиэтил)-аммонийхлорид (аквихол), содержащие общий оксабензильный фрагмент –OBzl (рис. 1), сопоставимы по ризогенезной активности с индолил-3-уксусной кислотой, но при этом не являются ауксинами. Это согласуется с данными о высокой ризогенезной активности соединений, содержащих оксабензильный или азабензильный фрагмент, которые ранее были получены в тест-системах укоренения черенков фасоли и проращивания семян ярового ячменя [8–10]. Таким образом, оксабензильная –OBzl и азабензильная –NHBzl группы являются новыми структурными фрагментами молекул химических регуляторов роста и развития растений, придающими последним высокую ризогенезную активность, не имеющую ауксиновой природы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Биотест на ауксиновую активность на основе трансгенного арабидопсиса Arabidopsis thaliana L., экспрессирующего репортерный ген GUS под контролем ауксин-чувствительного промотора DR5 (DR5::GUS A. thaliana)
Для проведения биотеста использовали трехдневные проростки трансгенного DR5::GUS A. thaliana. Соединения испытывали в широком диапазоне концентраций от 0.1 до 100 мкМ, время инкубации 4 или 24 ч при температуре 23°С. В качестве положительного контроля брали ИУК в тех же концентрациях. Критерием наличия ауксиновой активности являлся подъем активности GUS, который измеряли количественно флуориметрическим методом [25] в белковых экстрактах проростков. Расчет активности репортерного белка осуществляли с нормированием на концентрацию белка в пробе, определяемого по методу Bradford.
Биотест на ризогенезную активность бензихола, этихола и аквихола на проростках гороха (Pisum sativum L.), сорт “Шестинедельный”
Сорт гороха “Шестинедельный” был отобран как наиболее чувствительный к действию испытуемых соединений из четырех сортов гороха после предварительных испытаний. Семена стерилизовали в растворе “Белизна” в течение 30 мин (стерилизация не влияла на всхожесть семян), многократно отмывали дистиллированной водой. Проращивали на 1/10 среды Мурасиге–Скуга в течение 3 дней, отбирали наклюнувшиеся семена по 15 штук на повторность и раскладывали на агаризованную среду (0.7% агар-агара, 1/10 минеральных солей по Мурасиге–Скугу). Каждый вариант состоял из 3-х повторностей. Среда содержала испытуемые вещества в концентрации 10 мкМ, отобранной после предварительных проб. Контролем служил вариант с индолил-3-уксусной кислотой. Растения выращивали в течение десяти дней, после чего подсчитывали количество боковых корней на главном корне, а также проводили промер длин главного корня.
Список литературы
Полевой В.В. // Физиология растений. М.: Высшая школа, 1989. С. 31–54.
Икрина М.А., Колбин А.М. // Регуляторы роста и развития растений. Т. 1. Стимуляторы. М.: Химия, 2004. 695 с.
Икрина М.А., Колбин А.М. // Регуляторы роста и развития растений. Т. 2. М.: Химия, 2005. 471 с.
Никелл Л.Дж. // Регуляторы роста растений. Применение в сельском хозяйстве. М.: Колос, 1984. 192 с.
Мельников Н.Н., Новожилов К.В., Белан С.Р., Пылова Т.Н. // Справочник по пестицидам. М.: Химия, 1985. С. 117.
Безлер Н.В., Панина Н.В., Гафуров Р.Г. // Агрохимия. 2006. Т. 32. С. 49–55.
Гафуров Р.Г., Еров Ю.В., Валиев Р.Г., Зарипов Н.В., Сахапов Р.Л., Безлер Н.В. // Проблемы агрохимии и экологии. 2017. № 2. С. 54–58.
Гафуров Р.Г. // Российский патент № 2211562 от 13.09.1999 “Регуляторы роста, развития и плодоношения растений”.
Гафуров Р.Г., Махмутова А.А. // Докл. РАН. 2003. Т. 391. С. 562–565.
Гафуров Р.Г., Махмутова А.А. // Прикл. биохим. микробиол. 2005. Т. 41. С. 243–249.
Кефели В.И., Чайлахян М.Х., Турецкая Р.Х., Коф Э.М., Кочанков В.Г., Ложникова В.Н., Хлопенкова Л.П., Янина Л.И.,Комизерко Е.И., Мазин В.В., Фролова И.А., Яковлева Л.В., Власов П.В., Подольный В.З. // Физиология растений. 1975. Т. 22. С. 1291–1298.
Дерфлинг К. // Гормоны растений. Системный подход. М.: Мир, 1985. С. 33.
Гафуров Р.Г., Зефиров Н.С. // Доклады РАН. 2004. Т. 399. С. 422–424.
Гафуров Р.Г., Григорьев В.Ю., Прошин А.Н., Чистякоа В.Г., Мартынов И.В., Зефиров Н.С. // Биоорган. химия. 2004. Т. 30. С. 656–662. [Gafurov R.G., Grigor’ev V.Yu., Proshin A.N., Chistyakov V.G., Martynov I.V., Zefirov N S. // Russ. J. Bioorg. Chem. 2004. V. 30, P. 592–596.] https://doi.org/10.1023/B:RUBI.0000049778.67576.cc
О.А. Раевский. Моделирование соотношения “Структура–свойство”. М.: Добросвет, 2015. 288 с.
Ulmasov T., Murfett J., Hagen G., Guilfoyle T.J. // Plant Cell. 1997. V. 9. P. 1963–1971 https://doi.org/10.1105/tpc.9.11.1963
Savaldi-Goldstein S., Baiga T.J., Pojer F., Dabi T., Butterfield C., Geraint Parry G., Santner A., Dharmasiri N., Tao Y., Estelle M., Noel J.P., Chory J. // PNAS. 2008. V. 105. P. 15190–15195. https://doi.org/10.1073/pnas.0806324105
Hayashi K., Kamio S., Oono Y., Townsend L.B., Nozaki H. // Phytochem. 2009. V. 70. P. 190–197. https://doi.org/10.1016/j.phytochem.2008.12.020
Муромцев Г.С., Чканников Д.И., Кулаева О.Н., Гамбург К.З. // Основы химической регуляции роста и развития растений. М.: Агропромиздат, 1987. 383 с.
Панина Н.В. // Защита и карантин растений. 2005. Т. 3. С. 26.
Kolachevskaya O.O., Lomin S.N., Arkhipov D.V., Romanov G.A. // Plant Cell Rep. 2019. V. 38. P. 681–698. https://doi.org/10.1007/s00299-019-02395-0
Kolachevskaya O.O., Sergeeva L.I., Floková K., Getman I.A., Lomin S.N., Alekseeva V.V., Rukavtsova E.B., Buryanov Y.I., Romanov G.A. // Plant Cell Rep. 2017. V. 36. P. 419–435. https://doi.org/10.1007/s00299-016-2091-y
Кривошеев Д.М., Колячкина С.В., Михайлов С.Н., Тараров В.И., Ванюшин Б.Ф., Романов Г.А. // Доклады РАН 2012. Т. 444. С. 687–690. https://doi.org/10.1134/S1607672912030155
Гафуров Р.Г., Зефиров Н.С. // Вестник Моск. университета. Сер. 2. Химия. 2007. Т. 48. С. 60–64.
Зверева С.Д., Романов Г.А. // Физиология растений. 2000. Т. 47. С. 479–488.
Гафуров Р.Г., Григорьев В.Ю., Соколов В.Б., Костылев П.И., Метлина Г.В., Романов Г.А., Прошин А.Н., Загоскина Н.В., Безлер Н.В., Шаповал О.А. // Заключительный отчет по контракту № 10799р/19752 от 13.08.2012 с Российским государственным фондом содействия развитию малых форм предприятий в научно-технической сфере. Черноголовка. ИФАВ РАН, 2014. 278 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


