Биоорганическая химия, 2020, T. 46, № 5, стр. 553-556
Синтез и оптические свойства конформационно-фиксированных индольного и индолинового производных хромофора GFP
Н. С. Балеева 1, *, А. Ю. Смирнов 1, И. Н. Мяснянко 1, М. С. Баранов 1, 2
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 09.04.2020
После доработки 11.04.2020
Принята к публикации 13.04.2020
Аннотация
Синтезированы новые конформационно-фиксированные аминопроизводные хромофора GFP, содержащие индольный и индолиновый фрагменты. Изучены оптические свойства полученных соединений. Установлено, что введение индолинового фрагмента позволяет сместить максимумы поглощения и испускания в более длинноволновую область и стабилизировать величину квантового выхода флуоресценции. Введение индольного фрагмента приводит к гипсохромному сдвигу и резкому уменьшению интенсивности флуоресценции.
Изучение процессов, происходящих в живых организмах невозможно без современных методов визуализации, среди которых наибольшую популярность приобрела флуоресцентная микроскопия. Возрастающий круг задач, решаемых с помощью этого метода, требует все большего разнообразия используемых маркеров. В качестве основы для создания такого типа соединений все чаще встречаются производные хромофора зеленого флуоресцентного белка (GFP), так как они имеют небольшой размер, хорошо растворимы в воде, нетоксичны и характеризуются большим разнообразием оптических свойств [1–3]. Разработанные подходы к внешней или внутренней фиксации бензилиденового фрагмента этих молекул позволяют многократно увеличивать квантовый выход флуоресценции и использовать их в роли флуорогенных [4–9] или флуоресцентных [10–15] красителей.
Ранее нами было показано, что замена гидроксильной группы бензилиденового фрагмента производных хромофора GFP на аминогруппу позволяет сместить положение спектральных максимумов в длинноволновую область [11–13]. Однако наличие свободных алкильных заместителей при атоме азота часто обуслoвливает заметное варьирование величины квантового выхода флуоресценции этих веществ в различных растворителях. Избежать этой проблемы позволяет введение разнообразных циклических групп. В частности, эффективным оказалось введение в молекулы тетра- и дигидрохинолинового фрагмента (соединения (V) и (VI), схема 1 ).
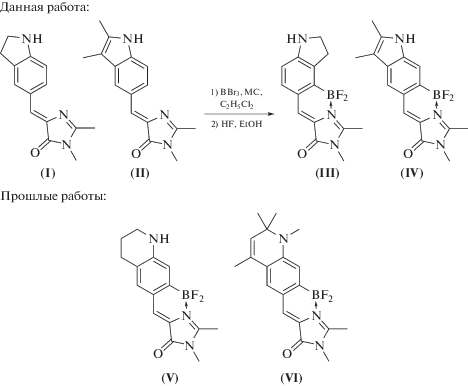
В данной работе мы продолжили свое исследование в этом направлении и создали похожие конформационно-фиксированные производные, содержащие индолиновый и индольный фрагменты (соединения (III) и (IV), схема 1 ). Эти вещества были получены по классической схеме из имидазолонов (I) и (II). Введение дифторборильной группы проводилось в дихлорэтане в присутствии трибромида бора и молекулярных сит (схема 1 ). Удивительным результатом оказался тот факт, что в случае соединения (I) борирование приводило к образованию стерически более нагруженного продукта, чего не наблюдалось ранее для соединения (V).
Схема 1. Схема синтеза производных (III) и (IV) и строение производных (V) и (VI).
Изучение оптических свойств полученных веществ показало, что индолиновый аналог (III) характеризуется заметным батохромным смещением максимумов поглощения и испускания относительно GFP и соответствующего ему хромофора, а также не отличается заметным варьированием квантового выхода флуоресценции в разных растворителях в отличие от родственных веществ с подвижными алкильными группами. Тем не менее отличия от соединения (V) для этого индолинового производного оказались не велики (рис. 1, табл. 1). Неожиданно было обнаружено, что полученное нами индольное производное (IV) и вовсе характеризуется весьма коротковолновым положением максимумов (рис. 1), более того, для него также было обнаружено резкое падение интенсивности эмиссии – квантовый выход флуоресценции снизился до ~1% во всех растворителях.
Рис. 1.
Нормализованные спектры поглощения (слева) и испускания (справа) соединений (III) (черный) и (IV) (серый) в ацетонитриле.
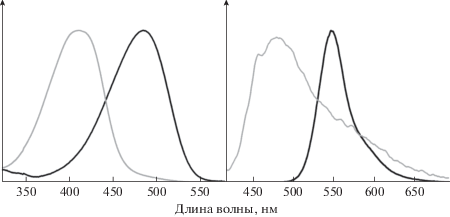
Таблица 1.
Оптические свойства соединений (III), (IV), (V) и (VI) в ацетонитриле
| Соединение | Максимум поглощения | Максимум эмиссии | Коэффициент молярного поглощения | Квантовый выход флуоресценции |
|---|---|---|---|---|
| (III) | 486 | 549 | 39 000 | 59% |
| (IV) | 412 | 480 | 30 000 | 1% |
| (V) | 487 | 547 | 44 000 | 67% |
| (VI) | 515 | 595 | 35 000 | 57% |
Таким образом, можно заключить, что индолиновое производное фиксированного хромофора GFP может быть использовано в качестве основы для новых флуоресцентных красителей и сенсоров, в то время как введение индольного фрагмента в подобные красители представляется нецелесообразным.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР (δ, м.д.; J, Гц) зарегистрированы на приборе Bruker Avance III (700 МГц, США) при 303 K в DMSO-d6 (внутренний стандарт –Me4Si). Спектры поглощения в УФ и видимом диапазоне регистрировали на спектрофотометре Varian Cary 100 Bio (США); спектры флуоресценции на спектрофлуориметре Varian Cary Eclipse (США). Температуры плавления определены на приборе SMP 30 (Великобритания) и не исправлены. Масс-спектры высокого разрешения записаны на приборе Bruker micrOTOF II, ионизация электрораспылением.
Z-5-(Аминобензилиден)-2,3-диметил-3,5-дигидро-4Н-имидазол-4оны. Соответствующий ароматический альдегид (5 ммоль) растворяли в хлороформе (25 мл), к полученному раствору добавляли раствор метиламина (40% водный, 2 мл), каталитическое количество пирролидина (0.05 ммоль) и безводный Na2SO4 (5 г). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, после чего отфильтровывали, дополнительно сушили над безводным Na2SO4 и упаривали на роторном испарителе. К полученному остатку добавляли этил(метоксиэтилиден)амино ацетат и выдерживали реакционную смесь при комнатной температуре в течение 24 ч. Затем реакционную смесь упаривали на роторном испарителе. Полученный продукт дополнительно очищали методом колоночной хроматографии (элюент – хлороформ–этиловый спирт, 50 : 1).
Z-5-(Индолин-5-илметилен)-2,3-диметил-3,5-дигидро-4Н-имидазол-4он (I). Желтый порошок (0.73 г, 60%); т. пл. 221–224°C; 1H-ЯМР: 8.03 (с, 1H), 7.70 (д, J2 8.0, 1H), 6.81 (с, 1Н), 6.48 (д, J2 8.2, 1H), 6.40 (с, 1Н), 3.54 (т, J2 8.6, 2H), 3.07 (с, 3Н), 2.98 (т, J2 8.5, 2H), 2.30 (с, 3H); 13C-ЯМР: 169.6, 159.7, 154.9, 134.0, 133.8, 129.2, 128.0, 127.0, 122.7, 107.1, 46.2, 28.2, 26.1, 15.1; HRMS (ESI) m/z: найдено М 242.1295; рассчитано для C14H16N3O+, [M + H]+ 242.1288.
Z-5-((2,3-Диметил-1Н-индол-5-ил)метилен)-2,3-диметил-3,5-дигидро-4Н-имидазол-4он (II). Желтый порошок (1.23 г, 92%); т. пл. 294–297°C; 1H-ЯМР: 10.93 (с, 1Н), 8.17 (с, 1H), 8.06 (д, J2 8.4, 1H), 7.27 (д, J2 8.4, 1H), 7.06 (с, 1Н), 3.10 (с, 3Н), 2.35 (с, 3Н), 2.31 (с, 3Н), 2.18 (с, 3H); 13C-ЯМР: 169.9, 161.3, 136.3, 135.7, 132.6, 129.2, 128.1, 124.5, 124.4, 123.1, 110.5, 106.3, 26.1, 15.2, 11.1, 8.2; HRMS (ESI) m/z: найдено М 268.1449; рассчитано для C16H18N3O+, [M + H]+ 268.1444.
Z-5-((Дифторборанил)аминобензилиден)-2,3-диметил-3,5-дигидро-4Н-имидазол-4оны. Соответствующий имидазолон (2 ммоль) растворяли в дихлорэтане (100 мл), к полученному раствору добавляли молекулярные сита (8 г 3Å и 8 г Å) и трибромид бора (8 ммоль). Полученную смесь кипятили в течение 3 часов (для соединения II перемешивали при комнатной температуре в течение 96 ч). Полученную смесь охлаждали и фильтровали, сита промывали этиловым спиртом (2 × 10 мл). К полученному фильтрату добавляли раствор плавиковой кислоты (40% водный, 4 мл) и перемешивали при комнатной температуре в течение 30 минут. Смесь разбавляли этилацетатом (100 мл), промывали водным раствором карбоната калия (5%, 2 × 50 мл), водой (2 × 50 мл) и насыщенным раствором хлорида натрия (2 × 50 мл). Полученный раствор сушили над безводным Na2SO4 и упаривали на роторном испарителе. Полученный продукт дополнительно очищали методом колоночной хроматографии (элюент – хлороформ–этиловый спирт, 50 : 1).
Z-5-((4-(Дифторборанил)индолин-5-ил)метилен)-2,3-диметил-3,5-дигидро-4Н-имидазол-4он (III). Оранжевый порошок (0.1 г, 18%); т. пл. около 300°C с разложением; 1H-ЯМР: 7.41 (с, 1H), 7.25 (д, J2 8.1, 1H), 6.98 (с, 1Н), 6.41 (д, J2 8.1, 1H), 3.61 (т, J2 8.6, 2H), 3.21 (с, 3H), 3.05 (т, J2 8.6, 2H), 2.67(с, 3Н); 13C-ЯМР: 161.9, 159.8, 156.8, 135.4, 133.1, 130.6, 122.8, 120.5, 106.4, 46.1, 27.6, 26.2, 12.5; HRMS (ESI) m/z: найдено М 290.1277; рассчитано для C14H15BF2N2O+, [M + H]+ 290.1271.
Z-5-((6-(Дифторборанил)-2,3-диметил-1Н-индол-5-ил)метилен)-2,3-диметил-3,5-дигидро-4Н-имидазол-4он (IV). Оранжевый порошок (0.06 г, 10%); т. пл. около 300°C с разложением; 1H-ЯМР: 11.18 (c, 1Н), 7.82 (с, 1H), 7.72 (с, 1H), 7.48 (с, 1H), 3.23 (с, 3Н), 2.73 (с, 3H), 2.50 (с, 1Н), 2.25 (с, 1Н); 13C-ЯМР: 163.6, 162.7, 138.7, 132.9, 131.6, 128.2, 124.5, 124.0, 114.3, 109.4, 106.6, 26.4, 15.0, 12.8, 8.2; HRMS (ESI) m/z: найдено М 316.1429; рассчитано для C16H17BF2N3O+, [M + H]+ 316.1427.
Список литературы
Walker C.L., Lukyanov K.A., Yampolsky I.V., Mishin A.S., Bommarius A.S., Duraj-Thatte A.M., Azizi B., Tolbert L.M., Solntsev K.M. // Curr. Opin. Chem. Biol. 2015. V. 27. P. 64–74. https://doi.org/10.1016/j.cbpa.2015.06.002
Baleeva N.S., Baranov M.S. // Chem. Heterocycl. Compd. 2016. V. 52. P. 444–446. https://doi.org/10.1007/s10593-016-1909-4
Yampolsky I.V., Kislukhin A.A., Amatov T.T., Shcherbo D., Potapov V.K., Lukyanov S., Lukyanov K.A. // Bioorg. Chem. 2008. V. 36. P. 96–104. https://doi.org/10.1016/j.bioorg.2007
Feng G., Luo C., Yi H., Yuan L., Lin B., Luo X., Hu X., Wang H., Lei C., Nie Z., Yao S. // Nucl. Acids Res. 2017. V. 45. P. 10 380–10 392. https://doi.org/10.1093/nar/gkx803
Filonov G.S., Moon J.D., Svensen N., Jaffrey S.R. // J. Am. Chem. Soc. 2014. V. 136. P. 16299–16308. https://doi.org/10.1021/ja508478x
Ge S., Deng H., Su Y., Zhu X. // RSC Adv. 2017. V. 7. P. 17 980–17 987. https://doi.org/10.1039/C7RA00974G
Chen C., Baranov M.S., Zhu L., Baleeva N.S., Smirnov A.Y., Zaitseva S.O., Yampolsky I.V., Solntsev K.M., Fang C. // Chem. Communs. 2019. V. 55. P. 2537–2540. https://doi.org/10.1039/C8CC10007A
Paige J.S., Wu K.Y., Jaffrey S.R. // Science. 2011. V. 333. P. 642–646. https://doi.org/10.1126/science.1207339
Povarova N.V., Zaitseva S.O., Baleeva N.S., Smirnov A.Yu., Myasnyanko I.N., Zagudaylova M.B., Bozhanova N.G., Gorbachev D.A., Malyshevskaya K.K., Gavrikov A.S., Mishin A.S., Baranov M.S. // Chem. – A Eur. J. 2019. V. 25. P. 9592–9596. https://doi.org/10.1002/chem.201901151
Zaitseva S.O., Farkhutdinova D.A., Baleeva N.S., Smirnov A.Yu., Zagudaylova M.B., Shakhov A.M., Astafiev A.A., Baranov M.S., Bochenkova A.V. // RSC Adv. 2019. V. 9. P. 38730–38734. https://doi.org/10.1039/C9RA08808C
Baleeva N.S., Myannik K.A., Yampolsky I.V, Baranov M.S. // Eur. J. Org. Chem. 2015. V. 2015. P. 5716–5721. https://doi.org/10.1002/ejoc.201500721
Baleeva N.S., Zaitseva S.O., Gorbachev D.A., Zagudaylova M.B., Baranov M.S. // Eur. J. Org. Chem. 2017. V. 35. P. 5219–5224. https://doi.org/10.1002/ejoc.201700805
Baranov M.S., Solntsev K.M., Baleeva N.S., Mishin A.S., Lukyanov S.A., Lukyanov K.A., Yampolsky I.V. // Chem. Eur. J. 2014. V. 20. P. 13 234–13 241. https://doi.org/10.1002/chem.201403678
Wu L., Burgess K. // J. Am. Chem. Soc. 2008. V. 130. P. 4089–4096. https://doi.org/10.1021/ja710388h
Baldridge A., Solntsev K.M., Song C., Tanioka N., Kowalik J., Hardcastle K., Tolbert L.M. // Chem. Comm. 2010. V. 46. P. 5686–5688. https://doi.org/10.1039/B927313A
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия