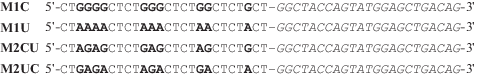Биоорганическая химия, 2020, T. 46, № 5, стр. 546-549
Одновременное встраивание модифицированных производных dU и dC в растущую цепь ДНК в реакции удлинения праймера и ПЦР
А. В. Чудинов 1, В. Е. Шершов 1, А. С. Павлов 1, О. С. Волкова 1, В. Е. Кузнецова 1, А. С. Заседателев 1, С. А. Лапа 1, *
1 ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова 32, Россия
* E-mail: lapa@biochip.ru
Поступила в редакцию 04.04.2020
После доработки 15.04.2020
Принята к публикации 18.04.2020
Аннотация
Изучена субстратная эффективность модифицированных производных 2'-дезоксиуридин (mod-dUTP) и 2'-дезоксицитидин-5'-трифосфатов (mod-dCTP) при их одновременном введении в реакции удлинения праймера (PEX) и ПЦР с полной заменой природных дезокситимидина (dT) и дезоксицитидина (dC). Применены полимеразы с отсутствующей 3'-5' экзонуклеазной активностью: Taq и Vent (exo-), а также природные и сконструированные ДНК-матрицы. Получены фрагменты ДНК, модифицированные одновременно двумя типами нуклеотидов как с аналогичными, так и с различными функциональными группами. Исследования важны для получения аптамеров с расширенными свойствами.
ВВЕДЕНИЕ
Аптамеры – РНК- или ДНК-олигонуклеотиды, способные проявлять аффинное сродство к биомолекулам. Введение модификаций в аптамеры позволяет изменить их физико-химические свойства и увеличить сродство к их мишеням [1, 2]; наиболее широко применяются ферментативные методы с использованием модифицированных трифосфатов дезоксинуклеозидов. Одновременное встраивание нуклеотидов с различными модификациями в одну растущую цепь ДНК способно изменить свойства получаемых модифицированных аптамеров, аптазимов и ДНК-зондов [3]. В настоящей работе проанализированы особенности одновременного встраивания в растущую цепь ДНК модифицированных dUTP и dCTP как с аналогичными, так и с различными функциональными модификациями.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
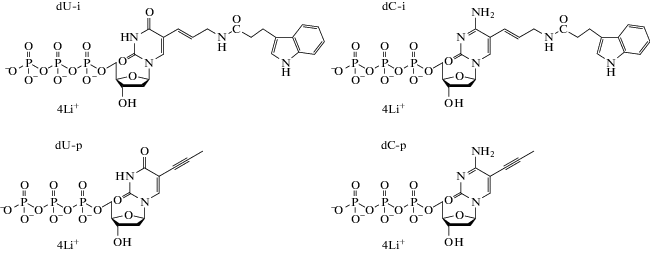
Исследовали субстратные свойства модифицированных аналогов дезоксинуклеозидов (mod-dUTP и mod-dCTP), структуры которых приведены на рис. 1. Проводили реакцию удлинения праймера (PEX) и ПЦР при одновременном введении mod-dUTP и mod-dCTP в реакционную смесь с полным замещением природных dTTP и dCTP. Cоздавали пары dU + dC с аналогичными и с различными модификациями. В качестве матриц для PEX и ПЦР применяли синтетические олигонуклеотиды и бактериальную ДНК, соответственно. Использовали ДНК-полимеразы Taq и Vent (exo-). Синтетические матрицы содержали участки для последовательного включения 1, 2, 3 и 4 модифицированных нуклеотидов.
Рис. 1.
Модифицированные трифосфаты дезоксиуридина (слева) и дезоксицитидина (справа). dU-i и dC-i – производные, содержащие на пиримидиновых основаниях фрагменты 3-индолпропионовой кислоты, dU-p и dC-p – производные, содержащие на пиримидиновых основаниях 5-пропинил.
В PEX с синтетическими матрицами Taq-полимераза воспринимала модифицированные производные dU, но показала слабую субстратную совместимость с mod-dC. Выходы продукта около 30% удалось получить лишь для 5-пропинил-производного. Введение в реакцию dCTP с массивным заместителем (индол) приводило к получению неполноразмерных продуктов либо полному их отсутствию. В парах модифицированных dU + dC выход реакции зависел от более “сложного” для полимеразы субстрата в паре, а именно модифицированного dC, и не превышал 10%. Для модифицированных dU удалось получить полноразмерные продукты для dU-i и dU-p с выходом около 30%.
Полимераза Vent (exo-) показала способность встраивать субстрат с гетероциклической модификацией (индол). В парах с различными модификациями выход определялся наиболее сложным субстратом, как и в случае Taq-полимеразы. Однако, в случае Vent (exo-) во всех вариантах комбинаций удалось получать полноразмерные продукты. Результат проведения PEX с Vent (exo-) полимеразой представлен на рис. 2a.
Рис. 2.
(a) PEX с применением модельных матричных олигонуклеотидов M2UC и M2CU (длина 49 нт). На примере Vent (exo-) ДНК-полимеразы. Ladder – маркер длин продуктов GeneRuler 50bp; пары использованных dNTP указаны над соответствующими лунками геля. Сверху каждой фореграммы указана использованная синтетическая матрица. Различная подвижность продуктов в геле, по-видимому, обусловлена структурными различиями модификаций. При выбранном временном интервале элонгации праймера наблюдается наличие полноразмерных продуктов реакции. (б) ПЦР с применением бактериальной ДНК-матрицы. Сверху каждой фореграммы указана использованная полимераза. Окрашивание бромистым этидием.
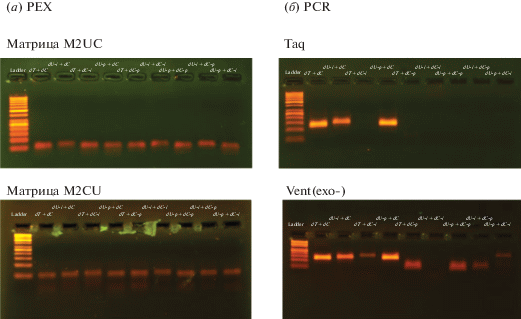
В случае ПЦР использовали те же комбинации модифицированных трифосфатов. В качестве матрицы использовали фрагмент гена rpoB Mycobacterium tuberculosis длиной 126 п.о. [4]. На рис. 2б показан результат ПЦР как для индивидуального применения разноименных нуклеотидов (mod-dU или mod-dC), так и для совместного введения (mod-dU + mod-dC) в различных комбинациях. Из электрофореграмм видно, что Taq-полимераза способна встраивать некоторые модифицированные dU, но модифицированные dC оказываются для нее более сложным субстратом, что хорошо коррелирует как с полученными ранее данными [5], так и с результатами PEX настоящего исследования.
Анализ методом ПЦР в режиме реального времени показывает, что производные с менее объемными функциональными группами (dU-p и dC-p) демонстрируют высокую скорость накопления продукта, в то время как массивные (dU-i и dC-i) демонстрируют либо пологую кривую накопления сигнала, либо задержку порогового цикла (Ct) в зависимости от использованной комбинации dU + dC. Поскольку в ПЦР временные интервалы элонгации праймеров гораздо меньше, чем в PEX, ингибирующее влияние модифицированных производных проявлялось сильнее. Увеличение времени элонгации праймеров может привести к большим выходам целевого продукта.
Наиболее сложным субстратом для Vent (exo-) оказался dC-i (индол). При индивидуальном применении для него удается получить полноразмерный продукт. Но в комбинации с модифицированными dU видно большое количество неполноразмерных продуктов.
Полимераза Vent (exo-) применима для проведения одновременного встраивания разноименных модифицированных трифосфатов в растущую цепь ДНК методом PEX при использовании матриц, содержащих последовательно от 1 до 4 повторов встраивания модифицированных производных. Показана возможность применения полимеразы Vent (exo-) в ПЦР для одновременного попарного введения разноименных модифицированных трифосфатов дезоксинуклеозидов (mod-dU + mod-dC) с различными модификациями. Эффективность амплификации зависит от природы введенных модификаций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Модифицированные аналоги трифосфатов дезоксинуклеозидов
Соединения dU-i и dC-i синтезированы в ИМБ РАН, соединения dU-p и dC-p произведены Trilink Biotechnologies (США). Структуры соединений приведены на рис. 1.
ДНК-матрицы
В работе использован фрагмент гена rpoB M. tuberculosis [4] для ПЦР и синтетические ДНК-матрицы для PEX длиной 49 нт, последовательности которых приведены ниже,
Полужирным шрифтом отмечены нуклеотиды, комплементарные исследуемым. Курсивом выделен праймерный участок.
Реакция удлинения праймера (PEX)
Реакционная смесь содержала природные dATP и dGTP в концентрации 0.2 мМ каждого, а также различные сочетания трифосфатов дезоксинуклеозидов, указанные на рис. 2; 1.5 U Taq- либо 0.5 U Vent (exo-) ДНК-полимеразы (реакционный буфер соответствовал примененной полимеразе); праймер для PEX; одну из синтетических матриц. Реакцию проводили на ДНК-амплификаторе MiniCycler (MJ Research, США) по следующей программе: 5 мин при 95°C; далее 30 с при 65°C и 40 минут при 72°C.
Полимеразная цепная реакция (ПЦР)
Реакционная смесь для ПЦР была аналогична примененной для PEX. В качестве матарицы использовали фрагмент гена rpoB M. Tuberculosis и соответствующие праймеры. Температурно-временной профиль ПЦР состоял из предварительной денатурации при 95°С в течение 3 мин, за которой следовал 31 цикл: 95°С в течение 30 с, 65°С в течение 30 с, 72°С в течение 40 с и далее завершающая инкубация при 72°С в течение 5 мин.
Список литературы
Rohloff J.C., Gelinas A.D., Jarvis T.C., Ochsner U.A., Schneider D.J., Gold L., Janjic N. // Mol. Ther. Nucleic Acids. 2014. V. 3. e201. https://doi.org/10.1038/mtna.2014.49
Tolle F., Mayer, G. // Chem. Sci. 2013. V. 4. P. 60–67. https://doi.org/10.1039/c2sc21510a
Gawande B.N., Rohloff J.C., Carter J.D., von Carlowitz I., Zhang C., Schneider D.J., Janjic N. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 2898–2903. https://doi.org/10.1073/pnas.1615475114
Mikhailovich V., Lapa S., Gryadunov D., Sobolev A., Strizhkov B., Chernyh N., Skotnikova O., Irtuganova O., Moroz A., Litvinov V., Vladimirskii M., Perelman M., Chernousova L., Erokhin V., Zasedatelev A., Mirzabekov A. // J. Clin. Microbiol. 2001. V. 39. P. 2531–2540.
Лапа С.А., Гусейнов Т.О., Павлов А.С., Шершов В.Е., Кузнецова В.Е., Заседателев А.С., Чудинов А.В. // Биоорган. химия. 2020. Т. 46. № 4. С. 411–417. [Lapa S.A., Gusejnov T.O., Pavlov A.S., Shershov V.E., Kuznetsova V.E., Zasedatelev A.S., Chudinov A.V. // Rus. J. Bioorg. Chem. 2020. V. 46. P. 551–556.] doi 10.1134/S106816202004010X
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия