Биоорганическая химия, 2020, T. 46, № 5, стр. 505-516
Регуляция свойств липидных мембран при взаимодействии с 2-гидроксипропил β-циклодекстрином. Молекулярные детали
А. А. Скуредина 1, *, А. С. Тычинина 1, И. М. Ле-Дейген 1, Н. Г. Белогурова 1, Е. В. Кудряшова 1
1 ФГБОУ ВО МГУ имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1/3, Россия
* E-mail: skuredinanna@gmail.com
Поступила в редакцию 04.04.2020
После доработки 15.04.2020
Принята к публикации 18.04.2020
Аннотация
Работа посвящена исследованию механизма взаимодействия 2-гидроксипропил β-циклодекстрина (ГПЦД) с липосомальным бислоем. Методом ИК-спектроскопии Фурье установлено, что основным сайтом связывания ГПЦД на поверхности нейтральных липосом на основе дипальмитоилфосфатидилхолина (ДПФХ) являются фосфатные группы липидов. Комплексообразование с ГПЦД приводит к стабилизации гелеобразного состояния в монокомпонентных липосомах (ДПФХ). Включение анионного компонента – кардиолипина (КЛ, 20%) в бислой приводит к изменению механизма взаимодействия липосомы-ГПЦД: наблюдается разупорядочение липидов в бислое, приводящее к нарушению целостности мембраны, что проявляется в высвобождении красителя (фенолфталеина), загруженного в липосомы. Влияние ГПЦД на процесс и параметры фазового перехода анионных липосом исследовали по термограммам, полученным на основе изменения положения полос поглощения ацильных цепей липидов в ИК-спектре липосом. Обнаружено расслоение ДПФХ/КЛ (80/20%) бислоя на две микрофазы с различным содержанием кардиолипина. Установлено, что ГПЦД обуслoвливает более выраженное расслоение в бислое: наблюдается дестабилизация мембраны вблизи температуры плавления микрофазы, обогащенной КЛ и наоборот – снижение подвижности липидов в областях с низким содержанием КЛ. При исследовании влияния ГПЦД на взаимодействие антибактериального препарата – левофлоксацина (ЛВ) с липидным бислоем обнаружено, что комплексообразование лекарственных молекул с ГПЦД приводит к увеличению эффективности адсорбции лекарственной молекулы на поверхности бислоя и может обеспечить облегчение транспорта лекарства за счет образования дефектов в мембране, при этом ЛВ в комплексе с ГПЦД демонстрирует высокую антибактериальную активность в системах in vitro, не ниже по сравнению со свободным ЛВ.
ВВЕДЕНИЕ
Одним из основных направлений развития биоорганической и биомедицинской химии на сегодняшний день является разработка новых высокоэффективных лекарственных формуляций с использованием различных систем доставок. Включение лекарства в системы доставки позволяет увеличить растворимость препарата и его биодоступность, снизить вероятность возникновения побочных эффектов, а также придать формуляции новые свойства: адресная доставка, замедленное высвобождение или высвобождение под действием внешнего фактора (температуры, изменения рН, облучения света и т.д.), влияние на проницаемость биомембран для лекарственной субстанции.
На сегодняшний день одним из перспективных видов носителей лекарств являются циклодекстрины (ЦД) – циклические олигосахариды, образованные несколькими D-глюкопиранозными остатками [1]. ЦД имеют форму усеченного конуса с внешней гидрофильной поверхностью и внутренней гидрофобной полостью. Такое строение ЦД обуславливает их способность формировать комплексы включения типа “гость-хозяин” со многими гидрофобными веществами, в том числе и с лекарственными молекулами. Включение в полость ЦД способствует увеличению растворимости и стабильности гидрофобной молекулы, устранению неприятных запахов и вкусов, а также обеспечению защиты от деградации микроорганизмами [2–4].
В зависимости от размера лекарственной молекулы возможно использование одного из трех типов ЦД (α-ЦД, β-ЦД или γ-ЦД), различающихся количеством D-глюкопиранозных остатков и, следовательно, размером внутренней полости. Большинство лекарственных молекул имеют в своей структуре небольшие гидрофобные ароматические фрагменты (например, фторхинолоны, ибупрофен, хлорамфеникол и др.), поэтому наиболее часто используются производные на основе β-ЦД [5]. Введение заместителей изменяет физико-химические свойства самого β-ЦД, значительно повышая его растворимость, а также влияет на стабильность его комплексов, поскольку новая функциональная группа может образовывать дополнительные связи с молекулой “гостя” [6–8].
Среди всех производных β-ЦД наиболее широкое применение в медицине имеет 2-гидроксипропил β-ЦД (ГПЦД). ГПЦД обладает высокой растворимостью в воде (больше 600 мг/мл), способен образовывать стабильные комплексы включения с широким спектром лекарственных препаратов. Безопасность ГПЦД была доказана in vivo, на сегодняшний день на фармацевтическом рынке существует несколько лекарственных формуляций на основе комплексов ГПЦД [2, 4].
Широкое применение ЦД в фармацевтике обуслoвливает необходимость глубокого изучения их способности взаимодействовать с биологическими мембранами. Известно, что в ряде случаев встраивание различных полимерных макромолекул в липидный бислой или их адсорбция на поверхности могут вызывать существенные изменения свойств биологической мембраны: ее проницаемости, микровязкости, скорости диффузии латеральной липидных молекул и скорости “флип-флопа”. Эти явления могут приводить к значительным изменениям в состоянии и жизнедеятельности клетки, вызывая активацию или ингибирование ферментов, влияя на клеточный гомеостаз, влиять на тромбогенность липидной мембраны [9, 10].
ЦД не способны проникать сквозь биологические барьеры, однако их производные могут сорбироваться на клеточной мембране и в ряде случаев извлекать из бислоя липиды, в том числе, холестерин, что приводит к нарушению целостности мембраны [1, 11]. Однако в целом эффект на физико-химические свойства мембраны чаще всего является мягким и обратимым. Возникновение дефектов в бислое под действием ЦД приводит к улучшению проникновения лекарственных препаратов сквозь мембрану и увеличивает их биодоступность [12].
В настоящее время механизм взаимодействия производных ЦД с липидами в бислое, как и влияние комплексообразования ЦД с лекарственными молекулами на проницаемость биомембран для этих лекарственных субстанций, недостаточно изучен. Определение эффективности связывания и основных сайтов взаимодействия липосом с ЦД необходимо для разработок высокоэффективных систем доставок лекарственных препаратов на основе ЦД с улучшенной биодоступностью. Для установления механизма взаимодействия производных ЦД с липидным бислоем в работе рассмотрено влияние ГПЦД на состояние и целостность липосом различного состава спектроскопическими методами, главным образом, с помощью метода ИК-спектроскопии Фурье. Методом КД спектроскопии изучено влияние ГПЦД на механизм взаимодействия лекарственной субстанции – левофлоксацина (ЛВ) с липосомами, что крайне важно при разработке систем доставки лекарств с использованием производных ЦД.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для детального исследования механизма взаимодействия ГПЦД нейтральными (100% ДПФХ) и анионными (ДПФХ/КЛ = 80/20%) липосомами, а также для установления основных сайтов связывания в комплексе липосомы-ГПЦД, был применен метод ИК спектроскопии Фурье. ИК спектроскопия является высокоинформативным методом исследования состояния бислоя, поскольку позволяет следить за изменениями состояния каждой функциональной группы липидов и их лигандов, и предоставляет ценную информацию об физико-химических свойствах мембраны, например, о подвижности гидрофобных цепей [14, 15].
Исследование систем липосомы-ГПЦД методом ИК спектроскопии Фурье
В ИК-спектре как монокомпонентных нейтральных (100% ДПФХ, рис. 1а), так и двухкомпонентных анионных (ДПФХ/КЛ = 80/20%) липосом присутствуют высокоинтенсивные полосы поглощения 2919 и 2851 см–1, соответствующие ассиметричным и симметричным валентным колебаниям CH2 групп гидрофобных цепей липидов. Полосы поглощения 1727–1740 и 1220–1230 см–1 характерны для колебаний С=О и асимметричных валентных колебаний фосфатных групп соответственно [13].
Рис. 1.
(а) ИК-спектр липосом из дипальмитоилфосфатидилхолина, Слипидов = 5 мг/мл, pH 7.4. (б) ИК-спектр 2-гидроксипропил β-циклодекстрина, Cгпцд = 50 мг/мл, рН 7.4.
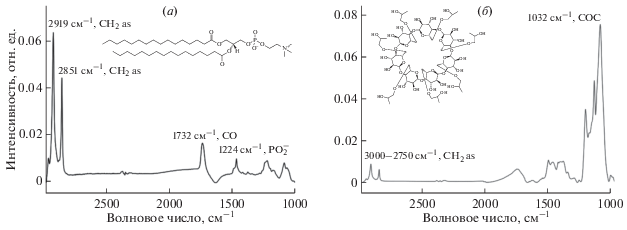
В ИК-спектре ГПЦД (рис. 1б) наиболее интенсивная полоса поглощения при 1032 см–1 соответствует колебаниям С–О–С связи. Кроме того, аналитически значимыми могут быть полосы поглощения в диапазоне 3000–2750 см–1, соответствующие колебаниям СН3 и СН2 группам. Следует отметить, что наиболее интенсивные полосы поглощения липосом находятся в области больших волновых чисел, в то время как для ГПЦД – в области малых, что делает ИК-спектроскопию более привлекательным методом для анализа систем, содержащих оба компонента, с точки зрения исключения перекрывания полос. В настоящей работе для исследования состояния бислоя в присутствии ГПЦД из ИК-спектра системы липосомы-ГПЦД вычитался ИК-спектр ГПЦД и были определены положения основных полос поглощения липидов.
Для получения комплексов липосомы-ГПЦД к суспензии липосом (5 мг/мл) добавляли ГПЦД в диапазоне значений концентрации от 20 до 60 мг/мл. Для того чтобы определить роль фазового состояния липидной мембраны на механизм взаимодействия липидного бислоя с ГПЦД варьировали температуру предварительной инкубации комплексов (25, 37 или 50°С): при 25°C липосомы (100% ДПФХ и 80/20% ДПФХ/КЛ) находятся в гелеобразном состоянии, вблизи 37°C – в состоянии фазового перехода, а при 50°C как анионные, так и нейтральные липосомы находятся в жидкокристаллическом состоянии [13]. После инкубации комплексы охлаждали до комнатной температуры и регистрировали ИК-спектры. В табл. 1 приведены положения полос ИК-спектров комплексов нейтральных липосом (100% ДПФХ) с ГПЦД при различных условиях инкубации. Важно отметить, что сдвиг полосы поглощения в ИК-спектре более, чем на 1 см–1 является аналитически значимым [14, 16].
Таблица 1.
Положения полос поглощения в ИК-спектре липосом (100% ДПФХ) при различных температурах инкубации с 2-гидроксиропил β-циклодекстрином, см–1. В скобках дополнительно указаны обнаруженные плечи полос. 0.02 М натрий-фосфатный буферный раствор, рН 7.4, 22°С
| Полоса поглощения | Без инкубации | Температура предварительной инкубации комплексов | ||
|---|---|---|---|---|
| 25°С | 37°С | 50°С | ||
| СГПЦД = 20 мг/мл | ||||
| νas (CH2) | 2919.3 ± 0.2 | 2919.3 ± 0.2 | 2919.0 ± 0.2 | 2918.8 ± 0.2 |
| νs (CH2) | 2849.9 ± 0.2 | 2850.6 ± 0.2 | 2850.8 ± 0.2 | 2851.3 ± 0.2 |
| ${\nu }\left( {{\text{PO}}_{{\text{2}}}^{ - }} \right)$ | 1222.5 ± 0.2 | 1225.0 ± 0.2 | 1225.9 ± 0.2 | 1226.6 ± 0.2 |
| ν (C=O) | 1733.4 ± 0.2 | 1732.8 ± 0.2 | 1732.7 ± 0.2 | 1731.5± 0.2 |
| СГПЦД = 40 мг/мл | ||||
| νas (CH2) | 2919.4 ± 0.2 | 2919.6 ± 0.2 | 2919.3 ± 0.2 | 2918.8 ± 0.2 |
| νs (CH2) | 2850.8 ± 0.2 | 2849.9 ± 0.2 | 2850.7 ± 0.2 | 2850.0 ± 0.2 |
| ${\nu }\left( {{\text{PO}}_{{\text{2}}}^{ - }} \right)$ | 1223.6 ± 0.2 | 1224.7 ± 0.2 | 1228.5 ± 0.2 | 1233.6 ± 0.2 |
| ν (C=O) | 1733.5 ± 0.2 | 1734.2 ± 0.2 | 1732.4 ± 0.2 | 1731.8 ± 0.2 |
| СГПЦД= 60 мг/мл | ||||
| νas (CH2) | 2919.1 ± 0.2 | 2919.8 ± 0.2 | 2917.1 ± 0.2 | 2917.8 ± 0.2 |
| νs (CH2) | 2851.2 ± 0.2 | 2851.3 ± 0.2 | 2851.3 ± 0.2 | 2850.1 ± 0.2 |
| ${\nu }\left( {{\text{PO}}_{{\text{2}}}^{ - }} \right)$ | 1222.6 ± 0.2 | 1223.9 ± 0.2 | 1224.0 ± 0.2 (1214.0 ± 0.2) | 1242.7 ± 0.2 (1213.7 ± 0.2) |
| ν (C=O) | 1733.1 ± 0.2 | 1733.0 ± 0.2 | 1733.7 ± 0.2 | 1732.2 ± 0.2 |
Согласно полученным данным, при температуре инкубации 25°C с ГПЦД положения полос поглощения в ИК-спектрах липосом (100% ДПФХ) существенным образом не изменяются вне зависимости от концентрации циклодекстрина. Вероятно, это свидетельствует об отсутствии или незначительности взаимодействия между ГПЦД с мембраной в гелеобразном состоянии, характеризующимся ограниченной подвижностью гидрофобных цепей в бислое.
Иная картина наблюдается при предварительной инкубации с нагревом. Установлено, что наиболее выраженные сдвиги полос поглощения в ИК-спектре липосом наблюдаются при температуре предварительной инкубации 50°C и наиболее высокой концентрации ГПЦД – 60 мг/мл (рис. 2). Липосомы при данной температуре находятся в жидкокристаллическом состоянии и обладают высокой подвижностью ацильных цепей в бислое.
Рис. 2.
Положение полос поглощения ассиметричных и симметричных СН2 групп липосом ДПФХ 100% (1) и комплексов липосом ДПФХ 100% с 2-гидроксиропил β-циклодекстрином (60 мг/мл) после инкубации при 50°С (2) и последующего охлаждения. 0.02 М натрий-фосфатный буферный раствор, рН 7.4, 22°С.
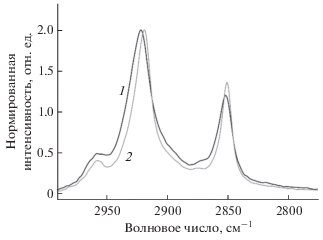
Согласно табл. 1 в данных условиях наиболее выраженные изменения наблюдаются для полосы поглощения асимметричных валентных фосфатной группы: существенный высокочастотный сдвиг указывает на снижение степени гидратации данных функциональных групп, по-видимому, за счет образования водородных связей со стерически наиболее доступными гидроксипропильными группами молекул ГПЦД.
Полосы поглощения асимметричных и симметричных валентных колебаний CH2 групп претерпевают значительный низкочастотный сдвиг, указывающий на снижение подвижности гидрофобных цепей при связывании с ГПЦД. По-видимому, в процессе инкубации комплекса при 50°С циклодекстрин не только адсорбируется на поверхности липосом, но и заглубляется в “размягченный бислой”, что при приводит к снижению подвижности гидрофобных цепей после охлаждения до комнатной температуры.
Данная гипотеза подтверждается и данными по взаимодействию липосом с ГПЦД при предварительной инкубации при 37°С, где наблюдаются аналогичные сдвиги полос поглощения, но выраженные в меньшей степени. В то же время, полоса νasCH2 уже смещается в область меньших волновых чисел, что свидетельствует о существенном снижении подвижности липидов в бислое.
Таким образом, для образования комплекса ДПФХ 100% липосом с ГПЦД необходимо, чтобы везикулы находились в состоянии фазового перехода или жидкокристаллическом состоянии. Кроме того, концентрация ГПЦД должна быть не менее 40 мг/мл. Полученные результаты подтверждают литературные данные [5, 11, 16], что ГПЦД является одним из наиболее безопасных и не токсичных производных β-ЦД по отношению к мембране – для достижения заметного изменения физико-химических свойств необходимы предварительный нагрев и высокие концентрации ЦД.
Иная картина наблюдается при взаимодействии ГПЦД с двухкомпонентными анионными липосомами, содержащими 20% кардиолипина (КЛ), где помимо привнесения отрицательного заряда фосфатных групп, “конусообразный” КЛ разрыхляет бислой, способствуя образованию дефектов и снижая температуру фазового перехода [17]. Положение полос поглощения в ИК-спектре липосом в условиях образования комплекса с ГПЦД (СГПЦД = 60 мг/мл, инкубация при 50°С) в зависимости от липидного состава (100% ДПФХ или ДПФХ/КЛ = 80/20%) представлены в табл. 2.
Таблица 2.
Положение полос поглощения в ИК-спектре липосом (100% ДПФХ и 80% ДПФХ/20% КЛ) в присутствии ГПЦД (60 мг/мл), температура предварительной инкубации 50°С. 0.02 М натрий-фосфатный буферный раствор, рН 7.4, 22°С
| Колебания связей | Липосомы (ДПФХ), см–1 |
Липосомы (ДПФХ) + + ГПЦД, см–1 | Липосомы (ДПФХ/КЛ), см–1 | Липосомы (ДПФХ/КЛ) + + ГПЦД, см–1 |
|---|---|---|---|---|
| 100% DPPC | 80% DPPC/20% CL | |||
| νas (CH2) | 2919.1 ± 0.2 | 2917.8 ± 0.2 | 2919.2 ± 0.2 | 2921.1 ± 0.2 |
| νs (CH2) | 2851.2 ± 0.2 | 2850.1 ± 0.2 | 2851.5 ± 0.2 | 2852.5 ± 0.2 |
| ${\nu }\left( {{\text{PO}}_{{\text{2}}}^{ - }} \right)$ | 1222.6 ± 0.2 | 1242.7 ± 0.2 (1213.7 ± 0.2) |
1225.0 ± 0.2 | 1222.0 ± 0.2 |
| ν (C=O) | 1733.1 ± 0.2 | 1732.2 ± 0.2 | 1739 ± 0.2 | 1738.2 ± 0.2 |
| (1723 ± 0.2) | ||||
Взаимодействие анионных липосом (ДПФХ/ КЛ = 80/20%) с ГПЦД обуслoвливает низкочастотные сдвиги полос поглощения ${\text{РО}}_{2}^{ - }$ и С=О групп (табл. 2), что указывает на повышение степени гидратации полярных групп липидов. Повышение степени гидратации карбонильных и фосфатных групп характерно при фазовом переходе липосом из гель-фазы в жидкокристаллическую фазу. Такие изменения организации липидов в бислое должны сопровождаться увеличением подвижности алифатических цепей липидов. Действительно, при образовании комплекса липосом (ДПФХ/КЛ = 80/20%) с ГПЦД наблюдается высокочастотный сдвиг полосы (табл. 2), соответствующий асимметричным колебаниям СН2 групп, на 2 см–1, что характерно при разупорядочении мембраны при переходе в жидкокристаллическое состояние [18].
Таким образом, в зависимости от липидного состава возможно два принципиально разных механизма взаимодействия ГПЦД с липидным бислоем. Для монокомпонентных липосомальных систем наблюдается преимущественная адсорбция ГПЦД на поверхности бислоя за счет образования водородных связей между гидроксильными группами ГПЦД и фосфатными группами ДПФХ. Кроме того, в условиях инкубации (50°С) возможно заглубление ГПЦД в “размягченный бислой”. Это приводит к снижению подвижности гидрофобных цепей после охлаждения до комнатной температуры. Взаимодействие ГПЦД с бислоем, содержащим КЛ, напротив, приводит к увеличению степени гидратации поверхностных фосфатных и карбонильных групп липидов, а также к увеличению подвижности ацильных цепей в гидрофобной части липидного бислоя. Подобные эффекты возможны вследствие образования дефектов в мембране, которые обусловлены неоднородностью липидного состава (“конусообразной” геометрией КЛ), а также формированием микрофаз, обогащенных и обедненных КЛ [13]. Кроме того, в таких системах может происходить извлечение липидов из бислоя: так в литературе описано извлечение дипальмитоилфосфатидилхолина, 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина, холестерина, дегидроэргостерола и других фосфолипидов из липосом и липидных монослоев под действием ЦД и их производных [11]. Более того, в экспериментах in vitro (Mycobacterium sp.) было показано, что ЦД извлекают липиды из клеточной стенки, тем самым повышая ее проницаемость для лекарственных молекул [19].
Влияние ГПЦД на температуру фазового перехода липосом
Для более глубокого понимания молекулярного механизма взаимодействия ГПЦД с бислоем, содержащим 20% КЛ, было рассмотрено влияние циклодекстрина на процесс фазового перехода в анионных липосомах. Температура фазового (Тm) перехода является ключевой характеристикой липосомальной мембраны, описывающей состояние бислоя. Наиболее чувствительными к фазовому переходу в ИК-спектре липосом являются полосы поглощения гидрофобных цепей липидов. Ранее было показано, что положение полос ассиметричных колебаний СН2 групп зависит от подвижности ацильных цепей: низкочастотный сдвиг указывает на более плотную упаковку липидов в бислое, а высокочастотный сдвиг свидетельствует о разупорядочивании бислоя [20].
Нейтральные липосомы (100% ДПФХ) характеризуются температурой фазового перехода (Тm) в диапазоне от 40 до 44°С [14, 18]. Термограмма анионных липосом, содержащих КЛ (ДПФХ/КЛ = = 80/20%), позволяет обнаружить основной фазовый переход при ~35–37°С и предварительный переход при 27–30°С (рис. 3), что свидетельствует о сосуществовании двух смешанных микрофаз, имеющих разное соотношение ДПФХ/КЛ. Ранее существование таких микрофаз для двухкомпонентных липосом (ДПФХ/КЛ) было продемонстрировано методом дифференциальной сканирующей калориметрией [13]. Согласно литературным данным фаза с более низким содержанием КЛ имеет более высокую температуру фазового перехода (35–37°С).
Рис. 3.
Термограмма контрольных липосом (1, ДПФХ/КЛ = 80/20%) и комплекса липосомы-ГПЦД (2, Сгпцд = 60 мг/мл). 0.02 М натрий-фосфатный буферный раствор, рН 7.4.
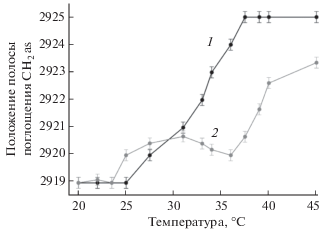
Образование комплекса липосомы-ГПЦД обуслoвливает выраженные изменения в термограмме: на начальном участке кривой характерно увеличение подвижности липидов вблизи температуры плавления микрофазы обогащенной КЛ (27°С), далее наблюдается выраженный минимум на 37°С, т.е. снижение подвижности липидов вблизи температуры плавления микрофазы с низким содержанием КЛ. По-видимому, связывание ГПЦД с микрофазой, обогащенной КЛ, в области первого фазового перехода (27°С) способствует разупорядочению мембраны и образованию дефектов в местах гетерогенности. При дальнейшем нагревании (35–37°С) наблюдается фазовый переход основной микрофазы – с высоким содержанием ДПФХ. В этом случае бислой взаимодействует с ГПЦД по механизму, описанному для 100% ДПФХ липосом, где, напротив, наблюдается снижение подвижности ацильных цепей в бислое и стабилизация гелеобразного состояния за счет образования водородных связей фосфатных групп липидов с ГПЦД (табл. 1). Как следствие, температура фазового перехода комплекса ГПЦД с липидным кластером с низким содержанием КЛ (высокотемпературная часть термограммы на рис. 3) существенно выше по сравнению с липосомами в отсутствие ГПЦД и составляет порядка 39°С, т.е. близка к липосомальной системе, состоящей из 100% ДПФХ (41°С).
Исследование целостности мембраны в присутствии ЦД
Для подтверждения гипотезы о возникновении дефектов в бислое и нарушении целостности мембраны под действием ГПЦД было исследовано влияние ГПЦД на целостность липосомальной мембраны (ДПФХ/КЛ = 80/20%). Одним из классических методов исследования целостности бислоя является исследование высвобождения красителей из везикул, например, флуорексона [21] и 6-карбоксифлуоресцеина [22], под действием внешних агентов в условиях, близких к физиологическим (перемешивание, 37°С).
В данной работе были получены липосомы, (ДПФХ/КЛ = 80/20%) загруженные индикатором фенолфталеином (ФФ) при рН 7.4. Липосомальная суспензия помещалась в диализный мешок и во внешний раствор натрий-боратного буферного раствора с рН 10.7. Поскольку раствор ФФ является бесцветным в нейтральных рН, а в щелочных условиях приобретает малиновую окраску, высвобождение ФФ из липосом должно сопровождаться увеличением интенсивности окраски внешнего раствора. Для детектирования красителя регистрировались УФ спектры: в спектре ФФ (боратный буфер рН 10.7) присутствует широкий пик поглощения с максимумом при длине волны 550 нм (рис. 4а).
Рис. 4.
(а) УФ-спектр фенолфталеина 10–7 М, рН 10.7. (б) Кинетика высвобождения фенолфталеина из липосом (1), под действием 2-гидроксипропил β-циклодекстрина (2), ТритонаХ-100 (3), 37°С.
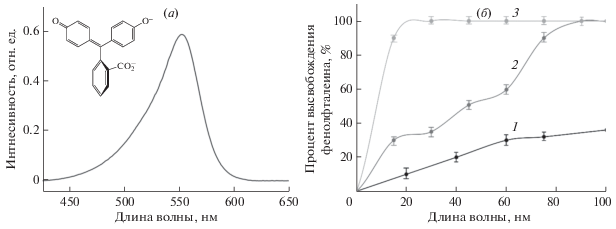
Поскольку ионы буферных систем имеют маленькие размеры, то они способны проникать сквозь диализную мембрану, что с течением времени приводит к формированию градиента рН на границе растворов. Такое изменение микроокружения липосом может приводить к нарушению их стабильности без воздействия дополнительных веществ. Действительно, наблюдается постепенное высвобождение 30% красителя из контрольных липосом в течение 2 ч (рис. 4б). Добавление к липосомам поверхностно-активного вещества ТритонХ-100 приводит к 100% высвобождению красителя в течение 15 мин. Столь быстрое высвобождение обусловлено полным разрушением липосомального бислоя под действием детергента.
Связывание ГПЦД, как было показано методом ИК-спектроскопии Фурье, способно приводить к разупорядочению мембраны. При введении ГПЦД в суспензию липосом, загруженных индикатором, на начальном участке наблюдается ускоренное (по сравнению с контрольной системой) высвобождение: 30% ФФ высвобождается за 20 мин. Полное высвобождение ФФ происходит спустя 90 мин. Таким образом, взаимодействие ГПЦД с микрофазой КЛ приводит к возникновению в бислое дефектов, что обуславливает высвобождение веществ как из мембраны, так и возможность проникновения других внутрь.
Исследование адсорбции комплексов ГПЦД-левофлоксацин на липосомальном бислое
Поскольку нами был обнаружен эффект нарушения целостности мембраны (37°С, ДПФХ/КЛ = = 80/20%) под действием ГПЦД было исследовано влияния образования комплекса ГПЦД с лекарственной молекулой на взаимодействие с липидным бислоем. Можно ожидать, что комплексообразование лекарственных препаратов с производными ЦД способно обеспечить облегчение транспорта лекарственных препаратов сквозь бислой за счет образования дефектов. Для исследования данного эффекта в качестве лекарственной молекулы был использован левофлоксацин (ЛВ) – антибактериальный препарат широкого спектра действия группы фторхинолонов.
Исследование состояния ЛВ проводили методом спектроскопии кругового дихроизма (КД), применимого для исследования биологических объектов, имеющих хиральные центры [23]. Кроме того, данный метод позволяет получать детальную информацию о состоянии лекарственной молекулы в изучаемой многокомпонентной системе, поскольку ни липосомы, ни ГПЦД не имеют собственных КД-спектров.
В КД спектре ЛВ наблюдается минимум на длине волны 301 нм (рис. 5а). Образование комплекса ЛВ с ГПЦД приводит к сдвигу КД спектра в сторону больших длин волн на 1 нм. Механизм образования комплексов фторхинолонов с производными ЦД заключается в погружении ароматического фрагмента лекарства внутрь гидрофобной полости ЦД [6]. Таким образом, сдвиг в КД спектре ЛВ свидетельствует об изменении его микроокружения на более гидрофобное. Действительно, красный сдвиг полосы характерен для комплексов ЛВ с каликсаренами [24], кроме того в независимом эксперименте нами было показано, что в более гидрофобном растворителе (ДМСО) КД-спектр ЛВ имеет минимум на 305 нм.
Рис. 5.
(а) КД-спектр свободного левофлоксацина (1) С = 2 × 10–3 М и левофлоксацина, адсорбированного на поверхность липосом (ДПФХ/КЛ = 80/20%) (2), рН 7.4. (б) Положение минимума в КД-спектре левофлоксацина (2) и левофлоксацина, связанного в комплекс с 2-гидроксипропил β-циклодекстрина (1), адсорбированного на поверхность липосом (ДПФХ/КЛ = 80/20%)), 37°С, рН 7.4.
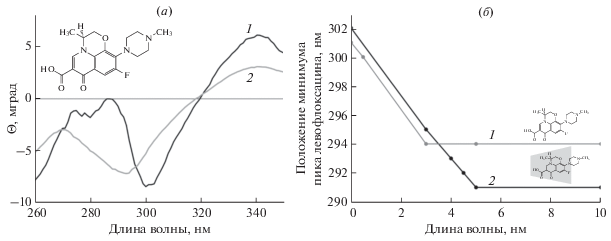
При добавлении ЛВ к анионным двухкомпонентным липосомам (ДПФХ/КЛ = 80/20%), напротив, наблюдается существенный сдвиг полосы в сторону меньших длин волн с 301 нм до 294 нм (рис. 5б). Такие изменения могут быть обусловлены увеличением степени гидратации ЛВ или, что более вероятно, к изменению в состоянии ионизации ЛВ. Так, на примере липосомальной формуляции другого фторхинолона – моксифлоксацина [13] было показано, что взаимодействие положительно заряженного гетероцикла фторхинолона (при рН 7.4) с фосфатными группами КЛ на поверхности липосом приводит к аналогичным изменениям в КД-спектре. Наиболее вероятно, что добавление ЛВ к суспензии липосом приводит к адсорбции ЛВ на поверхности бислоя за счет электростатических взаимодействий противоположно заряженных фосфатных групп липосом КЛ и азота в гетероцикле молекулы ЛВ (рис. 5а).
Насыщение поверхности бислоя молекулами ЛВ наблюдается при трехкратном мольном избытке по отношению к липидам, при дальнейшем увеличении содержания ЛВ изменения положения полосы поглощения ЛВ в КД-спектре не происходит.
При добавлении комплекса ЛВ-ГПЦД к липосомам наблюдались аналогичные изменения в положении КД-спектра ЛВ (сдвиг полосы в сторону меньших длин волн). Однако по сравнению со свободным ЛВ происходит намного более выраженный синий сдвиг – на 11 нм. Столь значимое изменение положения пика ЛВ указывает на более эффективное взаимодействие ЛВ с поверхностью бислоя. Кроме того, насыщение наблюдается для мольного избытка ЛВ по отношению к липидам равного 5. Т.е. в присутствие ГПЦД на поверхности липосом образуется больше доступных участков связывания для ЛФ.
Комплекс ЛВ-ГПЦД образуется за счет погружения карбоксильной группы и ароматического фрагмента ЛВ внутрь полости ЦД. Положительно заряженный гетероцикла фторхинолона (рис. 5) расположен вне полости ГПЦД [6] и может участвовать в образовании прочных электростатических взаимодействий с фосфатными группами липидов. Способность ГПЦД взаимодействовать с бислоем и вызывать в нем дефекты обуславливает значительное увеличение адсорбции лекарственной молекулы на поверхности липосом, что не достигается в случае свободного лекарства. Этот механизм может лежать в основе увеличения биодоступности фторхинолона включенного в комплекс с производными ЦД.
Исследование влияния ГПЦД на антибактериальную активность левофлоксацина
Для контроля влияния образования комплекса с ГПЦД на биологическую активность в работе исследована антибактериальная активность ЛВ-ГПЦД в сравнении со свободным ЛВ на штамме Escherichia coli MH-1. Определены минимальные ингибирующие концентрации (МИК) фторхинолона в данных системах. Для этого из твердой питательной среды с нанесенной бактериальной культурой были вырезаны кусочки агара диаметром 9 мм. В лунку помещался образец (свободный ЛВ или комплекс ЛВ-ГПЦД в фосфатном буфере рН 7.4). Спустя 24 ч инкубации были оценены диаметры ингибирующего действия (рис. 6, табл. 3). Согласно полученным данным антибактериальная активность ЛВ (свободный и в комплексе) имеет концентрационную зависимость, что подтверждает специфичность действия антибактериального препарата. МИК свободного ЛВ составляет 0.2 мкг/мл. Комплекс ЛВ-ГПЦД характеризуется чуть большими значениями диаметров ингибирующего действия, чем свободный ЛВ, что, по-видимому, обусловлено более эффективным взаимодействием ГПЦД с мембраной клеток. Значение МИК для образца ЛВ-ГПЦД (0.17 мкг/мл) практически не отличается (в пределах погрешности) от таковой для свободного ЛВ.
Рис. 6.
Диаметры ингибирующего действия левофлоксацина (а) и его комплекса с 2-гидроксипропил β-циклодекстрином (б) на E.coli при концентрации левофлоксацина 0.05 (1), 0.1 (2), 0.2 (3) и 1 (4) мкг/мл, инкубация 24 ч при 37°С, 0.02 М натрий-фосфатный буферный раствор, рН 7.4.

Таблица 3.
Значение диаметров ингибирующего действия левофлоксацина и его комплекса на E. coli на твердых питательных средах, инкубация 24 ч при 37°С, 0.02 М натрий-фосфатный буферный раствор, рН 7.4
| № | СЛВ, мкг/мл | ЛВ | Комплекс ЛВ + ГПЦД |
|---|---|---|---|
| Контроль | 0 | – | – |
| 1 | 0.05 | – | – |
| 2 | 0.1 | – | – |
| 3 | 0.2 | 11 ± 0.5 | 12 ± 0.5 |
| 4 | 1 | 22 ± 0.5 | 24 ± 0.5 |
Следует отметить, что свободные ЦД не проникают сквозь мембраны клеток [11]. Однако, взаимодействие ГПЦД с мембраной за счет образования дефектов в бислое может обуславливать увеличение проникновения молекул ЛВ сквозь мембрану, что происходит после диссоциации комплекса. Таким образом, взаимодействие ГПЦД не снижает антибактериальную активность ЛВ, а имеет тенденцию к усилению действия препарата.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. 2-Гидроксипропил-β-циклодекстрин, фенолфталеин, левофлоксацин, ТритонХ-100 – Sigma-Aldrich (США); дипальмитоилфосфатидилхолин (ДПФХ), кардиолипин (1',3'-бис[1,2-дипальмитоил-sn-глицеро-3фосфо]-глицерол, КЛ) – Avanti Polar Lipids (США), соли для приготовления буферных растворов – ЭкоСервис (Россия), соляная кислота – Реахим (Россия).
Получение липосом. Из раствора липидов в хлороформе в концентрации 25 мг/мл ДПФХ или ДПФХ/КЛ (80/20%) (в весовом соотношении) удаляли органический растворитель на вакуумном роторном испарителе при температуре 55°С. Полученную тонкую пленку липидов диспергировали в 0.02 М натрий-фосфатном буфере (pH 7.4) для достижения концентрации липидов 5 мг/мл. Далее раствор подвергали воздействию ультразвука (22 кГц) в течение 600 с (3 × 200 с) в непрерывном режиме на диспергаторе 4710 “Cole-Parmer Instrument” (США) при температуре 50–55°С.
Получение липосом, загруженных фенолфталеином. Включение в липосомы индикатора проводили методом пассивной загрузки. Тонкую липидную пленку диспергировали в растворе 0.01 М фенолфталеина в 0.02 М натрий-фосфатном буферном растворе (pH 7.4). Далее раствор подвергали воздействию ультразвука (22 кГц) в течение 600 с (3 × 200 с) в непрерывном режиме на диспергаторе 4710 “Cole-Parmer Instrument” (США) при температуре 50–55°С. Суспензию объемом 3 мл переносили в диализный мешок Orange Scientific (MWCO 3.5 кДа), который помещали в 500 мл 0.02 М натрий-фосфатного буферного раствора (pH 7.4). Диализ проводили в течение 1 ч с двукратной сменой внешнего буферного раствора.
Получение комплексов липосом с ГПЦД. К полученной суспензии липосом добавляли раствор 2‑гидркосипропил β-циклодекстрина (200 мг/мл) для достижения концентрации ГПЦД в итоговой системе 20 мг/мл, 40 мг/мл или 60 мг/мл. Образцы инкубировали при перемешивании в течение суток при температуре 25, 37 или 50°С. Перед регистрацией ИК-спектров системы охлаждались до комнатной температуры.
Регистрация термограмм. Регистрировали ИК-спектры липосом ДПФХ/КЛ = 80/20% (5 мг/мл) или липосом в присутствии ГПЦД (60 мг/мл) в интервале температур 20–50°С. Определяли зависимость положения характеристических полос поглощения асимметричных колебаний CH2 групп от температуры.
Получение комплексов 2-гидроксипропил β-циклодекстрина с левофлоксацином. К 0.02 М раствору левофлоксацина в солянокислом буферном растворе (рН 4.0) добавляли 0.02 М раствор ГПЦД в том же буферном растворе для достижения мольного соотношения ГПЦД : левофлоксацин = 1 : 1. Комплекс инкубировали при перемешивании в течение 1 ч при 37°С. Для проведения экспериментов по исследованию взаимодействия комплекса с поверхностью липосом, раствор разбавляли в 10 раз 0.02 М натрий-фосфатным буфером с контролем сохранности комплекса (рН 7.4) [6].
Изучение высвобождения фенолфталеина из липосом. 1 мл раствора липосом (5 мг/мл липидов, ДПФХ : КЛ = 80 : 20), загруженных фенолфталеином, переносили в диализный мешок Orange Scientific (MWCO 3.5 кДа), который помещали в 1 мл 0.02 М натрий-боратного буфера (рН 10.7). Растворы ГПЦД или ТритонаХ-100 добавляли к раствору липосом и помещали в диализный мешок. Системы инкубировались в течение 2 ч при перемешивании и температуре 37°С. Через определенные промежутки времени регистрировали УФ спектры внешнего раствора.
Исследование антибактериальной активности левофлоксацина и его комплекса с ГПЦД in vitro. Определение минимальной ингибирующей концентрации образцов ЛВ проводили на штамме Escherichia coli MH-1 (Michael Hall, США [25]). Бактерии культивировали в жидкой среде Luria-Bertani в течение 24 ч. Далее 500 мкл культуры равномерно распределяли по твердой питательной среде (Luria-Bertani) на чашке Петри; через 20 мин вырезали диски диаметром 9 мм. 50 мкл образца помещали в лунки и через 30 мин чашки Петри помещали в инкубатор 37°С. Спустя 24 ч были измерены диаметры ингибирования (отсутствия) роста бактерий.
УФ-спектры регистрировали на спектрометре УФ- и видимого диапазона AmerSharm Biosciences UltraSpec 2100 pro трижды в интервале от 200 до 400 нм в кварцевой кювете Hellma Analytics.
ИК-спектры регистрировали на ИК-спектрометре Фурье Tensor 27 “Bruker” (Германия), оснащенного MCT-детектором, охлаждаемым жидким азотом, с термостатом фирмы “Huber” (США). Измерения проводили в термостатируемой ячейке нарушенного полного внутреннего отражения (НПВО, BioATR-II, “Bruker”, Германия) с использованием кристалла однократного отражения ZnSe, при 22°C и постоянной скорости продувки системы сухим воздухом аппаратом “Jun-Air” (Германия). На кристалл ячейки НПВО наносили аликвоту (50 мкл) образца, спектр регистрировали трижды в интервале от 4000 до 950 см–1, с разрешением 1 cм–1; производили 70-кратное сканирование и усреднение. Фон регистрировали аналогично. Спектры анализировали с помощью программы Opus 7.0.
Спектры кругового дихроизма регистрировали с помощью спектрометра J-815 фирмы “Jasco” (Япония), оснащенного термостатируемой ячейкой. Измерения проводили в диапазоне длин волн 260–350 нм при температуре 25°C в кварцевой кювете (l = 1 мм). Проводили трехкратную регистрацию спектров шагом в 1 нм.
ЗАКЛЮЧЕНИЕ
Исследован механизм взаимодействия 2-гидроксипропил β-циклодекстрина с липосомальным бислоем. Методом ИК-спектроскопии Фурье установлено, что для получения комплексов липосомы-ЦД необходима концентрация ГПЦД не менее 40 мг/мл и, чтобы липосомы находились в состоянии фазового перехода или жидкокристаллическом состоянии. В зависимости от состава липосом возможны два механизма взаимодействия ГПЦД с бислоем: для нейтральных монокомпонентных липосом характерно взаимодействие ГПЦД с фосфатными группами липидов с образованием водородных связей за счет гидроксипропильных заместителей в ГПЦД, что обуславливает связывание ЦД на поверхности липосом и последующее заглубление ЦД в “размягченный бислой”. Данный процесс сопровождается снижением подвижности липидов в бислое и стабилизацией гелеобразного состояния.
Для анионных двухкомпонентных липосом при взаимодействии с ГПЦД показано выраженное расслоение системы на микрофазы с разным содержанием КЛ и разной температурой фазового перехода. В области плавления микрофазы обогащенной КЛ в присутствие ГПЦД наблюдается увеличение степени гидратации поверхностных групп и увеличение подвижности ацильных цепей липидов за счет разупорядочения мембраны под действием ГПЦД. Взаимодействие ГПЦД с микрофазой обогащенной ДПФХ, напротив, приводит к стабилизации гелеобразного состояния этой микрофазы и, соответственно, к увеличению температуры основного фазового перехода Тm. Дестабилизация мембраны в областях гетерогенности под действием ГПЦД обуслoвливает нарушение целостности липидного бислоя и вытекание индикатора во внешнюю среду. Однако нарушение целостности мембраны не столь выражено, как под действием модельных поверхностно-активных веществ полностью разрушающих мембрану. Образование комплексов циклодекстрина с лекарственной молекулой обуславливает повышенную адсорбцию левофлоксацина на поверхности липосом, и повышенную проницаемость для лекарственной субстанции, что объясняется образованием дефектов в биомембране под действием ЦД. Согласно исследованиям in vitro комплексы ЛВ-ГПЦД показывают высокую антибактериальную эффективность по отношению к клеткам E. coli – не ниже чем демонстрирует свободный ЛВ.
Список литературы
Loftsson T., Jarho P., Masson M., Jarvinen T. // Adv. Drug Deliv. Rev. 2005. V. 36. P. 335–346. https://doi.org/10.1016/S0169-409X(98)00051-9
Stella V.J., He Q. // Toxicol. Pathol. 2008. V. 36. P. 30–42. https://doi.org/10.1177/0192623307310945
Crini G., Fourmentin S., Fenyvesi É., Torri G., Fourmentin M., Morin-Crini N. // Environ. Chem. Lett. Springer International Publishing, 2018. V. 16. № 4. P. 1361–1375. https://doi.org/10.1007/s10311-018-0763-2
Del Valle E.M.M. // Process Biochem. 2004. V. 39. P. 1033–1046. https://doi.org/10.1016/S0032-9592(03)00258-9
Davis M.E., Brewster M. // Nat. Rev. Drug Discov. 2004. V. 3. P. 1023–1035. https://doi.org/10.1038/nrd1576
Le-Deygen I.M., Skuredina A.A., Uporov I.V., Kudryashova E.V. // Anal. Bioanal. Chem. Analytical and Bioanalytical Chemistry. 2017. V. 409. P. 6451–6462. https://doi.org/10.1007/s00216-017-0590-5
Skuredina A.A., Le-Deygen I.M., Uporov I.V., Kudryashova E.V. // Colloid J. 2017. V. 79. P. 668–676. https://doi.org/10.1134/S1061933X17050143
Skuredina A.A., Le-Deygen I.M., Kudryashova E.V. // Colloid J. 2018. V. 80. P. 312–319. https://doi.org/10.1134/S1061933X18030134
Saltzman W.M., Kyriakides T.R. // Principles of Tissue Engineering: Fourth Edition. Fourth Edi. Elsevier, 2013. P. 385–406. https://doi.org/10.1016/B978-0-12-398358-9.00020-3
Schulz M., Olubummo A., Binder W.H. // Soft Matter. 2012. V. 8. № 18. P. 4849–4864. https://doi.org/10.1039/c2sm06999g
Hammoud Z., Khreich N., Auezova L., Fourmentin S., Elaissari A., Greige-Gerges H. // Int. J. Pharm. Elsevier. 2019. V. 564. P. 59–76. https://doi.org/10.1016/j.ijpharm.2019.03.063
Challa R., Ahuja A., Ali J., Khar R.K. // AAPS PharmSciTech. 2005. V. 2. P. 329–357. https://doi.org/10.1517/17425247.2.1.335
Le-Deygen I.M., Skuredina A.A., Safronova A.S., Yakimov I.D., Kolmogorov I.M., Deygen D.M., Burova T.V., Grinberg N.V., Grinberg V.Y., Kudryashova E.V. // Chem. Phys. Lipids. Elsevier Ireland Ltd. 2020. V. 228. P. 104 891. https://doi.org/10.1016/j.chemphyslip.2020.104891
Ле-Дейген И.М., Скуредина А.А., Кудряшова Е.В. // Биоорган. химия. 2020. T. 46. C. 340–359. [Le-Deygen I.M., Skuredina A.A., and Kudryashova E.V. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 480–497.] doi 10.1134/S1068162020040123
Deygen I.M., Seidl C., Kölmel D.K., Bednarek C., Heissler S., Kudryashova E. V., Bräse S., Schepers U. // Langmuir. 2016. V. 32. P. 10 861–10 869. https://doi.org/10.1021/acs.langmuir.6b01023
Piel G., Piette M., Barillaro V., Castagne D., Evrard B., Delattre L. // Int. J. Pharm. 2007. V. 338. P. 35–42. https://doi.org/10.1016/j.ijpharm.2007.01.015
Yaroslavov A.A., Efimova A.A., Lobyshe, V.I., Kabanov V.A. // Biochimica et Biophysica Acta. 2002. V. 1560. P. 14–24. https://doi.org/10.1016/S0005-2736(01)00453-9
Bilge D., Sahin I., Kazanci N., Severcan F. // Spectrochim. Acta – Part A Mol. Biomol. Spectrosc. Elsevier B.V. 2014. V. 130. P. 250–256. https://doi.org/10.1016/j.saa.2014.04.027
Donova M. V., Nikolayeva V.M., Dovbnya D.V., Gulevskaya S.A., Suzina N.E. // Microbiology. 2007. V. 153. P. 1981–1992. https://doi.org/10.1099/mic.0.2006/001636-0
Le-Deygen I.M., Vlasova K.Y., Kutsenok E.O., Usvaliev A.D., Efremova M.V., Zhigachev A.O., Rudakovskaya P.G., Golovin D.Y., Gribanovsky S.L., Kudryashova E.V., Majouga A.G., Golovin Y.I., Kabanov A.V., Klyachko N.L. // Nanomedicine Nanotechnology, Biol. Med. Elsevier Inc. 2019. V. 21. P. 102 065. https://doi.org/10.1016/j.nano.2019.102065
Hatzi P., Mourtas S.G, Klepetsanis P., Antimisiaris S.G., // Int. J. Pharm. 2007. V. 333. P. 167–176. https://doi.org/10.1016/j.ijpharm.2006.09.059
Angelini G., Campestre C., Boncompagni S., Gasbarri C. // Chem. Phys. Lipids. Elsevier Ireland Ltd. 2017. V. 209. P. 61–65. https://doi.org/10.1016/j.chemphyslip.2017.09.004
Bertucci C., Pistolozzi M., De Simone A. // Anal. Bioanal. Chem. 2010. V. 398. P. 155–166. https://doi.org/10.1007/s00216-010-3959-2
Chamseddin C., Jira T. // Curr. Pharm. Anal. 2013. V. 9. P. 121–129. https://doi.org/10.2174/157341213804806160
Goddard J.M., Caput D., Williams S.R., Martin D.M. // Proc. Natl. Acad. Sci. USA. V. 80. P. 4281–4285. https://doi.org/10.1073/pnas.80.14.4281
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


