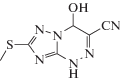
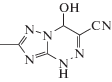
Биоорганическая химия, 2020, T. 46, № 6, стр. 784-791
Метод прогноза антигликирующей активности посредством определения энергий граничных молекулярных орбиталей на примере новых 4-гидрокси-1,4-дигидроазоло[5,1-с]-1,2,4-триазинов
Р. А. Литвинов 1, *, Р. А. Дрокин 2, Д. Д. Шамшина 1, М. Ю. Каленова 1, Л. Э. Усмиянова 1, Е. А. Муравьева 1, П. М. Васильев 1, Е. К. Воинков 2, Е. Н. Уломский 2, А. А. Спасов 1, В. Л. Русинов 2
1 ФГБОУ ВО Волгоградский государственный медицинский университет Минздрава РФ
400131 Волгоград, площадь Павших Борцов, 1, Россия
2 ФГАОУ ВО УрФУ имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: litvinov.volggmu@mail.ru
Поступила в редакцию 09.04.2020
После доработки 18.04.2020
Принята к публикации 26.04.2020
Аннотация
Гликирование белков является одним из патогенетических механизмов развития поздних осложнений сахарного диабета, прогрессирования некоторых нейродегенераций, болезней пожилого возраста. Ключевым патогенетическим фактором считается образование конечных продуктов гликирования (КПГ). Разработка модели прогноза антигликирующей фармакологической активности может улучшить качество и производительность скринингового этапа доклинических исследований новых соединений, активных при указанных заболеваниях. Азоло[5,1-c][1,2,4]триазины и азоло[1,5-а]пиримидины давно известны рядом полезных биологических активностей, в числе которых есть и антигликирующая. В связи с этим в качестве испытуемых соединений был выбран ряд ранее малоизученных 4-гидрокси-4Н-азоло-1,4-дигидро[5,1-с]-1,2,4-триазинов. Установлено, что производные азолотриазина оказывают антигликирующее действие, препятствуя гликированию бычьего сывороточного альбумина (BSA) глюкозой, подавляя специфическую флуоресценцию КПГ в равной или большей степени, чем аминогуанидин. Диапазон активности в концентрации 1000 мкМ для различно замещенных производных составляет 23.0–71.6% (30.3 ± 1.2% для аминогуанидина). Наиболее активным показало себя соединение 4-гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-c][1,2,4]триазин. Уровни антигликирующей активности соединений (без учета аминогуанидина) коррелируют с величиной разницы энергий граничных молекулярных орбиталей ∆(HOMO-LUMO) (принятые обозначения: HOMO – высшая занятая молекулярная орбиталь, LUMO – низшая вакантная молекулярная орбиталь), установленных полуэмпирически. Методом нейросетевого моделирования получена математическая модель, описывающая зависимость антигликирующей активности от расчетных энергий молекулярных орбиталей, вычисленных полуэмпирическим квантово-химическим методом. Установлено, что наибольший вклад в активность вносят энергия ELUMO и ∆(HOMO-LUMO). Модель может быть использована в будущем с целью прогноза данного вида активности.
ВВЕДЕНИЕ
Сахарный диабет (СД) остается одной из значимых медико-социальных проблем. В мире насчитывается 463 000 000 людей с СД [1]. Арсенал средств, препятствующих формированию поздних осложнений сахарного диабета (ПОСД) не достаточен [2]. ПОСД приводят к потере трудоспособности даже на фоне скорректированной гликемии [3]. Основываясь на том, что в патогенезе ПОСД значительная роль отведена гликированию и образованию конечных продуктов гликирования (КПГ), имеющих негативное воздействие на организм, следует учитывать данный механизм при направленном дизайне новых лекарственных средств [4].
На ранних этапах доклинических исследований задача поиска новых биологически активных соединений осложнена необходимостью анализа большого количества образцов и отсева наименее перспективных. Лимитирующими факторами становятся длительность исследований и финансовые затраты на проведение большого числа испытаний. Расчетная оценка перспективности соединений позволяет прогнозировать биологическую активность, давая возможность отсеять представителей класса низкой перспективности. Однако компьютерное прогнозирование некоторых видов биологической активности – в частности антигликирующей – сопряжено с трудностями.
Антигликирующая активность является неспецифической, то есть не направленной ни на одну классифицируемую фармакологическую мишень. Реализация эффекта происходит благодаря механизмам связывания разнородных карбонильных соединений с образованием гидразинов, или ацетилирования аминогрупп, или за счет связывания свободных радикалов или элементов переходного ряда, то есть благодаря участию в биохимических и окислительно-восстановительных реакциях [5]. Различные механизмы, от реакций присоединения до антиоксидантных реакций, связанных с явлениями электронного перехода и отсутствие унифицированной мишени осложняют прогноз, поскольку моделирование многих биохимических реакций в программной среде – сложная задача.
В соответствии с теорией возмущения молекулярных орбиталей [6], реакционная способность органических соединений в первом приближении обусловлена энергиями граничных молекулярных орбиталей – высшей занятой (HOMO) и низшей вакантной (LUMO). С учетом этого, для оценки in silico неспецифических биологических свойств химических соединений целесообразно использовать расчетные электронные параметры молекул и на их основе выполнять прогноз активности и проводить анализ молекулярного механизма действия.
В последнее время нами получены данные об антигликирующем и противодиабетическом действии производных азоло[5,1-с]-1,2,4-триазинов и азоло[1,5-а]-пиримидинов, а сама молекулярная основа может считаться привилегированной [7–10]. Таким образом указанные азолоазины являются перспективными объектами для разработки их синтеза и изучения антигликирующего действия в плане поиска препаратов для защиты от ПОСД. В то же время, следуя современным тенденциям, применение теории реакционной способности привлекает исследователей, прогнозирующих способность соединений препятствовать развитию ПОСД по механизму антигликирования [11]. В настоящей статье приводятся данные о синтезе и антигликирующей активности 4-гидрокси-1,4-дигидроазоло[5,1-с]-1,2,4-триазинов и предлагается разработанная с использованием этих данных методика прогноза антигликирующей активности, основанная на квантово-химическом расчете энергий граничных электронных орбиталей полуэмпирическим методом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтетическая часть
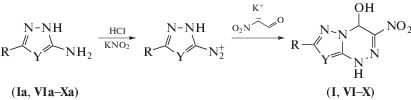
Для построения азоло-1,2,4-триазиновой структуры использована схема анелирования 1,2,4-триазинового цикла к азольному [12]. 3-Нитро-4-гидрокси-4Н-азоло-1,4-дигидро[5,1-с]-1,2,4-триазины (I, VI–X) получены по разработанному нами ранее методу (схема 1 ) [13].
Схема 1 .
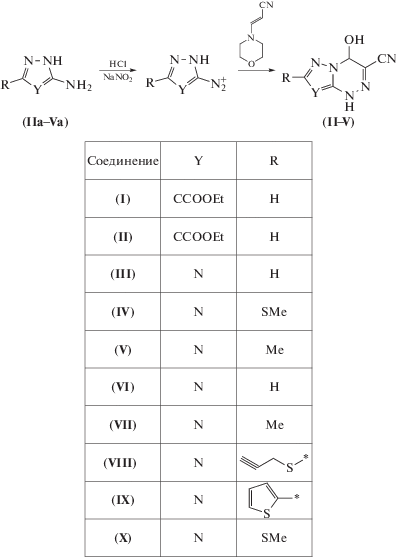
Для синтеза 3-циано-4-гидрокси-4Н-азоло-1,4-дигидро[5,1-с]-1,2,4-триазинов разработан метод с использованием в качестве синтона 1-морфолино-2-цианоэтилен [14]. 3-Циано-4-гидрокси-4Н-азоло-4,7-дигидро[5,1-с]-1,2,4-триазины (II–V) ранее не описаны и представлены впервые. Данные структуры получены при взаимодействии 1-морфолино-2-цианоэтилена в ацетонитриле с солями азолилдиазония. Во избежание возможной побочной реакции диазоазолов с морфолином азасочетание проводят в кислой среде (схема 2 ).
Схема 2 .
В спектрах 1Н ЯМР соединений (II–IV) не-изменно присутствуют характеристичные сигналы – сигнал протона Н4 – атома триазинового кольца в области δ = 6.4–6.6 м.д., а также сигнал в области δ = 8.1–8.2 м.д. соответствующий гидроксильной группе – и сигналы протонов в азольном цикле. Аналогично в спектрах 13С ЯМР присутствует характеристичный сигнал в области δ = 72–74 м.д. (С4). В ИК-спектрах соединений (II–IV) присутствует сигнал циано-группы в области 2230–2250 ν, см–1.
Антигликирующая активность
В результате проведенных исследований установлено, что ряд соединений является перспективным в качестве антигликирующих агентов. Соединение 4-гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-c] [1,2,4]триазин оказалось наиболее активным в описываемом ряду, превосходя аминогуанидин более чем в 2 раза по величине проявленного эффекта в исследуемой корнцентрации. Данный результат согласуется с ранними исследованиями, показавшими, что производные класса азолоазинов являются перспективными представителями класса антигликирующих средств [7–10]. Результаты представлены в табл. 1.
Таблица 1.
Величины антигликирующей активности производных азолоазина
| Соединения | Активность, % |
|---|---|
| (I) | 63.5 ± 0.4* |
| (II) | 30.1 ± 2.5* |
| (III) | 71.6 ± 2* |
| (IV) | 37.9 ± 3.3* |
| (V) | 58.7 ± 2.1* |
| (VI) | 40.4 ± 2.0* |
| (VII) | 33.6 ± 5.9* |
| (VIII) | 38.5 ± 0.7* |
| (IX) | 55.6 ± 2.5* |
| (X) | 23.0 ± 3.5 |
| Аминогуанидин | 30.3 ± 1.2* |
* Статистически значимые различия, ANOVA, пост-тест Туке, p < 0.05. Значения антигликирующей активности были кластеризованны методом k-средних (Statistica 12). В класс более активных соединений отнесены соединения I, III, V, IX. Остальные соединения при кластеризации были отнесены в класс менее активных.
Корреляционный анализ зависимости биологической активности соединений от их квантово-химических параметров
Исследование выполнено с применением полуэмпирического квантово-химического метода PM3 для вычисления энергий граничных молекулярных орбиталей соединений с последующим сопоставлением результатов расчетов с экспериментально установленными величинами антигликирующих активностей.
Актуальность подобного аналитического подхода ранее уже была продемонстрирована авторами настоящего исследования [9].
Проанализированы оптимизированные конформации 3D-моделей молекул, рассчитаны показатели энергий граничных молекулярных орбиталей и их разность. Результаты представлены в табл. 2.
Таблица 2.
Расчетные квантово-химические характеристики производных азолоазина
| Соединения | EHOMO | ELUMO | ΔEHOMO-LUMO |
|---|---|---|---|
| (I) | –9.898 | –1.553 | –8.346 |
| (II) | –9.562 | –1.237 | –8.325 |
| (III) | –9.794 | –1.238 | –8.556 |
| (IV) | –9.047 | –1.261 | –7.786 |
| (V) | –9.716 | –1.189 | –8.527 |
| (VI) | –10.150 | –1.631 | –8.520 |
| (VII) | –10.037 | –1.558 | –8.478 |
| (VIII) | –9.287 | –1.530 | –7.757 |
| (IX) | –9.531 | –1.576 | –7.955 |
| (X) | –9.179 | –1.578 | –7.602 |
| Аминогуанидин | –9.282 | 0.9740 | –10.256 |
При проведении корреляционного анализа между антигликирующей активностью соединений I–X и аминогуанидина и показателем ΔEHOMO-LUMO установлено, что расчетные квантово-химические величины не коррелируют с величинами антигликирующей активности (непараметрический коэффициент корреляции Спирмена, rs = –0.382, р = 0.1380). Исключение из анализа аминогуанидина позволило получить статистически значимую непараметрическую корреляцию (rs = –0.648, р = 0.0214).
Отсутствие статистически значимой корреляционной связи с включением аминогуанидина в выборку данных свидетельствует о том, что закономерность, описывающая зависимость антигликирующего действия от энергетических характеристик граничных орбиталей молекул не универсальна и контекстно зависит от принципиально важных структурных особенностей изучаемых соединений, в данном случае, от наличия конденсированной ароматической системы.
Поскольку ранговая корреляция отражает не прямую линейную зависимость, а симбатность анализируемых показателей, и значения коэффициентов корреляции Спирмена не очень велики, нами для построения более точной нелинейной модели была использована методология искусственных нейронных сетей.
Анализ зависимости биологической активности соединений от их квантово-химических параметров с помощью технологии искусственных нейронных сетей
С учетом сложного характера зависимости антигликирующей активности от параметров граничных орбиталей молекул, для построения ее более точной модели было использовано нейросетевое моделирование. Параметры наилучшей нейронной сети с архитектурой многослойного перцептрона, полученной при расчетах в стандартном режиме в программе Statistica 12 [15], представлены в табл. 3.
Таблица 3.
Сведения о нейронной сети, описывающей зависимость антигликирующей активности I–X и аминогуанидина от их параметров энергий граничных электронных орбиталей
| Архитектура | Точность при проверке на выборках, % | Обучающий алгоритм | Функции | ||||
|---|---|---|---|---|---|---|---|
| обучающая | тестовая | валидационная | ошибки | активационная скрытого слоя | активационная выходного слоя | ||
| MLP 3-5-2 | 88.9 | 100.0 | 100.0 | BFGS 15 | Entropy | Logistic | Softmax |
Анализ чувствительности этой нейросети показал, что наибольшее значение показателя (примерно одинаковой величины) присуще двум входным нейронам: ELUMO (8.9) и ΔEHOMO-LUMO (8.3); меньшую чувствительность показал нейрон ΔEHOMO (7.0).
Таким образом, в результате нейросетевого моделирования выявлен еще один квантово-химический параметр ELUMO, существенно влияющий на величину антигликирующей активности (помимо ΔEHOMO-LUMO). Стоит отметить, что соотношение вкладов параметров в конечный результат может меняться зависимо от применяемого расчетного метода. Полуэмпирические методы менее затратны по времени и не требовательны к производительности компьютеров, как неэмпирические (ab initio). Однако с помощью метода ab initio ранее нами был установлен существенный вклад EHOMO в наличие разных видов активностей, включая антигликирование [9].
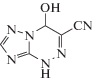
Подводя итог, можно заключить, что в результате исследований показано наличие антигликирующей активности у новых соединений, производных азоло-1,2,4-триазина. Величина активности соответствует таковой (соединения (II), (IV), (VII), (VIII), (X)) или значительно превосходит по выраженности (соединения (I), (III), (V), (VI), (IX)) антигликирующую активность аминогуанидина в концентрации 1000 мкМ. Это указывает на высокую перспективность ряда соединений в качестве антигликирующих агентов. Наилучшие результаты были получены для соединения III (4-гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-c][1, 2,4]триазин).
Также установлено, что уровень антигликирующих свойств соединений, а также анализируемого наравне с ними препарата сравнения аминогуанидина определяется энергетическими характеристиками молекулярных орбиталей. Наибольший вклад при этом вносит параметр ELUMO, а также ΔEHOMO-LUMO. Полученные данные позволят давать прогнозную оценку антигликирующему действию азолоазинов в экспериментах in silico.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальная химическая часть
ИК спектры записаны на спектрометре Bruker Alpha, ZnSe (НПВО). Спектры ЯМР 1Н и 13С сняты на приборе Bruker Avance II spectrometer (400 и 100 МГц соответственно) в DMSO-d6, внутренний стандарт ТМС. Элементный анализ выполнен на приборе C,H,N,S-analizator Perkin Elmer 2400 Series II. Температуры плавления определены на приборе “Staffordshire, ST15 0SA” Контроль чистоты соединений осуществляли при помощи ТСХ на пластинках Silufol UV-254.
Соединения (I), (VI–X) были получены по ранее описанной методике [13].
Общий метод синтеза 4-гидрокси-3-циано-1,4-дигидро-азоло[5,1-с][1,2,4]триазинов (II–V). К смеси (0.01 моль) амино-азола, 5 мл воды, 5 мл ацетонитрила и 10 мл конц. HCl (0.12 моль) порциями прибавляют раствор 0.75 г (0.011 моль) N-aNO2 в 3 мл воды при –7…–10°С. Реакционную массу выдерживают при этой температуре 10 мин и прибавляют к ней раствор 1.38 г (0.01 моль) 1‑морфолин-2-цианоэтилена в 25 мл ацетонитрила. Смесь выдерживают при температуре 0°С 1 час, затем при комнатной температуре 6 часов. Реакционную смесь экстрагируют этилацетатом. Этилацетат упаривают досуха, осадок перекристаллизовывают из ацетонитрила, фильтруют и сушат на воздухе.
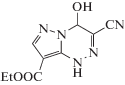
4-Гидрокси-3-циано-1,4-дигидро-пиразоло[5,1-с]этиловый эфир [1,2,4]триазин-8-карбоновой кислоты (II).
Выход 1.64 г (70%), порошок светло-коричневого цвета, имеет следующие физико-химические характеристики: Тпл = 185–187°С (разл.); 1Н ЯМР спектр (в DMSO-d6 δ, м.д.): 12.59 (с, Н, NН), 8.10 (c, Н, ОН), 7.93 (с, Н, СН), 6.41 (д, Н, СН), 4.26 (кв, 2Н, СН2, J = 7.1 Гц), 1.28 (т, 3Н, СН3, J = 7.1 Гц); 13С ЯМР спектр (в DMSO-d6 δ, м.д.): 161.48, 140.86, 137.26, 117.97, 115.77, 95.83, 71.76, 59.85, 14.41. Найдено: C – 43.01; H – 4.44; N – 27.62. Брутто-формула – C9H11N5O4. Вычислено: C – 42.69; H – 4.38; N – 27.66., ИК, ν, см–1 2231(СN), 3176(OH), 3267(H2O).
4-Гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-c][1,2,4]триазин (III).
Выход 1.26 г (77%), порошок светло-коричневого цвета, имеет следующие физико-химические характеристики: Тпл = 165–167°С (разл.); 1Н ЯМР спектр (в DMSO-d6 δ, м.д.): 13.25 (с, Н, NН), 8.12 (д, Н, ОН, J = 8.5 Гц), 7.96 (с, Н, СН), 6.53 (д, 2Н, J = 8.5 Гц, СН2); 13С ЯМР спектр (в DMSO-d6 δ, м.д.): 150.58, 145.45, 117.77, 115.64, 73.64. Найдено: C – 36.88; H – 2.44; N – 51.62. Брутто-формула – C5H4N6O. Вычислено: C – 36.59; H – 2.46; N – 51.21. ИК, ν, см–1 2227(СN), 3117(OH).
7-Метилсульфанил-4-гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-с][1,2,4]триазин (IV).
Выход 1.7 г (81%), порошок бежевого цвета, имеет следующие физико-химические характеристики: Тпл = 175–177°С (разл.); 1Н ЯМР спектр (в DMSO-d6 δ, м.д.): 13.30 (с, Н, NН), 8.13 (д, Н, ОН), 6.46 (с, Н, СН), 2.54 (с, 3Н, СН3); 13С ЯМР спектр (в DMSO-d6 δ, м.д.): 160.44, 146.11, 118.07, 115.40, 73.32, 13.52. Найдено: C – 33.98; H – 2.82; N – 39.62. Брутто-формула – C6H6N6OS. Вычислено: C – 34.28; H – 2.88; N – 39.98. ИК, ν, см–1 2231(СN), 3098(OH).
7-Метил-4-гидрокси-3-циано-1,4-дигидро-1,2,4-триазоло[5,1-с][1,2,4]триазин (V).
Выход 1.25 г (71%), порошок бежевого цвета, имеет следующие физико-химические характеристики: Тпл = 177–180°С (разл.); 1Н ЯМР спектр (в DMSO-d6 δ, м.д.): 13.16 (с, Н, NН), 8.03 (д, Н, ОН), 6.41 (с, Н, СН), 2.23 (с, 3Н, СН3); 13С ЯМР спектр (в DMSO-d6 δ, м.д.): 159.12, 145.50, 117.45, 115.57, 73.07, 13.79. Найдено: C – 36.58; H – 4.07; N – 42.62. Брутто-формула – C6H8N6O2S. Вычислено: C – 36.76; H – 4.11; N – 42.84. ИК, ν, см–1 2246(СN), 3082(OH), 3482(H2O).
Расчет квантово-химических параметров
Расчеты выполнены с использованием специализированной рабочей станции гибридной архитектуры (CPU + GPU) с пиковой производительностью 1.32 Tflops DP.
Построение первичных 3D-моделей изучаемых молекул выполняли и с помощью программы Chem3D [16] методом молекулярной механики в силовом поле MM2 [17] путем оптимизации конформации при вращении по всем подвижным связям. Окончательная оптимизация построенных таким образом конформеров была проведена полуэмпирическим квантово-химическим методом PM3 с помощью программы HyperChem [18]. В качестве характеристик реакционной способности молекул использовали расчетные значения энергий граничных орбиталей – высшей заполненной EHOMO и низшей пустой ELUMO, а также их разность ΔEHOMO-LUMO. Значения указанных показателей сопоставляли с экспериментальными данными по биологической активности.
Экспериментальная биологическая часть
При оценке антигликирующей активности проводили измерение флуоресценции КПГ на спектрофлуориметре TECAN M 200 Pro, λ(возбуждения) 370 нм, λ(испускания) 440 нм.
Активность определяли in vitro по методу [19]. Субстрат гликирования: бычий сывороточный альбумин (BSA), 1 мг/мл (ООО “ХИММЕД”, Россия); индуктор гликирования: глюкоза безводная, 0.5 М (Sigma, США); среда протекания реакции: фосфатный буферный раствор (0.05 М, рН 7.4). Длительность и условия реакции: 24 ч, 60°С. Все вещества растворяли в DMSO (конечная концентрация – 3%). В исследуемые образцы добавляли изучаемые вещества в конечной концентрации 1000 мкМ, растворенные в 99% DMSO (конечная концентрация в реакционной среде 3%), в контрольные образцы добавляли соответствующий объем растворителя. После протекания реакции белок осаждали при помощи трихлоруксусной кислоты (10% в конечной реакционной среде при осаждении), и центрифугирования при 15 000 об./мин. (4 мин, 4°С). Супернатант удаляли, осадок отмывали фосфатным буферным раствором. Повторное растворение проводили в фосфатном буферном растворе (0.05 М, рН 10.5). Спектр возбуждения/испускания детектируемых КПГ (370/440 нм соответственно) рассматривается как диапазон длин волн флуоресценции, характерный для многих КПГ [20]. В качестве вещества сравнения использовали известный ингибитор неферментативного гликозилирования – аминогуанидин [21]. Антигликирующую активность рассчитывали по отношению к показателю флуоресценции контрольных образцов. Вычисляли относительный показатель флуоресценции с учетом холостых проб BSA, проинкубированных с соединениями в отсутствии индуктора гликирования. Использовали формулу:
Величины относительных коэффициентов флуоресценции контрольных и опытных проб сравнивали статистически. Для количественного представления уровня проявленной активности определяли показатель ∆%:
Результаты оценки биологической активности проанализированы с применением ANOVA, пост-тест Туке, при уровне значимости p < 0.05 и условии соблюдения нормальности распределения и равенства дисперсий подгрупп выборок, корреляционный анализ проведен с применением критерия Спирмена, при уровне значимости p < 0.05 (GraphPad Prism 7.0).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучаемого вида активности с помощью модуля Statistica Neural Networks [22] программы Statistica 12 были построены бинарные классификационные модели, связывающие градации уровня активности “высокая” или “низкая” с квантово-химическими параметрами исследуемых соединений. В настоящем исследовании целевой была архитектура сети в виде двухслойного перцептрона MLP k-m-2, где: k – число входных нейронов, т.е. квантово-химических параметров (ELUMO, ΔEHOMO-LUMO, ΔEHOMO); m – число скрытых нейронов, устанавливается программой от 3 до 5. В программе Statistica при построении перцептронных сетей для скрытого и выходного слоев используются пять наиболее распространенных активационных функций Identity, Logictic, Tanh, Exponential, Sine [22], попарный перебор которых осуществляется программой. Обучение нейросетей в программе Statistica проводится с использованием алгоритма обратного распространения ошибок. Размер обучающей/тестовой/валидационной выборок устанавливался с использованием генератора случайных чисел, в соотношении 60/20/20% соответственно от размера исходной выборки. Это обеспечивает соблюдение требования о соотношении размера выборки и числа входных нейронов. В нейросетевом моделировании считается, что на каждый входной нейрон должно приходиться 2 или более наблюдения. Число сетей для обучения составляло 2000, а число лучших автоматически отбираемых сетей – 100. После окончания обучения, из 100 отобранных программой лучших нейросетей по совокупности характеристик точности обучения/тестирования/валидации вручную отбирали наиболее валидные.
Список литературы
Diabetes Atlas 9th Edition. International Diabetes Federation, 2019. 29 p.
Petrov V.I., Spasov A.A., Cheplyaeva N.I., Lenskaya K.V. Antidiabetogennyi potentsial benzimidazolov: khimiya, farmakologiya, klinika (Antidiabetic Potential of Benzimidazoles: Chemistry, Pharmacology, and Clinical Use) // Eds. Spasov A.A., Petrov V.I., Minkin M.I. Fundamental’nye osnovy poiska lekarstvennyh sredstv dlya terapii saharnogo diabeta 2-go tipa (Fundamental Principles of Searching of Medicinal Products for Diabetes Mellitus Type 2 Therapy). Chapter 1. Volgograd: Vogograd. Gos. Med. Univ., 2016. [Original chapter in Rus.].
Eid S., Sas K.M., Abcouwer S.F., Feldman E.L., Gardner T.W., Pennathur S., Fort P.E. // Diabetologia. 2019. V. 62. P. 1539–1549. https://doi.org/10.1007/s00125-019-4959-1
Rhee S.Y., Kim Y.S. // Diabetes Metab J. 2018. V. 42. P. 188–195. https://doi.org/10.4093/dmj.2017.0105
Sanchis P., Rivera R., Berga F., Fortuny R., Adrover M., Costa-Bauza A., Grases F., Masmiquel L. // Sci. Rep. 2018. V. 8. P. 9619. https://doi.org/10.1038/s41598-018-27853-9
Dewar M.J.S. The PMO Theory of Organic Chemistry. Plenum, New York, 1975. https://doi.org/10.1007/978-1-4613-4404-9
Rusinov V.L., Sapozhnikova I.M., Bliznik A.M., Chupakhin O.N., Charushin V.N., Spasov A.A., Vassiliev P.M., Kuznetsova V.A., Rashchenko A.I., Babkov D.A. // Archiv der Pharmazie. 2017. V. 350. P. 1–15. https://doi.org/10.1002/ardp.201600361
Spasov A.A., Babkov D.A., Sysoeva V.A., Litvinov R.A., Shamshina D.D., Ulomsky E.N., Savateev K.V., Fedotov V.V., Slepukhin P.A., Chupakhin O.N., Charushin V.N., Rusinov V.L. // Archiv der Pharmazie. 2017. V. 350. P. e1 700 226. https://doi.org/10.1002/ardp.201700226
Savateev K.V., Fedotov V.V., Butorin I., Eltsov O.S., Slepukhin P.A., Ulomsky E.N., Rusinov V.L., Litvinov R.A., Babkov D.A., Khokhlacheva E.A., Radaev P., Vasilev P.M., Spasov A.A. // Europ. J. Med. Chem. 2020. V. 185. P. 111 808. https://doi.org/10.1016/j.ejmech.2019.111808
Соколова Е.В., Хохлачева Е.А., Шамшина Д.Д., Батычек А.Е., Радаев П.А., Прокофьева Н.А., Литвинов Р.А., Бабков Д.А., Саватеев К.В., Федотов В.В. // Вестник Волгоградского государственного медицинского университета. 2019. № 1. С. 79–82.
Frau J., Glossman-Mitnik D. // Molecules. 2017. V. 22. P. E226. https://doi.org/10.3390/molecules22020226
Rusinov V.L., Charushin V.N., Chupakhin O.N. // Russ. Chem. Bull. 2018. V. 67. P. 573. https://doi.org/10.1007/s11172-018-2113-8
Voinkov E.K., Ulomskiy E.N., Rusinov V.L., Drokin R.A., Fedotov V.V., Gorbunov E.B. // Mendeleev Comm. 2017. V. 27. P. 285–286. https://doi.org/10.1016/j.mencom.2017.05.023
Rene L., Poncet J., Auzou G. // Synthesis. 1986. 1986. P. 419–420. https://doi.org/10.1055/s-1986-31661
Weib C.H. // Software Review: Advances in Statistical Analysis. 2007. V. 91. P. 339–341.
PerkinElmer/Chemistry Database, http://www.cambridgesoft.com/. Accessed 08 Apr. 2020.
Aped P., Senderowitz H. Molecular Mechanics Calculations // PATAI’S Chemistry of Functional Groups / Ed. Rappoport Z. 2009. https://doi.org/10.1002/9780470682531.pat0071
HyperChem(TM) Professional 7.51, Hypercube, Inc., 1115 NW 4th Street, Gainesville, Florida 32601, USA. http://www.hyper.com/. Accessed 08 Apr. 2020.
Thornalley P.J. // Arch. Biochem. Biophys. 2003. V. 419. P. 31–40. https://doi.org/10.1016/j.abb.2003.08.013
Beisswenger P.J., Howell S., Mackenzie T., Corstjens H., Muizzuddin N., Matsui M.S. // Diabetes Technol. Ther. 2012. V. 14. P. 285–292. https://doi.org/10.1089/dia.2011.0108
Jedsadayanmata A. // Naresuan Univ. J. 2005. V. 13. P. 35–41.
Нейронные сети. Statistica Neural Networks: Методология и технология современного анализа данных / Под ред. Боровикова В.П. М.: Горячая линия Телеком, 2008. – 392 с.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия