Биоорганическая химия, 2020, T. 46, № 6, стр. 770-783
Увеличение яркости флуоресценции сверхфотостабильного мутанта EGFP путем внесения мутаций, блокирующих протонирование хромофора
А. В. Мамонтова 1, А. М. Шахов 2, А. П. Григорьев 3, К. А. Лукьянов 4, А. М. Богданов 4, *
1 Центр наук о жизни, Сколковский институт науки и технологий
121205 Москва, Большой бульвар, 30, с. 1, Россия
2 Институт химической физики им. Н.Н. Семенова РАН
119334 Москва, ул. Косыгина, 4, корп. 1, Россия
3 ФГБОУ ВО Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1, Россия
4 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: noobissat@yandex.ru
Поступила в редакцию 21.04.2020
После доработки 26.04.2020
Принята к публикации 30.04.2020
Аннотация
Дизайн флуоресцентных белков с увеличенной фотостабильностью – важная практическая задача. Один из подходов к ее решению связан с поиском аминокислотных остатков, играющих ключевую роль в фотохимических реакциях с участием хромофора. Ранее было продемонстрировано влияние тирозина-145 на фотоокисление хромофора зеленого флуоресцентного белка EGFP (enhanced green fluorescent protein, улучшенный зеленый флуоресцентный белок), а также получен мутант EGFP-Y145L, в котором эффективность фотоокисления и связанного с ним фотообесцвечивания существенно снижены. В настоящей работе мы ищем пути увеличения яркости флуоресценции этого мутантного варианта, вводя в него замены S205V и E222G и их комбинацию с целью сдвига pH-равновесия хромофорного окружения в сторону ионизации хромофора. Мы показали, что оба варианта белка с заменой S205V несут в основном нейтральный хромофор, имеют низкую яркость и способны к медленной фотоактивации. Они могут представлять интерес для изучения светозависимого переноса протона и, возможно, функционировать в качестве времяразрешенных pH-сенсоров. В белке EGFP-Y145L/E222G, как мы и ожидали, хромофор пребывает преимущественно в анионной форме. Этот мутантный вариант характеризуется яркостью флуоресценции, в 4 раза превосходящей таковую у исходного EGFP-Y145L и фотостабильностью в 1.5–5 раз выше, чем у EGFP.
ВВЕДЕНИЕ
Белки семейства GFP – единственный класс кодируемых одним геном флуоресцентных красителей – занимают особое место среди маркеров, применяющихся в биомедицинской науке. Совместимость этих меток с большинством экспрессионных систем, самодостаточность формирования хромофорной группы, их стабильность и сравнительно невысокая токсичность обеспечили бурное развитие методов прижизненного мечения биологических объектов с помощью флуоресцентных белков (известное как “GFP-революция” [1]). За открытие GFP и его внедрение в научную практику была присуждена Нобелевская премия по химии [2].
Модификация кодирующей последовательности ДНК – основной способ получения новых вариантов флуоресцентных белков (ФБ). Так, уже в первые годы после клонирования гена avGFP из медузы Aequorea victoria и успешной демонстрации его экспрессии в гетерологичных биологических системах [3] были получены мутанты с улучшенной яркостью [4–6] и сдвигами эмиссии флуоресценции в синюю [7] и красную [8] области спектра. Внесение всего одной аминокислотной замены (T203H) позволило создать первый фотоактивируемый вариант GFP [9]. Позже, после клонирования генов красных флуоресцентных белков из морских кораллов [10], мутагенез помог решить проблему спонтанной олигомеризации этих молекул [11, 12]. Богатая палитра флуоресцентных белков, доступных исследователям на сегодняшний день [13], в основном наполнена вариантами, разработанными искусственно [14, 15].
Дизайн ФБ, особенно на ранних этапах “GFP-революции”, был нацелен на улучшение их базовых практических характеристик – увеличение яркости флуоресценции и скорости созревания хромофора, а также на расширение спектрального разнообразия этих флуорофоров, важного для развития методов многоцветного мечения [16, 17]. Успешное решение этих задач обеспечивалось, в частности, сравнительно простыми алгоритмами скрининга и селекции мутантов с искомыми свойствами в бактериальной системе экспрессии [7, 12]. Упомянутый выше мутант avGFP с увеличенной яркостью – EGFP (enhanced green fluorescent protein), описанный спустя всего год после демонстрации экспрессии avGFP в E. coli и С. elegans, был получен путем внесения двух аминокислотных замен в родительский белок. Примечательно, что EGFP по сей день остается одним из наиболее востребованных зеленых ФБ, несмотря на постепенное появление вариантов с оптимизированным фолдингом, более быстрым созреванием и существенно возросшей яркостью [18–20]. Таким образом, характеристики EGFP как метки для традиционной флуоресцентной микроскопии оказались адекватными запросам исследователей. Сложные экспериментальные модели и современные методы флуоресцентной визуализации заставили обратить внимание на свойства ФБ, прежде считавшиеся второстепенными, – фототоксичность, способность к фотопереключениям, фотостабильность, время жизни флуоресценции. Оказалось, что дизайн новых вариантов ФБ с настройкой таких характеристик – трудоемкая задача, хотя бы потому, что наладить массовый скрининг и отбор мутантов здесь сложно, а подчас и невозможно.
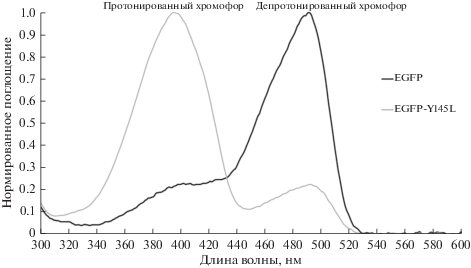
Одним из специфических требований, предъявляемых к флуорофорам в микроскопии сверхвысокого разрешения (семейство методов SMLM [21, 22]) и времяразрешенной микроскопии (FLIM [23]), выступает фотостабильность, т.е. способность молекулы поддерживать многократные циклы поглощения/испускания света [24]. Если в классической флуоресцентной микроскопии она влияет в основном на длительность эксперимента (как функцию удельной нагрузки возбуждающего излучения на образец), то в SMLM и FLIM, где регистрируются отдельные фотоны, фотостабильность определяет качество экспериментальных данных, связанное с числом фотонов, в среднем излучаемым отдельными молекулами маркера [25, 26]. Фотостабильность тесно связана с обесцвечиванием хромофора ФБ вследствие протекания фотохимических процессов с его участием. Изучение молекулярных механизмов фотообесцвечивания служит основной для разработки новых подходов к увеличению фотостабильности. В литературе описано получение фотостабильных вариантов ФБ с помощью направленной белковой эволюции [7, 27, 28], а также с помощью рационального дизайна, базирующегося на исследовании фотообесцвечивания. Так, в мутантах красных ФБ mKate2 S143C (назван mStable) и mPlum S146C фотостабильность примерно на порядок величины выше, чем в родительских белках, за счет стабилизации хромофора в цис-конформации сульфоксидными группами, образующимися при фотоокислении введенного в белок остатка цистеина [29]. Для фотопереключаемых белков семейства EosFP фотоокисление серосодержащего остатка было, наоборот, предложено как потенциальный канал исчерпания возможностей переключений (т.н. фотоусталости). Действительно, при введении замены Met159Ala фотостабильность IrisFP (гомолога EosFP) значительно увеличилась [30]. Наконец, в нашей работе, посвященной поиску аминокислотных остатков EGFP, опосредующих фотоокисление его хромофора, была выявлена ключевая роль Tyr145 как промежуточного электронного акцептора и описан мутант EGFP-Y145L, демонстрирующий примерно десятикратный прирост фотостабильности при микроскопии в живых клетках и 80-кратный – при облучении очищенного белка in vitro в окислительных условиях [31]. Вместе с тем, замена Y145L привела к существенному смещению рН-равновесия в окружении хромофорной группы, доминированию нефлуоресцирующей нейтральной формы хромофора (максимум поглощения – около 400 нм) и, как следствие, – снижению яркости мутанта по сравнению с исходным EGFP (рис. 1). Более того, EGFP-Y145L способен к фотоактивации (по-видимому, за счет светозависимого депротонирования хромофора). Эти факторы снижают его ценность как фотостабильного маркера.
Один из возможных подходов к повышению яркости EGFP-Y145L – снижение эффективности протонирования хромофора, которое, предположительно, может быть достигнуто введением дополнительных аминокислотных замен, описанных ранее как влияющие на кислотность хромофора GFP.
Интерес с точки зрения влияния на рКа хромофора GFP представляет остаток серина-205. Контактируя через молекулу структурной воды с Tyr66 хромофора [32–34], он играет важную роль в светоиндуцированном переносе протона (ESPT), а также влияет на протонирование хромофора в основном состоянии [35]. Мутации по этому положению способны привести к существенной реорганизации сети водородных связей в хромофорном окружении [36, 37]. Так, в avGFP замена серина в 205 положении на валин замедляет кинетику ESPT [36–38], в белке SiriusGFP способствует смещению pH-равновесия хромофора в сторону депротонирования [39]. Более того, в случае хлоридного сенсора mClY, разработанного на базе желтого флуоресцентного белка YFP (несущего хромофор типа GFP), и зеленого ФБ SiriusGFP, близкого гомолога EGFP, введение замены Ser205Val приводит к существенному увеличению фотостабильности белка [36, 40].
Второй аминокислотный остаток, ставший мишенью для мутагенеза в настоящей работе, – глутамат-222. Заместитель по 222 положению высоко консервативен в природных ФБ и, наряду с аргинином-96, считается важной структурной детерминантой созревания хромофора [41–43], стабилизации зрелого хромофора во флуоресцентном состоянии [32, 43] и, в конечном счете, комплекса физико-химических характеристик ФБ [44–46]. Однако с точки зрения поставленных нами задач глутамат-222 интересен прежде всего своим участием во внутрибелковом транспорте протона, как в основном [47], так и в возбужденном электронном состоянии хромофора [33, 34, 42, 48]. В частности, Glu222 рассматривается как терминальный акцептор протона в нативной цепи ESPT avGFP [49]. Замена глутамата в 222 положении на незаряженный глутамин блокирует ESPT [49], действуя подобно мутации S65T первой аминокислоты хромофорной триады (при введении последней карбоксильная группа глутамата переориентируется в сторону от Tyr66 хромофора [4, 50]). Наибольший интерес для нас представляет замена E222G, которая была описана еще в составе ранних мутантов avGFP как подавляющая протонирование хромофора [32, 52]. Позже эта же мутация была выявлена в экспериментах по направленной белковой эволюции acGFPL, бесцветного GFP-подобного белка из гидромедузы Aequorea coerulescens, где она позволила получить яркий белок aceGFP, хромофор которого в физиологическом диапазоне pH находится строго в ионизованном состоянии [53]. Кроме того, E222G может блокировать дополнительный канал фотоокисления хромофора, исключая из цепи переноса электрона потенциальный акцептор (ионизованный остаток Glu222) [54]. Наша работа по анализу вовлеченных в светоиндуцированный транспорт электрона в EGFP аминокислотных остатков не подтверждает роли Glu222 [31], однако если гипотеза Saha et al. верна, то мутация E222G может не только способствовать депротонированию хромофора, но и улучшать фотостабильность белка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мутация S205V
Мы предположили, что внесение мутации S205V в EGFP-Y145L может не только сместить pKa хромофора в кислую область, восстановив яркость флуоресценции за счет преобладания анионной формы, но и способствовать сохранению высокой фотостабильности двойного мутанта. Анализ спектральных свойств EGFP-Y145L/S205V, однако, показал, что наше предположение оказалось неверным. В спектре поглощения мутантного варианта с двумя заменами (рис. 2а) доминировала нейтральная форма хромофора с максимумом поглощения 395 нм, примерно в 15 раз превосходящим по амплитуде пик анионного хромофора, сдвинутый на ~10 нм в красную область по сравнению с соответствующим пиком EGFP (рис. 2а, табл. 3). Спектры флуоресценции (рис. 2б) демонстрируют заметный (~5 нм) батохромный сдвиг максимума эмиссии (при возбуждении на 470 нм), а также существенный (более 10 нм) сдвиг максимума возбуждения относительно EGFP. Кроме того, у EGFP-Y145L/S205V хорошо выражен второй коротковолновый (390 нм) максимум возбуждения, свидетельствующий о протекании в этом мутанте ESPT, а также, возможно, о его способности к фотоактивации. При возбуждении флуоресценции EGFP-Y145L/S205V при λвозб = 395 нм в спектре эмиссии детектируется как синяя (454 нм), так и зеленая (511 нм) полоса (рис. 2в). Отличие в положении максимума эмиссии зеленой флуоресценции при коротковолновом возбуждении от такового при длинноволновом (511 нм против 516 нм) – характерный спектральный признак светозависимого переноса протона.
Рис. 2.
(а) спектры поглощения белков EGFP, EGFP-Y145L и EGFP-Y145L/S205V. Максимумы поглощения протонированной формы хромофора ~395 нм, депротонированной (анионной) формы 490–500 нм. (б) спектры возбуждения (пунктир, λem = 530 нм) и эмиссии (сплошная линия, λex = 470 нм) флуоресценции тех же флуоресцентных белков. По оси ординат отложен нормированный на максимальное значение флуоресцентный сигнал. (в) спектр эмиссии флуоресценции EGFP-Y145L/S205V при возбуждении 395 нм. По оси ординат отложен нормированный на максимальное значение флуоресцентный сигнал.
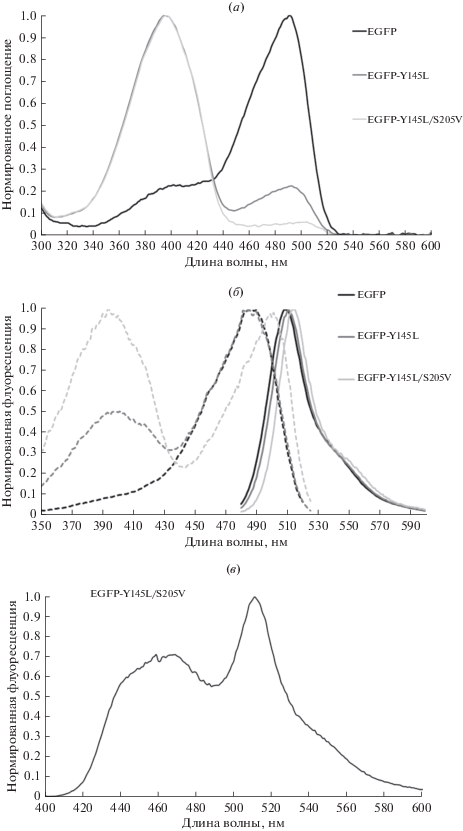
Таблица 1.
Кинетические характеристики затухания флуоресценции EGFP, Y145L и Y145L/S205V при возбуждении анионного хромофора
| Белок | Режим возбуждения* | τ1, ps | A1, % | τ2, ps | A2, % |
|---|---|---|---|---|---|
| EGFP | 1P | 2760 ± 6 | 100 | – | – |
| 2P | 2725 ± 7 | 100 | – | – | |
| Y145L | 1P | 2630 ± 7 | 100 | – | – |
| 2P | 2565 ± 5 | 100 | – | – | |
| Y145L/S205V | 1P | 1925 ± 20 | 58 | 627 ± 10 | 42 |
| 2P | 2070 ± 25 | 55 | 710 ± 30 | 45 |
Таблица 2.
Кинетические характеристики затухания флуоресценции EGFP-Y145L/E222G и Y145L/S205V/E222G при возбуждении анионного хромофора
| Белок | Режим возбуждения* | τ1, ps | A1, % | τ2, ps | A2, % |
|---|---|---|---|---|---|
| Y145L/E222G | 1P | 3190 ± 12 | 100 | – | – |
| 2P | 3080 ± 10 | 100 | – | – | |
| Y145L/S205V/E222G | 1P | 2310 ± 23 | 75 | 644 ± 20 | 25 |
| 2P | 2420 ± 30 | 64 | 830 ± 40 | 36 |
Измерение времен жизни флуоресценции EGFP-Y145L и EGFP-Y145L/S205V показало наличие в последнем двух мажорных флуоресцентных фракций с временами жизни 630–700 пс (в зависимости от режима возбуждения) и ~2 нс, соответственно (табл. 1). Примечательно, что кинетика затухания флуоресценции EGFP-Y145L и в однофотонном и в двухфотонном режиме хорошо аппроксимируется однокомпонентной экспоненциальной моделью с временем жизни ~2.6 нс, близким к таковому у EGFP, и соответствует прямой флуоресценции из анионной формы хромофора. Вероятно, в случае двойного мутанта кинетика затухания флуоресценции с временем жизни 2 нс также характеризует прямой S1-S0 переход анионного хромофора (с некоторым гашением в результате ESPT), а короткоживущая компонента – флуоресценцию нейтрального хромофора в синей области (~460 нм).
Мутантный белок EGFP-Y145L/S205V характеризуется чрезвычайно низкой квантовой эффективностью при возбуждении в синей области. Коэффициент экстинкции анионной формы хромофора составляет всего 2400 M–1 см–1, а квантовый выход флуоресценции (λвозб = 500 нм) 0.2 (табл. 3). Таким образом, при флуоресцентной визуализации с помощью стандартных для GFP наборов светофильтров эффективная яркость флуоресценции этого белка будет составлять ~1% от таковой у EGFP. Результаты наших экспериментов по флуоресцентной микроскопии EGFP-Y145L/ S205V как in vitro, с использованием белка, иммобилизованного на частицах металлоаффинной смолы, так и in cellulo, где белок экспрессировался в клетках линии HEK293T, подтверждают эти расчеты (данные не показаны). Кроме того, мы обнаружили, что двойной мутант способен к фотоактивации (см. главу Фотостабильность и фотоактивация).
Таблица 3.
Спектральные характеристики и фотостабильность EGFP и его мутантов
| Белок | λex/λem, нм | EC, M–1 см–1 | QY | RB, % | Фотостабильность# | ||
|---|---|---|---|---|---|---|---|
| in vitro, солевой буфер | in vitro, 500 мкМ феррицианид калия | in cellulo, клетки HEK293T | |||||
| EGFP | 488/509 | 55 000 | 0.60 | 100 | 2.5 ± 1 мин | 2.5 ± 0.3 c | 35 ± 4 c |
| EGFP-Y145L | 397 и 489/509 | 10 400 | 0.52 | 16 | 7 ± 2 мин | 45 ± 7 c | 3.5 ± 1 мин |
| EGFP-Y145L/E222G | 483/509 | 65 000 | 0.36 | 71 | 3.5 ± 1 мин | 12 ± 1.7 c | 1 ± 0.5 мин |
| EGFP-Y145L/S205V | 390 и 501/516 | 2400 | 0.20 | 1.5 | 35 ± 5 мин | 10 ± 2 мин | 9 ± 3 мин |
| EGFP-Y145L/S205V/E222G | 394 и 496/515 | 2100 | 0.30 | 1.9 | 31 ± 8 мин | 23 ± 5 мин | 5 ± 2 мин |
EC – коэффициент экстинкции анионной формы хромофора белка. QY – квантовый выход флуоресценции. RB – относительная яркость белка. Относительная яркость рассчитывается как произведение молярного коэффициента экстинкции и квантового выхода флуоресценции и дается по сравнению с яркостью EGFP. # Под фотостабильностью понимается время, за которое интенсивность флуоресценции снижалась на 50%. Для измерений фотостабильности в клетках N ≥ 20.
Мутация E222G
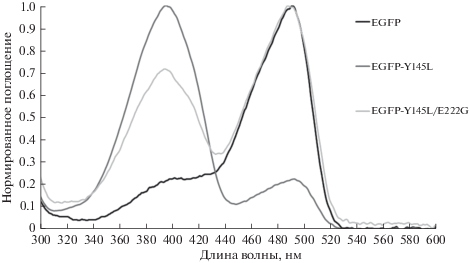
В свою очередь, спектральные характеристики EGFP-Y145L/E222G говорят об искомом смещении кислотности хромофора в сторону депротонирования. Так, амплитуды пиков поглощения нейтрального (λ = 395 нм) и анионного (λ = 488 нм) хромофора у него соотносятся как 1 : 1.4, тогда как у исходного EGFP-Y145L это соотношение ~4 : 1 (рис. 3).
Рис. 3.
Спектры поглощения белков EGFP, EGFP-Y145L и EGFP-Y145L/E222G. Максимумы поглощения протонированной формы хромофора ~395 нм, депротонированной (анионной) формы хромофора ~490 нм.
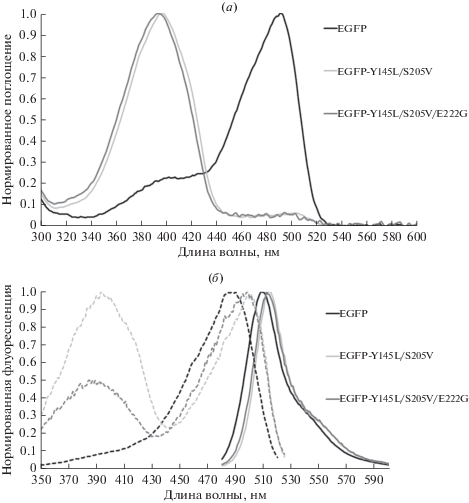
Спектры возбуждения и эмиссии флуоресценции мутантного белка с двумя заменами практически идентичны таковым для EGFP (данные не показаны), а кинетика затухания флуоресценции при возбуждении на 490 нм хорошо аппроксимируется однокомпонентной моделью с τ ~ 3.1 нс (см. табл. 2). Кроме того, в условиях флуоресцентной микроскопии изолированного белка (удельная мощность возбуждения ~1 Вт/см2) мы не обнаружили у него признаков фотоактивации синим (470 ± 20 нм) светом. Относительная яркость флуоресценции EGFP-Y145L/E222G составляет ~70% яркости EGFP, уступая последнему в основном из-за невысокого квантового выхода флуоресценции анионной формы (см. табл. 3). В целом приведенные данные свидетельствуют о гомогенности флуоресцентной популяции EGFP-Y145L/ E222G и, соответственно, о возможности применения этого белка в качестве флуоресцентной метки в типовых экспериментах. Однако, согласно результатам спектрофотометрии, доля молекул EGFP-Y145L/E222G, несущих нейтральный хромофор, составила около 40%, а значит почти половина белка не флуоресцирует. Неполная компенсация заменой E222G смещенного в щелочную область pKa хромофора EGFP-Y145L, как мы полагаем, отражает комплексный и не всегда хорошо предсказуемый характер формирования физико-химических свойств ФБ. Детерминанты протонирования хромофора многочисленны [49], блокирование одних путей внутрибелкового переноса протона зачастую приводит к задействованию других. Более того, недавние структурные данные высокого разрешения, полученные на мутанте E222Q (эффект мутации похож на E222G) показывают, что статус протонирования Tyr66 хромофора не связан напрямую с системой водородных связей вокруг Thr65/Gln222 [55]. Допуская, что остаточное протонирование хромофора может быть связано с формированием новой сети водородных связей в хромофорном окружении и задействованием альтернативной цепи переноса протона, мы предположили, что серин-205 может играть роль донора или акцептора протона в молекуле EGFP-Y145L/E222G. Для проверки этого предположения мы сконструировали вариант EGFP, несущий три аминокислотные замены, – EGFP-Y145L/S205V/E222G. Оказалось, что по спектральным свойствам этот мутантный белок существенно ближе к EGFP-Y145L/S205V, чем к EGFP-Y145L/E222G. В его спектре поглощения (рис. 4а) доминирует полоса нейтрального хромофора (λmax = 394 нм), а флуоресценция в зеленой области (λmax = 515 нм) характеризуется бимодальным возбуждением (максимумы на 394 и 496 нм), свидетельствующем о протекании ESPT (рис. 4б). Впрочем, эффективность переноса протона в возбужденном состоянии, по всей видимости, невелика: на спектре эмиссии тройного мутанта, измеренном при возбуждении 395 нм заметен только синий пик (~455 нм, данные не показаны). EGFP-Y145L/S205V/E222G демонстрирует низкую яркость флуоресценции (~2% яркости EGFP) при возбуждении синим светом (см. табл. 3).
Рис. 4.
Спектры поглощения белков EGFP, EGFP-Y145L/S205V и EGFP-Y145L/S205V/E222G. (а) максимумы поглощения протонированной формы хромофора ~395 нм, депротонированной (анионной) формы 490–500 нм. (б) спектры возбуждения (пунктир, λem = 530 нм) и эмиссии (сплошная линия, λex = 470 нм) флуоресценции тех же флуоресцентных белков. По оси ординат отложен нормированный на максимальное значение флуоресцентный сигнал.
Сравнительная времяразрешенная спектроскопия вариантов EGFP-Y145L/E222G и Y145L/ S205V/E222G (табл. 2) подтверждает выводы, сделанные при анализе стационарных спектров. Двойной мутант, как было упомянуто выше, формирует гомогенную фракцию с моноэкспоненциальным затуханием сигнала (τ ~ 3.1 нс), а у тройного появляется дополнительная короткоживущая компонента, связанная, по всей вероятности, с вкладом синей флуоресценции нейтрального хромофора. Степень гашения (укорочения времени жизни) флуоресценции анионного хромофора (τ ~ 2.3–2.4 нс), однако, выражены меньше, чем у EGFP-Y145L/S205V, что наряду со сравнительно небольшой амплитудой коротковолнового пика возбуждения (λmax = 394 нм), дополнительно свидетельствует о сниженной относительно EGFP-Y145L/S205V эффективности ESPT.
Высокая доля протонированного хромофора в вариантах EGFP, несущих замену S205V, рассматривалась как один из ожидаемых исходов. Так, похожий спектральный портрет был описан для белка avGFP-S205V, который послужил моделью для изучения альтернативных путей переноса протона в GFP [37]. Более того, avGFP-S205V/T203V, в котором ESPT удалось заблокировать полностью, вообще не содержит анионной формы хромофора и флуоресцирует только в синей области спектра (459 нм) при возбуждении нейтрального хромофора.
Фотостабильность и фотоактивация
Мы измерили кинетики фотообесцвечивания всех упомянутых выше мутантных белков и их родоначальника EGFP в идентичных экспериментальных условиях (табл. 3). Оценка фотостабильности ФБ проводилась с помощью широкопольной флуоресцентной микроскопии с использованием стандартного набора светофильтров GFP (см. раздел Микроскопия главы Материалы и методы) в трех модельных системах. Первая из них – очищенный белок в нейтральном солевом буфере – является стандартной для измерения фотостабильности in vitro [16, 27, 56]; вторая – белок в присутствии одноэлектронного окислителя (феррицианида калия) хорошо зарекомендовала себя для выявления вклада в фотообесцвечивание окислительных процессов в возбужденном состоянии [31, 57, 58]; третья – белок, экспрессируемый живыми клетками HEK293T – вероятно, наиболее адекватно отражает фотостабильность маркера в условиях биологической визуализации. Отметим, что сравнение экспериментальных значений возможно только внутри наборов данных для каждой модельной системы.
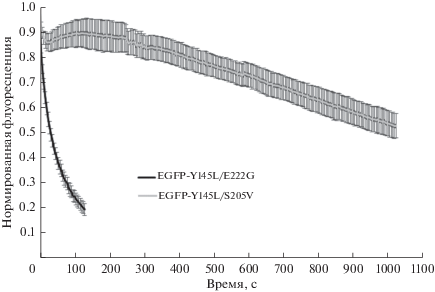
Поведение белка EGFP-Y145L при фотообесцвечивании было подробно описано ранее [31], и данные, приведенные здесь, в целом повторяют предыдущие результаты. EGFP-Y145L чрезвычайно устойчив к обесцвечиванию, однако его слабая фотоактивация при облучении широкополосным синим светом приводит к некоторому завышению наблюдаемой фотостабильности. Визуализация EGFP-Y145L/E222G потребовала практически одинаковых с EGFP настроек чувствительности детектора. При сравнимой с родительским белком яркости этот мутант продемонстрировал существенно увеличенную относительно EGFP фотостабильность во всех трех модельных системах: в ~1.5 раза в солевом буфере, в ~5 раз с окислителем и в ~2 раза в живых клетках. Мы склонны связывать больший относительный эффект замедления фотообесцвечивания EGFP-Y145L/E222G в окислительных условиях in vitro с ролью мутации Y145L в блокировании светозависимого транспорта электрона. Оба мутантных варианта, несущих замену S205V, заметно фотоактивируются при измерении кинетики фотообесцвечивания (рис. 5). По этой причине характеристические времена фотообесцвечивания, приведенные для EGF-P-Y145L/S205V и EGFP-Y145L/S205V/E222G в табл. 3, отражают не истинную, а кажущуюся фотостабильность этих флуорофоров. Такое поведение указанных белков вкупе с их низкой яркостью делает их мало пригодными для рутинной флуоресцентной визуализации.
Рис. 5.
Кинетика изменения интенсивности флуоресценции белков EGFP-Y145L/E222G и EGFP-Y145L/S205V in vitro в присутствии 500 мкМ K3[Fe(CN)6]. N = 10.
Вместе с тем, фотоактивация вариантов с заменой S205V может представлять определенный интерес для научного сообщества, например, в контексте методов SMLM. Резонно предположить, что наблюдаемая фотоактивация связана со светоиндуцированным депротонированием хромофора, которое инициируется поглощением белков в фиолетовой области спектра (при флуоресцентной микроскопии мы используем фильтр BP470/40 на возбуждение). Механизм депротонирования может быть схож с таковым для хорошо охарактеризованной фотоактивации белка PAGFP (EGFP-T203H) [59–62], при которой вызванная ESPT ионизация хромофора сопровождается декарбоксилированием боковой цепи Glu222 с последующей перестройкой сети водородных связей, благоприятствующей стабилизации анионной формы хромофора. Однако, декарбоксилирование Glu222 в EGFP-Y145L/S205V/E222G невозможно. Кроме того, важной структурной детерминантой такой стабилизации является стекинг-взаимодействие остатка His203 с хромофором [9], отсутствующее в наших белках. Вероятно, в EGFP-Y145L/S205V и EGFP-Y145L/S205V/E222G реализуется альтернативный сценарий фотоактивации, изучение механизма которого требует дополнительных структурных изысканий. Для оценки эффективности и установления спектральных особенностей фотоактивации мы провели эксперимент, в котором облучали водный раствор очищенного EGFP-Y145LS/205V/E222G интенсивным фиолетовым светом, с определенной периодичностью измеряя спектр поглощения раствора (рис. 6).
Рис. 6.
Спектры поглощения мутанта EGFP-Y145L/S205V/E222G, полученные при облучении препарата белка коротковолновым (405 нм) интенсивным (~5.5 Вт/см2) светом.
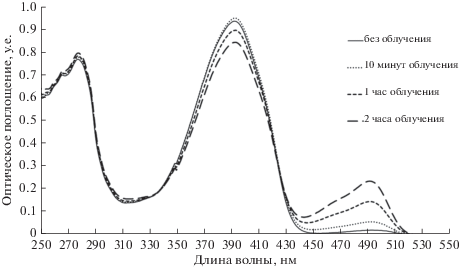
Как видно из результатов эксперимента, возбуждение нейтральной формы хромофора действительно приводит к постепенному увеличению популяции молекул с анионным (λпогл = 495 нм) хромофором. Фотоактивация EGFP-Y145L/S205V/ E222G – не очень эффективный процесс, за 2 часа облучения поглощение анионной формы хромофора увеличилось только в 3–4 раза (для сравнения, при УФ-фотоактивации мутанта aceGFP-G222E достигалось 1000-кратное увеличение флуоресцентного сигнала [53]).
ЗАКЛЮЧЕНИЕ
Нами было протестировано введение двух аминокислотных замен, представляющих собой важные детерминанты кислотности хромофора GFP – S205V и E222G – а также их комбинации как способ увеличения яркости фотостабильного мутанта EGFP-Y145L. Мутация S205V не оправдала наших ожиданий, она смещает pKa хромофора в щелочную область, способствует протонированию хромофора, протеканию ESPT. С другой стороны, мутантные белки с этой заменой могут быть интересны для изучения кинетики ESPT (возможно, что этот процесс в EGFP-Y145L/S205V протекает с задействованием альтернативного канала переноса протона). EGFP-Y145L/S205V и EGFP-Y145L/ S205V/E222G – фотоактивируемые ФБ, вероятно, использующие не описанный ранее механизм фотоактивации. Их свойства могут найти применение в SMLM. Наконец, сложное фотоповедение вариантов с заменой S205V во временном домене, высокий вклад короткоживущих флуоресцентных популяций в пул регистрируемых фотонов, вкупе с выраженным протонированием хромофора при нейтральных рН, открывает перспективу их использования в качестве времяразрешенных сенсоров рН, особенно в щелочном диапазоне. Эффект мутации E222G, введенной в EGFP-Y145L, напротив, соответствовал нашим требованиям. Двойной мутант EGFP-Y145L/S205V/E222G – сравнительно яркий ФБ, сохраняющий повышенную в 1.5–5 раз по сравнению с родительским EGFP фотостабильность.
МАТЕРИАЛЫ И МЕТОДЫ
Сайт-направленный мутагенез
Мутанты EGFP были получены с использованием метода Overlap-extension PCR со следующим набором олигонуклеотидов, содержащим соответствующую замену: концевые праймеры – прямой 5'-ATGCGGATCCATGGTGAGCAAGGGCGAG-3' и обратный 5'-ATGCAAGCTTTTACTTGTACAGCTCGTC-3' для всех мутантных вариантов EGFP и прямой 5'-GAGTACAACCTGAACAGCCAC-3', обратный 5'-GTGGCTGTTCAGGTTGTACTC-3' для EGFP Y145L; прямой 5'-GTCCTGCTGGGCTTCGTGACC-3', обратный 5'-GGTCACGAAGCCCAGCAGGAC-3' для EGFP-E222G; прямой 5'-AGCACCCAGGTCGCCCTGAGC-3', обратный 5'-GCTCAGGGCGACCTGGGTGCT-3' для EGFP-S205V. Для бактериальной экспрессии амплифицированный с помощью ПЦР фрагмент, содержащий на концах сайты рестрикции BamHI/ HindIII и кодирующий вариант ФБ, был клонирован в вектор pQE30 (Qiagen).
Экспрессия и очистка белка
EGFP, а также мутанты EGFP были клонированы в вектор pQE30 (Qiagen) с меткой 6His на N-конце, экспрессированы в штамме E. coli XL1 Blue (Invitrogen) и очищены с использованием металло-аффинной смолы TALON (Clontech). Для экспрессии в клетках млекопитающих использовали вектор EGFP-N1 (Clontech). Мутанты EGFP были клонированы в EGFP-N1 вместо EGFP. Клетки HEK293T (ATCC) трансфицировали перечисленными выше конструкциями для получения временной экспрессии белка.
Спектроскопия и оценка яркости флуоресценции
Для измерения спектров поглощения и возбуждения/эмиссии флуоресценции использовали спектрофотометр Cary 100 UV/VIS и флуоресцентный спектрофотометр Cary Eclipse (Varian). Яркость флуоресценции оценивали как произведение молярного коэффициента экстинкции и квантового выхода флуоресценции. Измерения всех нативных белков проводили в фосфатно-солевом буферном растворе (PBS, pH 7,4, GIBCO). Для определения молярного коэффициента экстинкции мы использовали измерение концентрации зрелого хромофора. EGFP и его мутанты были денатурированы щелочью в 1 М NaOH. Известно, что в этих условиях GFP-подобный хромофор поглощает при 447 нм с коэффициентом экстинкции 44 000 М–1 см–1. На основе поглощения нативного и денатурированного щелочью белков были рассчитаны молярные коэффициенты экстинкции для нативных состояний. Для определения квантового выхода флуоресценции площади под кривой спектров эмиссии флуоресценции мутантов сравнивали с таковой для EGFP с тем же поглощением (квантовый выход 0.60).
Микроскопия
Для широкопольной флуоресцентной микроскопии использовалась система визуализации Leica AF6000 LX с ПЗС-камерой Photometrics CoolSNAP HQ. Флуоресцентные изображения получали с использованием масляного иммерсионного объектива 63× NA1.4 и стандартного набора фильтров GFP (возбуждение BP470/40, эмиссия BP525/50). Флуоресцентные белки, иммобилизованные на смоле TALON, и живые эмбриональные клетки почки человека 293 (HEK293T), культивируемые в среде DMEM (визуализацию также осуществляли в среде DMEM) и экспрессирующие целевые белки в цитоплазме, визуализировали и обесцвечивали с использованием следующих настроек: для детектирования сигнала (25–50 мВт/см2, выдержка 10–100 мс) и для фотообесцвечивания (~1 Вт/см2, выдержка 5 с). Фотообесцвечивание наблюдали при циклической съемке, чередуя съемку при низкой интенсивности света с воздействием облучения максимальной интенсивности (набор фильтров GFP). Изображения были получены и количественно оценены с использованием программ Leica LAS AF.
Микроскопия времени жизни флуоресценции очищенных белков при однофотонном и двухфотонном возбуждении
Для флуоресцентных белков, несущих анионные хромофоры, характерны расхождения спектральных свойств при однофотонном и двухфотонном поглощении [63]. Кроме того, описаны различия в кинетических характеристиках затухания флуоресценции в зависимости от режима возбуждения у зеленых ФБ с несколькими спектральными формами и светозависимыми переходами между этими формами [64]. Поэтому для расширения информативности анализа времяразрешенного сигнала измерение затухания флуоресценции всех белков мы проводили как в однофотонном, так и в двухфотонном режиме.
Фемтосекундные лазерные импульсы (частота 80 МГц, 100 фс, до 25 нДж на импульс) из Титан-Сапфирового осциллятора (Tsunami, Spectra-Physics), накачиваемого непрерывным зеленым Nd:YVO4 лазером (532 нм, Millennia Prime 6sJ, Spectra-Physics), преобразовывались во вторую гармонику в нелинейном кристалле бората бария (BBO, Model 3980, Spectra-Physics). Фемтосекундные лазерные импульсы на фундаментальной длине волны совмещалось с излучением второй гармоники через длинноволновое дихроичное зеркало (DMLP650, Thorlabs). Совмещенные лазерные пучки заводились в инвертированный оптический микроскоп Olympus IX71 через диэлектрический фильтр (FESH0750, Thorlabs) установленный под углом 45°, и фокусировались объективом (40× 0.75NA UPlanFLN, Olympus) на образец, который был помещен на 3-координатный столик. При каждом эксперименте был открыт только один из лазерных пучков. Образцы были приготовлены в виде капель очищенных флуоресцентных белков, растворенных в фосфатно-солевом буфере (PBS, pH 7.4, GIBCO), нанесенных на стандартное покровное стекло 24 × 24 мм (Heinz Herenz, Germany). Средняя мощность лазера, достигающая образца, точно настраивалась с помощью поляризационного аттенюатора, состоящего из полуволновой пластины и поляризационного куба в каждом из пучков. Однофотонное возбуждение флуоресценции в образце производилось излучением второй гармоники при средней мощности до 10 мкВт на длине волны 490 нм. Двухфотонное возбуждение выполняли при длине волны 980 нм и средней мощности лазера до 10 мВт. Флуоресценция образца, возбуждаемого фемтосекундным лазером, в обоих режимах проходила обратно через объектив и фильтр, заводящий лазерное излучение, а затем направлялась на вход полихроматора Acton SP300i с двумя отдельными выходами. Для регистрации флуоресцентных спектров использовалась ПЗС-камера PI-MAX 2 (Princeton Instruments) на первом выходе монохроматора. Фотоэлектронный умножитель время-коррелированной системы счета фотонов SPC-730 (Becker & Hickl GmbH) на втором выходе детектировал кинетику затухания флуоресценции в спектральном диапазоне 510–530 нм. Данные о времени жизни флуоресценции были получены с использованием программного обеспечения SPC Image NG (Becker & Hickl, Germany), а затем экспортированы в формате ASCII и проанализированы с использованием программного обеспечения Origin Pro 9 (OriginLab, США).
Список литературы
van Roessel P, Brand A.H. // Nat. Cell. Biol. 2002. V. 4. P. 15–20. https://doi.org/10.1038/ncb0102-e15
Shimomura O. // Angew. Chem. Int. Ed. Engl. 2009. V. 48. P. 5590–5602. https://doi.org/10.1002/anie.200902240
Chalfie M., Tu Y., Euskirchen G., Ward W.W., Prasher D.C. // Science. 1994. V. 263. P. 802–805. https://doi.org/10.1126/science.8303295
Heim R., Cubitt A.B., Tsien R.Y. // Nature 1995. V. 373. P. 663–664. https://doi.org/10.1038/373663b0
Zhang G., Gurtu V., Kain S.R. // Biochem. Biophys. Res. Commun. 1996. V. 227. P. 707–711. https://doi.org/10.1006/bbrc.1996.1573
Tsien R.Y. // Annu. Rev. Biochem. 1998. V. 67. P. 509–544. https://doi.org/10.1146/annurev.biochem.67.1.509
Ai H.W., Shaner N.C., Cheng Z., Tsien R.Y., Campbell R.E. // Biochemistry. 2007. V. 46. P. 5904–5910. https://doi.org/10.1021/bi700199g
Kremers G.J., Goedhart J., van Munster E.B., Gadella T.W. Jr. // Biochemistry. 2006. V. 45. P. 6570–6580. https://doi.org/10.1021/bi0516273
Henderson J.N., Gepshtein R., Heenan J.R., Kallio K., Huppert D., Remington S.J. // J. Am. Chem. Soc. 2009. V. 131. P. 4176–4177. https://doi.org/10.1021/ja808851n
Matz M.V., Fradkov A.F., Labas Y.A., Savitsky A.P., Zaraisky A.G., Markelov M., Lukyanov S.A. // Nat. Biotechnol. 1999. V. 17. P. 969–973. https://doi.org/10.1038/13657
Shcherbo D., Murphy C.S., Ermakova G.V., Solovieva E.A., Chepurnykh T.V., Shcheglov A.S., Verkhusha V.V., Pletnev V.Z., Hazelwood K.L., Roche P.M., Lukyanov S., Zaraisky A.G., Davidson M.W., Chudakov D.M. // Biochem. J. 2009. V. 418. P. 567–574. https://doi.org/10.1042/BJ20081949
Bindels D.S., Haarbosch L., van Weeren L., Postma M., Wiese K.E., Mastop M., Aumonier S., Gotthard G., Royant A., Hink M.A., Gadella T.W., Jr. // Nat. Methods. 2016. V. 14. P. 53–56. https://doi.org/10.1038/nmeth.4074
https://www.fpbase.org/.
Nguyen A.W., Daugherty P.S. // Nat. Biotechnol. 2005. V. 23. P. 355–360. https://doi.org/10.1038/nbt1066
Goedhart J., von Stetten D., Noirclerc-Savoye M., Lelimousin M., Joosen L., Hink M.A., van Weeren L., Gadella T.W., Jr., Royant A. // Nat. Commun. 2012. V. 3. P. 751. https://doi.org/10.1038/ncomms1738
Shaner N.C., Steinbach P.A., Tsien R.Y. // Nat. Methods. 2005. V. 2. P. 905–909. https://doi.org/10.1038/nmeth819
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiol. Rev. 2010. V. 90. P. 1103–1163. https://doi.org/10.1152/physrev.00038.2009
Pédelacq J.-D., Cabantous S., Tran T., Terwilliger T.C., Waldo G.S. // Nat. Biotechnol. 2005. V. 24. P. 79–88. https://doi.org/10.1038/nbt1172
Cubitt A.B., Woollenweber L.A., Heim R. // Methods Cell Biol. 1998. V. 58. P. 19–30. https://doi.org/10.1016/s0091-679x(08)61946-9
Shaner N.C., Lambert G.G., Chammas A., Ni Y., Cranfill P.J., Baird M.A., Sell B.R., Allen J.R., Day R.N., Israelsson M., Davidson M.W., Wang J. // Nat. Methods. 2013. V. 10. P. 407–409. https://doi.org/10.1038/nmeth.2413
Jradi F.M., Lavis L.D. // ACS Chem. Biol. 2019. V. 14. P. 1077–1090. https://doi.org/10.1021/acschembio.9b00197
Yan R., Moon S., Kenny S.J., Xu K. // Acc. Chem. Res. 2018. V. 51. P. 697–705. https://doi.org/10.1021/acs.accounts.7b00545
De Los Santos C., Chang C.W., Mycek M.A., Cardullo R.A. // Mol. Reprod. Dev. 2015. V. 82. P. 587–604. .https://doi.org/10.1002/mrd.22501
Мамонтова А.В., Григорьев А.П., Царькова А.С., Лукьянов К.А., Богданов А.М. // Биоорган. химия. 2017. Т. 43. С. 598–607. [Mamontova A.V., Grigoryev A.P., Tsarkova A.S., Lukyanov K.A, Bogdanov A.M. // Russ. J. Bioorgan. Chem. 2017. V. 43. P. 625–633.] https://doi.org/10.7868/S0132342317060021
Seefeldt B., Kasper R., Seidel T., Tinnefeld P., Dietz K.J., Heilemann M., Sauer M. // J. Biophotonics. 2008. V. 1. P. 74–82. https://doi.org/10.1002/jbio.200710024
Duan C., Adam V., Byrdin M., Ridard J., Kieffer-Jaquinod S., Morlot C., Arcizet D., Demachy I., Bourgeois D. // J. Am. Chem. Soc. 2013. V. 135. P. 15 841–15 850. https://doi.org/10.1021/ja406860e
Shaner N.C., Lin M.Z., McKeown M.R., Steinbach P.A., Hazelwood K.L., Davidson M.W., Tsien R.Y. // Nat. Methods. 2008. V. 5. P. 545–551. https://doi.org/10.1038/nmeth.1209
Zhong S., Navaratnam D., Santos-Sacchi J. // PLoS One. 2014. V. 9. P. e99 095. https://doi.org/10.1371/journal.pone.0099095
Ren H., Yang B., Ma C., Hu Y.S., Wang P.G., Wang L. // ACS Chem. Biol. 2016. V. 11. P. 2679–2684. https://doi.org/10.1021/acschembio.6b00579
Duan C., Byrdin M., El Khatib M., Henry X., Adam V., Bourgeois D. // Methods Appl. Fluoresc. 2015. V. 3. P. 014 004. https://doi.org/10.1088/2050-6120/3/1/014004
Bogdanov A.M., Acharya A., Titelmayer A.V., Mamontova A.V., Bravaya K.B., Kolomeisky A.B., Lukyanov K.A., Krylov A.I. // J. Am. Chem. Soc. 2016. V. 138. P. 4807–4817. https://doi.org/10.1021/jacs.6b00092
Ormo M., Cubitt A.B., Kallio K., Gross L.A., Tsien R.Y., Remington S.J. // Science. 1996. V. 273. P. 1392–1395. https://doi.org/10.1126/science.273.5280.1392
Brejc K., Sixma T.K., Kitts P.A., Kain S.R., Tsien R.Y., Ormö M., Remington S.J. // Proc. Natl. Acad. Sci. U S A. 1997. V. 94. P. 2306–2311. https://doi.org/10.1073/pnas.94.6.2306
Palm G.J., Zdanov A., Gaitanaris G.A., Stauber R., Pavlakis G.N., Wlodawer A. // Nat. Struct. Biol. 1997. V. 4. P. 361–365. https://doi.org/10.1016/s0076-6879(00)05489-6
Kennis J.T.M, Larsen D.S., van Stokkum I.H.M., Vengris M., van Thor J.J., van Grondelle R. // PNAS 2004. V. 101. P. 17 988–17 993. https://doi.org/10.1073/pnas.0404262102
Zhong S., Navaratnam D., Santos-Sacchi J. // PLoS One. 2014. V. 9. P. e99 095. https://doi.org/10.1371/journal.pone.0099095
Shu X., Leiderman P., Gepshtein R., Smith N.R., Kallio K., Huppert D., Remington S.J. // Protein Sci. 2007. V. 16. P. 2703–2710. https://doi.org/10.1110/ps.073112007
Simkovitch R., Huppert A., Huppert D., Remington S.J., Miller Y. // J. Phys. Chem. B. 2013. V. 117. P. 11 921–11 931. https://doi.org/10.1021/jp405698g
Laptenok S.P., Lukacs A., Gil A., Brust R., Sazanovich I.V., Greetham G.M., Tonge P.J., Meech S.R. // Angew. Chem. Int. Ed. Engl. 2015. V. 54. P. 9303–9307. https://doi.org/10.1002/anie.201503672
Zhong S., Rivera-Molina F., Rivetta A., Toomre D., Santos-Sacchi J., Navaratnam D. // J. Neurosci. Methods. 2019. V. 313. P. 68–76. https://doi.org/10.1016/j.jneumeth.2018.12.008
Barondeau D.P., Putnam C.D., Kassmann C.J., Tainer J.A., Getzoff E.D. // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 12 111–12 116. https://doi.org/10.1073/pnas.2133463100
Sniegowski J.A., Lappe J.W., Patel H.N., Huffman H.A., Wachter R.M. // J. Biol. Chem. 2005. V. 280. P. 26 248–26 255. https://doi.org/10.1074/jbc.M412327200
Craggs T.D. // Chem. Soc. Rev. 2009. V. 38. P. 2865–2875. https://doi.org/10.1039/b903641p
Lin C.Y., Romei M.G., Oltrogge L.M., Mathews I.I., Boxer S.G. // J. Am. Chem. Soc. 2019. V. 141. P. 15 250–15 265. https://doi.org/10.1021/jacs.9b07152
Nakano H., Okumura R., Goto C., Yamane T. // Biotech. Bioproc. Eng. 2002. V. 7. P. 311–315. https://doi.org/10.1007/BF02932841
Banerjee S., Schenkelberg C.D., Jordan T.B., Reimertz J.M., Crone E.E., Crone D.E., Bystroff C. // Biochemistry. 2017. V. 56. P. 736–747. https://doi.org/10.1021/acs.biochem.6b00800
Brejc K., Sixma T.K., Kitts P.A., Kain S.R., Tsien R.Y., Ormö M., Remington S.J. // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 2306–2311. https://doi.org/10.1073/pnas.94.6.2306
Oltrogge L.M., Wang Q., Boxer S.G. // Biochemistry. 2014. V. 53. P. 5947−5957. https://doi.org/10.1021/bi500147n
Agmon N. // Biophys. J. 2005. V. 88. P. 2452–2461. https://doi.org/10.1529/biophysj.104.055541
Stoner-Ma D., Jaye A.A., Matousek P., Towrie M., Meech S.R., Tonge P.J. // J. Am. Chem. Soc. 2005. V. 127. P. 2864–2865. https://doi.org/10.1021/ja042466d
Arpino J.A., Rizkallah P.J., Jones D.D. // PLoS One. 2012. V. 7. P. e47 132. https://doi.org/10.1371/journal.pone.0047132
Ehrig T.F.G.P., O’Kane D.J. // FEBS Lett. 1995. V. 367. P. 163–166. https://doi.org/10.1016/0014-5793(95)00557-p
Gurskaya N.G., Fradkov A.F., Pounkova N.I., Staroverov D.B., Bulina M.E., Yanushevich Y.G., Labas Y.A., Lukyanov S., Lukyanov K.A. // Biochem. J. 2003. V. 373. P. 403–408. https://doi.org/10.1042/BJ20021966
Saha R., Verma P.K., Rakshit S., Saha S., Mayor S. and Pal S.K. // Sci. Rep. 2013. V. 3. P. 1–7. https://doi.org/10.1038/srep01580
Takaba K., Tai Y., Eki H., Dao H.A., Hanazono Y., Hasegawa K., Miki K., Takeda K. // IUCrJ. 2019. V. 6. P. 387–400. https://doi.org/10.1107/S205225251900246X
Shaner N.C., Campbell R.E., Steinbach P.A., Giepmans B.N., Palmer A.E., Tsien R.Y. // Nat. Biotechnol. 2004. V. 22. P. 1567–1572. https://doi.org/10.1038/nbt1037
Bogdanov A.M., Mishin A.S., Yampolsky I.V., Belousov V.V., Chudakov D.M., Subach F.V., Verkhusha V.V., Lukyanov S., Lukyanov K.A. // Nat. Chem. Biol. 2009. V. 5. P. 459–461. https://doi.org/10.1038/nchembio.174
Sen T., Mamontova A.V., Titelmayer A.V., Shakhov A.M., Astafiev A.A., Acharya A., Lukyanov K.A., Krylov A.I., Bogdanov A.M. // Int. J. Mol. Sci. 2019. V. 20. P. 5229. https://doi.org/10.3390/ijms20205229
Patterson G.H., Lippincott-Schwartz J. // Science. 2002. V. 297. P.1873–1877. https://doi.org/10.1126/science.1074952
van Thor J.J., Gensch T., Hellingwerf K.J., Johnson L.N. // Nat. Struct. Biol. 2002. V. 9. P. 37. https://doi.org/10.1038/nsb739
Bell A.F., Stoner-Ma D., Wachter R.M., Tonge P.J. // J. Am. Chem. Soc. 2003. V. 125. P. 6919–6926. https://doi.org/10.1021/ja034588w
Shcherbakova D.M., Verkhusha V.V. // Curr. Opin. Chem. Biol. 2014. V. 20. P. 60–68. https://doi.org/10.1016/j.cbpa.2014.04.010
Drobizhev M., Makarov N.S., Tillo S.E., Hughes T.E., Rebane A. // Nat. Methods. 2011. V. 8. P. 393–399. https://doi.org/10.1038/nmeth.1596
Volkmer A., Subramaniam V., Birch D.J., Jovin T.M. // Biophys. J. 2000. V. 78. P. 1589–1598. https://doi.org/10.1016/S0006-3495(00)76711-7
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия