Биоорганическая химия, 2020, T. 46, № 6, стр. 761-769
Получение рекомбинантных аллергенов Phl p 1 и Amb a 1 для детекции иммуноглобулинов класса E
О. О. Михеева 1, *, М. А. Костромина 1, Д. Д. Лыкошин 1, М. Н. Терешин 1, С. К. Завриев 1, Е. В. Свирщевская 1, С. В. Хлгатян 2, Р. С. Есипов 1, **
1 ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 ФГБНУ Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
105064 Москва, Малый Казенный пер., 5, Россия
* E-mail: olga.mikheeva.92@mail.ru
** E-mail: esipov@ibch.ru
Поступила в редакцию 07.04.2020
После доработки 18.04.2020
Принята к публикации 24.04.2020
Аннотация
В клетках E. coli экспрессированы основные рекомбинантные аллергены Phl p 1 тимофеевки луговой (Phleum pratense) и Amb a 1 амброзии полыннолистной (Ambrosia artemisiifolia) и разработаны методики их очистки с использованием анионообменной и аффинной хроматографий, которые позволяют получать 10 мг Phl p 1 и 7.5 мг Amb a 1 с литра культуральной среды с электрофоретической чистотой не менее 90%. Для анализа способности IgE антител связывать Phl p 1 и Amb a 1 использовали сыворотки людей с IgE к различным аллергенам, идентифицированных методом RIDA. Часть сывороток связывала Phl p 1 или Amb a 1, что подтвердило иммунореактивность полученных рекомбинантных белков. Титры антител к Amb a 1 коррелировали с данными RIDA по чувствительности к смеси трав и пыльце ржи. Титры антител к Phl p 1 не коррелировали с данными RIDA. Из отобранных 20 положительных сывороток 73 и 89% сывороток, распознающих Phl p 1 или Amb a 1 соответственно, имели антитела к кроссреактивной группе аллергенов ольха/береза/лещина.
ВВЕДЕНИЕ
Различными формами аллергических заболеваний I типа, опосредованных антителами E класса (IgE), страдает 20–30% населения развитых стран [1]. Аллергическую реакцию могут вызывать самые разнообразные белки, которые содержатся в пыльце растений, домашней пыли, плесневых грибах, пищевых продуктах и т.д. Для формирования аллергии необходимыми и достаточными условиями являются: генетическая предрасположенность; размер сенсибилизирующего агента и наличие в его составе значительного белкового компонента. Поскольку в развитых странах доля людей, страдающих аллергией, устойчиво держится на уровне 20–30% населения и понемногу растет, аллергию следует отнести не столько к болезни, сколько к одному из типов нормального функционирования иммунной системы. Ранее наличие патогенных и условнопатогенных инфекций приводило к переключению иммунной системы на борьбу с инвазией патогенов. В современном стерильном и вакцинированном против основных патогенов мире иммунная система распознает все чужеродное, что попадает на барьерные ткани тела: кожу, бронхолегочную систему (БЛС) и в желудочно-кишечный тракт (ЖКТ). Аллергическая реакция I типа, манифестирующаяся синтезом IgE, начинается в детском возрасте в ответ на пищевые белки, а в дальнейшем присоединяется респираторная форма или атопический дерматит.
Пыльца трав, вследствие интенсивного и длительного высвобождения, является одним из наиболее важных переносимых по воздуху источников аллергенов во всем мире [2, 11].
В России одними из основных аллергенов, вызывающих аллергические реакции, являются пыльца березы (Betula pendula) [22], а также тимофеевка луговая и амброзия полынолистная.
Тимофеевка луговая распространена в Европе и соседних регионах Африки и Азии. Она широко культивируется в большинстве регионов мира с умеренным климатом на пастбищах и для производства сена, поэтому аллергия на пыльцу этого растения является глобальной проблемой [3].
Аллергены пыльцы злаков группы 1 гомологичны, присутствуют во всех видах пыльцы семейства злаковых и могут перекрестно разпознаваться IgE антителами из сывороток больных. Один из наиболее характерных аллергенов группы 1 из пыльцы тимофеевки является Phl p 1 [12]. Его эпитопы имеют гомологию с эпитопами аллергенов группы 1 других растений, и соответственно, наблюдается перекрестная реактивность к большинству других аллергенов группы 1 [4]. Несколько клинических исследований продемонстрировали высокую аллергенную активность и клиническую значимость Phl p 1 [13, 14], так как он является основным аллергеном, а сенсибилизация к нему обычно предшествует сенсибилизации к другим компонентам пыльцы злаков [5], в связи с чем его можно использовать в качестве диагностического маркера для выявления пациентов с аллергией на пыльцу этого вида трав [15]. Phl p 1 относится к классу бета-экспансинов – белков клеточной стенки, играющих важную роль в проникновении пыльцевой трубки в семязачаток.
На сегодняшний день второй по частоте причиной респираторной аллергии после пыльцы трав являются аллергены из пыльцы амброзии [16]. Родиной растений рода амброзия является Северная Америка, откуда они были занесены в Европу. Быстрому распространению этого растения способствуют атмосферные циклоны, которые переносят пыльцу амброзии на большие расстояния [6], что, в свою очередь, приводит к сенсибилизации до 80% населения определенных регионов [17]. Основным аллергеном пыльцы амброзии является Amb a 1, чувствительность к которому у пациентов составляет до 90% [18, 19]. Amb a 1 – это негликозилированный белок массой 38 кДа, принадлежащий к семейству пектат-лиазных белков, который составляет до 15% от общего количества белков в пыльце амброзии [20, 21].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение рекомбинантного белка Phl p 1
Ген, кодирующий пыльцевой аллерген из Phleum pratense получен методом обратной транскрипции на матрице мРНК, выделенной из пыльцы тимофеевки луговой и клонирован в плазмидный вектор pET23a+ для прокариотической экспрессии в E. coli.
Эффективность экспрессии рекомбинантного гена оценивали при культивировании разных штаммов E. coli при температурах 23 и 37°С в течение 4 и 18 часов после индукции биосинтеза белка. В целом белок эффективно нарабатывался во всех штаммах-носителях E. coli. Несколько большее содержание (32%) и съем биомассы (4.4 г/л) достигался при культивировании штамма-продуцента E. coli BL21 (DE3)pLys/pER-Phlp1 (табл. 1).
Таблица 1.
Содержание белка Phl p 1 в штаммах-продуцентах относительно общего белка клетки. (Данные получены при использовании программы Image Lab (версия 5.2.1), Bio-Rad, США)
| Штамм-носитель, E. coli | Условия культивирования | Содержание белка, % | Объем клеточной биомассы, г/л |
|---|---|---|---|
| KRX | 23°С, 4 часа | 27 | 3.8 |
| 23°С, 18 часов | 26.4 | 4.0 | |
| 37°С, 4 часа | 31.1 | 4.0 | |
| 37°С, 18 часов | 28.6 | 4.2 | |
| C3030 | 23°С, 4 часа | 27.6 | 3.6 |
| 23°С, 18 часов | 27.5 | 4.1 | |
| 37°С, 4 часа | 33.2 | 3.9 | |
| 37°С, 18 часов | 31.3 | 4.1 | |
| ER2566 | 23°С, 4 часа | 30.3 | 4.0 |
| 23°С, 18 часов | 29.8 | 4.2 | |
| 37°С, 4 часа | 30.7 | 4.2 | |
| 37°С, 18 часов | 30.6 | 4.4 | |
| Bl21(DE3)pLys | 23°С, 4 часа | 29.7 | 3.8 |
| 23°С, 18 часов | 29.2 | 4.1 | |
| 37°С, 4 часа | 32.0 | 4.4 | |
| 37°С, 18 часов | 29.5 | 4.6 |
Белок Phl p 1 в ходе культивирования агрегировал с образованием тел включений (рис. 1). После разрушения клеточной биомассы проводили отмывку тел включения от нуклеиновых кислот и липидной фракции [23]. Для солюбилизации целевого белка из тел включений подбирали концентрации мочевины – установлено, что белок Phl p 1 экстрагируется при использовании буферного раствора, содержащего 4 М мочевину (рис. 1).
Рис. 1.
Получение и очистка белка Phl p 1. М ‒ маркер молекулярных масс, 1 ‒ тотальный клеточный лизат, 2 ‒ осветленный клеточный лизат, 3 – осадок тел включений, 4, 7 ‒ тотальный клеточный лизат при 4 и 8 М мочевине соответственно; 5, 8 ‒ осветленный клеточный лизат при 4 и 8 М мочевине соответственно; 6, 9 ‒ клеточный осадок при 4 и 8 М мочевине соответственно, 10 ‒ Phl p 1 после гель-фильтрационной хроматографии.
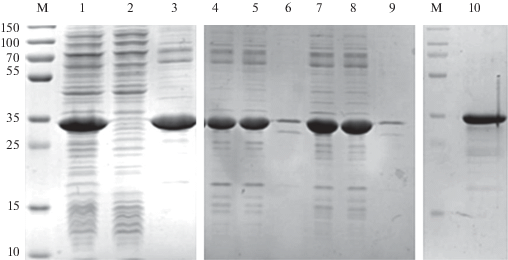
Для очистки Phl p 1 от клеточных белков на первом этапе использовали металл-хелатную аффинную хроматографию в присутствии 4 М мочевины в градиенте имидазола. При разработке методики выделения было установлено, что Phl p 1 склонен к образованию олигомерных форм [2, 8]. Для предотвращения олигомеризации дальнейшие стадии ионообменной и гель-фильтрационной хроматографий проводили на фоне 5 мМ ДТТ.
Полученный белок Phl p 1 охарактеризован с использованием электрофореза в SDS-ПААГ (рис. 1). По данным электрофоретического анализа, чистота препарата составила не менее 95%.
Получение рекомбинантного белка Amb a 1
Ген, кодирующий пыльцевой аллерген из Ambrosia artemisiifolia, получен методом обратной транскрипции на матрице мРНК, выделенной из пыльцы амброзии полынолистной и клонирован в плазмидный вектор pET23a+ для прокариотической экспрессии в E. coli.
При анализе последовательности гена Amb a 1 с помощью Codon Usage Database, было обнаружено, что в гене содержится 3% редко встречаемого для экспрессии в E. coli кодона AGG, кодирующего аргинин. Поэтому для экспрессии гена Amb a 1 использовали штамм E. coli Rosetta (DE3), предназначенный для экспрессии генов с редкими для E. coli кодонами (AUA, AGG, AGA, CUA, CCC и GGA).
В ходе подбора условий культивирования штамма ‒ носителя для экспрессии гена Amb a 1 было исследовано влияние температуры (23 и 37°С) и времени индукции белкового биосинтеза (4 и 18 часов). Содержание целевого белка относительно общего клеточного белка за 4 часа составил 11.8% при 37°С (табл. 2).
Таблица 2.
Содержание белка Amb a 1 в штамме-продуценте E. coli Rosetta (DE3)/pER-Amba1 относительно общего белка клетки. (Данные получены при использовании программы Image Lab (версия 5.2.1), Bio-Rad, США)
| Условия культивирования | Содержание белка, % | Объем клеточной биомассы, г/л |
|---|---|---|
| 23°С, 4 часа | – | 2.2 |
| 23°С, 18 часов | 5 | 2.6 |
| 37°С, 4 часа | 11.8 | 3.1 |
| 37°С, 18 часов | 10.3 | 2.9 |
При культивировании штамма-продуцента E. coli Rosetta (DE3)/pER-Amba1 белок агрегировал с образованием тел включений (рис. 2). После разрушения клеточной биомассы проводили отмывку тел включения от нуклеиновых кислот и липидной фракции. Для солюбилизации целевого белка из клеточного осадка подбирали концентрации мочевины. Было установлено, что белок Amb a 1 экстрагируется при использовании буферного раствора, содержащего 8 М мочевину (рис. 2).
Рис. 2.
Получение и очистка белка Amb a 1. М ‒ маркер молекулярных масс. 1 ‒ клеточный лизат до индукции белкового биосинтеза, 2 ‒ тотальный клеточный лизат через 4 часа после индукции белкового биосинтеза при 37°С, 3 ‒ осветленный клеточный лизат при 8 М мочевине, 4 – клеточный осадок после лизирования в 8 М мочевине, 5 – белок после гель-фильтрационной хроматографии.
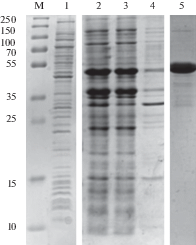
На первой стадии очистки Amb a 1 проводили анионообменную хроматографию в буферных растворах, содержащих 8 М мочевину. Фракции с чистотой более 70% объединяли и проводили ренатурацию белкового раствора. После ренатурации последовательно осуществляли металл-аффинную и гель-фильтрационную хроматографии.
Полученный Amb a 1 охарактеризован с использованием электрофореза в SDS-ПААГ (рис. 2). По данным электрофоретического анализа, чистота препарата составила не менее 95%.
Иммуноферментный анализ сывороток против рекомбинантных аллергенов Phl p 1 и Amb a 1
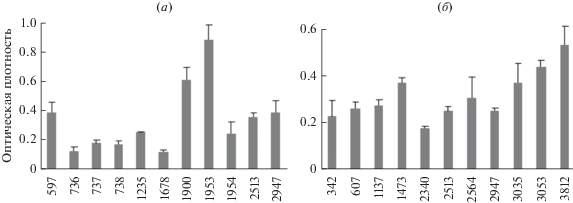
Способность IgE распознавать полученные рекомбинантные белки Phl p 1 и Amb a 1 анализировали с помощью метода непрямого твердофазного ИФА. Для анализа использовали набор сывороток людей с диагностированной респираторной аллергией на различные типы аллергенов, входящие в состав пыльцевой панели № 2 RIDA (R-Biopharm AG, Германия). В состав панели № 2 входит 20 аллергенов: клещи домашней пыли D. pseronisinus, D. farinae, ольха, береза, лещина, дуб, смесь трав (рожь посевная, тимофеевка луговая, овсяница луговая, райграс высокий, колосок душистый, костер безостый, пырей ползучий, ежа сборная, плевел, лисохвост луговой, бухарник шерстистый, свинорой пальчатый), рожь (пыльца), полынь, подорожник, кошка, лошадь, собака, морская свинка, хомяк, кролик, грибы penicillum, cladosporium, aspergillus и alternaria. Антигены тимофеевки луговой входят только в смесь трав, а аллергенов амброзии в составе панели нет. Для анализа отбирали произвольные сыворотки, содержащие IgE к любому из аллергенов панели. Из 132 протестированных сывороток в анализе Phl p 1 29 сывороток (21%) показали достоверное связывание (рис. 3а). Из 84 сывороток в анализе Amb a 1 положительными оказались 11 сывороток (13%) (рис. 3б). Все образцы сывороток были получены от жителей Москвы и Московской области. Различие частоты сенсибилизации к тимофеевке и амброзии показывает, что в центральном регионе амброзия распространена меньше, чем на юге России.
Рис. 3.
Распознавание IgE антителами из сывороток больных с респираторной аллергией рекомбинантных белков Phl p1 (а) и Amb a 1 (б). Номерами отмечены различные сыворотки. Сыворотка 2947 распознавала оба аллергена.
Можно предположить, что распознавание Phl p 1 в ИФА и смеси трав из набора № 2 RIDA, в который входит экстракт тимофеевки, будет коррелировать. Для анализа корреляции использовали данные RIDA и ИФА. На рис. 4 приведен спектр сенсибилизации к респираторным аллергенам панели № 2 RIDA сывороток, связывающихся с Phl p 1 (рис. 4а) и Amb a 1 (рис. 4б). Общая картина сенсибилизации на респираторные аллергены в группе больных с IgE антителами к антигенам тимофеевки и амброзии отличалась. Сыворотки, специфично распознающие Phl p 1, высокоспецифичны к группе гомологичных аллергенов – ольха, береза, лещина. В группе Amb a 1 сыворотки распознавали не только отмеченную триаду, но и многие другие пыльцевые аллергены, а также грибные (рис. 4).
Рис. 4.
Распознавание респираторных аллергенов IgE антителами из сывороток, специфичных к Phl p 1 (а) или Amb a 1 (б). Класс титров IgE к различным аллергенам показан по увеличению от светлого до темного фона, где белый цвет соответствует отсутствию IgE антител, светло-серый соответствует умеренному распознаванию (классы 2–3); темно-серый соответствует значительному распознаванию (классы 4–6).
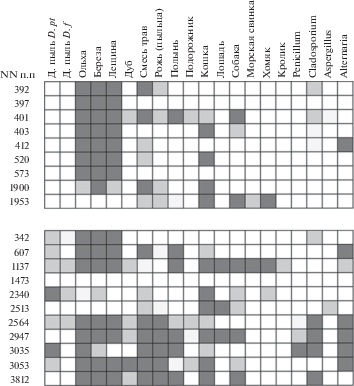
Анализ корреляции распознавания Phl p 1 не выявил связи данных ИФА с распознаванием других респираторных аллергенов в системе RIDA (табл. 3). Распознавание Amb a 1 достоверно (p < 0.05) коррелировало с распознаванием сорных трав и пыльцы ржи (табл. 3).
Таблица 3.
Коэффициенты корреляции Пирсона данных панели № 2 RIDA и ИФА на белках Phl p1 и Amb a 1
| Ольха | Береза | Лещина | Дуб | Смесь трав | Рожь | Полынь | |
|---|---|---|---|---|---|---|---|
| Phl p 1 | 0.222 | 0.160 | 0.214 | – | –0.100 | –0.116 | 0.453 |
| Amb a 1 | 0.286 | 0.087 | 0.301 | 0.429 | 0.679* | 0.784* | 0.329 |
Таким образом, очевидно, что белок Amb a 1 является иммуногенным и может быть использован как в диагностических целях, так и для аллерген-специфической иммунотерапии. Распознавание рекомбинантного белка Phl p 1 не коррелировало с распознаванием смеси трав, в состав которых входит экстракт тимофеевки. Это может означать как малое количество аллергенов тимофеевки в составе экстракта, так и неспецифическое распознавание Phl p 1. Известно, что распознавание конформационных эпитопов некоторых белков аллергенов опосредовано связыванием IgE с сахарами белков, например, как это было показано для белков Der f 1 и Der p 1 из клещей домашней пыли. С другой стороны, имеются тест-системы на основе Phl p 1, например, компания HELIX (Москва, Россия) (https://helix.ru/kb/item/21-679), что демонстрирует возможность использования негликозилированного белка Phl p 1 для диагностики. Дополнительным свидетельством достаточной иммуногенности Phl p 1 является значительная связь с чувствительностью 8 из 9 сывороток (89%) к триаде гомологичных аллергенов – береза, ольха и лещина (рис. 4). Отсутствие корреляции данных RIDA и ИФА для этих белков может быть связано с лимитированным диапазоном полуколичественного распознавания белков тестом RIDA. В дальнейшем планируется проведение параллельного анализа чувствительных к Phl p 1 сывороток методами ИФА и immunoCAP для возможного использования полученного белка в качестве иммуномаркера и создания тест-системы для диагностики аллергии на пыльцу трав.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При создании экспрессионного вектора использовали: набор для выделения суммарной РНК ExtractRNA, набор для синтеза кДНК Mint, набор для выделения и очистки ДНК из агарозного геля и реакционных смесей Cleanup Standart, набор для выделения плазмидной ДНК Plasmid Miniprep, Encyclo-полимеразу – Евроген (Россия), рестриктазы NdeI и XhoI (Thermo Scientific, США), pET23a+ (EMD Millipore, США). Использовали бактериальные штаммы E. coli Bl21 (DE3) pLys и Rosetta (DE3). При культивировании использовали бакто-триптон, бакто-агар и дрожжевой экстракт (Becton Dickinson, США). При выделении белка использовали следующие реактивы производства Panreac (США): Трис(гидроксиметил)-аминометан гидрохлорид (Трис-HCl), дигидрофосфат натрия, хлорид натрия, имидазол, динатриевая соль этилендиаминтетрауксусной кислоты (EDTA); PageRuler™ Prestained Protein Ladder, 10 to 250 kDa (Thermo Scientific, США).
Получение экспрессионных плазмидных векторов, содержащих гены Phl p 1 и Amb a 1
Из образцов пыльцы Phleum pretense и Ambrosia artemisiifolia с использованием реактива для выделения суммарной РНК ExtractRNA (Евроген, Россия) была выделена мРНК, на матрице которой была получена кДНК с помощью ревертазы Mint (Евроген, Россия) в соответствии с протоколом фирмы-производителя. Для амплификации генов, кодирующих аллергены Phl p 1 и Amb a 1 были использованы олигонуклеотидные праймеры Phl-forward GGTGGTCATATGATCCCCAAGGTTCCCCCGGGTC и Phl-reverse GGTGGTCTCGAGCTTGGACTCGTAGGCGGTGTCGGC; Amb-forward GGTGGTCATATGGCCGAAGATCTCCAGGAAATC и Amb-reverse GGTGGTCTCGAGGCAAGGTGCTCCAGGAG, содержащие сайты узнавания эндонуклеаз рестрикции NdeI и XhoI, соответственно (подчеркнуты) (Thermo Scientific, США). Олигонуклеотидные праймеры были подобраны на основании последовательности мРНК генов, кодирующих Phl p 1 и Amb a 1 (номера в GenBank CQ789447 и M80558.1, соответственно). Для ПЦР использовали Encyclo-полимеразу (Евроген, Россия). Полученные ампликоны были обработаны эндонуклеазами рестрикции NdeI и XhoI и клонированы в плазмидный вектор pET23a+, предварительно обработанный этими же рестриктазами. В результате были получены рекомбинантные экспрессионные вектора pER-Phlp1 и pER-Amba1. Правильность нуклеотидных последовательностей клонированных генов была подтверждена их секвенированием (Евроген, Россия).
Подбор штаммов E. coli для экспрессии генов аллергенов Phl p 1 и Amb a 1
В качестве штаммов-носителей для созданного вектора pER-Phlp1 использовали штаммы E. coli BL21 (DE3) pLys, KRX, C3030 и ER2566, а для вектора pER-Amba1 ‒ Rosetta (DE3). Трансформированные клетки высевали на среду LB (1% бакто-триптон, 0.5% дрожжевой экстракт, 1% NaCl) с агаром, содержащих 100 мкг/мл ампициллина для клеток ER2566, BL21 (DE3) pLys и KRX и 100 мкг/мл ампициллина и 20 мкг/мл хлорамфеникола для клеток Rosetta (DE3) и C3030, и выращивали в течение 14 ч при 37°С для получения отдельных колоний. После чего несколько колоний переносили в 100 мл среды LB с 20% глюкозой и 100 мкг/мл ампициллина и выращивали 16 ч при 37°С на шейкере CERTOMAT® S II (Sartorius, Германия) при перемешивании со скоростью 180 об./мин для получения ночной культуры с OD600 3.5. Полученной ночной культурой штаммов-продуцентов E. coli BL21 (DE3)pLys/pER-Phlp1, KRX/pER-Phlp1, ER2566/pER-Phlp1, Rosetta (DE3)/pER-Amba1 засевали среду LB с 0.2% глюкозой и 100 мкг/мл ампициллина, культурой C3030/pER-Phlp1 засевали среду SOB с 0.2% глюкозой и 100 мкг/мл ампициллина в культуральных колбах Эрленмейера (процент засева составлял 2%) и выращивали при 37°C при перемешивании со скоростью 160 об./мин. При поглощении клеточной культуры OD600 0.8 вносили IPTG до концентрации 0.4 мМ, в случае культуры клеток штамма-продуцента KRX/pER-Phlp1вносили IPTG до концентрации 0.4 мМ и рамнозы до 0.2% и выращивали при 23 и 37°C в течение 4 и 18 часов. Клеточную биомассу получали центрифугированием в течение 20 мин при 4°C и 4000 об./мин на центрифуге Avanti J-30I (Beckman Coulter, Германия).
Выделение аллергена Phl p I
4 г клеточной биомассы штамма-продуцента E. coli BL21 (DE3) pLys/pER-Phlp1 ресуспендировали в буферном растворе 50 мМ Трис-HCl, pH 8.5 с 1 мМ PMSF в соотношении 1 : 10 (w/v) и разрушали с помощью ультразвукового дезинтегратора Labsonic P (Sartorius, Германия) в течение 20 мин при 4 °C (цикл – 0.5 с, амплитуда – 50%). Затем центрифугировали при 12000 об./мин в течение 30 мин при 4°C на центрифуге Hermle Z383K (HERMLE Labortechnik GmbH, Германия). Для очистки от нуклеиновых кислот и липидов полученный осадок тел включения последовательно отмывали (ресуспендировали в соотношении 1 : 10 (w/v), перемешивали 30 мин, центрифугировали) в двух буферных растворах: № 1 – 50 мМ Трис-HCl, pH 8.5 (буфер А) с 0.1% тритоном X-100; № 2 – буфер А. После чего осадок, полученный при дезинтеграции штамма-продуцента BL21 (DE3) pLys/pER-Phlp1 ресуспендировали в буферном растворе А с 4 М мочевиной в соотношении 1 : 20 (w/v) и перемешивали до полного растворения в течение 1 часа. После центрифугирования белковый раствор разбавляли в 2 раза раствором А с 4 М мочевиной и наносили на колонку ХК 26/40 (GE Healthcare, США), содержащую 30 мл сорбента Ni2+-IDA (Qiagen, Германия), предварительно уравновешенную буферным раствором А с 4 М мочевиной. Отмывку от балластных белков проводили буферным раствором А с 4 М мочевиной. Целевой белок элюировали линейным градиентом буферного раствора А с 4 М мочевиной и 500 мМ имидазолом.
После металл-хелатной хроматографии в элюат добавляли ДТТ до 5 мМ и наносили на колонку XK 16/20 (GE Healthcare, США), содержащую 15 мл сорбента Q HP (GE Healthcare, США), уравновешенного буферным раствором А с 5 мМ ДТТ. Элюцию целевого белка проводили линейным градиентом буферного раствора А с добавлением 5 мМ ДТТ и 1 М NaCl.
Элюат после ионообменной хроматографии концентрировали при помощи ультрафильтрационной ячейки Amicon 8200 объемом 200 мл (Millipore, США) на мембране RC 10 кДа (Millipore) до конечной концентрации 2 мг/мл. Последующую очистку проводили на колонке HiLoad 16/60 с сорбентом Superdex 75 (GE Healthcare) в буферном растворе А с 100 мМ NaCl, 10% глицерина и 5 мМ ДТТ. Фракции, содержащие целевой белок, объединяли и концентрировали с помощью ультрафильтрации до конечной концентрации 2 мг/мл, как описано ранее.
Выделение аллергена Amb a 1
4 г клеточной биомассы штамма-продуцента E. coli Rosetta/pER-Amba1 ресуспендировали в буферном растворе 50 мМ Трис-HCl, pH 8.5 с 1 мМ PMSF в соотношении 1 : 10 (w/v) и разрушали с помощью ультразвукового дезинтегратора Labsonic P (Sartorius, Германия) в течение 20 мин при 4°C (цикл – 0.5 с, амплитуда – 50%). Затем центрифугировали при 12000 об./мин в течение 30 мин при 4°C на центрифуге Hermle Z383K (HERMLE Labortechnik GmbH, Германия). Для очистки от нуклеиновых кислот и липидов полученный осадок тел включения последовательно отмывали (ресуспендировали в соотношении 1 : 10 (w/v); перемешивали 30 мин; центрифугировали) в двух буферных растворах: № 1 – 50 мМ Трис-HCl, pH 8.5 (буфер А) с 0.1% тритоном X-100; № 2 – буфер А. После чего осадок, полученный при дезинтеграции штамма-продуцента Rosetta (DE3)/pER-A-mba1 ресуспендировали в буферном растворе А с 8 М мочевиной в соотношении 1 : 20 (w/v) и перемешивали до полного растворения в течение 1 часа. После центрифугирования белковый раствор разбавляли в 2 раза раствором А с 8 М мочевиной и наносили на колонку XK 16/20 (GE Healthcare, США), содержащую 15 мл сорбента Q HP (GE Healthcare, США), уравновешенного буферным раствором А с 8 М мочевиной. Элюцию целевого белка проводили линейным градиентом буферного раствора А с добавлением 8 М мочевины и 1 М NaCl. Затем в элюат после анионообменной хроматографии добавляли ДТТ до 5 мМ и перемешивали в течение 1 часа, после чего разбавляли в 20 раз буферным раствором А и инкубировали при перемешивании в течение 14 часов при 10°С. После чего белковый раствор наносили на колонку ХК 26/40 (GE Healthcare, США), содержащую 30 мл сорбента Ni2+-IDA (Qiagen, Германия), предварительно уравновешенную буферным раствором А. Отмывку от балластных белков проводили буферным раствором А. Целевой белок элюировали линейным градиентом буферного раствора А с 500 мМ имидазолом.
Элюат после металл-аффинной хроматографии концентрировали при помощи ультрафильтрационной ячейки Amicon 8200 объемом 200 мл (Millipore, США) на мембране PES 10 кДа (Millipore) до конечной концентрации 5 мг/мл. Последующую очистку проводили на колонке HiLoad 16/60 с сорбентом Superdex 75 (GE Healthcare) в буферном растворе А с 100 мМ NaCl, 10% глицерина. Фракции, содержащие целевой белок, объединяли и концентрировали с помощью ультрафильтрации до конечной концентрации 2 мг/мл, как описано ранее.
Аналитические методы
Концентрацию белка определяли по методу Бредфорда, используя БСА в качестве стандарта [9]. Чистоту белка определяли с помощью ДСН‒ПААГ электрофореза в денатурирующих условиях [10].
Получение биотинилированных антител
Моноклональные антитела к человеческому IgE (Сорбент, Москва) были конъюгированы с производным биотина сульфосукнимидил-6-(биотинамидо)гексаноатом, взятом в 10-кратном молярном избытке. Реакцию проводили в течение 1 часа при комнатной температуре. От избытка непрореагировавшего биотина избавлялись с помощью диализа в течение 18 часов при 4°С.
Сыворотки крови больных с аллергией
Сыворотки получены из КПО ФГБНУ НИИ вакцин и сывороток им. И. И. Мечникова (Москва, Россия) с информированного добровольного согласия участников и собраны за период с 2009 по 2017 гг. Пациенты проходили первичную аллергодиагностику с использованием коммерческих наборов RIDA (Германия). Всего использовали 132 сыворотки больных с аллергией на Phl p 1 и 84 сыворотки для Amb a 1.
Проведение непрямого иммуноферментного анализа (ИФА)
Для проведения ИФА на 96-луночный планшет (Linbro, Germany) наносили 50 мкл раствора белка Phl p 1 или Amb a 1 (5 мкг/мл) в качестве подложки и оставляли на ночь при 4°С. Затем производили трехкратную отмывку фосфатным буфером (ФБ) (137 мМ NaCl, 2.7 мМ KCl, 10 мМ Na2HPO4, 1.76 мМ KH2PO4, рН 7.4, 0.05% Tween-20), после чего на планшет наносили 1% раствор бычьего сывороточного альбумина (БСА) в ФБ. Далее в лунки добавляли разведенные сыворотки больных и оставляли инкубироваться на 2 ч при комнатной температуре. После этого вновь проводили трехкратную отмывку. Вносили 50 мкл раствора первичного конъюгата биотинилированных антител к IgE (титр 1 : 1000) и оставляли инкубироваться на 2 час. Производили двукратную отмывку и добавили по 50 мкл раствора стрептавидина в ФБ в соотношении 1 : 10 000, инкубировали 30 мин. После инкубации отмывали планшет 3 раза, затем добавляли 50 мкл 3,3'5,5'-тетраметилбензидина. Реакцию останавливали через 10–15 мин, добавляя в лунки планшета по 50 мкл 10% раствора серной кислоты. Оптическую плотность образцов определяли на планшетном спектрофотометре Titertek (UK) при длине волны 450 нм.
Статистический анализ
Результаты обрабатывали при использовании пакета Microsoft Excel и параметрическим корреляционным анализом по Пирсону. Подсчитывали двусторонний t-критерий Стьюдента и параметрический двусторонний коэффициент корреляции по Пирсону. Статистически значимой считали уровень достоверности p < 0.05.
Список литературы
Haahtela T., Holgate S., Pawankar R., Akdis C.A., Benjaponpitak S., Caraballo L., Demain J., Portnoy J., Hertzen von L. // World Allergy Organization. 2013. P. 1–13. https://doi.org/10.1186/1939-4551-6-3
Andersson K., Lidholm J. // Int. Arch. Allergy Immunol. 2003. V. 130. P. 87–107. https://doi.org/10.1159/000069013
Bousquet P.-J., Chinn S., Janson C., Kogevinas M., Burney P., Jarvis D. // Allergy. 2007. V. 62. P. 301–309. https://doi.org/10.1111/j.1398-9995.2006.01293.x
Focke M., Mahler V., Ball T., Sperr W.R., Majlesi Y., Valent P., Kraft D., Valenta R. // FASEB J. 2001. V. 15. P. 2042–2044. https://doi.org/10.1096/fj.01-0016fje
Hatzler L., Panetta V., Lau S., Wagner P., Bergmann R.L., Illi S., Bergmann K.E., Keil T., Hofmaier S., Rohrbach A., Bauer C.P., Hoffman U., Forster J., Zepp F., Schuster A., Wahn U., Matricardi P.M. // J. Allergy Clin. Immunol. 2012. V. 130. P. 894–901. e5. https://doi.org/10.1016/j.jaci.2012.05.053
Storkey J., Stratonovitch P., Chapman D.S., Vidotto F., Semenov M.A. // PLoS One. 2014. V. 9. P. e88 156. https://doi.org/10.1371/journal.pone.0088156
Smith M., Cecchi L., Skjøth C.A., Karrer G., Šikoparija B. // Environ. Int. 2013. V. 61. P. 115–126. https://doi.org/10.1016/j.envint.2013.08.005
Suck R., Kamionka T., Schäffer B., Wahl R., Nandy A., Weber B., Petersen A., Birner-Grünberger R., Siva Charan D.V., Keller W., Fiebig H., Cromwell O. // Biochimica et Biophysica Acta. 2006. V. 1764. P. 1701–1709. https://doi.org/10.1016/j.bbapap.2006.09.015
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J.J. // Biol. Chem. 1951. V. 193. P. 265–275.
Laemmli U.K. // Nature. 1970. V. 227. P. 680–685.
Suphioglu C., Singh M.B., Taylor P., Bellomo R., Holmes P., Puy R., Knox R.B. // Lancet. 1992. V. 339. P. 569–572. https://doi.org/10.1016/0140-6736(92)90864-y
Laffer S., Valenta R., Vrtala S., Susani M., Van Ree R., Kraft D., Scheiner O., Duchêne M. // J. Allergy Clin. Immunol. 1994. V. 94. P. 689–698. https://doi.org/10.1016/0091-6749(94)90176-7
Westritschnig K., Horak F., Swoboda I., Balic N., Spitzauer S., Kundi M., Fiebig H., Suck R., Cromwell O., Valenta R. // Eur. J. Clin. Invest. 2008. V. 38. P. 260–267. https://doi.org/10.1111/j.1365-2362.2008.01938.x
Niederberger V., Stübner P., Spitzauer S., Kraft D., Valenta R., Ehrenberger K., Horak F. // J. Invest. Dermatol. 2001. V. 117. P. 848–851. https://doi.org/10.1046/j.0022-202x.2001.01470.x
Bokanovic D., Aberer W., Hemmer W., Heinemann A., Komericki P., Scheffel J., Sturm G.J. // Allergy. 2013. V. 68. P. 1403–1409. https://doi.org/10.1111/all.12263
Asero R. // Allergy. 2007. V. 62. P. 1097–1099. https://doi.org/10.1111/j.1398-9995.2007.01436.x
Oswalt M.L., Marshall G.D. // Allergy Asthma Clin. Immunol. 2008. V. 4. P. 130–135. https://doi.org/10.1186/1710-1492-4-3-130
King T.P., Norman P.S., Tao N. // Immunochemistry. 1974. V. 11. P. 83–92. https://doi.org/10.1016/0019-2791(74)90321-8
Gadermaier G., Wopfner N., Wallner M., Egger M., Didierlaurent A., Regl G., Aberger F., Lang R., Ferreira F., Hawranek T. // Allergy. 2008. V. 63. P. 1543–1549. https://doi.org/10.1111/j.1398-9995.2008.01780.x
Bordas-Le Floch V., Groeme R., Chabre H., Baron-Bodo V., Nony E., Mascarell L., Moingeon P. // Allergy Asthma Rep. 2015. V. 15. P. 63. https://doi.org/10.1007/s11882-015-0565-6
Rafnar T., Griffith I.J., Kuo M.C., Bond J.F., Rogers B.L., Klapper D.G. // J. Biol. Chem. 1991. V. 266. P. 1229–1236.
Симонова М.А., Пивоваров В.Д., Рязанцев Д.Ю., Костромина М.А., Муравьева Т.И., Мокроносова М.А., Хлгатьян С.В., Есипов Р.С., Завриев С.К. // Биоорган. химия. 2018. Т. 44. С. 203–211. [Simonova M.A., Pivovarov V.D., Ryazantsev D.Yu., Kostromina M.A., Muravieva T.I., Mokronosova M.A., Khlgatian S.V., Esipov R.S., Zavriev S.K. // Russ. J. Bioorg. Chem. 2018. V. 44. P. 217–224.] https://doi.org/10.7868/S0132342318020124
Романов В.П., Костромина Т.И., Мирошников А.И., Феофанов С.А. // Биоорган. химия. 2016. Т. 42. С. 697–703. [Romanov V.P., Kostromina T.I., Miroshnikov A.I., Feofanov S.A. // Russ. J. Bioorg. Chem. 2016. V. 42. P. 631–637.] https://doi.org/10.1134/S1068162016040154
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


